Компьютерное моделирование при опухолях
(11).jpg)
Помощь при травмах и осложненных переломах рук и ног, операции на головном мозге при опухолях и внутримозговых гематомах, высокоточная диагностика легких — этим и другим жизненно важным темам посвящают свои исследования московские врачи. 33 молодых специалиста рассказали о новых технологиях и уникальных операциях на конференции, которая прошла в НИИ скорой помощи имени Н.В. Склифосовского.
Лучшей эксперты признали работу Александра Неведрова — научного сотрудника отделения сочетанной и множественной травмы НИИ скорой помощи имени Н.В. Склифосовского. Он предложил репетировать операцию на 3D-моделях. Это снижает риски, повышает точность операции и сокращает ее длительность. Автора разработки наградили поездкой на стажировку в Китай.
Александр Неведров рассказал mos.ru, как смоделировать хирургическое вмешательство в 3D, когда очки виртуальной реальности будут обязательны в операционной и почему работа хирурга сродни проектированию большого здания.

— В чем суть вашей технологии?
— Мы — отделение травматологии — совместно с отделениями микрохирургии и компьютерной томографии улучшаем технологию выполнения сложных реконструктивных вмешательств на конечностях. Допустим, человек сломал ногу: у него повреждены мягкие ткани, кости, сосуды. Чтобы поставить его на ноги, чтобы он не стал инвалидом, требуется большое количество оперативных вмешательств, и одно из важнейших — восстановление скелета конечностей, ведь угловые деформации, укорочение, несросшиеся переломы могут вызывать боль или лишить человека работоспособности.
Эти вмешательства требуют очень большой точности выполнения. Их, наверное, можно сравнить с архитектурой или проектированием большого здания: все должно быть правильно, все углы, размеры нужно соблюсти. Если у человека нет какого-то участка кости, мы должны подобрать костный трансплантат, точно соответствующий дефекту. С этой же проблемой сталкиваются челюстно-лицевые хирурги при восстановлении челюсти, поэтому у них технология 3D-моделирования, которой мы занимаемся, тоже активно применяется.
Мы идем на операцию, смоделировав ее в трехмерном пространстве
Суть нашей работы заключается в том, что мы выполняем детальное предоперационное планирование и на операцию идем, смоделировав это оперативное вмешательство в виртуальном трехмерном пространстве. Идею операции нужно перенести из виртуального пространства в реальное, а наиболее быстрой сейчас является технология так называемого прототипирования — 3D-печати. С помощью бесплатной программы 3D Slicer можно перенести данные с компьютерной томографии (КТ) и построить модели, которые может обработать обычный трехмерный графический редактор, например Blender. На нем создаются трехмерные игры — стрелялки, бродилки. А нам он помогает планировать операции.
Мы можем буквально за один вечер получить данные КТ пациента, смоделировать оперативное вмешательство в 3D-редакторе, подобрать, на сколько мы должны изменить угол кости, на сколько удлинить или укоротить ее, подобрать имплант для фиксации, трансплантат, все это рассчитать и почти в тот же вечер распечатать на 3D-принтере шаблоны и направители для операции.
.jpg)
.jpg)
.jpg)
.jpg)
— Сколько времени занимает такая подготовка?
— Само планирование, моделирование — минут 40. В среднем время операции на столько и сокращается, но операционное время очень дорого. Как говорил кардиохирург Дебейки (американский кардиохирург Майкл Эллис Дебейки. — Прим. mos.ru), операционная не место для импровизации. Здесь все должно получаться. А при виртуальном трехмерном планировании можно попробовать один вариант, другой. Так что, мне кажется, эти затраты времени вполне оправданны, особенно при выполнении сложных реконструктивных вмешательств.
— Ваш метод уже применяется на практике?
— Да. На сегодня по этой технологии прооперированы 12 пациентов. Мы начали не так давно — около 10 месяцев назад.
— Какая из этих операций вам запомнилась?
— У молодого пациента 18 лет было повреждение ладьевидной кости. Это маленькая косточка в запястье, но от нее зависит очень многое: если она деформирована или есть ее несросшийся перелом, то появится выраженная боль. А если человек занимается физическим трудом, он не сможет из-за этого работать.
Мы сделали КТ поврежденного и здорового запястья, в трехмерном редакторе отзеркалили ладьевидную кость со здорового запястья и совместили с ладьевидной костью поврежденного, смоделировали кровоснабжаемый трансплантат нужного размера, выяснили, как нам нужно подвинуть отломки ладьевидной кости для воссоздания ее первоначальной формы. И все это в компьютере перед операцией легко встало на свои места.
Если операция без 3D-планирования занимала около двух с половиной часов и было не очень понятно, насколько хорошо мы восстановили анатомию пациента, тут она заняла 1,5 часа. Мы пересадили васкуляризированный трансплантат, восстановили первоначальную форму ладьевидной кости, достигли сращения, и пациент вернулся к работе.
До внедрения этой технологии мне было очень сложно в трехмерном пространстве представить операцию.
.jpg)
— В чем преимущества этого метода для врача и пациента?
— Когда все возможности есть в отделении, это быстрота. Первое время мы это делали в сторонних организациях, и уходила неделя. Мы решили, что все нужно делать, что называется, у постели больного.
Мне как хирургу этот метод позволяет четко представить оперативное вмешательство, спланировать его. А еще, когда есть шаблоны и распечатанные направители, получается очень удобно и хорошо оперировать. Это уже не сложная операция века: и в голове, и в компьютере план есть, все получается быстро и легко.
Благодаря этой технологии более качественно восстанавливается анатомия
Любая минута, проведенная под наркозом на операционном столе, отражается на здоровье пациента, и чем быстрее мы все делаем, тем для него лучше. Кроме того, благодаря этой технологии более качественно восстанавливается анатомия. Чем лучше мы восстановим анатомию, тем лучше результат. Это очень важно для пациента.

— Насколько эта технология затратна?
— Мы живем в век, когда возможности современной телестудии может заменить смартфон, а технология 3D-печати позволяет заменить возможности производства пластиковых изделий. Стоимость материалов для одной операции составляет рублей 20. К тому же сейчас очень хорошо развито так называемое свободное программное обеспечение, и мы пользуемся бесплатным программами для этой технологии.
— То есть московские больницы могут себе позволить такой метод?
— Да. Сам 3D-принтер сейчас стоит 300 долларов.
— Чтобы с ним работать, нужна подготовка?
— Сейчас проще и с подготовкой: посмотрел два-три ролика на YouTube — и вот ты разбираешься в какой-то технологии. Понятно, что к медицине это не относится, но напечатать заготовку — почему нет? Получается быстро, эффективно, недорого. Это фактически распечатанная компьютерная томограмма кости пациента. Обычно мы смотрим двухмерные снимки КТ, а тут мы можем посмотреть и пощупать. И даже для пациента это хорошо, потому что мы можем ему четко объяснить: у вас хронический остеомиелит, в большой берцовой кости вот такая-то полость, мы должны ее убрать.
Планируем развивать технологию дополненной реальности
— Вы планируете еще работать над ней?
— Для меня первое место на конференции — это признание того, что мы движемся в правильном направлении и эти технологии действительно востребованы. Конечно, это мощный стимул продолжать работу. Мы планируем совершенствовать эту технологию и развивать другие направления быстрого прототипирования, в частности технологию дополненной реальности, когда используются очки и совмещается КТ-изображение и реальный объект.
— Что-то похожее уже делается в мире?
— Да, над этим сейчас активно работают, это перспективное направление. Наверное, в скором будущем мы уже будем видеть пациента насквозь, видеть через кожу и оперировать. Чувствуется, что технологии шагнули далеко вперед.
— В чем преимущества вашей технологии в сравнении с зарубежными?
— За рубежом эта технология применяется в основном в челюстно-лицевой хирургии, а мы активно ее применяем при реконструкции конечностей. Также мы совмещаем ее с микрохирургией, по-научному это называется аутотрансплантация васкуляризированных комплексов тканей человека. У человека много донорских мест, и, когда у пациента дефект кожи, кости, мышцы, мы можем взять их для пересадки у него же.

.jpg)

— Чего вы ждете от стажировки в Китае?
— Китайцы, пожалуй, находятся впереди планеты всей в вопросах микрохирургии и реконструктивных вмешательств. Это и хотелось бы посмотреть, набраться опыта. Пока программа находится в стадии разработки.
— На конференции 33 специалиста презентовали свои научные разработки. Какие из них вы бы отметили?
— Мне очень понравилась работа моего коллеги из Боткинской больницы по опухолям мозга. Это тяжелейшая проблема, и отлично, что они ее с большим процентом успеха решают. Они очень четко маркируют границы опухоли с помощью специальных флуоресцентных красителей. Под микроскопом это прекрасно видно. И они используют нейромониторинг: фактически мозг пациента во время операции работает, и врачи следят за тем, чтобы не затронуть какие-то важнейшие нейроструктуры при удалении опухоли и в то же время удалить ее полностью, иначе будет рецидив.
Еще запомнилась работа, связанная с 3D-печатью по гнойным осложнениям при эндопротезировании, и работа по новым видам остеосинтеза, в частности новым видам остеосинтеза переломов ключицы.
Вообще, медицина, наверное, без науки не может существовать, потому что любой врач оценивает результаты своей работы, думает, как можно эти результаты улучшить. А это уже во многом научная деятельность.
— Город поддерживает изыскания московских ученых?
— Да, активно поддерживает. Медицина, особенно в последние годы, стала вполне доходной профессией.
— На премию молодым ученым планируете подавать заявку?
— Я в прошлом году подавал заявку. Мы работали над проблемой аутотрансплантации васкуляризированных комплексов тканей у пациентов с острой травматической патологией. Над технологией 3D-моделирования еще нужно детально поработать, это были предварительные результаты.
— Почему вы выбрали профессию врача?
— Когда я учился в девятом или десятом классе, летом работал в ветеринарной клинике. Мне понравилось лечить. У меня мама — врач, и мне посоветовали не идти в ветеринарию, а заняться лечением людей.
— А почему именно травматология?
— В институте я очень увлекался экстремальными видами спорта, и травматология была для нас самым насущным вопросом. Правда, сам я в больницу с травмами не попадал, Бог миловал.
— Какая у вас профессиональная мечта?
— Когда я еще в школе учился, у меня была мечта работать травматологом в Склифе. Вот она и реализована.
— А что в планах на будущее?
— Ближайшая рабочая и научная цель уже сбывается. Это написание книги о лечении тяжелых открытых переломов. Сейчас мы с научным руководителем этим занимаемся: первую главу уже написали, к маю нужно написать вторую.
Со временем необходимым атрибутом в операционных будут очки виртуальной реальности
— Как, на ваш взгляд, изменилась травматологическая служба в Москве в последнее время?
Во-вторых, произошел прогресс в реконструктивных вмешательствах. Если раньше мы не могли помогать пациентам при тяжелом переломе голени или каких-то тяжелых гнойных осложнениях в области нижней конечности и единственным выходом была ампутация, то сейчас современные технологии позволяют помочь этим пациентам сохранить ногу и вернуться к полноценной жизни.
Технологии меняют наши методики лечения. Со временем, наверное, необходимым атрибутом при выполнении оперативных вмешательств будет интраоперационная компьютерная томография, когда исследование больного можно будет сделать во время операции, и очки дополненной реальности, чтобы результаты исследований и шаблоны операции можно было видеть на реальном теле пациента.
Возможности трехмерного моделирования при резекции почки с селективным пережатием почечных сосудов
Несмотря на преимущества современных методов лучевой диагностики, таких как МСКТ и МРТ, данные диагностические методы не всегда позволяют ответить на все вопросы, интересующие хирурга. В первую очередь это касается крайне необходимой информации об особенностях топографо-анатомических взаимоотношений патологического процесса, в частности опухоли, с важнейшими анатомическими структурами почки и последующим трехмерным визуальным отображением. Это связано с тем, что базовое программное обеспечение даже самых современных томографов не позволяет совместить все 4 фазы контрастного исследования почек и получить всестороннее объемное изображение.
В нашей клинике разработана и успешно применяется новейшая методика, не применявшаяся ранее в урологии – трехмерное компьютерное моделирование патологического процесса. Метод основан на воссоздании единой картины патологического процесса в трехмерном режиме путем совмещения всех четырех фаз исследования почек полученных при МСКТ с контрастным усилением.
В нашей клинике для 3D моделирования используется программное обеспечение Аmira, которое эффективно и без искажений позволяет совместить все четыре фазы визуализации на одном интегральном изображении, что дает исчерпывающую информацию об анатомических особенностях пораженной опухолевым процессом почки.
Рассмотрим несколько примером использование нашей методики при опухоли почки.
При интрасинусных новообразованиях почки трехмерное моделирование позволяет точно определить характер кровоснабжения опухоли и при выполнении органосохраняющих операций произвести интрапаренхиматозное клипирование сосудов, находящихся в зоне резекции или энуклеации. Провести виртуальное удаление опухоли с оценкой раны почки и определение прилегающих структур.
Выполняется ретроперитонеоскопическая энуклеация с интрапаренхиматозным клипированием артериальных и венозных сосудов, питающих опухоль.
В тех случаях, когда опухоль расположена полностью интраренально и внешние границы почки не изменены, выполненное перед операцией моделирование позволяет хирургу сформировать трехмерную модель почки с опухолью и, с помощью наружных ориентиров, таких как сосуды почки, чашечно-лоханочная система и другие, запланировать зону резекции почки.
Выполняется ретроперитонеоскопическая резекция левой почки, ориентируясь на почечные структуры, чашечно-лоханочную систему почки и внешние границы почки.
Следующее направление использования 3D – это селективная ишемия при резекции почки.
Многообразие сосудистой ангиоархитектоники не всегда позволяет точно определить характер кровоснабжения конкретной зоны почки. При трехмерном моделирования появилась возможность построить ветви почечной артерии 2, 3 и иногда 4 порядка. В данном наблюдении опухоль кровоснабжалась не только ветвью нижнесегментарной артерии, но ветью отходящей от верхнесегментарной артерии.
Это хорошо видно в режиме полупрозрачности ткани и виртуального удаления опухоли почки.
В ходе лапароскопической резекции сосудистый зажим наложен только на две ветви питающих зону опухоли.
Хорошо видна граница ишемии между верхней и нижней половиной почки.
В условиях практически сухого операционного поля произведена резекция почки, в то же время верхний сегмент почки продолжает кровоснабжаться.
Наиболее сложная категория пациентов – это пациенты с опухолью единственной функционирующей почки, когда особенно важно время и объем ишемии.
В данном наблюдении у пациента диагностирована опухоль единственной правой почки. При компьютерном моделировании определен не только характер кровоснабжения зоны почки с опухолью, но и выявлена интрапаренхиматозная ветвь непосредственно питающая новообразование.
В ходе лапароскопической операции удалось выделить сегментарные сосуды 3-4 порядка, произвести предварительное клипирование сосуда питающего опухоль и выполнить резекцию при селективном пережатии только сосудов питающих зону интереса.
Использование трехмерного моделирования в ходе нашей работы позволило добиться в послеоперационном периоде процента кровотечений после резекций почки менее 2%.
В одном из номеров нашего журнала (№4, 2011) авторы этой публикации уже познакомили наших читателей с проблемами и методами персонализации лекарственной терапии рака – одной из самых серьезных и трудноизлечимых болезней наших дней. В новой публикации исследователи представляют результаты своей успешной многолетней работы по созданию оригинальной математической модели развития опухолей. Созданная на ее основе компьютерная программа уже в недалеком будущем может стать для специалистов-онкологов незаменимым инструментом при подборе индивидуальных схем лечения конкретным пациентам
Сегодня имеется много подходов к моделированию развития раковой опухоли – этим занимаются и биохимики, и системные биологи, и физики, и математики. И хотя в этих моделях используется большой массив знаний о деталях и механизмах онкологического процесса на клеточном и молекулярном уровнях, однако полноценной модели, адекватно описывающей это явление, до сих пор не создано.
Это и не удивительно, ведь сформировавшаяся опухоль представляет собой сложную систему, состоящую из нескольких миллионов клеток. И если, к примеру, поведение каждой из них описывать своей системой уравнений, то мощности современных компьютеров просто не хватит для проведения необходимых расчетов. Кроме того, такая модель должна учитывать влияние лекарственной терапии: специфическое действие, распространение и выведение лекарств из организма, – что достаточно непросто, а также взаимное влияние лекарств и опухоли, чего пока не делают даже самые сложные из современных моделей.
Такая аналогия далеко не случайна. Как известно, и вода, и лед достаточно стабильны при плавном изменении температуры, но в окрестностях 0 °С свойства системы резко меняются. Какое-то время в ней в относительном равновесии могут существовать сразу обе фазы, резко различающиеся по свойствам, в частности по плотности. Тем не менее этот фазовый переход обратим, а его условия определяются рядом параметров, как внешних для системы, так и внутренних.
Авторы данной статьи на основе этой теории и обобщенного математического описания фазовых переходов начали разработку математического аппарата для моделирования развития раковых опухолей (Mamontov, et al., 2006). Затем был сделан следующий шаг: за четыре года удалось уверенно связать формальные параметры, используемые в модели, с величинами, реально измеримыми на практике.
На пяти постулатах
Модель, описывающая динамику поведения плотных раковых опухолей, базируется на небольшом числе постулатов.
• Концентрация лекарства в тканях и ее изменение в пространстве и времени неразрывно связаны с развитием опухолей в пространстве и времени. Хорошая (адекватная) модель обязана учитывать это обстоятельство, чего не делают в силу своего происхождения фармакокинетические и фармакодинамические модели.
Надо сказать, что все эти постулаты достаточно серьезно обоснованы: на сегодняшний день авторам не удалось обнаружить ни одного экспериментально подтвержденного факта, вступающего с ними в противоречие. Конечно, не следует забывать, что любая модель ограничена и является лишь приближенным описанием действительности. Например, как выше отмечалось, эта модель мало применима к описанию роста опухолей на поздних стадиях развития, когда они густо пронизаны кровеносными сосудами.
Когда потерян контроль
Теперь уже в рамках такого подхода можно качественно описать появление и развитие раковой опухоли.
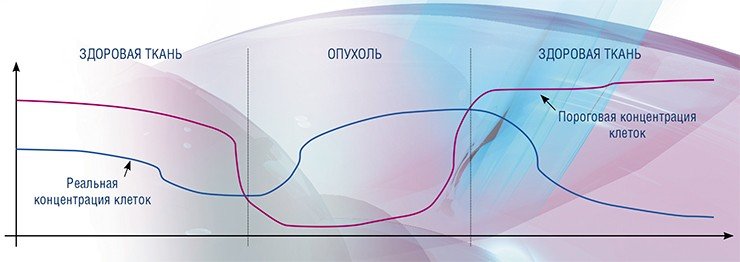
Если же теперь внутривенно ввести лекарственный препарат, то проникнуть в центр опухоли ему будет достаточно сложно: лекарство будет работать только на периферии, там, где доставка пока еще эффективна. При этом регулирование на периферии может восстановиться, и там начнется постепенное уменьшение концентрации клеток. Улучшится и доставка химических веществ к более плотным внутренним частям опухоли. Если концентрация клеток в ткани будет оставаться ниже пороговой, этот процесс при продолжении правильного лечения будет продолжаться вплоть до полного исчезновения опухоли.
В одном уравнении
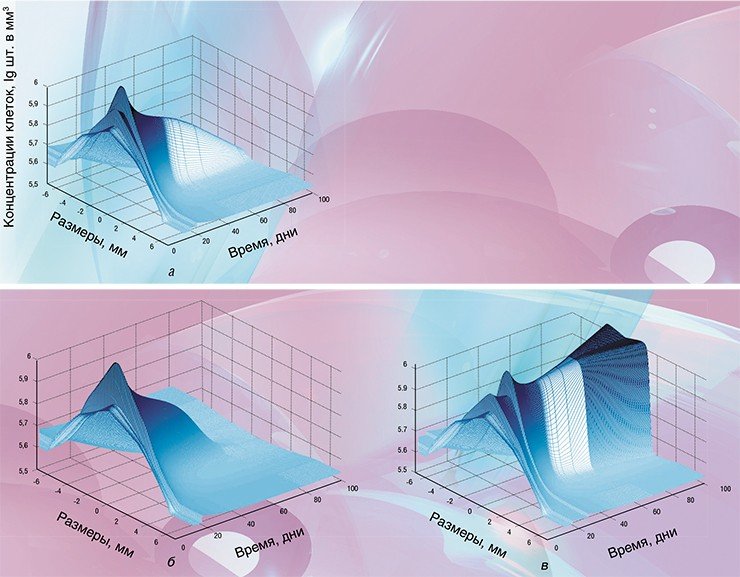
Как она работает
Параметры, которые пользователь должен ввести в программу, разбиты на две основные группы – индивидуальные данные о пациенте и самой опухоли; данные о лекарстве и режиме его использования; а также данные, определяющие режим моделирования.
В первую группу входят результаты анализа ткани, полученной при помощи не совсем обычной биопсии с множественными пробами. Нужны несколько образцов из здоровой ткани, окружающей опухоль, а также из самой опухоли, причем необходимо точно знать расстояния между точками отбора проб.
ОНКОЛОГИЧЕСКИЕ ЗАБОЛЕВАНИЯ И СТРЕСС
Во вторую группу данных, если использовать в качестве примера внутривенные препараты, входят: название препарата из встроенной библиотеки программы, его доза, количество и длительность инъекций. Аналогичный список можно привести для других форм применения препаратов, например таблеток или инъекций, однако точность моделирования при оральном приеме лекарств падает.
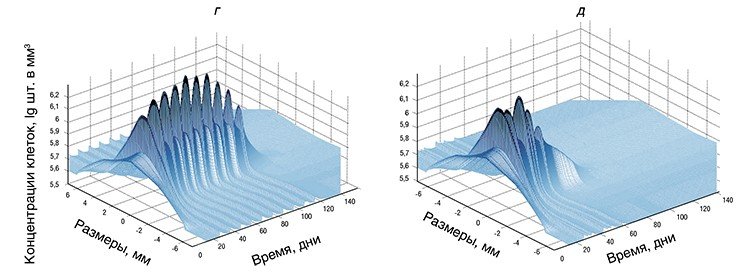
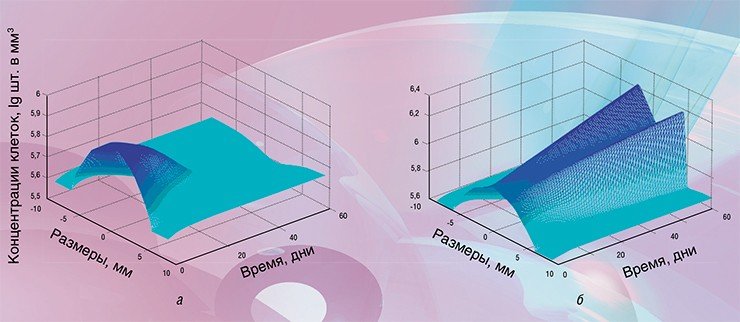
Итак, исходные данные в программу загружены. Сама работа программы занимает около одной минуты даже при использовании сравнительно маломощных ноутбуков. Вывод данных осуществляется в виде, выбранном пользователем, и представляет собой ряд различных графиков и поверхностей, иллюстрирующих динамику развития опухоли при выбранной терапии.
В качестве примера приведем подбор режимов лечения радионуклидными препаратами. В последние годы такие препараты часто вводят дробными дозами, чтобы уменьшить вероятность осложнений, однако вариантов терапии даже при двух дробных дозах существует множество. Если же требуются более мелкие дозы (например, для обеспечения более щадящего режима лечения), то, соответственно, многократно увеличивается и возможное количество вариантов.
В результате многолетней работы удалось создать модель, адекватно описывающую динамику развития опухоли. Качественно модель хорошо согласуется со всеми известными экспериментальными данными. Количественная проверка модели была проведена на основе материалов из архивов Шальгренского исследовательского госпиталя (Гетеборг, Швеция) и результатов собственных экспериментов авторов. С помощью сотрудников Тюменского отделения РАН сейчас проводятся новые эксперименты на лабораторных животных с целью проверки основных постулатов модели без использования статистических методов усреднения.
Basso A. M., Depiante-Depaoli M., and Molina V. A. Chronic variable stress facilitates tumoral growth: reversal by imipramine administration // Life Sciences. 1992. Vol. 50. P. 1789—1796,
Corre P. Le. Bio-équivalence et génériques de principes actifs à marge thérapeutique étroite (Narrow therapeutic index drugs: bioequivalence and generics) // Presse Medicale. Feb 2010. Vol. 39, No. 2. P. 169-176.
Koptioug A., Mamontov E., Myrberg T., Sukhovey Yu. Software for pretherapeutic design of tumor/patient-individual tumor-eradicating drug regimens // Communications in Applied and Industrial Mathematics. 2012 (в печати).
Mamontov E., Koptioug A., and Psiuk-Maksymowicz K. The minimal, phase-transition model for the cell-number maintenance by the hyperplasia-extended homeorhesis // Acta Biotheoretica. 2006. Vol. 54. P. 61–101.
Schepkina V. D., Chenevert T. L., Kuszpit K., Lee K. C. et al. Sodium and proton diffusion MRI as biomarkers for early therapeutic response in subcutaneous tumors // Magnetic Resonance Imaging. 2006. Vol. 24. P. 273–278.
Современная технология трёхмерного моделирования при раке почки создана на основе принципов компьютерной обработки снимков, получаемых при выполнении МСКТ. Мультиспиральная компьютерная томография является одним из передовых методов диагностики рака почки.
Трёхмерное моделирование открывает перед хирургами огромные перспективы. Они получили возможность моделировать процесс выполнения операций, чтобы учесть все возможные сложности, которые могут возникать в ходе оперативного вмешательства, в том числе и при органосохраняющих операциях.

При помощи технологии 3D моделирования патологического процесса врачи воспринимают анатомический блок намного лучше. Современная техника позволяет создать изображение из нескольких слоёв, каждый из которых обладает разной степенью прозрачности. Уролог видит орган полностью, включая кровеносные сосуды, чашечно-лоханочную систему и соотношение данных структур с патологическим процессом в почке. Во время операции хирург не имеет такой возможности, потому моделирование позволяет заранее предусмотреть многие ситуации во время операции.
Различные анатомические структуры на изображении выделены разными цветами. Модель органа может быть, как статичной, так и вращаемой. При таких заболеваниях, как рак почки, крайне важно иметь максимум информации перед операцией.
Используя метод наложения изображения, врачи исследуют топографическое взаимоотношения различных анатомических структур. Это имеет огромное значение, когда планируется операция, в ходе которой необходимо сохранить орган (резекция почки).
Подобные исследования позволяют с большой точностью проводить и более радикальные операции, такие, как лапароскопическая нефрэктомия.
3D-технология позволяет смоделировать ход операции и избежать негативных последствий, таких, как сильные кровотечения, приводящие к летальному исходу.
Хирург получает возможность рассмотреть почку пациента во всех ракурсах, многие из которых просто невозможно получить при помощи видеолапароскопа в ходе лапароскопической операции. Используя 3D-очки, врачи могут видеть объёмную картину.
В настоящее время для органосохраняющих операций активно используются виртуальные технологии моделирования. В нашей стране их начали применять в 2010 году. Первые шаги в этом направлении сделал академик Юрий Геннадьевич Аляев. Этот выдающийся уролог является директором клиники урологии Первого МГМУ им. И.М. Сеченова, и заместителем директора НИИ Уронефрологии и репродуктивного здоровья человека. Он активно развивает в России методики визуализации, что дало возможность качественно поднять уровень отечественной диагностики и мониторинга рака почки.
При помощи трёхмерного моделирования сейчас проводятся исследования в области таких заболеваний, как опухоли почек, гидронефроз и коралловидный нефролитиаз. Удаление опухоли почки становится намного безопаснее после того, как операция будет полностью смоделирована.
Данные методики позволяют с большей эффективностью проводить подготовку и обучение специалистов. Врачи получили возможность создавать точный прогноз хода операции. Благодаря этому существенно снизился травматизм и процент осложнений, возникающих как в ходе операций, так и после них.
Современная технология трёхмерного моделирования при раке почки создана на основе принципов компьютерной обработки снимков, получаемых при выполнении МСКТ. Мультиспиральная компьютерная томография является одним из передовых методов диагностики рака почки.
Трёхмерное моделирование открывает перед хирургами огромные перспективы. Они получили возможность моделировать процесс выполнения операций, чтобы учесть все возможные сложности, которые могут возникать в ходе оперативного вмешательства, в том числе и при органосохраняющих операциях.

При помощи технологии 3D моделирования патологического процесса врачи воспринимают анатомический блок намного лучше. Современная техника позволяет создать изображение из нескольких слоёв, каждый из которых обладает разной степенью прозрачности. Уролог видит орган полностью, включая кровеносные сосуды, чашечно-лоханочную систему и соотношение данных структур с патологическим процессом в почке. Во время операции хирург не имеет такой возможности, потому моделирование позволяет заранее предусмотреть многие ситуации во время операции.
Различные анатомические структуры на изображении выделены разными цветами. Модель органа может быть, как статичной, так и вращаемой. При таких заболеваниях, как рак почки, крайне важно иметь максимум информации перед операцией.
Используя метод наложения изображения, врачи исследуют топографическое взаимоотношения различных анатомических структур. Это имеет огромное значение, когда планируется операция, в ходе которой необходимо сохранить орган (резекция почки).
Подобные исследования позволяют с большой точностью проводить и более радикальные операции, такие, как лапароскопическая нефрэктомия.
3D-технология позволяет смоделировать ход операции и избежать негативных последствий, таких, как сильные кровотечения, приводящие к летальному исходу.
Хирург получает возможность рассмотреть почку пациента во всех ракурсах, многие из которых просто невозможно получить при помощи видеолапароскопа в ходе лапароскопической операции. Используя 3D-очки, врачи могут видеть объёмную картину.
В настоящее время для органосохраняющих операций активно используются виртуальные технологии моделирования. В нашей стране их начали применять в 2010 году. Первые шаги в этом направлении сделал академик Юрий Геннадьевич Аляев. Этот выдающийся уролог является директором клиники урологии Первого МГМУ им. И.М. Сеченова, и заместителем директора НИИ Уронефрологии и репродуктивного здоровья человека. Он активно развивает в России методики визуализации, что дало возможность качественно поднять уровень отечественной диагностики и мониторинга рака почки.
При помощи трёхмерного моделирования сейчас проводятся исследования в области таких заболеваний, как опухоли почек, гидронефроз и коралловидный нефролитиаз. Удаление опухоли почки становится намного безопаснее после того, как операция будет полностью смоделирована.
Данные методики позволяют с большей эффективностью проводить подготовку и обучение специалистов. Врачи получили возможность создавать точный прогноз хода операции. Благодаря этому существенно снизился травматизм и процент осложнений, возникающих как в ходе операций, так и после них.
Читайте также:

