Эпидемиология рака молочной железы
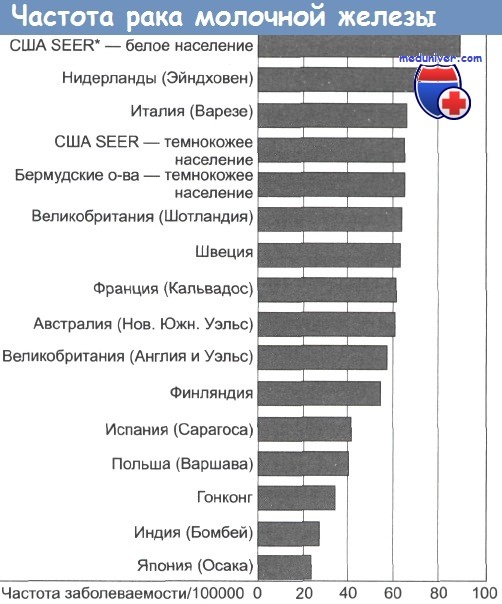
Рак молочной железы является наиболее распространенным женским онкозаболеванием. Ежегодно в Великобритании диагносцируется почти 40 000 новых случаев заболевания этим раком, а в США — 143 000 случаев. За последние 50 лет частота заболеваемости раком молочной железы постепенно увеличилась, причем отмечаются существенные различия в географическом распространении. В развитых странах Запада этот рак распространен в гораздо большей степени, чем в развивающихся странах.
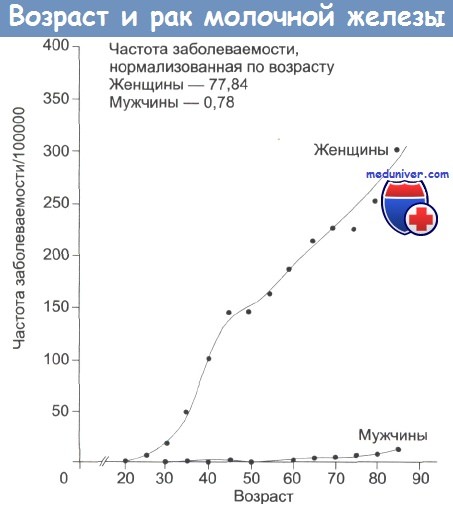
На рисунке ниже представлена заболеваемость раком молочной железы в зависимости от возраста. В среднем, у одной из десяти женщин в течение жизни развивается рак молочной железы, что делает эту болезнь основной причиной смерти от онкозаболеваний среди женщин Запада. Этот вид рака настолько распространен в Великобритании, что примерно половина всех раковых пациенток больны раком молочной железы.
Известен ряд этиологических факторов, предрасполагающих к развитию рака молочной железы. Так, риск заболевания оказывается в три раза выше у женщин, ближайшие родственники которых болели этим раком. Особенно высокая степень риска отмечена для дочерей тех женщин, у которых в период пременопаузы был диагносцирован рак молочной железы. Для них вероятность заболевания увеличивается в 3-11 раз. Женщины, впервые родившие ребенка в возрасте свыше 30 лет, почти в три раза чаще заболевают раком молочной железы, чем женщины, родившие в возрасте до 20 лет.
Степень риска возрастает также для тех женщин, у которых в анамнезе отмечены доброкачественные заболевания молочной железы, особенно такие как эпителиоз и клеточная атипия. Опухоли развиваются чаще при раннем наступлении менструаций и поздней менопаузе, причем удаление яичников, проведенное в раннем периоде жизни, оказывает некоторое защитное действие. Известно, что профилактическое удаление яичников, проведенное у женщин с мутациями по генам BRCA1 и BRCA2, существенно снижает риск развития рака молочной железы. В настоящее время проводят генетический анализ мутаций у женщин, составляющих группу повышенного риска, т. е. из семей с наследственным раком молочной железы или яичников.
В случае положительных результатов для снижения риска заболевания, в качестве профилактической меры предусматривается возможность проведения у них двухсторонней мастэктомии и/или сальпингоэктомии. Для этой категории женщин особенно трудно сделать выбор между такими профилактическими мерами и возможностью ранней диагностики заболевания. Это связано с сомнительной эффективностью скрининговых процедур и с довольно сложной системой аргументов в пользу проведения профилактической операции.
Недавно The National Institute for Clinical Excellence (NICE) в Великобритании выпустил руководство, в котором приводятся основные критерии отбора женщин, входящих в группу повышенного риска развития семейного рака, и излагаются принципы дальнейшего клинического наблюдения за ними. В зависимости от степени риска, для этих женщин предусматривается несколько категорий клинических обследований: первая, вторая и третья. Данные о влиянии применения пероральных противозачаточных средств на развитие рака молочной железы носят противоречивый характер. Тем не менее среди женщин, пользующихся противозачаточными средствами, рак развивается не чаще, чем у тех, кто к ним не прибегает.
В масштабных исследованиях, проведенных в США (Women s Health Initiative, WHI), было показано, что после 5,2 лет применения эстрогенов/прогестина у женщин возникает дополнительный риск заболевания раком молочной железы, который составляет 26%. Наряду с этим увеличивается риск развития инсульта и кардиологических заболеваний. В наблюдениях за жертвами атомной бомбардировки Хиросимы было показано увеличение среди них случаев заболевания раком молочной железы. Демографические различия в заболеваемости, скорее, больше связаны с рационом питания, культурными и географическими различиями, чем с антропологическими характеристиками. Так, у дочерей и внучек женщин, переехавших в США из Японии и Гавайских о-ов, рак молочной железы развивается с такой же частотой, как и у американок. По результатам исследований международной группы эпидемиологов, потребление большого количества жиров вряд ли влияет на развитие заболевания.
Однако выявлена взаимосвязь между заболеваемостью раком молочной железы и неумеренным потреблением алкоголя. К числу факторов, содержащихся в продуктах питания и способных предотвращать развитие рака молочной железы, относятся серусодержащие органические соединения (S-аллилцистеин, присутствующий в чесноке и в растениях из семейства крестоцветных, например в брюссельской капусте), индол-3-карбинол (также присутствующий в крестоцветных), каротиноиды (бета-каротин в зеленых и желтых овощах), витамин Е, селен и полифеноловые антиоксиданты чая, а также флавоноиды.
Как можно предполагать на основании последних исследований, у женщин, ведущих активный образ жизни и регулярно выполняющих оздоровительные физические упражнения, риск заболевания раком молочной железы снижается. Тем не менее риск заболевания среди женщин, которые пользуются гормональной заместительной терапией, или эстрогенами, или их комбинацией с прогестинами, остается несколько более высоким. Небольшой добавочный риск, по крайней мере частично, может компенсироваться такими более благоприятными последствиями гормональной терапии, как, например, снижение риска развития остеопороза.
Обычно через 5 лет после прекращения приема гормонов этот эффект не проявляется. В недавно выполненном большом исследовании продемонстрирована важная роль грудного вскармливания в предотвращении заболевания раком молочной железы. Прослежена четкая взаимосвязь между продолжительностью периода кормления грудью и риском развития заболевания. Относительное снижение заболеваемости достигает 4,3% на каждый год грудного кормления, и с рождением каждого нового ребенка заболеваемость снижается еще на 12%. Эти выводы остаются справедливыми для женщин, живущих как в развитых, так и в развивающихся странах, не зависят от их возраста и возраста установления менопаузы, от принадлжености женщин к той или иной этнической группе, возраста первой беременности, и от общего количества рожденных детей.
Как показали авторы исследования, кумулятивная частота заболеваемости раком молочной железы в развитых странах могла бы снизиться более чем в два раза (с 6,3 до 2,7 на 100 женщин 70-летнего возраста), если бы женщина имела не менее 2-3 детей, и на протяжении всего детородного периода вскармливала их грудью. До недавних пор это было распространено среди женщин в развивающихся странах. По мнению авторов, грудное вскармливание обеспечивает почти две трети общего снижения заболеваемости раком молочной железы.
Вообще в настоящее время наблюдается снижение смертности от рака молочной железы. Это, вероятно, связано с совершенствованием методов ранней диагностики и лечения, а также с внедрением Национальной программы скрининговых исследований в Великобритании. Как показали последние исследования, прием аспирина снижает риск возникновения рака молочной железы. Так при ежедневном приеме этого препарата риск снижается на 28% — с вероятностью успешного исхода 0,72, причем эффект более выражен у женщин в периоде постменопаузы.
Идентификация и клонирование генов BRCA1 и BRCA2 позволили понять молекулярные основы происхождения семейного рака молочной железы. Присутствие мутаций в этих генах обуславливает на протяжении жизни 50-85%-ю вероятность заболевания раком молочной железы, обычно в периоде постменопаузы. При этом риск развития рака яичника составляет 15-45%. Однако большое число случаев спорадического рака не связано с генами BRCA1 и BRCA2, и известны другие гены, которые также определяют предрасположенность к этому заболеванию, например ген, кодирующий белок р53. К группе повышенного риска также относятся женщины, у которых выявляется мутантный ген атаксии те-лангиэктазии. Ген BRCA1 состоит из 5711 пар оснований и занимает около 100 кбаз.
Общие сведения
• Рост частоты инфильтрирующего рака объясняется большим распространением скрининга, увеличением доли пожилого населения, социальными тенденциями, более поздним наступлением первой беременности и увеличением частоты применения гормонозаместительной терапии (ГЗТ).
• Маммографический скрининг на 40% снизил летальность от рака молочной железы у женщин в возрасте 50-70 лет.
• Выживаемость при органосохраняющих хирургических вмешательствах (ОСХВ) при операбельных I и II стадиях рака молочной железы эквивалентна таковой при мастэктомии.
• Органосохраняющие хирургические вмешательства применимы у большинства пациенток, страдающих злокачественными новообразованиями размером менее 4 см, при этом края резекции более 1 мм не снижают частоту местного рецидивирования и неблагоприятно влияют на косметический эффект операции.
• Мастэктомия является предпочтительной операцией для пациенток, которые: (а) выбирают мастэктомию; (б) имеют несколько опухолевых очагов; (в) имеют крупные неинфильтрирующие опухоли, или для тех, (г) у которых ОСХВ приведет к неприемлемому косметическому результату (большая часть опухолей размером свыше 4 см).
• Всем пациенткам с инфильтрирующим раком следует удалять и подвергать гистологическому исследованию подмышечные лимфатические узлы, однако применение подмышечной лимфаденэктомии рекомендуется ограничивать пациентками с вовлечением подмышечных лимфатических узлов или пациентками с высоким риском их вовлечения. Пациенткам с вовлечением подмышечных лимфатических узлов следует проводить лимфаденэктомию подмышечных лимфатических узлов (ЛПЛУ) или лучевую терапию на область подмышечной ямки.
У пациенток, перенесших органосохраняющие хирургические вмешательства по поводу инфильтрирующего рака молочной железы, следует проводить лучевую терапию, захватывая всю молочную железу, с дополнительными дозами у более молодых пациенток (до 60 лет).
У пациенток с высоким риском местного рецидива после мастэктомии эффективна лучевая терапия на область грудной стенки, которая снижает частоту местных рецидивов и улучшает выживаемость.
У пациенток, страдающих положительным к рецепторам эстрогена (ЭР) и/или прогестерона (ПР) инфильтрующим раком молочной железы, следует рассмотреть необходимость назначения гормональной терапии.
Химиотерапия существенно снижает частоту местных рецидивов, особенно у молодых женщин.
Добавление герцептина снижает частоту рецидивирования на 50% у пациенток с положительным анализом на HER2.
Пациенткам с крупными операбельными опухолями или местнораспространенным раком молочной железы (МРМЖ) можно назначать неоадъювантную химиотерапию с целью уменьшения размеров опухоли, что в дальнейшем позволит выполнить менее объемное хирургическое вмешательство или сделает МРМЖ операбельным.
Хотя неоадъювантная химиотерапия используется наиболее часто, предпочтительным методом у женщин в периоде постменопаузы с крупными, насыщенными ЭР злокачественными опухолями является неоадъювантная эндокринная терапия.
Эпидемиология, факторы риска и генетика
Каждый год в мире диагностируется свыше миллиона новых случаев инфильтрирующего рака молочной железы. Рак молочной железы является самой распространенной среди женщин злокачественной опухолью и составляет 18% от всех злокачественных опухолей, развивающихся у женщин. Заболеваемость увеличивается, в крупных западных странах рак поражает одну из восьми женщин.
Заболеваемость раком молочной железы увеличивается с возрастом, удваиваясь каждые 10 лет до наступления менопаузы, когда скорость нарастания заболеваемости уменьшается.
Скорректированные по возрасту заболеваемость и летальность варьируют между отдельными странами, но эти различия начинают исчезать. Среди мигрантов, перебирающихся с востока на запад, частота рака молочных желез равна его частоте в родной стране лишь в пределах одного-двух поколений. Это указывает на то, что факторы окружающей среды имеют большее значение, чем генетические факторы.
Значительная генетическая предрасположенность обусловливает до 10% случаев рака молочной железы в западных странах. Два подробно описанных гена — BRCA1 и 2, расположенные на длинных плечах хромосом 17 и 13 соответственно, — встречаются у значительной части семей высокого риска. Гены p53 и PTEN, несмотря на их редкость, связаны с синдромами семейных злокачественных опухолей, которые включают высокий риск развития рака молочной железы.
Описано немного семей, в которых многочисленные случаи рака молочной железы приписываются мутациям генов ATM и Chk2. Вероятно, имеются пока не описанные гены, вносящие вклад в развитие опухолей. Критерии выявления женщин со значительно повышенным риском, основанные на их семейном анамнезе, которые могут применяться как показания к генетическому тестированию и скринингу в молодом возрасте, изложены в табл. 5.1.
Таблица 5.1. Критерии выявления женщин, имеющих риск развития рака молочной железы
Следующие категории указывают на женщин, имеющих риск развития рака молочной железы, в три или более раза превосходящий риск среди населения в целом
Женщина, которая имеет:
• одну родственницу первой степени родства* с двусторонним раком молочных желез или раком молочной железы и яичников;
• одну родственницу первой степени родства с раком молочной железы, диагностированным в возрасте младше 40 лет, или одного родственника первой степени родства мужского пола, страдавшего раком молочной железы, диагностированным в любом возрасте;
• двух родственниц первой или второй степени родства, больных раком молочной железы, диагностированным в возрасте до 60 лет, или раком яичников в любом возрасте по той же семейной линии;
• трех родственниц первой или второй степени родства, страдавших раком молочных желез и раком яичников, по одной семейной линии.
Критерии выявления женщин с крайне высоким риском, которым может быть показано генетическое тестирование
Женщины, имеющие пролиферативные изменения молочных желез, особенно атипичную гиперплазию эпителия, имеют риск развития рака молочных желез в четыре-пять раз выше. Другие доброкачественные изменения, включая пальпируемые кисты, сложную фиброаденому, папиллому протоков, склерозирующий аденоз и распространенную гиперплазию эпителия, имеют немного более высокий, но клинически незначимый риск рака молочных желез.
Ионизирующее облучение, особенно лучевая терапия всего тела, выполненная в молодом возрасте по поводу лимфомы Ходжкина, увеличивает у женщин риск и обязывает к проведению раннего скрининга.
Раннее менархе, поздняя менопауза, бездетность и поздняя первая беременность увеличивают риск развития рака молочной железы, как и препараты комбинированной ГЗТ, назначаемые после менопаузы (табл. 5.2).
Таблица 5.2. Установленные и вероятные факторы риска рака молочной железы
| Фактор | Относительный риск | Группа высокого риска |
| Возраст | > 10 | Пожилые |
| Географическое расположение | 5 | Развитые страны |
| Возраст менархе | 3 | Возраст до 11 лет |
| Возраст менопаузы | 2 | Возраст старше 54 лет |
| Возраст первой полноценной беременности | 3 | Первый ребенок в возрасте 40-45 лет |
| Семейный анамнез | > 2 | Рак молочной железы у родственницы первой степени родства в молодом возрасте |
| Предшествующее доброкачественное состояние | 4-5 | Атипичная гиперплазия |
| Рак другой молочной железы | 4 | |
| Социально-экономическая группа | 2 | I и II социально-экономические группы |
| Диета | 1,5 | Высокое потребление насыщенных жирных кислот |
| Предменопауза | 0,7 | индекс массы тела (ИМТ) > 35 |
| Постменопауза | 2 | ИМТ > 35 |
| Потребление алкоголя | 1,3 | Чрезмерное потребление |
| Воздействие ионизирующего излучения | 3 | Патологическое воздействие на девочек старше 10 лет |
| Прием экзогенных гормонов | ||
| Оральные контрацептивы | 1,24 | Прием в настоящий момент |
| Комбинированная гормонозаместительная терапия | 2,3 | Прием свыше 10 лет |
| Применение только эстрогенов | 1,3 | Прием свыше 10 лет |
| Диэтилстильбэстрол | 2 | Прием во время беременности |
Клиническая картина, предоперационное обследование и диагностика
Женщины, страдающие раком молочной железы, либо обращаются в лечебные учреждения по поводу симптоматики, либо выявление опухоли осуществляется посредством скрининга.
Все пациентки, обратившиеся в специализированные лечебные учреждения либо имеющие выявленные при скрининге подозрительные образования, должны быть подвергнуты тройному обследованию — сочетанию физикального осмотра, визуализирующего исследования и цитологического исследования с помощью трепанобиопсии, тонкоигольной аспирационной биопсии (ТАБ) или обоих методов.
В специализированных лечебных учреждениях с большим потоком пациентов тройное обследование может предприниматься в амбулаторных условиях.
Втяжение кожи наблюдается у 25% пациенток с пальпируемой под участком кожи опухолью, но симптом также может быть обусловлен хирургическим вмешательством, травмой или доброкачественной патологией.
Пальпацию молочной железы следует выполнять в положении пациентки лежа с запрокинутыми за голову руками. Это облегчает выявление патологически измененных участков. Ткани пальпируют кончиками пальцев. Если обнаруживают отдельное образование, то следует описать его контур, консистенцию и степень глубокой фиксации к грудным мышцам.
Образование следует измерить циркулем и обозначить на рисунке любые обнаруженные изменения. Следует проверить подмышечные и надключичные лимфатические узлы, но их физикальная оценка неточна.
Маммография выполняется у имеющих симптомы женщин в возрасте старше 35 лет. До этого возраста ткани молочной железы обладают повышенной рентгеновской плотностью, и поэтому маммография имеет ограниченную ценность.
У более молодых женщин маммографию следует проводить, только если имеется сильное клиническое подозрение на наличие злокачественного новообразования. Маммография, выполняемая каждые 2-3 года начиная с 50-летнего возраста, также считается обоснованным методом скрининга и снижает летальность в последующем на 40%.
Чтобы выявить объемное образование, деформацию паренхимы и микрокальцификаты, исследование выполняют в двух проекциях — косой и краниокаудальной.
У женщин до 35 лет ультразвуковое исследование (УЗИ) молочных желез является наиболее эффективным визуализирующим методом исследования. У пожилых женщин оно может использоваться для дополнительного определения локализации пальпируемых и маммографических образований.
Пучок высокочастотных звуковых волн направляется через молочную железу, его отражение улавливается датчиком и превращается в изображение. Злокачественные опухоли обычно имеют неразличимые края и гипоэхогенный характер.
Магнитно-резонансная томография (МРТ) не используется в клинической практике рутинно, однако является точным способом визуализации молочных желез. Ее чувствительность в отношении диагностики злокачественных новообразований высока, а метод ценен своей способностью демонстрировать распространенность инфильтрирующих и неинфильтрирующих форм.
Роль МРТ в улучшении частоты успешных случаев ОСХВ в настоящее время оценивается. Доказано, что магнитно-резонансная томография является эффективным методом скрининга у женщин высокого риска в возрасте от 35 до 50 лет и является оптимальным методом визуализации имплантатов молочной железы.
Биопсия молочной железы
Трепанобиопсия предпочтительнее цитологического исследования с ТАБ, поскольку позволяет дифференцировать инфильтрирующий и неинфильтрирующий рак. Местным анестетиком с добавлением эпинефрина инфильтрируют ткани вокруг опухоли.
Через небольшой разрез кожи извлекают столбик тканей объемного образования либо участка ультразвуковых или маммографических изменений с помощью иглы 14-го размера и механического пистолета. Берут несколько столбиков тканей, чтобы гарантировать информативность образцов всех частей образования и можно было установить его природу.
Если осмотр и визуализирующие исследования подтверждают подозрение на злокачественное образование, требуется проведение биопсии молочной железы. Аспирация солидных образований нацелена на получение достаточного количества клеток для цитологического исследования.
Проведение манипуляции под контролем визуализирующих исследований увеличивает точность при небольших и непальпируемых образованиях. Результаты можно получить в течение часа.
Классификация инфильтрирующего рака молочной железы
Рак молочной железы происходит из эпителиальных клеток, выстилающих терминальные протоки ацинусов. Инфильтрирующий рак молочной железы является опухолью, при которой происходит диссеминация опухолевых клеток за пределы базальной мембраны протоков и долек в окружающие нормальные ткани.
В наиболее часто используемой классификации инфильтрирующего рака молочной железы его подразделяют на протоковый и дольковый типы. Эта классификация основывается на допущении, что протоковый рак in situ возникает из протоков, а дольковый рак — из долек. Очевидно, что оба инфильтрирующих рака — протоковый и дольковый — возникают из терминальных протоков ацинусов молочной железы, поэтому данная терминология более не считается правильной, хотя и сохраняет широкое хождение.
Некоторые опухоли демонстрируют отличительный характер роста и клеточной морфологии. На этом основании выделяют определенные типы рака молочной железы. Опухоли, которые имеют особые признаки, называют инфильтрирующим раком особого типа, тогда как остальные таковыми не считаются.
При определенных опухолях особого типа прогноз значительно лучше, чем при опухолях, не относящихся к таковым (рис. 5.1). Так называемый инфильтрирующий дольковый рак (ИДР) может быть трудно диагностируемым ввиду своего гистологического типа, когда инфильтрация одиночными клетками не формирует — ни клинически, ни при визуализирующих методах исследования — хорошо видимого образования.

Рис. 5.1. Процедура тройного обследования с биопсией
Прогностическую информацию об опухолях, не относящихся к особому типу, можно получить, оценив стадию дифференцировки опухоли. Степени формирования желез, плеоморфизма ядер, частоты митозов оцениваются от 1 до 3 баллов. Эти значения комбинируются и превращаются в три группы: 1-я степень (3-5 баллов), 2-я степень (6 и 7 баллов) и 3-я степень (8 и 9 баллов).
Данная классификация по степеням является важным прогностическим фактором в отношении безопухолевой и общей продолжительности жизни. Гистологические признаки лимфатической или сосудистой инфильтрации (ЛСИ) сопровождаются повышенным риском местных и отдаленных рецидивов.
Внедрение методов молекулярной диагностики ознаменовало изменение описания рака молочной железы. В настоящее время в рутинном порядке устанавливается наличие эстрогеновых рецепторов (ЭР), прогестероновых рецепторов (ПР) и HER2.
Определение стадии инфильтрирующего рака
К раку молочной железы часто применяются двухстадийные классификации, однако ни одна из них не подходит достаточно хорошо к данному виду опухолей. Классификация TNM (опухоль, лимфатические узлы, метастазы) базируется на данных осмотра и клинической оценке состояния лимфатических узлов, что не обеспечивает ее надежность. Классификация International Union Against Cancer (UICC, Международный союз по борьбе с онкологическими заболеваниями) включает классификацию TNM.
Для совершенствования классификации TNM в нее включена отдельная гистологическая классификация, которая позволяет учитывать размер опухоли и состояние лимфатических узлов по оценке патологоанатома. Прогноз и лечение зависят от стадии опухоли на момент установления диагноза (табл. 5.3 и 5.4).
Таблица 5.3. Классификация инфильтрирующего рака молочной железы
| Особые типы | Обычный тип (ОТ) |
| • Классический дольковый • Тубулярный • Коллоидный/слизистый • Ситовидный • Папиллярный • Медуллярный • Классический дольковый | Классический протоковый* |
Примечание: *Прогностическая информация относительно такого рака может быть получена в соответствии со стадией.
Таблица 5.4. Классификации рака молочной железы TNM и UICC
| Классификация рака молочной железы TNM | |
| Tis Ракin situ | N0 Метастазы в регионарные лимфатические узлы отсутствуют |
| T1 0,5-1 см, T1c 1-2 см) | N1 Пальпируемые подвижные пораженные подмышечные лимфатические узлы на стороне поражения |
| T2 > 2-5 см | N2 Спаянные вовлеченные подмышечные лимфатические узлы на стороне поражения |
| T3 > 5 см | N3 Вовлечение внутренних маммарных лимфатических узлов на стороне поражения (редко выявляемое клинически) |
| T4a Прорастание грудной клетки | M0 Признаков отдаленных метастазов нет |
| T4b Прорастание кожи (изъязвление, прямая инфильтрация, апельсиновая корка и сателлитные узелки) | M1 Отдаленные метастазы (включают метастазы в надключичные лимфатические узлы на стороне поражения) |
| T4c T4a и T4b вместе | |
| T4d Воспалительный рак | |
| Сопоставление классификаций UICC (1987) и TNM | |
| Классификация TNM | Стадия по классификации UICC |
| T1, N0, M0 | I |
| T1, N1, M0; T2, N0-1, M0 | II |
| Любая T, N2-3, M0; T3, любая N, M0; T4, любое N, M0 | III |
| Любое T, любое N, M1 | IV |
Большинству пациенток с операбельным или ранним раком молочной железы требуется только ограниченный ряд предоперационных исследований. Обычно проводят общий анализ крови, функциональные пробы печени и рентгенографию органов грудной клетки.
При небольших опухолях редко встречаются отдаленные метастазы; и дополнительных исследований не требуется, если первичный общий анализ крови и рентгенография органов грудной клетки в норме. Если имеются местные симптомы или по результатам данных исследований обнаружены какие-либо изменения, то выполняют сцинтиграфию печени и костей скелета.
К.И. Бленда, М.У. Бухлера, А. Ксендес, М.Г. Сарра, О.Д. Гардена, Д. Уонга
Рак молочной железы — злокачественное новообразование, развивающееся из клеток эпителия протоков и/или долек паренхимы железы.
Эпид-я. РМЖ на 1 месте в структуре онкологической заболеваемости женщин. На 2 месте в мире. На 5 месте в Бел. Самые высокие показатели - в США.Самую низкую заболеваемость регистрируютв странах Африки.Заболеваемость РМЖ увеличивается с возрастом,начиная с 40 и достигая пика в 60-65 лет. Для женщин 70 лет ежегодный риск заболевания РМЖ в 3 раза выше, чем для женщин в возрасте 40 лет, а ежегодный риск смерти от РМЖ в 5 раз выше, чем для женщин 40 лет.
Этиол-я. Доказана наследственнаяая предрасположенность к РМЖ. Исходя из этого, выделяют:
• спорадический рак (около 68%); нет случаев рака молочной железы у обоих родителей в 2 поколениях;
• семейный РМЖ (около 23%).Случаи РМЖ у одного или нескольких кровных родственников;
• генетическое предрасположение к раку в результате наличия мутаций генов BRCA1/BRCA2 (около 9%). Отмечают случаи РМЖ у кровных родственников, а также ассоциированный рак (первичная множественность — поражение яичников, толстой кишки).
Группы риска по раку молочной железы зависят от следующих этиологических факторов:
1. Гормональные факторы:
а) эндогенные - гиперэстрогенемия в результате:
- особенностей менструального цикла (раннее менархе до 12 лет; поздняя менопауза после 55 лет)
- детородной функции (нерожавшие, 1-ые роды после 30 лет; аборты до 18 лет и после 30 лет)
- особенностей лактации (гипо- и агалактия)
- особенностей половой жизни (ее отсутствие, позднее начало, фригидность, механические способы контрацепции)
- заместительная терапия гормонами в пред- и постменопаузе сроком более 5 лет.
- длительный прием комбинированных оральных контрацептивов: более 4 лет до первых родов, более 15 лет в любом возрасте.
2. Факторы образа жизни и окружающей среды
- географическое расположение и питание (высококалорийная диета, избыточное потребление животных жиров, малая физическая активность)
- злоупотребление алкоголя (увеличивают риск на 30%)
- курение (до 16 лет – увеличивает риск в 2 раза)
- радиация (облучение) и травмы молочных желез
3. эндокринно-метаболические нарушения: ожирение, атеросклероз, заболевания надпочечников и щитовидной железы
4. индивидуальный анамнез:
- возраст старше 40 лет
- ранее перенесенный рак молочной железы или рак яичников
5. Предшествующие заболевания молочных желез
- атипическая гиперплазия молочных желез
6. Семейный анамнез: генетические факторы:
- наличие у ближайших родственников рака молочной железы, рака яичника, колоректального рака
- связь с наследственными синдромами (Cowden, BLOOM)
- мутации генов BRCA-1; BRCA-2
Патогенез. Вследствие воздействия факторов – активация пролиферативных процессов, акт-я продукции ФСГ- увелич. фолликула – увелич. эстрогены – пролиферация слизистой матки, эпителия протоков железы.
Факторы защиты: ранняя беременность, первый ребёнок мальчик, долг. вскармливание.
Клинические проявления РМЖ.
1) безболезненное плотное образование различных размеров, округлой или неправильной формы, с бугристой поверхностью, незначительным ограничением подвижности (если не прорастает в грудную стенку). Молочная железа часто деформирована (увеличена или уменьшена, имеет локальное выбухание, срезанный контур).
б) симптом площадки – при приеме, аналогичном предыдущему, появляется уплощенный участок фиксированной кожи
в) симптом втяжения (умбиликации) – при приеме, аналогичном предыдущему, появляется легкое втяжение
г) симптом лимонной корки – лимфатический отёк кожи, виден визуально
д) утолщенная складка ареолы (симптом Краузе)
е) изменение цвета кожи над опухолью
ж) раковая язва – не глубокая, плотнее окружающих тканей, имеет подрытые, выступающие над поверхностью кожи края и неровное дно, покрытое грязноватым налетом
3) симптомы со стороны соска: изменения формы и положения соска, втяжения соска и ограничение его подвижности вплоть до полной фиксации (симптом Прибрама – смещение опухоли вместе с соском – результат прорастания опухолью выводных протоков железы), геморрагическое отделяемое из соска
4)Увеличение подмышечных лимфоузлов.
5) Изолированный отёк.
Вторичные симптомы: изьязвление кожи, кровотечения, присоединение вторичной инфекции, метастазы в кости (позвоночника, таза, бедро, рёбра), метастазы в печень, лёгкие, плевру.
Физикальное обследование: ассиметричность, увеличение в объёме, различные уровни сосков, выделения из сосков, изменения кожи, пальпация стоя и лёжа, симптомы см. выше.
Осмотр. Осмотр молочных желез следует проводить при достаточном освещении, на некотором расстоянии от пациентки, стоящей сначала с опущенными руками, а затем — с поднятыми кверху.
1) размеры (диаметр) — принято отмечать до 1 см, до 2 см, от 2 до 5 см, свыше 5 см; измерения обычно производят с помощью линейки или циркуля;
2) анатомическая форма — узловатая, местно-распространенная, или локально-инфильтративная, диффузно-инфильтративная (занимающая либо большую часть, либо всю молочную железу);
3) консистенция — плотная, плотноэластическая, бугристая;
4) локализация — центральная, наружные квадранты (верхний и нижний), внутренние квадранты (верхний и нижний).
При пальпации регионарных л. у. в подмышечной, подключичной и надключичной зонах важно установить:
а) отсутствие уплотненных и увеличенных л.у.;
б) наличие увеличенных или уплотненных л.у.;
в) расположение увеличенных л.у. в виде цепочки или конгломерата спаянных между собой узлов;
г) наличие или отсутствие отека верхней конечности.
Совокупность анамнестических сведений, данных осмотра и пальпации является условием определения клинической формы РМЖ: узловатой, местной инфильтративной, диффузной инфильтративной или осложненных (инфильтративно-отечной, инфильтративно-лимфангитической, язвенной).
Особый интерес представляет рак Педжета — своеобразная форма РМЖ, поражающая сосок и ареолу. По преобладанию тех или иных клинических симптомов при раке Педжета различают экземоподобную (узелковые, мокнущие высыпания на коже ареолы), псориазоподобную (наличие чешуек и бляшек в области соска и ареолы), язвенную (кратероподобная язва с плотными краями) и опухолевую (наличие опухолевидных образований в субареолярной зоне или в области соска) формы.
Читайте также:

