Превратить все клетки в раковые клетки
Клетки с раковыми мутациями могли бы использовать своё преимущество в скорости деления и захватить всю ткань, но им мешают другие клетки с такими же амбициями.
Злокачественные опухоли возникают из-за мутаций, которые разрешают клеткам бесконтрольно делиться. Эти мутации появляются как из-за внешних факторов, вроде канцерогенных веществ, которые мы съедаем и вдыхаем, так и по естественным внутренним причинам. Наши клетки регулярно обновляются, на место старых приходят новые, а новые берутся из стволовых клеток-предшественников, которые очень долго сохраняют способность делиться. Но при делении молекулярные машины, которые удваивают ДНК, неизбежно допускают ошибки, которые остаются неисправленными и постепенно накапливаются. Некоторые исследователи полагают, что раковые мутации возникают по большей части как раз из-за неточного копирования ДНК.
Некоторые мутации появляются у нас уже в юности (как в матке, например), а с возрастом их число возрастает десятикратно. Однако далеко не всегда они приводят к чему-то плохому. Исследователи из Института Сенгера полагают, что раковые мутации остаются безопасными из-за конкуренции между клетками-мутантами.
Мутация в стволовой клетке может попасть (и часто попадает) в онкоген – то есть в ген, который, например, управляет делением клетки, но который в норме сохраняет связь с реальностью, то есть воспринимает ограничительные сигналы из внешней среды, от других клеток, от других генов той же самой клетки и т. д. Но после мутации такой ген становится уже чуть менее управляемым, и теперь стволовая клетка-предшественник начинает делиться чуть быстрее, чем обычная стволовая клетка. С одной мутации рак не начнётся, но если клетка-мутант наплодит много потомков, то повышается вероятность того, что в них к этой первой мутации добавятся ещё пара-тройка, и клетки начнут делиться по-раковому.
Но клетки существуют в ткани не сами по себе, а в окружении множества других клеток. И в них тоже могут появляться мутации, которые ускоряют их деление, делая его чуть менее контролируемым. И если одни мутанты столкнуться с другими, у которых есть те же конкурентные преимущества, они начнут друг другу мешать, и в результате никто не будет делиться быстрее и никакой опухоли не появится. В наших тканях места мало, поэтому клеткам приходится согласовывать свои интересы друг с другом.
Исследователи проверили эту гипотезу в экспериментах с мышами, у которых специально заставляли мутировать эпителиальные клетки пищевода (пищевод и кожа – два органа, в которых к среднему возрасту большинство клеток уже несут в себе те или иные мутации). У мышиных клеток очень тщательно выискивали мутации и сопоставляли эти мутации с тем, насколько успешно клетки-мутанты одного рода занимают территорию и как их успех соотносится с соседями. В статье в Nature Genetics говорится, что клоны мутантов действительно сдерживали друг друга, так что в итоге все клетки делились с нормальной скоростью. Разумеется, если в каких-то клетках появятся мутации, которые сразу дадут сильное преимущество, то сбалансировать их другим клеткам уже не получится, и, скорее всего, начнёт развиваться опухоль.
Как именно клетки-мутанты сдерживают друг друга, авторы работы пока не знают. Но если мы поймём, какие сигналы они друг другу посылают, какие молекулы задействуют, то и сами мы сможем использовать эти же сигналы, чтобы подавлять рост уже настоящих раковых клеток.
Рак остается одним из самых сложных для лечения заболеваний, от которого не существует одного эффективного лекарства. При этом в многочисленных исследованиях, посвященных поиску эффективных средств от недуга, не раз упоминаются определенные продукты питания, которые разными исследователями считаются эффективными для уничтожения раковых стволовых клеток.

Это очень важно, потому что именно тот факт, что химиотерапия не уничтожает раковые стволовые клетки, считается причиной того, что у онкологических пациентов случаются рецидивы и появляются метастазы. Эти клетки, иногда называемые "материнскими клетками", составляют лишь небольшую часть всех клеток опухоли, но они имеют способность самовосстанавливаться и сопротивляются химиотерапии. Они также могут отделяться и создавать новые колонии опухолей, поэтому их уничтожение является ключом к эффективному лечению рака в долгосрочной перспективе.
Лекарств, нацеленных конкретно на эти клетки, нет, но исследователи обнаружили множество природных веществ, способных бороться с этими клетками. Naturalnews. com перечислил продукты, которые являются лучшими "убийцами" раковых клеток.
Зеленый чай
Зеленый чай уже давно используется в китайской медицине для лечения множества недугов, но только недавно исследователи раскрыли его невероятный потенциал для лечения рака. Исследователи из медицинского центра Бэйлорского университета обнаружили, что активный ингредиент зеленого чая, EGCG (epigallocatechin-3-gallate), убивает раковые стволовые клетки и, следовательно, может помочь в случаях, когда образование не поддается химиотерапии. Хотя EGCG присутствует также в черном чае, в зеленом чае его концентрация выше.
Имбирь
Доклиническое исследование показывает, что один из компонентов имбиря дает в 10 000 раз большую эффективность в борьбе со стволовыми клетками при раке молочной железы, чем популярный препарат Таксол. Компонент, который известен как 6-Shogaol, выделяется, когда корень имбиря сварен или высушен, и его концентрация, необходимая для умерщвления раковых клеток, для клеток здоровых не опасна, в отличие от традиционных препаратов, применяемых в таких случаях.
Куркума
Куркумин, компонент древней индийской специи куркума, может выборочно влиять на стволовые раковые клетки без риска воздействия на здоровые стволовые клетки, необходимые для регенерации ткани. Это вещество эффективно при раке молочной железы, раке поджелудочной железы, колоректальном раке и раке головного мозга.
Ягоды винограда
Вещество resveratrol, которое находится в коже и семенах ягод винограда, наносит "смертельный" удар по стволовым клеткам рака толстой кишки. Таковы выводы ученых из Пенсильванского университета. Они верят, что в будущем это открытие поможет научиться предотвращать рак толстой кишки, который является одним из самых распространенных ныне типов рака. Когда во время эксперимента resveratrol и выдержка из семени винограда принимались одновременно, их воздействие было чрезвычайно мощно, и при этом они не повредили здоровым клеткам.
Другие продукты, которые убивают раковые стволовые клетки
Хотя вышеозначенные продукты — одни из самых мощных противораковых природных лекарств, есть и много других со сходным эффектом. Среди них — черника, морковь, кофе, грейпфрут, мята, вишня, лук, черный перец и тимьян.
Обилие продуктов, которые могут иметь большое влияние на рак, напоминает нам, насколько эффективно и безопасно природа может помочь справиться с серьезными недугами нашего времени. Многие врачи не очень хорошо разбираются в теме, у иных же есть финансовые мотивы, чтобы продолжать настаивать на дорогих и часто опасных лекарствах. По этой причине есть большой смысл расширять свой кругозор и узнавать, что, помимо лекарственной помощи, доступно нам в борьбе с серьезными заболеваниями.
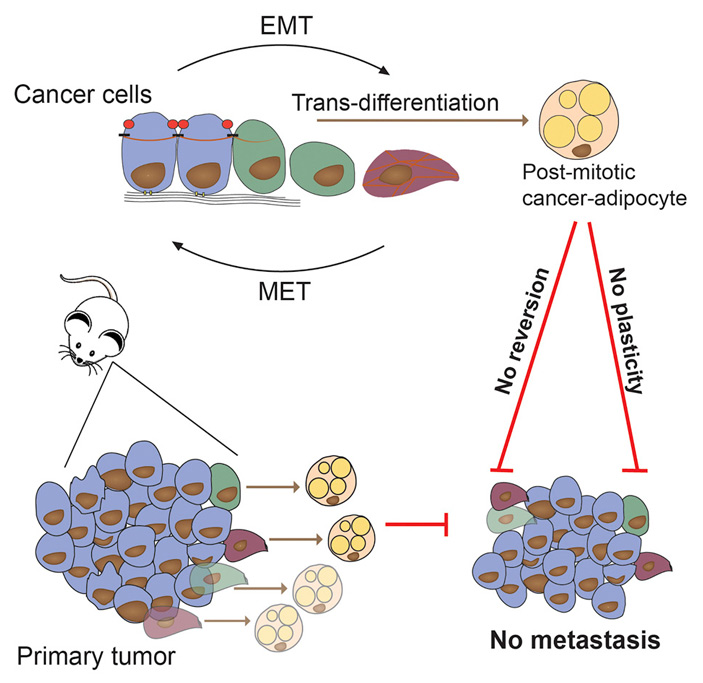
Рис. 1. Общая схема дифференцировки раковых клеток в адипоциты, в результате которой раковые опухоли теряют способность к инвазии и метастазированию. ЕМТ — эпителиально-мезенхимальный переход (ЭМП), МЕТ — мезенхимально-эпителиальный переход (МЭП, это процесс, обратный ЭМП). Эпителиальные клетки, превратившиеся в злокачественные (cancer cells), могут претерпевать ЭМП и переходить в недифференцированное состояние, в котором они могут распространяться по организму, оседая в разных органах и образовывая метастазы. В обсуждаемой статье показано, что с помощью фармакологических средств можно провести дальнейшую искусственную дифференцировку (см. Transdifferentiation), превращающую такие недифференцированные раковые клетки в адипоциты (post-mitotic cancer-adipocyte) — клетки жировой ткани, которые не имеют способности к дальнейшим превращениям (no plasticity) и не способны к обратной дедифференцировке в раковые клетки (no reversion). В результате первичная раковая опухоль (primary tumor) теряет способность к метастазированию (no metastasis). Рисунок из обсуждаемой статьи в Cancer Cell
Раковые клетки обладают пластичностью — способностью реагировать на сигналы своего окружения и трансформироваться в неспециализированное состояние, в котором они разносятся по организму, давая метастазы. Ученые из Базельского университета показали, что один из основных механизмов, обеспечивающих пластичность, можно использовать для борьбы с опухолью, вызывая дифференцировку раковых клеток в обычные жировые клетки — адипоциты. Это подавляет прорастание опухоли в окружающие ткани и формирование метастазов. Исследования еще далеки от клинического применения, но пока что новый метод демонстрирует большой потенциал для лечения больных раком.
Поскольку ЭМП связан с развитием рака, разные научные группы предпринимали попытки подавить опухоли при помощи обратного процесса — мезенхимально-эпителиального перехода (МЭП, см. Mesenchymal–epithelial transition). Он проходит довольно трудно, и постепенно накапливаются данные о том, что в результате может усиливаться метастазирование. Альтернативный подход — терапия посредством стимуляции дальнейшей дифференцировки клеток, совершивших ЭМП, — по крайней мере в случае одной из форм лейкемии оказался успешным (H. de Thé, 2018. Differentiation therapy revisited).
Ученые из группы Герхарда Кристофори (Gerhard M. Christofori) из Базельского университета (Швейцария) опубликовали статью, в которой описывают еще один успешный случай применения этого подхода. Они предположили, что распространение раковых клеток сóлидной опухоли, для которого необходима пластичность, может быть подавлено, если простимулировать их дальнейшую дифференцировку в адипоциты (жировые клетки).
Первая серия экспериментов была проведена in vitro на различных линиях культивируемых клеток, полученных из опухолей молочной железы мышей, которые используются для моделирования рака и метастазов. Адипогенез индуцировали с помощью комбинированного воздействия росиглитазоном (rosiglitazone, известен в первую очередь как средство против диабета, однако здесь важна его способность ингибировать рецепторы, активируемые пероксисомными пролифераторами, которые участвуют в регуляции клеточной дифференцировки) и белком ВМР2 (который относится к семейству трансформирующего ростового фактора-бета, TGF-β). За несколько дней клетки практически полностью дифференцировались в адипоциты (рис. 2). Причем все проверенные молекулярные и биохимические маркеры показали, что адипоциты, возникшие из опухолевых клеток, полностью соответствовали истинным адипоцитам.
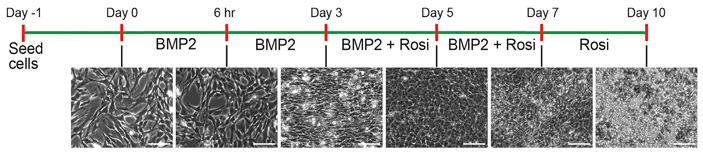

Рис. 2. Сверху — протокол терапии при помощи росиглитазона и BMP2. Снизу — микрофотографии состояния культивируемых in vitro клеток рака молочной железы мышей в соответствующие дни. Видно, что буквально за несколько дней почти все раковые клетки превращаются в адипоциты: светлые пятна на двух правых фото — это капельки жира, скопившегося в адипоцитах. Длина масштабного отрезка — 100 мкм. Рисунок из обсуждаемой статьи в Cancer Cell
Далее ученые выясняли, какие факторы транскрипции активируются или подавляются при ЭМП и как можно на них повлиять в плане регуляции адипогенеза. На этой стадии исследования они работали с культурой мышиных клеток, которые уже претерпели ЭМП.
Чтобы проверить, в какой мере эффекты, наблюдавшиеся в культурах клеток, воспроизводятся на живых организмах, были проведены эксперименты на модельных мышах. Им подсаживали клетки рака молочной железы. Введение животным комбинации росиглитазона и PD98059 в разных дозах приводило к тому, что у некоторых раковых клеток появлялись свойственные адипоцитам признаки: внутри них формировались пузырьки жира, а также синтезировались характерные маркеры (FABP4 и адипонектин). Такие клетки локализовались преимущественно по периферии опухоли — это та ее часть, на которой формируются зоны инвазии (прорастания опухоли в окружающие ткани).
Тогда исследователи предположили, что адипогенная дифференцировка может подавлять инвазию опухоли. Для проверки использовалась комбинированная терапия росиглитазоном и траметинибом (trametinib, это вещество тоже ингибирует сигнальный путь MEK/ERK и, в отличие от PD98059, оно прошло все клинические испытания и разрешено для применения). Предположение блестяще подтвердилось: эта комбинация препаратов не была токсичной для мышей, подавляла развитие зон инвазии опухоли и стимулировала формирование адипоцитов. Дальнейшие исследования показали, что такая терапия подавляет и метастазирование опухолей.
Наконец, ученые провели доклинические испытания, которые обязательно предшествуют применению новых лекарств и способов лечения к людям: была проведена стандартная для таких случаев ксенотрансплантация (пересадка ткани организма другого вида, см. Xenotransplantation). Фрагменты опухоли больной раком молочной железы пациентки пересадили нескольким мышам. Через 4 недели после трансплантации фрагментов опухоли мышам они были разделены на 4 экспериментальные группы: мышам из первой группы не вводили лекарств, второй группе вводили только росиглитазон, третьей — траметиниб, четвертой — оба препарата. В течение последующих 8 недель ученые следили за ростом опухолей, затем первичные опухоли извлекали и определяли их массу.
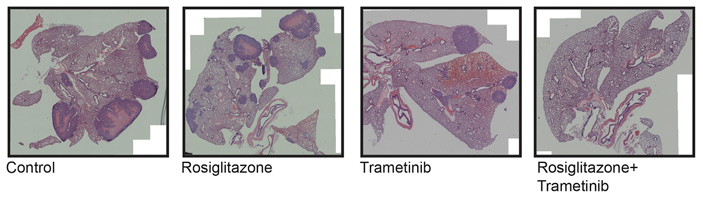

Рис. 3. Гистологические срезы мышиных легких через 4 месяца после ксенотрансплантации им фрагментов опухоли молочной железы человека. Показаны по одному срезу из разных экспериментальных групп: контроль; мыши, которым давали только росиглитазон; мыши, которым давали только траметиниб, и мыши, которым давали оба препарата. Метастазы при окрашивании гематоксилином и эозином выглядят как более темные пятна. Хорошо заметно, что терапия обоими препаратами подавляет развитие метастазов. Рисунок из обсуждаемой статьи в Cancer Cell
Результаты обсуждаемой работы показывают, что у комбинированной терапии траметинибом и росиглитазоном есть большой потенциал для лечения рака молочной железы и, возможно, других онкологических заболеваний (это еще надо проверять). В доклинических испытаниях были использованы лекарственные средства, которые уже применяются для лечения человека, что может облегчить дальнейшее внедрение этого подхода. Разумеется, представленный подход должен еще пройти всесторонние испытания: нужно определить его эффективность и наличие возможных побочных эффектов. Возможно, удастся подобрать и более активные индукторы дифференцировки раковых клеток в жировую ткань.
Американские ученые нашли способ трансформации раковых клеток в нормальные клетки с помощью процесса, связанного с выработкой микроРНК (miRNA). Исследователи из клиники Майо говорят, что их разработка открывает перспективы новой стратегии борьбы с раком, основанной на возвращении канцерных клеток обратно в нормальное состояние. Исследование было опубликовано в журнале Nature Cell Biology.

Малые некодирующие молекулы РНК (микроРНК) регулируют экспрессию группы генов. Когда нормальные клетки контактируют друг с другом, подгруппа микроРНК подавляет гены, стимулирующие рост клеток.
В раковых клетках адгезия нарушается, микроРНК начинают работать неправильно, а клеточный рост становится неконтролируемым. После того, как ученые восстановили нормальный уровень микроРНК в раковых клетках, процесс неконтролируемого роста был обращен вспять.
По адгезивным белкам, которые нужны для развития нормальной эпителиальной ткани, имеются противоречивые данные. Одни исследования выставляют E-кадгерин и катенин р120 в качестве подавителей опухолей, другие – стимуляторов.
Это привело нас к мысли, что эти молекулы имеют два лица – хорошее, обеспечивающее нормальное поведение клеток, и плохое, которое провоцирует онкогенез, — говорят ученые.
Как оказалось, поведение клеток регулируется белком PLEKHA7. При его отсутствии работа микроРНК нарушается и клетки становятся раковыми. Ученые сравнивают PLEKHA7 с педалью тормоза в ускоряющемся автомобиле.
Первые эксперименты с некоторыми агрессивными видами рака показали перспективность этого подхода.

На сегодняшний день антидепрессанты для многих являются единственным способом борьбы с волнениями и стрессом. Несмотря на то, что разработка этих препаратов началась еще в 50-х годах прошлого века, ученые до сих пор точно не знают, как работают некоторые антидепрессанты. Но тот факт, что для многих людей они являются эффективными, не вызывает сомнений, иначе данные препараты […]

Как думаете, сахар – это наркотик? Этот вопрос обсуждается уже не первое десятилетие. Сахар щекочет наши дофаминовые рецепторы точно так же, как алкоголь, никотин и другие наркотики, вдохновляя систему вознаграждения нашего мозга. Ученым известно, что избыток сахара является виновником целого ряда опасных для жизни заболеваний. Но даже с учетом этого потребление сладкого во всем мире […]

Мы склонны думать, что только негативные изменения причиняют боль. Мы связываем боль с потерями, отказами и неудачами. Тем не менее, в нашей жизни случаются позитивные изменения, которые тоже приходят с долей страданий, что может показаться несколько неожиданным. Часто речь идет о выбранных изменениях, которые, вероятно, сделают нас лучше в долгосрочной перспективе, но они не лишены […]
- Чем раковые клетки отличаются от нормальных?
- Каковы причины появления раковых клеток?
- Какие бывают типы генов рака?
- Основные характеристики и строение раковых клеток
- Как выглядят раковые клетки под микроскопом?
- Как развиваются раковые клетки, какие этапы проходят в своем развитии?
- Ликвидация раковых клеток: что помогает их уничтожить?

Чем раковые клетки отличаются от нормальных?
Для того чтобы организм человека правильно работал как единое целое, каждая клетка в нем должна подчиняться общим правилам и обладать некоторыми основополагающими свойствами:
Не перестает размножаться. Сколько бы своих копий ни создала опухолевая клетка, она не останавится. Злокачественная опухоль постоянно растет и распространяется в организме.
Не специализируются. Раковая клетка не становится специализированной и не выполняет полезные для организма функции. Процесс клеточной специализации называется дифференцировкой. Чем ниже степень дифференцировки, тем агрессивнее ведет себя рак.
Каковы причины появления раковых клеток?
Почему в теле конкретного человека возникли раковые клетки — вопрос во многом риторический.
Каждая живая клетка функционирует и размножается в соответствии с заложенной в ней генетической информацией. При возникновении определенных мутаций эти тонкие механизмы регуляции сбиваются, и может произойти злокачественное перерождение.
Сложно сказать, что именно привело к таким мутациям в каждом конкретном случае. Современным врачам и ученым известны лишь факторы риска, которые повышают вероятность злокачественного перерождения и развития заболевания. Вот основные из них:
- Неблагоприятная экологическая ситуация.
- Курение.
- Чрезмерное употребление алкоголя.
- Профессиональные вредности, контакт с канцерогенными веществами и различными излучениями на производстве.
- Ожирение, избыточная масса тела.
- Ультрафиолетовое излучение солнца и соляриев.
- Малоподвижный образ жизни.
- Возраст: со временем мутации накапливаются, поэтому вероятность возникновения в организме раковых клеток повышена у пожилых людей.
- Нездоровое питание: преобладание в рационе животных жиров, красного и обработанного мяса.
Ни один из этих факторов не приводит со стопроцентной вероятностью к развитию злокачественной опухоли.
Какие бывают типы генов рака?
Не все мутации одинаково опасны. К раку приводят те, которые возникают в определенных генах:
Онкогены активируют размножение клеток. Злокачественное перерождение происходит, когда они становятся слишком активны. В качестве примера можно привести ген, который кодирует белок HER2. Этот белок-рецептор находится на поверхности клетки и заставляет ее размножаться.
Мутации, которые приводят к раку, могут быть наследственными (возникают в половых клетках) и соматическими (возникают в клетках тела в течение жизни).

Основные характеристики и строение раковых клеток
Раковые клетки обладают тремя основополагающими характеристиками, за счет которых так опасны онкологические заболевания:
- Способность к бесконтрольному размножению.
- Способность к инвазии — прорастанию в окружающие ткани.
- Способность к метастазированию — распространению в организме и образованию новых очагов в различных органах.
Не всякая опухолевая клетка — раковая. Раком или карциномой называют злокачественные опухоли из эпителиальной ткани, которая выстилает кожу, слизистые оболочки внутренних органов, образует железы. Из соединительной ткани (костной, жировой, мышечной, хрящевой, кровеносных сосудов) развиваются саркомы. Злокачественные заболевания органов кроветворения называют лейкозами. Опухоли из клеток иммунной системы — лимфомы и миеломы.
Как выглядят раковые клетки под микроскопом?
Если коротко, то они сильно отличаются от нормальных, тех, что ожидает увидеть патологоанатом, когда рассматривает под микроскопом фрагмент ткани. Раковые клетки имеют более крупные или мелкие размеры, неправильную форму, аномальное ядро. Если нормальные клетки в одной ткани все примерно одинаковых размеров, то раковые зачастую разные. Ядро содержит очень много ДНК, поэтому оно крупнее (его размеры тоже вариабельны), а при окрашивании специальными веществами выглядит более темным.
Из нормальных клеток образуются определенные структуры, например, железы. Раковые клетки располагаются более хаотично. Например, они образуют железы искаженной, неправильной формы или непонятные массы, которые на железы совсем не похожи.
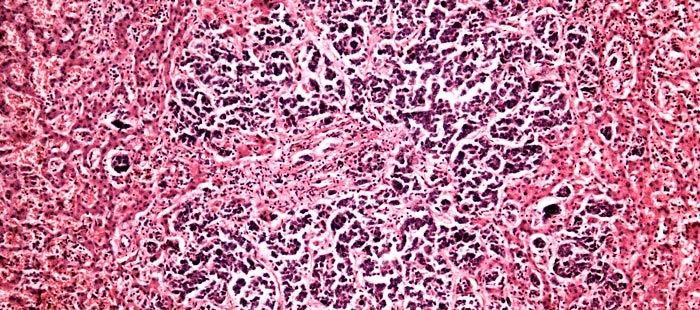
Как развиваются раковые клетки, какие этапы проходят в своем развитии?
Раковые опухоли растут за счет деления клеток, которые входят в их состав. Во время деления злокачественная клетка образует две своих копии, таким образом, рост происходит в геометрической прогрессии. Например, для того чтобы образовалась опухоль размером 1 см, нужно около 30 удвоений. Через 40 удвоений новообразование достигает веса 1 кг, и этот размер считается критическим, смертельным для пациента.
Согласно современным представлениям, за рост злокачественной опухоли отвечают так называемые стволовые опухолевые клетки. Они активно делятся, в то время как другие опухолевые клетки просто существуют. Современные ученые заняты поиском методов лечения, направленных против этих стволовых клеток.
Время удвоения опухолевых клеток бывает разным. Например, при лейкозе это происходит за 4 дня, а при раковых новообразованиях толстой кишки — за 2 года. Проходит много времени, прежде чем опухоль достигнет настолько больших размеров, что станет проявляться какими-либо симптомами. Например, если у онкологического больного появились некоторые жалобы, и после этого он прожил год, вероятно, опухоль в его организме на момент появления жалоб существовала уже около трех лет, просто он об этом не знал.
Пока раковая опухоль небольшая, ей вполне хватает кислорода. Но по мере роста она все сильнее испытывает кислородное голодание — гипоксию. Чтобы обеспечить свои потребности, опухолевые клетки вырабатывают вещества, которые стимулируют образование кровеносных сосудов — ангиогенез.
По мере роста опухоли происходит инвазия — распространение раковых клеток в окружающие ткани. Они вырабатывают ферменты, которые разрушают нормальные клетки.
Некоторые из них отрываются от материнской опухоли, проникают в кровеносные и лимфатические сосуды, образуют в них вторичные очаги — метастазы. В этом самая главная опасность злокачественных опухолей. Именно метастатические очаги становятся причиной гибели многих онкологических пациентов.
Ликвидация раковых клеток: что помогает их уничтожить?
С раковыми клетками можно бороться разными способами. Например, удалить их из организма хирургическим путем. Но это возможно лишь в случаях, если опухоль не успела сильно распространиться в организме. Даже если можно выполнить радикальную операцию, никогда нет стопроцентной гарантии того, что в организме не остались микроскопические опухолевые очаги, которые в будущем станут причиной рецидива. Поэтому зачастую хирургические вмешательства дополняют адъювантной и неоадьювантной терапией.
Другие методы лечения:
В Европейской клинике применяются наиболее современные оригинальные препараты для борьбы с раком. У нас есть возможность провести молекулярно-генетический анализ опухолевой ткани, разобраться, из-за каких мутаций клетки стали злокачественными, и назначить наиболее эффективную персонализированную терапию. Свяжитесь с нами, мы знаем, как помочь.
Сколько в человеческом организме клеток, не знает никто. Публикуемые в научных работах шести-, семи-, а то и восьмизначные цифры обозначают лишь приблизительную вероятность, но не реальное количество. Гораздо точнее наука установила разницу между ними - клетки сердца, легких, печени, почек, любых тканей отличаются друг от друга белками, из которых состоят, ферментами, участвующими в их функционировании, генами в их ДНК. И в "чужом" органе они работать не будут. Исключение составляют так называемые стволовые клетки, но не о них сейчас речь.
Но есть одно свойство, присущее всем клеткам, - свойство, за которое ученый с мировым именем академик РАН Владимир Скулачев образно назвал их камикадзе, - готовность в любой момент прибегнуть к "самоубийству" - запрограммированной клеточной смерти, называемой апоптозом. Название придумал древнеримский врач Гален, наблюдая осенний сброс листвы деревьями, - тоже своего рода суицид. К апоптозу клетка прибегает тогда, когда что-то в ней непоправимо сломалось и ее дальнейшее существование может навредить организму. Подчеркиваю: только может навредить, до настоящего вреда дело не доходит, поскольку тут же поступает приказ на уничтожение и запускается система умерщвления. Вот так клетки бросаются на амбразуру - все, кроме раковых.
Раковые будто пришли с другой планеты. В отличие от остальных они безудержно размножаются, пожирая ткани вокруг себя и образуя опухоль, растущую как лавина. И обладают поразительной способностью к выживанию, вот почему так трудно остановить их рост, а еще труднее вообще уничтожить. В отличие от остальных клеток, срок жизни которых исчисляется днями или неделями, раковые умирают вместе с "хозяином", в теле которого поселились и которого сами же убили. В некоторых лабораториях мира они живут в колбах уже более ста лет и чувствуют себя превосходно. И до недавнего времени считалось, что к добровольному уходу из жизни они неспособны. Российские и американские исследователи доказали, что это мнение ошибочно.
- Апоптоз, самоубийство клеток происходит по сложной, четко отработанной технологии, - рассказывает руководитель российской группы исследователей, лауреат Ленинской премии Михаил Ханин, профессор Центра теоретических проблем физико-химической фармакологии РАН. - В каждой клетке затаились и ждут своего часа особые ферменты, их называют каспазами. Это - палачи, непосредственные исполнители смертной казни. А сигнал к исполнению дают специальные рецепторы на клеточной мембране, зорко следящие за состоянием своей клетки, за ее взаимодействием с окружающими тканями и точно отмечающие момент, когда она может стать опасной для организма. Специалисты называют их жутковато - "рецепторы смерти". Отданный ими сигнал запускает длинную цепь биохимических реакций, в результате которых мирно "спящие" каспазы превращаются вдруг в бешеных убийц, уничтожающих цитоплазму, ядро и наконец сам геном клетки. Она сморщивается, уменьшает объем, после чего ее съедают окружающие здоровые клетки, используя ее ткани в своем развитии. Так сказать, своего рода безотходная технология.
Уже 30 лет биологи интенсивно изучают механизм апоптоза. И довольно далеко продвинулись в этой работе. Главное, выяснили, как запускается в действие огромная, многоэтапная цепочка биохимических реакций, несущая роковой приказ клетке на самоуничтожение, где одни белки и ферменты передают эстафету другим, на определенных этапах к ним примыкают третьи, четвертые, пятые и еще другие, которые вроде бы и не имеют прямого отношения к поставленной задаче, но без их присутствия приказ до цели не дойдет. Более того, исследователи научились сами запускать цепную реакцию апоптоза, провоцируя "рецепторы смерти" давать сигнал на уничтожение, и вполне работоспособные клетки послушно кончают самоубийством. Теперь остался последний шаг: от обычных клеток перейти к раковым.
Заставить раковую клетку покончить с собой. На первый взгляд - задача из области фантастики. Ведь цель этих клеток не оберегать организм, в котором они живут, а, наоборот, уничтожать окружающие ткани, пожирая их и перерабатывая в собственные белки, чтобы питать ими постоянно растущую опухоль. Так что, логически рассуждая с позиций здравого смысла, у раковых клеток вовсе не должно быть механизма апоптоза, а если он почему-то есть, то должен быть просто неработоспособным. Вот таким предположением поделился я со своим собеседником, чем вызвал у него откровенную усмешку.
- Неблагодарное это занятие - пытаться разгадать загадки природы, опираясь на обывательскую логику здравого смысла, - сказал Михаил Ханин. - Природа мыслит другими категориями, учитывая в своих решениях множество факторов, которые, на наш взгляд, никакого отношения к данной проблеме не имеют. Вот так и с раковыми клетками. Казалось бы, зачем им апоптоз, если их предназначение разрушать организм, а не оберегать его? Тем не менее в каждой раковой клетке, как и в любой другой, есть механизм самоуничтожения. И он безотказно срабатывает, если суметь его запустить.
В последней фразе - суть проблемы. Раковые клетки - отнюдь не сестры-близнецы, у каждого вида рака они свои. И по-разному противостоят попыткам запустить механизм апоптоза. Большинство клеток бешено сопротивляются, другие поддаются команде на уничтожение так же, как и обычные клетки, а третьи даже легче. Вот почему медицина достигла определенных успехов в лечении онкологических заболеваний. Некоторые болезни подчас излечиваются полностью, развитие других сильно замедляется. Сегодня медики считают, что все виды рака можно излечить апоптозом, тем более что механизмы его запуска давно освоены. Это, в частности, всем известные - радиационное облучение и химические токсичные вещества, которые не просто сами разрушают раковые клетки, как считалось раньше, а заставляют "рецепторы смерти" дать роковой сигнал. И чем раньше обнаружены скопления раковых клеток, начавших превращаться в опухоль, тем меньше их живучесть, тем слабее сопротивление сигналу на смерть. Есть и другие способы запуска апоптоза, только вот беда: ни один из них не дает стопроцентного эффекта. Один и тот же рак на одной и той же стадии у одного больного иногда излечивается полностью, у второго просто прекращается рост опухоли, а у третьего он лишь слегка замедляется. К тому же при одном запуске апоптоза результаты одни, при другом у того же вида рака бывают совсем другие. Поэтому не всегда можно предсказать заранее, что лучше поможет данному больному: облучение или химиотерапия? Почему же так происходит? А дело в том, что для науки до сих пор остается "черной дырой" средний этап апоптоза - процессы, происходящие между подачей сигнала на смерть и до разрушения клетки.
- Задача медицины - подавить сопротивление раковых клеток сигналу саморазрушения,- говорит Михаил Александрович,- добиться его неукоснительного выполнения. На это и направлена наша работа совместно с американскими коллегами из клиники Мейо в городе Рочестер (штат Миннесота), которой руководит выдающийся исследователь апоптоза, доктор философии и медицины, профессор Скотт Гарольд Кауфманн. И решаем мы эту проблему с двух разных сторон, соединив, казалось бы, далекие друг от друга вещи - биохимию и математику.
Надо думать, природе пришлось немало потрудиться, чтобы решить головоломную задачу - как изменить главное свойство обычной клетки при перерождении ее в раковую, не изменяя ее строения. Ведь механизм апоптоза никуда не выбросишь, он остается в клетке, задачи которой теперь кардинально меняются: не оберегать организм, а разрушать его. И апоптоз должен не мешать этому процессу, но тем не менее быть готовым и к разрушению самой клетки на случай, так сказать, непредвиденных ситуаций. Природа решила эту задачу, сделав раковый апоптоз сложнейшей нелинейной системой, в которой участвует огромное количество белков, где одни способствуют самоубийству клеток, другие не мешают, а третьи препятствуют. И во всей этой запутанной паутине различных биохимических процессов скрывается некий единственный процесс, который и приводит к окончательному результату - смерти клетки. Природе он известен, и она им иногда пользуется: иначе чем объяснить редкие случаи самоизлечения рака, ставящие медиков в тупик? Науке же пока известно, что этот процесс существует и у каждого вида рака он свой. Его и необходимо вычленить, выявить участвующие в нем белки, определить влияние каждого из них на общую динамику системы. Более того, необходимо определить скорость каждой из десятков и сотен биохимических реакций, входящих в систему апоптоза данного вида рака, без чего невозможно научиться управлять этим процессом. По сравнению со всей этой работой поиски пресловутой иголки в стоге сена - задачка для первоклассников. И исследования американских биохимиков грозили затянуться на десятки лет, если бы к ним не пришли на помощь российские математики.
- В последние годы математические и компьютерные модели занимают все большее место в биологических лабораториях, показав себя весьма эффективным методом исследования динамики сложных биохимических систем, - отмечает профессор Ханин. - А если говорить просто, то все, что биохимики создают в своих колбах и на что у них уходят недели и месяцы, а бывает, и годы, мы воспроизводим на экране компьютера, за считаные минуты проигрывая вариант за вариантом.
Конечно, это сказано слишком просто. На деле же идет сложнейшая работа - скрупулезный перебор на компьютерных моделях всех биохимических реакций, входящих в систему апоптоза, и их сочетаний. Определение их скоростей и других параметров, сверка полученных данных с теми, что успели получить коллеги за океаном - если сошлось, значит, правильно. Вот так белок за белком определяется одна из возможных цепочек от "рецепторов смерти" до раковых клеток. Но как определить, та ли это цепочка, по которой приказ на смерть дойдет до адресата, не потеряв силы, и разбудит "спящих" каспаз, заставив их приступить к своей палаческой работе? Или в нее попали белки лишние, не поддерживающие приказа, а то и препятствующие ему? Поэтому полученные варианты тестируются великим принципом оптимальности, которым руководствуется природа, создавая все свои творения. Он гласит, что все, что делается, должно происходить с минимальными затратами времени и энергии. Поэтому исследователи четко знают, что им надо искать, - цепочку биохимических реакций, содержащую минимальное количество белков, по которой сигнал на смерть доходит до палачей-каспаз за минимальное время и с минимальными потерями энергии. А вот получение этих данных позволит медикам создать систему управления механизмом апоптоза, действующую при лечении больных с максимальной эффективностью.
Читайте также:

