Бактериофаг для лечения рака
| Текущее время: 14-07, 15:17 |
Часовой пояс: UTC + 3 часа
Бактериофаг - найти цель и обезвредить
БАКТЕРИОФАГ - НАЙТИ ЦЕЛЬ И ОБЕЗВРЕДИТЬ
Заметка опубликована в газете "Омская медицинская газета" №13(131) июль 2002 г
В последние годы в связи с продолжающимся распространением антибиотикоустойчивых форм патогенных и условно-патогенных бактерий большой интерес вызывает использование в лечебных целях бактериофагов. Бактериофаги являются вирусами, поражающими исключительно бактерии. Открыты они были в начале 20 века и, как выяснилось позже, в природе распространены повсеместно. Везде, где имеются бактерии, удается обнаружить и бактериофаги.
Бактериофаги, подобно другим вирусам, являются внутриклеточными паразитами. Проникнув в бактерию через расположенные на ее поверхности фагоспецифические рецепторы, ДНК фага изменяет синтезирующие механизмы клетки, заставляя бактерию синтезировать ДНК и белки фага. На определенном этапе бактерия разрушается, и из нее выходит новое поколение дочерних бактериофагов.
Важным свойством бактериофагов является их высокая специфичность, они избирательно лизируют бактерии не только определенного вида, но даже их отдельные серологические группы. Бактериофаги безошибочно находят и уничтожают только те бактерии, против которых направлено их действие, не затрагивая нормальную микрофлору организма, не говоря уже о его собственных клетках. Именно этим и объясняется отсутствие побочных эффектов и противопоказаний к применению бактериофагов, что делает особенно привлекательным их использование в педиатрической практике. Возникновение у бактерий антибиотикоустойчивости не сказывается на их чувствительности к бактериофагам, поэтому последние зачастую активны даже в отношении полирезистентной госпитальной микрофлоры. Однако следует учитывать специфичность бактериофагов: каждый вид фага распознает в качестве своей мишени только те серотипы бактерий, которые имеют определенные фагоспецифические рецепторы. Поэтому назначать бактериофаги необходимо под микробиологическим контролем чувствительности к ним данного возбудителя.
Отечественная промышленность выпускает большой спектр лекарственных бактериофагов: Стафилококковый, Стрептококковый, Коли, Протейный, Синегнойный, Клебсиеллезный, Брюшнотифозный, Дизентерийный, Сальмонеллезный. Имеются и их комбинированные формы: Колипротейний бактериофаг, Интести бактериофаг (содержит фаги шигелл Флекснера серовара 1,2,3,4,6 и Зонне, сальмонелл (паратифа А и В, энтерилитис, тифимуриум, холера суис, ораниенбург), энтеропатогенных групп кишечной палочки, протея вульгарис и мирабилис, стафилококков, синегнойной палочки и патогенных энтерококков), Пиобактериофаг комбинированный (содержит фаги стафилококков, стрептококков, патогенной кишечной палочки и синегнойной палочки). Созвучный, но все-таки иной препарат Пиобактериофаг поливалентный очищенный содержит фаги стафилококков, стрептококков, патогенной кишечной палочки, синегнойной палочки, протея и клебсиелл пневмонии. Данный препарат отличается наиболее высокой степенью очистки от бактериальных метаболитов, что значительно улучшает его вкусовые качества и делает средством первого выбора у детей до года. Бактериофаг клебсиелл поливалентный очищенный активен в отношении клебсиелл пневмонии, озены, риносклеромы.
Интересна история развития производства бактериофагов в Советском Союзе. Основоположником фаготерапия можно считать грузинского микробиолога Георгий Элиава, по инициативе которого и благодаря поддержке Серго Орджоникидзе был создан Институт Исследования Бактериофагов в Тбилиси. Георгий Элиава был одним из учеников первооткрывателя бактериофагов канадского бактериолога Д'Эрелля, который в 1931-34 неоднократно бывал в Тбилиси и принимал личное участие в создании и оснащении нового института. В 1938 г. Институт Бактериофагов был соединен с Институтом Микробиологии и Эпидемиологии под управлением Наркома здравоох-ранения Грузии, а в 1951 г. он был передан группе Институтов Вакцин и Сывороток Всесоюзного министерства здравоохранения, заняв ведущее место в обеспечении бактериофагами для терапии и бактериального типирования во всем Советском Союзе. По заявкам Министерства здравоохранения сотни тысяч образцов патогенных бактерий посылались в Институт со всего Советского Союза для выделения наиболее эффективных штаммов фагов и лучшей характеристики их полезности. Еще 10 лет назад в аптеках Омска можно было встретить Интести-бактериофаг тбилисского производства. В 1988 г. было образовано Научно-производственное объединение "Бактериофаг" с производственными площадками в Уфе, Хабаровске и Нижнем Новгороде, Перми, предприятия которых и являются в настоящее время единственными производителями бактериофагов в России. За рубежом набольшей известностью пользуется именно Тбилисский институт бактериофагов, однако, в настоящее время промышленное производство бактериофагов там практически не осуществляется.
Уже в период Великой Отечественной войны мази с бактериофагами широко применялась для лечения раненых, и с тех пор использование лечебных бактериофагов в России никогда полностью не прекращалось.
На западе после открытия антибиотиков в работы с бактериофагами были полностью свернуты. В последние несколько лет, в связи с увеличением распространенности внутрибольничных инфекций, резистентных к большинству или ко всем из известных антибиотиков, многие западные биотехнологические компании сделали резкий поворот к изучению возможности создания лекарств на основе бактериофагов. Однако, несмотря на существенные технологические преимущества, для успешного создания эффективных лекарств необходима коллекция бактериофагов, действующих на клинически наиболее значимые штаммы возбудителей и соответствующий опыт их клинического применения, чем западные компании пока не обладают. Не будет преувеличением сказать, что если в России есть лидирующие направления в лечении инфекционной патологии, то это именно фаготерапия.
Наибольшее распространение бактериофаги нашли в лечении дисбактериозов кишечника, острых кишечных инфекций, энтероколитов, гнойно-воспалительных заболеваний горла и носа. Между тем, область их клинического применения значительно шире, и они могут быть с успехом использованы для лечения хирургической, урогенитальной, кожной и других инфекций.
Для врачей, которые еще не имели опыта работы с бактериофагами, можно отметить, что для лечения дисбактериоза кишечника и других заболеваний, требующих избирательной санации желудочно-кишечного тракта от условно-патогенной микрофлоры, предпочтительны Пиобактериофаг комбинированный, Пиобактериофаг поливалентный очищенный, Интести бактериофаг, Стафилококковый и Колипротейный бактериофаги. В этом году в Омск впервые стал поступать стафилококковый бактериофаг Хабаровского производства, который содержит штаммы отличные от применяющихся много лет в Омске Пермского, Уфимского и Нижегородского стафилококкового бактериофага и может иметь более высокую активность по отношению к омским штаммом золотистого стафилококка.
Убийца россиян № 2 – рак.
Хотя он и №2, - но страху на людей он нагоняет больше чем убийцы №1 и №3 – сердечно – сосудистые и эндокринные заболевания.
Возможно потому, что эта болезнь носит, как правило, длительный и мучительный характер, а диагноз воспринимается как приговор, - в отличие от диагнозов сердечно – сосудистых и эндокринных заболеваний, которые оставляют шанс на излечение. При том, действительно, лечение сердечно – сосудистых и эндокринных заболеваний может реализоваться временным успехом средствами современной медицины в сочетании с соблюдением пациентом правил здорового образа жизни.
По прогнозам Всемирной организации здравоохранения, в 2030 году во всём мире от рака умрут 11,5 млн. человек, что на 45% больше, чем в 2007-м, когда разнообразные онко недуги унесли 7,9 млн. жизней.
В ходе технической революции человек создал среду, не адекватную самому себе. Масса канцерогенных (онкообразующих) факторов нарушает гармонию в природе и угнетает реактивные (защитные) системы человеческого организма.
Эта агрессивная среда воздействует на человека, можно сказать, ежесекундно, а значит, ежесекундно человек должен предпринимать защитные, антиканцерогенные мероприятия. Реально такую защиту можно организовать только через питание.
Позор мировой онкологии!
Почему потеряли самых известных онкобольных земли. Почему их не смогла спасти мировая онкология - хирургия, химиотерапия?
“Рак мой личный враг!”
Владимир Хилько, ( по материалам fitooncologia.narod.ru)
В России ежегодно от рака умирают 330 000 онкобольных , ежегодно рак диагностируется у 500 000 человек на учёте состоит 2,5 млн. онкобольных в 2004 году более 22800 онкобольных отказались (отказники) от лечения официальными методами в онкобольницах.
Число "отказников" растёт, так как люди не доверяют свою жизнь официальной онкологии. Десятки тысяч онкобольных в 4 стадии ежегодно принудительно выписываются домой, для умирания без лечения. Фитотерапия здесь последняя надежда и она не подводит.
Следует обратить пристальное внимание на всем известные обязательные диагностические пункции, биопсии, операции, которым подвергаются 80-100% онкобольных и обследуемых пациентов.
Происходит разрушение опухоли и раковые клетки, попадая в кровоток, разносятся по всему организму, создавая метастазы и сокращая срок жизни онкобольных, ежегодно около 300 000 онкобольных подвергаются пункциям, биопсиям, операциям, химиотерапии. результаты печальные.
Нужно обладать недюжинной способностью к абстрагированию, чтобы почувствовать то, что может чувствовать человек, которому стал известен свой страшный диагноз – рак! Большинство из россиян в своей жизни получали какие-нибудь диагнозы менее трагичные и могут получить, хотя бы ,отдалённое представление о страхе, безнадёжности и отчаяния перед лицом такой перспективы.
Почему страх и безнадёжность? Наверное потому, что, несмотря на утверждения онкологов о возможности успешного лечения рака, особенно, якобы, при ранней диагностике, повседневная жизнь доказывает обратное. И если такие известные и не самые бедные люди России и других стран, преждевременно ушедшие из жизни по причине рака в последние годы, как:
Олег Янковский, Патрик Суэйзи, Лучано Паваротти, Раисе Горбачева, Анна Самохина, Александр Абдуллов, Валентина Толкунова, Игорь Алексеев соответственно, несмотря на свою известность и финансовые возможности не смогли в рамках современной медицины справиться с болезнью, то что говорить о простых смертных.
20 мая 2009 года в возрасте 65 лет умер актёр от бога – Олег Янковский. Трагедия для всех нас.
Причиной смерти явился рак поджелудочной железы. Статистика говорит, что при этой форме рака лишь двое из десяти больных проживают больше года после диагноза, а от года до пяти лет выживают считанные единицы.
Почему же Янковский, который длительное время страдал от онкозаболевания и которому поставили страшный диагноз, ушёл из жизни так быстро?
Первые клинические эксперименты с бактериофагами начались сто лет назад, и казалось, что этот новый метод терапии обречен на успех: с научной точки зрения он выглядел безупречным, и результаты применения выглядели многообещающими.
Почему же в последующие десятилетия интерес к терапевтическому применению бактериофагов в мире упал? Почему он возник вновь, и почему эта замечательная идея до сих пор не реализована в полной мере? И практические врачи, и их пациенты сегодня должны четко представлять не только суть, но и все сильные и слабые стороны этого перспективного вида терапии
Бактериофаги – это не обычные лекарства. Они не являются простыми химическими веществами, как антибиотики и большинство других препаратов, но их вряд ли можно считать и полноценными живыми организмами, так как они, как и все остальные вирусы, могут размножаться только в клетке-хозяине. По сути, это нанороботы с генетической программой, способные проникнуть внутрь бактериальной клетки и там размножиться, разрушив ее.
Поэтому к бактериофагам не всегда применимы стандартные для фармакологии нормы и подходы. И хотя фаговые препараты сегодня производятся и используются в медицине, наши знания о многообразии этих вирусов, механизмах их взаимодействия с бактериями и конкуренции с себе подобными пока недостаточны, чтобы в полной мере использовать их мощный терапевтический потенциал.
Безопасно и эффективно
Фаготерапия родилась едва ли не сразу после открытия самих бактериофагов, однако широкие испытания этих противобактериальных средств начали проводиться в СССР только в конце 1930-х гг. В результате была доказана эффективность препаратов бактериофагов как профилактического средства при борьбе с эпидемиями дизентерии и холеры, а использование их при лечении ран и гнойно-воспалительных процессов показало их потенциал как альтернативы антибиотикам.
Однако результаты исследований тех времен были зачастую противоречивы: иногда фаги сразу подавляли развитие инфекционных процессов, но иногда оказывались бесполезными. Специалисты сразу поняли, в чем причина: лечение было успешным лишь тогда, когда использовались фаги, способные инфицировать именно тот бактериальный штамм, который и вызвал заболевание. Поэтому при возникновении эпидемии требовалось выделить инфекционный агент, проверить на нем имеющиеся фаговые препараты и запустить в производство в качестве препарата наиболее эффективный бактериофаг.
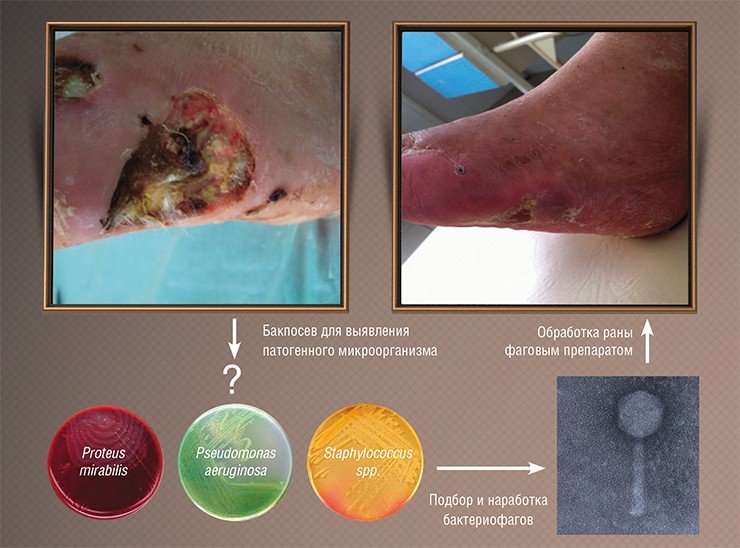
К сожалению, результаты подобных исследований, проводившихся в СССР, не были должным образом документированы и описаны в научной литературе, к тому же они проводились по схемам, не соответствующим принятым на сегодня протоколам клинических испытаний. Тем не менее главные результаты этой работы были бесспорны: фаги доказали свою безопасность и высокую эффективность в реальных условиях и с тех пор используются в нашей стране в клинической практике наряду с обычными лекарственными средствами.

Знакомьтесь – фекотрансплантация
С появлением антибиотиков интерес к фагам на Западе был утрачен, но после появления антибиотикоустойчивых штаммов бактерий в разных странах начали разрабатывать фаговые препараты и проводить испытания, которые, по сути, повторяли исследования, уже проведенные в СССР. Результаты этих работ вновь подтвердили безопасность препаратов бактериофагов, что, в частности, отметило и Управление по контролю за качеством пищевых продуктов и лекарственных препаратов США (FDA).
В Великобритании успешно проведены эксперименты по лечению бактериофагами хронического отита, вызванного нечувствительной к антибиотикам синегнойной палочкой Pseudomonas aeruginosa, а в рамках проекта Phagoburn семь медицинских центров Франции, Бельгии и Швейцарии проводят клинические испытания коктейля фагов для предотвращения инфекций при ожогах. Об испытаниях собственных оригинальных коктейлей фагов для лечения широкого спектра заболеваний сообщает и ряд американских фирм (Intralytix, Enbiotix, AmpliPhi). Правда ни одно из этих масштабных клинических испытаний пока не доведено до конца.
В России препараты бактериофагов можно приобрести в обычной аптеке. Но при этом нужно понимать, что в отличие от других лекарств с точной химической формулой и концентрацией действующих компонентов препарат бактериофага представляет собой нестандартный раствор, содержащий живые вирусные частицы. Даже препарат с одним и тем же названием, но произведенный на разных предприятиях или в разное время, может содержать отличающиеся комбинации и (или) пропорции фагов.
Поэтому покупать препарат бактериофага, чтобы лечиться самостоятельно, не стоит. Назначить лечение и выбрать лекарство должен специалист. Спектр заболеваний, которые можно лечить бактериофагами широк: трофические язвы, ожоговые и раневые инфекции, инфекции органов дыхания, мочеполовой системы и желудочно-кишечного тракта, остеомиелит и т. п. Возбудителями болезней во всех этих случаях служат такие печально известные бактерии, как золотистый стафилококк, включая лекарственно устойчивые штаммы, синегнойная палочка, патогенные формы кишечной палочки, сальмонеллы, протеи, стрептококки и др. В принципе в природе можно найти бактериофаг против любой бактерии, включая возбудителей чумы и сибирской язвы. Можно применять бактериофаги и для профилактики бактериальных инфекционных болезней, например, они были успешно использованы в детских садах и школах для предотвращения эпидемии дизентерии.

Основная же и главная причина неудач – неумелый подбор фагов для лечения конкретных пациентов. Каждый конкретный фаг эффективен против одного или максимум нескольких штаммов бактерий, а у разных пациентов схожая по внешнему проявлению инфекция, например, ангина может быть вызвана разными штаммами стрептококка. Чтобы вылечить больного, необходимо выделить культуру патогена и протестировать ее на чувствительность к конкретным фагам. То есть терапия бактериофагами должна проводиться с использованием принципов персонализированной медицины, к чему современная медицина практически не готова.

На пути к персонализированной Фаготерапии
Опыт СССР, Грузии и Польши показал, что для успешного применения бактериофагов нужны не только клиника, но и производственно-лабораторный участок, располагающий коллекцией фагов и специалистами, способными идентифицировать бактерии, подбирать и выделять бактериофаги для конкретного пациента.
Но в таком случае имеет ли смысл масштабное производство фаговых препаратов? Ответ – да, потому что проблема узкой специфичности фагов частично решается производством фаговых коктейлей из нескольких (иногда десятков) разных фагов, поражающих разные штаммы целевого возбудителя. Ведь подобрать для больного нужный фаговый коктейль быстрее и проще, чем тестировать отдельные фаги из большой коллекции.
И все же не надо думать, что бактериофаги полностью заменят антибиотики – эти препараты дополняют друг друга, и применяться они должны в разных ситуациях. Когда больной находится в тяжелом состоянии, и есть уверенность, что причиной служит бактериальная инфекция, времени на эксперименты и подбор препаратов нет. Единственно правильное решение в этой ситуации – антибиотик широкого спектра действия.
Но в ситуации хронической инфекции или инфекции, вызванной бактериями со множественной устойчивостью к антибиотикам, предпочтение следует отдавать бактериофагу. В случае таких затяжных болезней, как отит, у врача есть время, чтобы использовать фаговый коктейль или специально подобрать фаг. Или же, когда после операции больной поражается антибиотикоустойчивым бактериальным штаммом, и его состояние быстро ухудшается, фаготерапия может стать единственным спасением.
Богатый опыт применения бактериофагов в клинической практике, накопленный за последние сто лет, свидетельствует о перспективности фаговых медицинских технологий. Дальнейшая работа специалистов из множества компаний, работающих сегодня в этой области, и применение методов синтетической биологии обязательно приведут к созданию препаратов с несравненно большей эффективностью по сравнению с современными фаговыми коктейлями.
Тем не менее, биотехнологи, также как ученые и медики, надеются, что безвредные и эффективные препараты все же займут свое законное место в арсенале терапии инфекционных заболеваний.
Алешкин А. В. Бактериофаги в инфекционной патологии: прошлое, настоящее и будущее // Лекции по исследованию и применению бактериофагов. 2016. Ульяновск. С. 11—51.
Козлова Ю. Н., Репин В.Е., Анищенко В.В., Власов В.В. и др. Штамм бактериофага Pseudomonas aeruginosa, используемый в качестве основы для приготовления асептического средства против синегнойной палочки. // Патент РФ №2455355. 2012.
Козлова Ю. Н., Морозова В. В., Тикунова Н. В. и др. Штамм бактериофага Staphylococcus aureus SA20, обеспечивающий разрушение биопленок, образуемых бактериями рода Staphylococcus // Патент РФ № 2565824. 2015.
Морозова В. В., Козлова Ю. Н., Тикунова Н. В. и др. Штамм бактериофага Citrobacter freundii CF17, способный лизировать патогенные штаммы Citrobacter freundii // Патент РФ № 2565559. 2015.
Тикунова Н. В., Морозова В. В. Фаговый дисплей на основе нитчатых бактериофагов: применение для отбора рекомбинантных антител // Аcta Naturae. 2009. № 3. С. 6—15.
Тикунова Н. В. и Власов В. В. Бактериофаги – враги наших врагов // Наука из первых рук. 2013. № 2(50). С. 58—69.
Покровская М. П. Каганова Л. С., Морозенко М. А. и др. Лечение ран бактериофагом. М.: НАРКОМЗДРАВ СССР, МЕДГИЗ. 1941. 57 с
Górski A. et al. Phages targeting infected tissues: novel approach to phage therapy. // Future Microbiol. 2015. V. 10. P. 199—204.
Międzybrodzki R. et al. Clinical aspects of phage therapy // Adv. Virus. Res. 2012. V. 83. P. 73—121.
В публикации использованы иллюстрации из книги Лечение ран бактериофагом. М.: НАРКОМЗДРАВ СССР, МЕДГИЗ. 1941. 57 с.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Человек живет впостоянном контакте исложнейшем взаимодействии снеисчислимым множеством микроорганизмов. Жить без микробов невозможно, ноисмногими изних— тоже. Ежегодно, посамым скромным оценкам, неучитывающим недоступные для статистики ВОЗ данные многих развивающихся стран, погибает отпневмонии 3,9млн человек, отдиареи— 1,6млн, оттуберкулеза— 1,6млн [1].
Человек живет в постоянном контакте и сложнейшем взаимодействии с неисчислимым множеством микроорганизмов. Жить без микробов невозможно, но и с многими из них — тоже. Ежегодно, по самым скромным оценкам, не учитывающим недоступные для статистики ВОЗ данные многих развивающихся стран, погибает от пневмонии 3,9 млн человек, от диареи — 1,6 млн, от туберкулеза — 1,6 млн [1].
С учетом нарастающей резистентности флоры к антибиотикам, вероятности аллергических и токсических реакций возникает проблема: что применять вместо антибиотиков или в комплексе с ними?
Бактериофаги — древнейшие вирусы, наиболее распространенный в биосфере биологический объект. Чистая природная вода содержит в 1 мл 2×108 фагов, на каждую бактериальную единицу приходится не менее 10 фаговых [5, 6].
Длительное время фаги изучали на примере фагов , размножающихся на Escherichia (Е.) coli штамма В. Внедрение и совершенствование электронной микроскопии позволили говорить о разнообразии форм фагов. Принципиально фаг вне зависимости от вида построен из белковой или липопротеиновой оболочки, внутри которой заключены ДНК ( чаще, реже), еще реже 1- или РНК и ферменты. Выделяют головку фага (возможны нитчатая, сферическая, полигональная, плеоморфная формы фага), где и заключены генетическая информация и ферменты, и хвост фага, прикрепляющийся за счет специфических рецепторов на поверхности клетки. Фаг является облигатным внутриклеточным паразитом, он растворяет оболочку клетки, впрыскивает в клетку свой геном. Последний полностью за счет транскриптаз переключает метаболизм клетки, и начинается синтез ДНК или, соответственно, РНК фага, и капсида. За 1–24 ч образуется 100–300 новых фагов. Клетка разрушается, выделившиеся в окружающее пространство фаги инфицируют новые клетки. Экспоненциальное размножение фагов завершается только после уничтожения специфических для них клеток. Во внешней среде фаги способны переживать десятилетия [7].
В многочисленных отечественных и зарубежных публикациях продемонстрирована эффективность применения бактериофагов, генетически модифицированных, в лечении поверхностной и системной инфекций [8, 9]. Лечение фагами привлекательно по следующим причинам:
2. Бактериофаги — естественные природные средства. Бактериофаг не может длительно циркулировать в макроорганизме — длительность его жизни лимитирована наличием .
При применении бактериофагов следует учитывать, что специфичность фагов может ограничивать их применение в острых случаях.
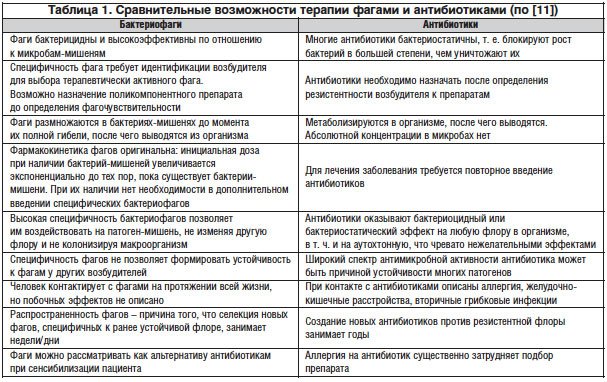
Соотношение бактериофаго- и антибиотикотерапии представлено в таблице 1.
В эксперименте [14, 15] была показана эффективность фагов в лечении кожных инфекций и внутримышечных абсцессов (Pseudomonas (Ps.) aeruginosa, Staphylococcus (S.) aureus). В клинической практике эффективность лечения инфекций ран, инфицированных пострадиационных некрозов была продемонстрирована K. Markoishwili et al. [16] и другими представителями школы грузинского ученого Г. Элиавы.
В нашей стране для наружного применения используют комплексные фаговые препараты. Препарат пиобактериофаг поливалентный (Секстафаг®) для приема внутрь (20 мл 3 р./сут, 7–15 дней), местно или наружно способен лизировать стафило- и стрептококки, патогенные кишечные и синегнойные бактерии (Proteus mirabilis, Proteus vulgaris, Klebsiella pneumoniae). Это позволяет применять его при заболеваниях уха, горла, носа, дыхательных путей, легких и плевры (воспалении пазух носа, среднего уха, ангине, фарингите, ларингите, трахеите, бронхите, пневмонии, плеврите). Секстафаг®, являясь эффективной альтернативой антибиотикам, может также применяться с ними комплексно. Крайне важно, что препарат может применяться при заболеваниях у новорожденных и детей грудного возраста (омфалит, гастроэнтероколит), беременных и рожениц. Все это подчеркивает безопасность препарата.
Гель Отофаг применяют местно в дозировке 1–2 мл: для профилактики рецидивов заболеваний — 2–3 р./сут в течение 7–10 дней, при наличии бактериального воспалительного заболевания — 2–3 р./сут в течение 7–14 дней.
Применение фагов как профилактического, лечебного и противорецидивного средства продемонстрировало свою эффективность в самой частой педиатрической группе: пациенты с инфекционной патологией верхних дыхательных путей (риносинуситы, тонзиллиты, ларингиты, фарингиты). Обычно эти инфекции трактуются как вирусные, хотя достаточно часто причиной бывают и бактерии, или бактериальная флора активируется в процессе манифестации вирусной инфекции.
Подавляющее большинство всех случаев острых заболеваний детей, особенно младшего возраста, вызваны острой респираторной инфекцией (ОРИ). Первичная заболеваемость детей и подростков по г. Москве за колебалась от 1680,2‰ до 1763,6‰3. Заболеваемость болезнями органов дыхания за этот же период составила 1147,4–1188,8‰. Общий экономический ущерб от заболеваний гриппом детей и взрослых в 2008 г. составил 375,2 млрд руб. Заболеваемость ОРВИ детей и подростков до 17 лет в 8,3 раза выше, чем взрослых. Так, при совместных исследованиях с [17] было показано, что на первом году жизни частота эпизодов ОРИ составляет 1535,9:1000, у детей достигает 3796,29:1000. Даже если первоначально заболевание разворачивается как вирусное, то впоследствии часто присоединяется бактериальная флора или активируется собственная, что требует взвешенного решения о выборе препарата или сочетании антибиотиков с иными препаратами, бактериофагами.
Инфекционный ринит дебютирует первоначально, как правило, как вирусный с типичным водянистым или отделяемым. Появление отделяемого, лихорадки, боли в области придаточных пазух говорит о присоединении бактериальной флоры. В качестве профилактики такого развития заболевания можно обсуждать местное применение поливалентного бактериофага.
Присоединение бактериальной инфекции с ее распространением на придаточные пазухи носа приводит к синуситу. Любые нарушения цилиарного клиренса, вентиляции, местного или системного иммунного ответа создают условия для хронизации синусита, вылечить который без воздействия на первоначальные причины невозможно. Признаки синусита:
- сохранение симптомов респираторной инфекции на протяжении 7–10 дней;
- дневной кашель и ринорея;
- заложенность носа;
- нередко низкий субфебрилитет;
- средний отит (у 60–70% больных);
- беспокойство;
- головные боли.
К признакам тяжелого течения синусита или его осложнений относятся гнойная ринорея, лихорадка выше 39ºС и периорбитальный отек. При остром и подостром синусите чаще обнаруживают Streptococcus pneumoniae, реже — Haemophilus (H.) influenzae, Moraxella catarrhalis, Streptococcus pyogenes (β-гемолитический). Хронический синусит чаще полимикробный, вызывается α-гемолитическим стрептококком, S. aureus, коагулазонегативными стафилококками, нетипичными H. influenzae, а также Moraxella catarrhalis и анаэробными бактериями (Peptostreptococcus spp., Prevotella, Bacteroides, Fusobacterium spр.), после многих курсов антибиотиков (или у иммунокомпрометированных пациентов) — Pseudomonads. Эти сведения еще раз заставляют оценить место и роль поливалентных бактериофагов в комплексном лечении синуситов.
При лечении риносинуситов препаратом пиобактериофаг путем его местного введения в пазухи отмечено значительное улучшение, нормализовались показатели завершенности фагоцитоза, что указывало на снижение интенсивности воспаления с восстановлением адекватного иммунного ответа слизистых оболочек носа. Таким образом, препарат пиобактериофаг поливалентный (Секстафаг®) обладает противовоспалительными и иммунорегуляторными свойствами, что проявляется нормализацией показателей местного иммунитета. В то же время применение антибиотиков при лечении больных хроническим гнойным риносинуситом сопровождается сохранением признаков воспаления в виде активации нейтрофильного звена иммунной системы, увеличением внеклеточной пероксидазной активности и угнетением процесса фагоцитоза с нарушением механизмов завершенности в клетках [18]. Пиобактериофаг при местном введении в пазухи улучшает показатели завершенности фагоцитоза, что свидетельствует о снижении интенсивности воспаления с восстановлением адекватного иммунного ответа слизистых оболочек носа [19].
При обследовании пациентов с компенсированной формой хронического тонзиллита S. aureus выделен у 92,5%. Чувствительность культур золотистого стафилококка к стафилококковому бактериофагу оказалась очень высокой (97,4%). По результатам монотерапии специфическим бактериофагом и комбинированного лечения зарегистрированы клиническое улучшение и уменьшение высеваемости S. aureus со слизистой оболочки миндалин [26].
Обострения хронического ларингита сопровождается обсеменением слизистой гортани патогенной микрофлорой. Использование в комплексном лечении таких пациентов специфического бактериофага в виде инстилляций в гортань, а в случае тяжелого обострения — в виде приема внутрь позволяет существенно сократить продолжительность лечения, значительно повышая его качество, достичь более длительной ремиссии болезни и снизить частоту обострений [27].
Эффективность бактериофаготерапии у иммунокомпрометированных пациентов доказана в зарубежных исследованиях [28].
Бактериофаги продемонстрировали эффективность при лечении инфекции, находящейся под биопленкой. Биопленка — плотная колония микроорганизмов на поверхности биологических или небиологических сред, окружающих себя секретируемым экстрацеллюлярным полимером, практически непроницаемым для антибиотиков. Способность бактерий образовывать биопленку — важнейшее условие их выживания на поверхности тканей или медицинских объектов (катетеры, имплантаты). свойства биопленок позволили выдвинуть идею о кооперированных микробных группах как аналогах многоклеточных организмов и социобиологических общностей [29]. Разрушение биопленки возможно при применении фагов [30]. В частности, обработка катетеров перед их постановкой коагулазонегативными фагами резко снижает вероятность образования биопленки Staphylococcus epidermidis [31].
Применение бактериофагов известно также при собственно кишечных инфекциях [32] и при сепсисе, вызванном кишечной инфекцией Ps. aeruginosa [33]. При этом в эксперименте прием бактериофага per os привел к 67% выживаемости в экспериментальной группе животных и к 0% в контрольной.
Особое внимание привлекает возможность бактериофаготерапии при внутренних и системных инфекциях. Большинство таких исследований принадлежит отечественным ученым. Показано, что совместное применение бактериофагов и антибиотиков в лечении детей с осложненной инфекцией мочевыводящих путей значительно эффективней, чем изолированная антибиотикотерапия [34].
[35] пролечено 36 детей в возрасте от 14 дней до 3 лет с тяжелыми заболеваниями бронхолегочной системы с наличием в мокроте синегнойной и кишечной палочек, клебсиеллы, энтерококка, стафилококка, которые, будучи нозокомиальной флорой, в большинстве случаев были нечувствительны к большинству известных антибиотиков. Путем ингаляций вводили моно- или поливалентные бактериофаги, пиобактериофаг. Курс антибактериальной терапии сократился с 13–17 до 8–11 дней. Элиминация возбудителя и уменьшение воспаления в трахеобронхиальном дереве подтверждались контрольным бактериологическим посевом и цитологическим исследованием мокроты: эффективность составила 88,8%. Использование поливалентных фагов явилось более оправданным по сравнению с монофагами на фоне элиминации основного бактериального агента в меньшей мере происходила параллельная контаминация другими, не менее вирулентными, микробами. Таким образом, применение небулайзеротерапии бактериофагами в комплексном лечении острых и хронических обструктивных бронхолегочных заболеваний, включая муковисцидоз, показало высокую клиническую эффективность, позволило сократить сроки лечения дорогостоящими антибиотиками широкого спектра, уменьшить риск развития кандидоза. В эксперименте на животных, моделирующем лечение муковисцидоза, введение бактериофага при тяжелой пневмонии, вызванной Ps. aeruginosa, сопровождалось резким повышением выживаемости в подопытной группе [36].
Есть много нерешенных проблем, которые сводятся к организации многоцентровых исследований по принципам доказательной медицины, соотношению антибиотиков и бактериофагов при лечении.
В любом случае можно утверждать, что это направление перспективно и достаточно обнадеживающе, особенно при инфицировании резистентными штаммами.
Разнообразие лекарственных форм бактериофагов (таблетки, гели, растворы) позволяет применять их как перорально, так и наносить на раневые поверхности, вводить в полости организма. Препараты бактериофагов широко применяются в педиатрии, акушерстве и гинекологии, офтальмологии Например, назначение по поводу кесарева сечения препарата Секстафаг®, предварительно адаптированного к флоре, циркулирующей в конкретном учреждении, приводило к снижению осложнений (18,7%) в большей степени (26,7%), чем в группе женщин, получавших антибиотикопрофилактику.
История изучения бактериофагов и анализ их применения в медицине позволяют с уверенностью сказать, что бактериофаги могут оказаться чрезвычайно востребованными в лечении самых разнообразных инфекционных заболеваний человека, особенно при антибиотикорезистентных возбудителях. Каждый препарат, тем более обладающий качествами живого и вводимый в организм человека, имеет свои положительные и вероятностные отрицательные эффекты. В частности, литический эффект фагов, приводящий к разрушению клеточной стенки микроба, сопровождается выбросом в кровь большого количества эндотоксинов, что приводит к эффекту септицемии. Обсуждается необходимость приема активированного угля или иных адсорбентов. Более перспективным направлением кажется генетическая инженерия фага, которая сохраняла бы свой , но фаг был бы . Такой фаг мог бы использоваться в клинической практике как эффективный антимикробный агент, лишенный побочных эффектов [37]. Кроме того, бактериофаги, как и любые другие вирусы, способны переносить гены вирулентности от одной бактерии к другой [38].
В настоящее время в большинстве публикаций указывается на безопасность фаготерапии; хорошо организованные двойные слепые рандомизированные контролируемые исследования позволят определить безопасность и эффективность фагов как альтернативы антибиотикам при инфекциях с полирезистентной флорой [39]. Дальнейшее изучение возможностей бактериофаготерапии будет зависеть от объективной заинтересованности медицинского сообщества, проведения многоцентровых независимых исследований, развития вирусологии с ее возможностями получения новых чистых препаратов фагов.
1 Сборник среднемосковских основных показателей деятельности учреждений Департамента здравоохранения г. Москвы за М., 2009. 87 с.
2 Выбор инфекционного агента для опытов не был случайным: отец был известным микробиологом, написавшим монографию о сибиреязвенной палочке, переведенную и на немецкий язык.
3 Департамент здравоохранения г. Москвы. Доклад о состоянии здоровья населения г. Москвы в 2008 г.
Только для зарегистрированных пользователей
Читайте также:

