Лечение рака яичников при мутации brca1
· Особенность BRCA1 и BRCA2 генов
· Вероятность развития рака яичников при выявлении BRCA1 и BRCA2
· Клинико-патологические особенности BRCA-ассоциированного рака яичников
· Прогностическое значение BRCA1 и BRCA2 при раке яичников
· Рекомендации по проведению тестирования
· Интерпретация результатов BRCA-теста пробанда (человека, выступающего в качестве отправной точки генетического исследования семьи)
· Менеджмент носителей BRCA мутации
Особенность BRCA1 и BRCA2 генов
BRCA1 и BRCA2 являются отдельными генами, расположенными на двух разных хромосомах (17q21 и 13q12.3 соответственно). Эти гены считаются генами опухолевых супрессоров, так как они отвечают за поддержание геномной стабильности и, следовательно, за контроль роста клеток.
BRCA1 и BRCA2 белки в основном вовлечены в репарацию двунитиевых ДНК (DSBs). Ген Вrca1 - очень крупный ген, отвечающий за генерацию нескольких различных конъюгатов. Наибольший окончательный размер гена - 2843 аминокислоты (p220), а также белок меньшего размера - 1399 аминокислот, названный BRCA1-IRIS, который и может быть онкоактивным.
BRCA2 - еще больше по размеру (имеет 3418 аминокислот), но менее значим в данном аспекте проблемы. Brca1 и Вrca2 имеют очень высокую плотность повторяющихся элементов ДНК, которые способствуют их генетической нестабильности. Дефицит их специфических геномных функций влечет за собой высокую степень хромосомной нестабильности. Эта нестабильность приводит к использованию альтернативных путей восстановления утраченных функций. С дефицитом генов BRCA1, в одной из трех основных систем репарации, начинают преобладать механизмы ошибочной репарации, а при дефиците BRCA2 –активизируются механизмы патологической репарации в двух других системах. Потеря функции генов BRCA1/2 может возникнуть из-за соматических мутаций или эпигенетической ошибки. Как результат - низкая точность считывания информации ДНК и потенциальная нестабильности генома. Это, в свою очередь, может привести к злокачественной трансформации. Риск рака, вызванного BRCA1 и BRCA2 мутациями, наследуются по доминантному принципу. Отсутствие функции генов BRCA1 и BRCA2 напрямую связано с риском развития эпителиального рака яичников (от 40% до 50% у пациентов с генами BRCA1-мутациями и от 20% до 25% у пациентов с BRCA2-мутациями).
Вероятность развития рака яичников при выявлении BRCA1 и BRCA2
Синдром наследственного рака молочной железы и рака яичников (HBOC), вызванный патологическим наследованием BRCA1 или BRCA2, характеризуется повышенным риском развития рака молочной железы у женщин, фаллопиевых труб, первичного перитонеального рака яичников, поджелудочной железы, колоректального рака, меланомы, рака простаты и молочной железы у мужчин. Показатели в такой группе риска следующие:
1. 40%-80% для рака молочной железы,
2. 11%-40% для рака яичников,
3. 1%-10% для рака молочной железы у мужчин,
4. до 39% для рака предстательной железы,
5. 1%-7% для рака поджелудочной железы, соответственно.
Мутации BRCA кластера в семьях проявляются по аутосомно-доминантному типу передачи по материнской, либо по отцовской линиям. Вероятность развития рака варьирует даже в пределах всей семьи с такой мутацией. Было подсчитано, что более чем у 90% семей с наследственно обусловленным раком молочной железы и раком яичников выявлены мутации в генах BRCA 1/2. По оценкам ESMO диапазон риска развития рака молочной железы - от 41% до 90%, с повышенным риском развития коллатерального рака, рака молочной железы и рака яичников - от 8% до 62% в зависимости от исследуемой популяции. Подсчитанная суммарная вероятность риска развития BRCA1/2-ассоциированного рака молочной железы и рака яичников в возрасте до 70 лет, при наличии BRCA1-мутации, составляет от 50% до 80% и от 24% до 40%, соответственно; при наличии BRCA2-мутации - от 40% до 70 % для рака молочной железы и от 11% до 18% - для рака яичников. В настоящее время неясно, является ли данная статистическая достоверность абсолютной только при наличии конкретной мутации, выявленной в семье, или же играют определенную роль и дополнительные факторы (например, экологические).
Клинико-патологические особенности BRCA-ассоциированного рака яичников
Каждый тип опухоли, несущий в себе специфические BRCA-мутации, даже при отсутствии видимой наследственности, был связан с конкретным онкологическим фенотипом заболевания (например, низкодифференцированный рак молочной железы) и имел отличительные клинические особенности. Что касается гистологической картины рака яичников, более высокая встречаемость этой генетической аберрации наблюдалась при высокодифференцированном серозном подтипе рака (около 20-25%), хотя эндометриоидные и недифференцированные подтипы также были зарегистрированы в этих подгруппах. Последний молекулярный анализ высокодифференцированного серозного рака яичников с помощью Атласа генома раковых заболеваний (TCGA) показал, что около 50% этих опухолей имеют отклонения в гомологической рекомбинации (HRR) генов. Более 90% опухолей у женщин с BRCA1-ассоциированным раком - серозные (по сравнению с приблизительно 50% женщин без BRCA1-ассоциированных опухолей). Серозные аденокарциномы, как правило - высокодифференцированные и представлены крупными интраэпителиальными лимфоцитами с атипичными ядрами и избыточными митозами. Гетерозиготы по мутации BRCA1 патогенетического варианта также представляют значительную опасность в плане развития папиллярного серозного рака брюшины - злокачественного заболевания, которое невозможно отличить от серозного рака яичников (встречается реже у пациентов с BRCA2 патогенетическим вариантом по сравнению с BRCA1). Тщательный гистологический анализ фаллопиевых труб, удаленных во время профилактической овариектомии, идентифицировал ворсинчатые хорионы как потенциальную угрозу в плане развития первичной карциномы фаллопиевых труб и серозной аденокарциномы (STIC).
Прогностическое значение BRCA1 и BRCA2 при раке яичников
Поскольку персонализированная терапия сегодня является основным направлением лечения онкологических пациентов, анализ генетической информации позволяет предложить пациентам наиболее рациональный подход в терапии их заболевания. Своевременная и точная идентификация больных с мутацией BRCA является важным составляющим компонентом в плане прогноза заболевания, оценки риска наследственности и принятии решения о лечении в каждом конкретном случае.
Лечение рака яичников у пациентов с BRCA1- или BRCA2-ассоциированными опухолями до сих пор является спорадическим, несмотря на то, что некоторые доклинические исследования показали, что в основном BRCA1, как представляется, является важным фактором для воздействия ДНК-повреждающих соединений.
BRCA-позитивные пациенты были отмечены как:
1. Пациенты с более высокими показателями общей выживаемости
2. Пациенты с более длительными периодами ремиссий после химиотерапии первой линии
3. Пациенты с более длительными временными интервалами между каждой линией терапии
4. Пациенты со значительно лучшим клиническим ответом на часто используемые химиотерапевтические агенты (алкилирующих препаратов, соединений платины, липосомального доксорубицина (PLD), класса ингибиторов полимеразы АДФ – полимиразы (PARP)).
Рекомендации по проведению тестирования
На основании вышеприведенных доказательств, Европейские и американские рекомендации советуют женщинам проходить генетическое консультирование и генетическое тестирование даже при отсутствии доказанной наследственности на момент постановки диагноза эпителиального рака яичников, фаллопиевых труб и первичного перитонеального рака. Комплексная молекулярная фаза диагностики необходима при расчете возможного рационального терапевтического подхода с позиции облегчения доступа к генетическому консультированию. Определение статуса BRCA1/2 может быть соответствующим клиническим прогностическим биомаркером и связана с показателем выживаемости, а также прогностическим критерием, влияющим на реакцию или устойчивость к химиотерапии. BRCA-ассоциированные опухоли яичников связаны с наследственной предрасположенностью к развитию этих типов рака. Хотя большинство из этих женщин не имеют доказанных BRCA мутаций, некоторые из пациенток имели информацию о возможной генетической предрасположенности. Недавние исследования показали, что у пациенток с раком яичников имеется распространенность патогенных вариантов BRCA-мутаций> 10%, независимо от возраста на момент постановки диагноза и наличия наследственной предрасположенности к развитию рака яичников / молочной железы. Общая распространенность BRCA1 / 2 –ассоциированных вариантов в общей популяции (исключая ашкеназских) оценивается как 1 из 400, но варьирует в зависимости от этнической принадлежности. Распространенность этих патогенных вариантов возрастает у больных с серозным раком яичников (17-20%), высокодифференцированной серозной карциномой (23-25%) и у пациентов, чувствительных к препаратам платины (30-40%).
BRCA-тесты, проведенные на основании образцов периферической крови, способны выделить конституциональные (или зародышевые) / наследственные изменения, передающиеся детям (50% вероятности для каждого ребенка). Тесты BRCA, проводимые на опухолевой ткани, в состоянии выделить оба варианта мутаций. Характер варианта идентифицированной мутации (конституциональный или приобретенный) должен быть доказан уже с помощью анализа нормальной ткани (кровь, другой ткани). На основании имеющихся исследований ожидается, что 2/3 патогенных вариантов BRCA, идентифицируемых у больных раком яичников, носят конституционный (или зародышевый) характер (присутствует в каждой клетке в теле) и 1/3 являются мутациями соматического типа (приурочены к опухолевой ткани ). Почти во всех случаях, варианты зародышевых генов BRCA1 и BRCA2 унаследованы от матери или отца (менее 1% случаев обусловлены De Novo мутациями). Наличие многочисленных полиморфизмов, а также интронных мутации часто трудно интерпретировать, особенно если проводятся более сложные диагностические процедуры. Для двух генов BRCA также идентифицированы около 3800 мутаций и 1500 генетических вариантов неопределенного значения (VUS), которые сейчас активно изучаются. Из-за длины двух генов, анализ в настоящее время сосредоточен на кодирующей части (51 экзонов, в общей сложности около 16 000 нуклеотидов).
Интерпретация результатов BRCA-теста пробанда (человека, выступающего в качестве отправной точки генетического исследования семьи)
Из-за широкого спектра BRCA-генных мутаций, проблема классификации генетических вариантов, определенных в процессе тестирования, имеет большое значение, так как очень часто лаборатория идентифицирует вариант, который не был ранее освещен в литературе. Важно, чтобы каждая лаборатория имела четкие критерии классификации вариантов, и чтобы отчеты составлялись в соответствии с текущими рекомендациями надлежащей лабораторной практики. Целесообразно также, что лаборатории участвуют во внешних программах контроля качества, систематизации и централизованного сбора исследуемых вариантов BRCA. Это должно способствовать улучшению процесса классификации. В последнее время конкретные критерии для интерпретации клинической значимости конституционных вариантов генов BRCA были разработаны на основании фактических данных Evidence-based Network forthe Interpretation of Germline Mutant Alleles (ENIGMA) и доступны на веб-сайте консорциума. Исследования, проведенные на мышах, показали, что не существует прямой корреляционной зависимости между вариантами генов BRCA, связанных с повышенным риском развития опухоли, и клетками - мишенями развития ответа на лечение с анти-PARP.
Варианты классифицируются следующим образом:
· Условно пагубные мутации: пока нет явных доказательств, но изменение в настоящее время считается вредным.
· Вариант неизвестного значения (VUS): имеет ли мутация какой-либо эффект - неизвестно. Это общий результат теста, и большинство вариаций начинается именно в этой категории. По мере приобретения большего количества доказательств, полученные результаты переквалифицируется.
· Полиморфный вариант: пока нет явных доказательств, изменение считается безвредным.
· Доброкачественный полиморфизм: изменение классифицируется как безвредное. Такие изменения могут быть представлены как "отсутствие мутации".
Согласно Американским и Европейским практическим руководствам, генетическое консультирование и генетическое исследование рекомендуются женщинам (даже при отсутствии явной наследственной предрасположенности) в процессе постановки диагноза эпителиального рака яичников, фаллопиевой трубы и первичного рака брюшины.
Мутации генов BRCA, Анджелина Джоли, рак груди и рак яичников
Смертность от рака яичников стоит на 8-м месте среди причин смертности женщин от онкологических заболеваний. Из-за отсутствия свойственных только этому заболеванию симптомов, рак яичников до сих пор диагностируют довольно поздно. Что может современная медицина, с ее генетическими исследованиями и новыми препаратами, а что зависит от самих женщин, рассказывает онколог Светлана Хохлова.

Почему большинство случаев рака яичников у женщин приходится на возраст после 50 лет? Как связан рак яичников с отсутствием беременности и грудного вскармливания? С раком груди?
На сегодняшний день выделяют несколько факторов, которые повышают риск развития рака яичников: гормональный, генетический, алиментарные факторы, к которым относится экология и питание, и социальные факторы.
Многочисленные эпидемиологические исследования показывают влияние гормональных факторов в группах пациенток, у которых либо раньше начиналась менструация, либо поздно наступала менопауза.
Прямой связи с гормональными нарушениями в организме в этих исследованиях не наблюдалось. Однако установлено, что повышенное количество эстрогенов, во-первых, участвует в развитии рака молочной железы, а во-вторых, может повысить риск развития рака яичников.
Эти гормональные нарушения связаны, в основном, с процессами овуляции. При выходе яйцеклетки из яичника в каждом менструальном цикле происходит незначительное повреждение коркового слоя яичника. Эти повреждения эпителия накапливаются и могут приводить к перерождению эпителия в рак, поэтому женщины в возрасте после 40 лет и попадают в группу риска. Также приводить к перерождению ткани в рак могут воспалительные процессы, кисты яичников, эндометриоз.
Напротив, беременность и грудное вскармливание уменьшают количество овуляций в жизни женщины, с чем и связано предположение, что материнство снижает риск развития онкологии. Это подтверждает статистика: установлено, что в странах с низкой рождаемостью (а это, как правило, развитые страны) рак яичников встречается чаще. В развивающихся странах с высокой рождаемостью риск развития рака яичников намного ниже.
Сейчас проверяются гипотезы о том, насколько повышают риск развития рака препараты, стимулирующие работу яичников, например, эстрогены. В то же время, имеются данные, что контрацептивы с эстрогенами и прогестинами уменьшают риск развития данного заболевания.
Что такое гены BRCA и как они связаны с раком яичников и раком груди? Надо ли носителям мутировавших генов на всякий случай удалять яичники, как Анджелина Джоли удалила грудь?
Наиболее важным фактором развития рака яичников последние годы считают генетический. Всевозможные повреждения ДНК происходят в организме каждую секунду и могут приводить к развитию опухоли. Однако выявлены определенные гены-супрессоры, которые блокируют опухолевый рост. К таким генам, которые участвуют в восстановлении ДНК и сдерживают развитие опухолевого процесса, как раз и относятся BRCA1 и BRCA2.
Если же в этих генах имеются мутации, то механизм, который восстанавливает поврежденные ДНК, не работает, количество мутаций в ДНК накапливается и развивается злокачественная опухоль. По имеющейся статистике, к 70 годам у 44% носителей мутированного гена развивается злокачественная опухоль яичников. А частота мутации гена BRCA среди больных раком яичников превышает 15%.
Генетические мутации BRCA1/2 наследуемы и часто встречаются в семьях, где кто-то болел или болеет раковым заболеванием. Не обязательно раком яичников или молочной железы — сейчас уже есть данные, что меланома, рак поджелудочной железы и ряд других опухолевых заболеваний в семьях также влияют на предрасположенность к развитию рака яичников. Поэтому члены таких семей должны быть на особом учете и проходить обследования.
Что касается таких решительных мер, как профилактическое удаление яичников и молочных желез, то исследования действительно показывают значительное снижение риска развития опухоли в этих случаях. Однако в нашей стране юридически данные виды операции не разрешены.

Какие есть способы ранней диагностики рака яичников? Диагностируется ли он на УЗИ?
К сожалению, скрининг для рака яичников не показал свою значимость. Ни УЗИ, ни определенные маркеры не показывают на ранних этапах данную патологию. С помощью ультразвукового исследования можно увидеть кисты, опухолевые изменения, и если есть подозрения на злокачественную опухоль, то пациентку обязательно нужно направить к онкологу и сделать анализ крови на маркер CA125.
Так что на сегодняшний день раннюю диагностику ракового заболевания может обеспечить онконастороженность самих женщин.
Действительно ли симптомы рака яичников могут напоминать расстройство желудка? Если женщина пойдет с болью в животе к гастроэнтерологу, он заподозрит неладное?
Рак яичников имеет имплантационный характер прогрессирования: метастазирование идет по серозной оболочке кишечника, желудка, печени, также появляется жидкость в брюшной полости. Поэтому часто пациентка жалуется на расстройство желудка, боли в эпигастральной области, в правом подреберье. Такие симптомы, как увеличение живота и запоры, появляются уже на 3-4-й стадии рака.
Проблема своевременной постановки диагноза заключается в отсутствии уникальных симптомов. Даже в Москве, где медицина на достаточно высоком уровне, с момента появления у женщины жалоб до первого визита к онкологу проходит от 4 месяцев до полутора лет. Все это время она может проходить обследования по месту жительства у терапевта, но правильный диагноз установлен не будет. 80% пациенток попадают к онкологу уже на 3-4-й стадии рака яичников. Единственный путь, который может изменить скорбную ситуацию — это информирование и обучение медицинских работников первичного звена.
Если опухоль обнаружена, то операция обязательна? Существуют ли варианты лекарственной терапии?
Да, основным методом лечения рака яичников является, конечно, оперативное: удаление первичной опухоли, большого сальника, всех видимых опухолевых изменений в брюшной полости.
Вне зависимости от стадии заболевания после операции пациенты проходят химиотерапию. Обойтись без химиотерапии можно только на очень ранней стадии, но из-за сложности обнаружения заболевания таких случаев мало. Часто во время операции оказывается, что стадия рака гораздо больше, чем предполагалось по данным обследования.
За многие годы большое количество всевозможных таргетных (или целевых) препаратов изучалось при раке яичников, но на сегодня из этой группы только один препарат зарегистрирован для лечения данной патологии.
С увеличением наших познаний в биологии рака ученые обнаружили, что в опухолевых клетках с мутацией гена BRCA ряд механизмов восстановления ДНК выключены. Для пациенток — носителей данных мутаций разработали препараты, которые блокируют другие механизмы восстановления ДНК, ДНК не восстанавливается, и опухолевая клетка погибает.
Это так называемые PARP-ингибиторы. Практическое применения этих препаратов показало преимущество использования их в поддерживающем режиме у пациенток с рецидивом рака яичников с мутацией гена BRCA1/2, у которых удалось достичь полного или частичного ответа на химиотерапию с применением препаратов платины. Такие препараты выводят лечение пациенток, страдающих раком яичников, на качественно новый уровень и улучшают их выживаемость.

Можно ли сформулировать порядок действий для профилактики рака яичников — в каком возрасте какие обследования проходить женщине?
Профилактика рака яичников связана с уже упомянутыми факторами риска: правильное питание, своевременное лечение воспалительных процессов, обследование и лечение кист, лечение эндометриоза и других предраковых заболеваний.
Те, у кого выявлена генетическая мутация, встают на учет к генетику и проходят специальную скрининговую диагностику с раннего возраста. Мутация BRCA1/2 может проявляться и в виде рака молочной железы, и виде рака яичников, поэтому женщины группы риска должны проходить осмотр у гинеколога и маммолога регулярно с 25 лет. С 25-30 лет раз в год необходимо делать МРТ молочных желез и маммографию, с 35 лет — УЗИ яичников, малого таза и брюшной полости, а также анализ крови на определение маркера CA125.
Главным помощником женщины может быть ее собственная информированность и онконастороженность. Рекомендую каждой женщине после 30-35 лет регулярно проходить осмотр у гинеколога и проверять молочные железы.
Основу лечения распространенного эпителиального рака яичников составляет выполнение первичной циторедуктивной операции и проведение последующей химиотерапии. В начале этого столетия произошла смена первой линии химиотерапии распространенного рака яичников. Комбинация производных платины (цисплатин или карбоплатин) и таксанов сместила с трона ранее стандартную комбинацию цисплатина и циклофосфана, увеличив медиану времени до прогрессирования с 13 до 18 мес. и общую продолжительность жизни с 24 до 38 мес. С тех пор в течение долгого времени нам не удавалось улучшить результаты первой линии химиотерапии распространенного рака яичников. Проведение внутрибрюшинной терапии, демонстрирующей лучшие показатели отдаленных результатов, остается экспериментальным подходом. Использование тройных комбинаций, еженедельное введение химиотерапии, совместное назначение таргетных препаратов и химиотерапии, как правило, не демонстрировали своего преимущества. Добавление бевацизумаба позволило выиграть 3 месяца в медиане без прогрессирования, но не повлияло на увеличение продолжительности жизни. С этого времени многочисленные исследователи репортируют примерно одинаковые цифры отдаленных результатов: для больных с первичной оптимальной циторедукцией проведение химиотерапии позволяет достигнуть медианы времени до прогрессирования 18-26 мес. и продолжительности жизни 50-60 мес., для больных с неоптимальной первичной циторедукцией или интервальной циторедукцией 10-13 мес. и 23-36 мес. соответственно.
Ингибиторы фермента PARP (полиаденозиндифосфат-рибоза) блокируют его работу по репарации однонитевого разрыва ДНК, постоянно возникающего в опухолевых клетках. Однонитевые разрывы ДНК в процессе деления клетки и удвоения ДНК превращаются в двухнитевые. Двухнитевые разрывы ДНК в норме эффективно восстанавливаются с помощью механизма гомологичной рекомбинации. Этот механизм дефектен у здоровых носителей и больных с наличием инактивирующей мутации генов BRCA1/2. Ингибирование PARP в данном случае приводит к невозможности репарации возникших повреждений ДНК, что запускает процесс апоптоза опухолевой клетки. Это явилось предпосылкой применения PARP-ингибиторов в монотерапии у больных с наличием герминальной или соматической мутации генов BRCA1/2.
У 30% больных низкодифференцированным серозным и эндометриоидным раком яичников имеется мутация генов BRCA1/2, что объясняет интерес к изучению эффективности PARP-ингибиторов при этой локализации опухоли. В исследовании SOLO2 PARP-ингибитор олапариб сравнивали с плацебо в качестве поддерживающей терапии после завершения платиновой терапии платиночувствительного рецидива [1]. Олапариб достоверно увеличил медиану времени до прогрессирования с 5,5 мес. до 19,1 мес., что соответствует снижению относительного риска прогрессирования на 70% (HR=0,30; p
Недавно проведенное исследование большого объема (более 20 000 образцов) показало, что весьма простой (всего два определяемых маркера) и неинвазивный молекулярный тест может увеличить чувствительность определения меланомы (т.е.
Проведен метаанализ 23-х проспективных клинических исследований профиля и эффективности нератиниба. Нератиниб представляет собой новый ингибитор тирозинкиназы - рецептора эпидермального фактора роста человека (HER), который показал многообещающую активность против нескольких типов злокачественных новообразований, особенно HER2-положительного рака молочной железы (HER+РМЖ).
Компания AstraZeneca анонсировала предварительные результаты III фазы клинического исследования OLYMPIAD (NCT02000622), в котором изучалась эффективность и безопасность использования противоопухолевого препарата олапариб (olaparib) в монотерапии по сравнению со стандартом…
10 апреля 2017 г. в России стартовала социальная кампания #ЗАЖГИЛУЧСВЕТА, которая призвана привлечь внимание к такому серьезному заболеванию как рак яичников и рассказать о возможностях определения наследственного риска его развития.
Компания Tesaro на ежегодной конференции Общества онкогинекологии представила результаты III фазы клинического исследования (NCT01847274) по эффективности противоопухолевого препарата нирапариб (niraparib) у пациенток, страдающих от рака яичников, чувствительного к препаратам…
Ключевыми и долгожданными событиями 2016 года можно назвать регистрацию в Государственном реестре лекарственных средств трех препаратов, относящихся к новому классу иммуноонкологических препаратов – ингибиторов точек иммунного ответа: ингибитора CTLA-4 - Ервой® (ипилимумаб);…
С предрасположенностью к возникновению синдрома РМЖ/РЯ связано присутствие у таких пациентов мутаций в генах BRCA1 или BRCA2. Мутации являются наследственными – то есть, буквально в каждой клетке организма такого человека есть повреждение, которое передалось ему по наследству. Вероятность возникновения злокачественного новообразования у пациентов с мутациями BRCA1 или BRCA2 к 70 годам достигает 80%.
Однако, в каждой клетке присутствует две копии каждого гена — от мамы и от папы, поэтому вторая копия может компенсировать нарушение работы клеточных систем. Но вероятность выхода ее из строя также очень высока. При нарушении процессов восстановления ДНК в клетках начинают накапливаться и другие изменения, которые, в свою очередь, могут привести к злокачественной трансформации и росту опухоли.
Определение генетической предрасположенности к онкологическим заболеваниям:
На базе лаборатории молекулярной онкологии НМИЦ онкологии им. Н.Н. Петрова применяется проведение поэтапного анализа для пациентов:
- сначала исследуется присутствие самых частых мутаций (4 мутации)
- при отсутствии таковых и клинической необходимости возможно проведение расширенного анализа (8 мутаций) и/или анализа полной последовательности генов BRCA1 и BRCA2.
 |  |
На данный момент известно более 2 000 вариантов патогенных мутаций в генах BRCA1 и BRCA2. Кроме того, данные гены являются довольно большими – 24 и 27 экзонов соответственно. Поэтому полный анализ последовательностей генов BRCA1 и BRCA2 является трудоемким, дорогостоящим и длительным по времени процессом.
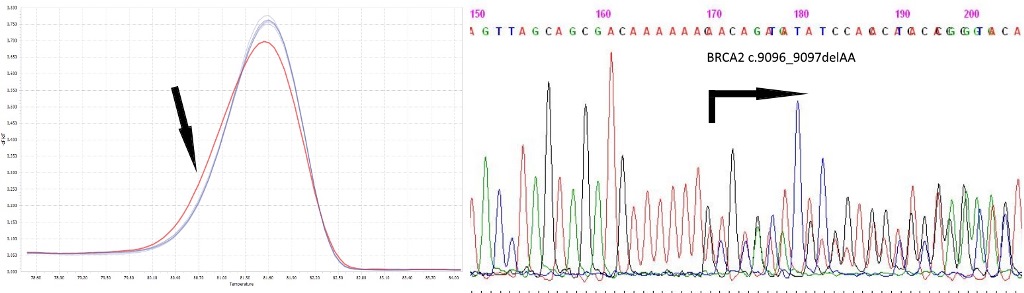
Анализ последовательности гена BRCA2, выявление мутации c.9096_9097delAA
В каких случаях нужно сдать анализ на мутации BRCA1 и BRCA2?
Национальная онкологическая сеть – National Comprehensive Cancer Network (NCCN) рекомендует направлять на генетическое исследование следующих пациентов:
- Пациенты до 45 лет с диагнозом рак молочной железы
- Пациенты в возрасте до 50 лет с РМЖ, если в семье есть хотя бы один близкий кровный родственник с таким диагнозом
- Также в том случае, если у пациента до 50 лет с РМЖ семейная онкологическая история неизвестна
- Если в возрасте до 50 лет диагностировано множественное поражение молочных желез
- Пациенты с РМЖ в возрасте до 60 лет — если по результатам гистологического исследования опухоль является трижды-негативной (отсутствует экспрессия маркеров ER, PR, HER2).
- При наличии диагноза рак молочной железы в любом возрасте — если присутствует хотя бы один из следующих признаков:
- не менее 1 близкой родственницы с РМЖ в возрасте менее 50 лет;
- не менее 2 близких родственниц с РМЖ в любом возрасте;
- не менее 1 близкой родственницы с РЯ;
- наличие не менее 2 близких родственников с раком поджелудочной железы и/или раком предстательной железы;
- наличие родственника-мужчины с раком грудной железы;
- принадлежность к популяции с высокой частотой наследственных мутаций (например, евреи Ашкенази);
- Все пациенты с диагностированным раком яичников.
- Если диагностирован рак молочной железы у мужчины.
- Если диагностирован рак простаты (с индексом по шкале Глисона >7) при наличии не менее одного родственника с РЯ или РМЖ в возрасте менее 50 лет или при наличии не менее двух родственников с РМЖ, раком поджелудочной железы или раком простаты.
- Если диагностирован рак поджелудочной железы при наличии не менее одного родственника с РЯ или РМЖ в возрасте менее 50 лет или при наличии не менее двух родственников с РМЖ, раком поджелудочной железы или раком простаты.
- Если рак поджелудочной железы диагностирован у уиндивидуума, принадлежащего к этносу евреев Ашкенази.
- Если у родственника обнаружена мутация BRCA1 или BRCA2
Выполнение молекулярно-генетического анализа должно сопровождаться генетическим консультированием, в ходе которого обсуждаются содержание, смысл и последствия тестирования; значение позитивного, негативного и неинформативного результатов; технические ограничения предлагаемого теста; необходимость информировать родственников в случае обнаружения наследственной мутации; особенности скрининга и профилактики опухолей у носителей мутаций и др.
Как сдать анализ на мутации BRCA1 и BRCA2?
Материалом для анализа является кровь. Для генетических исследований используют пробирки с ЭДТА (фиолетовая крышка). Сдать кровь можно в лаборатории НМИЦ или привезти из любой другой лаборатории. Кровь хранится при комнатной температуре до 7 дней.
 |  |
Особая подготовка к исследованию не нужна, на результаты исследования не влияют приемы пищи, прием лекарств, введение контрастных веществ и пр.
Пересдавать анализ через некоторое время или после лечения не потребуется. Наследственная мутация не может исчезнуть или появиться в течение жизни или после полученного лечения.
Что делать, если у женщины обнаружена мутация BRCA1 или BRCA2?
Для носителей патогенных мутаций разработан комплекс мероприятий по ранней диагностике, профилактике и терапии новообразований молочной железы и рака яичников. Если среди здоровых женщин своевременно выявить тех, у кого имеется генный дефект, есть возможность диагностировать развитие заболевания на ранних стадиях.
Исследователями были выявлены особенности лекарственной чувствительности BRCA-ассоциированных опухолей. Они хорошо реагируют на некоторые цитостатические препараты, и лечение может быть весьма успешным.
Для здоровых носителей BRCA-мутаций рекомендовано:
- Ежемесячное самообследование с 18 лет
- Клиническое обследование молочных желез (маммография или магнитно-резонансная томография) с 25 лет.
- Мужчинам-носителям мутации в генах BRCA1/2 рекомендовано проведение ежегодного клинического обследования грудных желез начиная с 35-летнего возраста. С 40 лет целесообразно выполнение скринингового обследования предстательной железы.
- Проведение дерматологического и офтальмологического осмотров c целью ранней диагностики меланомы.
Как предрасположенность к РМЖ и РЯ передается по наследству.
Часто у носителей мутаций BRCA1/BRCA2 возникает вопрос – всем ли детям она передалась и какие генетические причины появления наследственной формы РМЖ? Шансы передать повреждённый ген потомству составляют 50%.
Заболевание одинаково наследуется, как мальчиками, так и девочками. Ген, связанный с развитием рака молочной железы и рака яичников, расположен не на половых хромосомах, поэтому вероятность носительства мутации не зависит от пола ребенка.
Если мутация в нескольких поколениях передавалась через мужчин, очень сложно проводить анализ родословных, так как мужчины довольно редко болеют РМЖ даже при наличии генного дефекта.
Например: носителями были дедушка и отец пациентки, и у них заболевание не проявилось. На вопрос, были ли случаи онкологических заболеваний в семье, такая пациентка ответит отрицательно. При отсутствии других клинических признаков наследственных опухолей (ранний возраст/множественность опухолей), наследственная составляющая заболевания может быть не учтена.
При обнаружении мутации BRCA1 или BRCA2 всем кровным родственникам рекомендуется также пройти тестирование.
Почему при генетическом исследовании важно учитывать этнические корни?
Для многих этнических групп характерен свой набор частых мутаций. Национальные корни обследуемого необходимо учитывать при выборе глубины исследования.



Читайте также:

