Укажите правильную последовательность стадий патогенеза лейкозов
Под влиянием онкогенных вирусов, ионизирующей радиации, химических веществ происходит мутация генов или эпигеномное нарушение регуляции процесса размножения и созревания кроветворных клеток. При этом в костном мозге образуется клон опухолевых клеток, для которых характерны беспредельный рост и пониженная способность к дифференцировке. Быстрый рост лейкозных клеток приводит к распространению (метастазированию) их по всей системе крови, включая кроветворные органы и кровь. В образовавшихся клетках, циркулирующих в крови, обнаруживаются одинаковые хромосомные маркеры. Для хронического миелолейкоза таким маркером служит "филадельфийская" хромосома.
Нестабильность генотипа лейкозных клеток приводит к возникновению мутаций, как спонтанных, так и обусловленных продолжающимся воздействием канцерогенных факторов, в результате чего образуются новые опухолевые клоны.
Таким образом, лейкоз проходит две стадии своего развития: 1) моноклоновую (относительно более доброкачественную) и 2) поликлоповую (злокачественную, терминальную). Переход из одной стадии в другую является показателем опухолевой прогрессии — лейкозные клетки приобретают большую злокачественность. Они становятся морфологически и цитохимически недифференцируемыми, в кроветворных органах и крови увеличивается количество бластных клеток с дегенеративными изменениями ядра и цитоплазмы. Лейкозные клетки распространяются за пределы кроветворных органов, образуя лейкозные инфильтраты в самых различных органах. Вследствие отбора уничтожаются клетки тех клонов, на которые действовали иммунная система и гормоны организма, цитостатические средства (химические, гормональные, лучевые). Доминируют клоны опухолевых клеток, наиболее устойчивых к этим воздействиям.
Какими клиническими синдромами могут проявляться лейкозы?
Все многообразие клинических признаков лейкозов можно подразделить на три группы.
I. Гематологические синдромы, связанные с замещением нормальной кроветворной ткани лейкозной и угнетением в связи с этим нормального кроветворения.
1. Панцитопения - уменьшение содержания всех форменных элементов крови. Особенно выражена при острых лейкозах.
2. Анемия. Основу ее патогенеза составляет нарушение эритропоэза. Однако при некоторых видах лейкозов определенное значение может иметь иммунный гемолиз эритроцитов (например, при хроническом лимфолейкозе) и кровотечения (геморрагический синдром).
3. Геморрагический синдром. Обусловлен в основном тромбоцитопенией и лейкозными инфильтратами в стенки кровеносных сосудов.
4. Нарушение неспецифической противомикробной защиты, в связи с чем уменьшается резистентность организма к инфекциям. Основной причиной этого является уменьшение содержания функционально полноценных гранулоцитов.
5. Иммунологическая недостаточность. Развивается как следствие лимфопении (при острых лейкозах и хроническом миелолейкозе) или неполноценности лейкозных лимфоцитов (хронический лимфолейкоз).
II. Синдромы, связанные с особенностями функционирования лейкозных клеток.
1. Лихорадка. Показано, что только у 7-8% больных лейкозами повышение температуры в начале заболевания связано с инфекцией. В большинстве же случаев лихорадка имеет неинфекционное происхождение.
2. Интоксикация. Большое количество лейкозных клеток погибает и освобождает в кровь свое содержимое. Многие компоненты погибших клеток обладают токсическим действием на центральную нервную систему. Отсюда утомляемость, общая слабость, тошнота и др.
3. Аутоиммунные процессы. Связаны с изменениями, затрагивающими лимфоцитарный росток крови, а именно с появлением так называемых "запретных" клонов лимфоцитов, с уменьшением количества и функциональной активности Т-супрессоров.
III. Синдромы, связанные с метастазированием лейкозных клетоки развитием лейкозных пролифератов в разных органах и тканях.
1. Увеличение лимфатических узлов, печени и селезенки.
2. Кожный синдром. Обусловлен появлением в коже пролифератов лейкозных клеток — лейкемидов.
3. Язвенно-некротические поражения слизистых оболочек (язвенно-некротические стоматит, ангина, энтеропатии).
4. Костно-суставной синдром, проявляющийся болями в костях и суставах.
5. Синдром нейролейкоза. Может проявляться менингиальным синдромом, синдромом повышения внутричерепного давления, разнообразными неврологическими нарушениями: парезами, параличами, парестезиями. В основе его развития — появление лейкозных пролифератов в оболочках головного и спинного мозга, веществе мозга, нервных стволах, вегетативных ганглиях.
6. Лейкозный пневмонит. Лейкозные пролифераты нарушают дыхательную функцию легких — развивается недостаточность внешнего дыхания.
7. Сердечная недостаточность. Может быть следствием размножения лейкозных клеток в мышце сердца.
Любая опухоль может развиваться только из тех клеток, которые обладают первоначальной способностью к делению. Не являются исключением и лейкозы.
Источником лейкозов могут быть клетки I-IV классов, т.е. клетки, способные к пролиферации. Клетки V и VI классов (созревающие и зрелые) трансформироваться в лейкозные не могут, поскольку потеряли структуры, необходимые для осуществления клеточного деления.
Под влиянием онкогенных вирусов, ионизирующей радиации, химических веществ происходит мутация генов или эпигеномное нарушение регуляции процесса размножения и созревания кроветворных клеток. При этом в костном мозге образуется клон опухолевых клеток, для которых характерны беспредельный рост и пониженная способность к дифференцировке. Быстрый рост лейкозных клеток приводит к распространению (метастазированию) их по всей системе крови, включая кроветворные органы и кровь. В образовавшихся клетках, циркулирующих в крови, обнаруживаются одинаковые хромосомные маркеры. Для хронического миелолейкоза таким маркером служит "филадельфийская" хромосома.
Нестабильность генотипа лейкозных клеток приводит к возникновению мутаций, как спонтанных, так и обусловленных продолжающимся воздействием канцерогенных факгоров, в результате чего образуются новые опухолевые клоны.
Таким образом, лейкоз проходит две стадии своего развития 1) моноклоновую (относительно более доброкачественную) и 2) поликлоновую (злокачественную, терминальную). Переход из одной стадии в другую является показателем опухолевой прогрессии — лейкозные клетки приобретают большую злокачественность. Они становятся морфологически и цитохимически недифференцируемыми, в кроветворных органах и крови увеличивается количество бластных клеток с дегенеративными изменениями ядра и цитоплазмы. Лейкозные клетки распространяются за пределы кроветворных органов, образуя лейкозные инфильтраты в самых различных органах. Вследствие отбора уничтожаются клетки тех клонов, на которые действовали иммунная система и гормоны организма, цитостатические средства (химические, гормональные, лучевые). Доминируют клоны опухолевых клеток, наиболее устойчивых к этим воздействиям.
Свойства лейкозных клеток
Гиперплазия. Использование современных радиоизотопных методов изучения кроветворения у больных лейкозами показало, что пролиферативная активность костномозговых клеток при хроническом лейкозе незначительно снижена (или не изменена), а при остром лейкозе снижена резко. Наряду со снижением митотической активности бластов, митотический цикл их значительно более продолжительный. Однако, несмотря на снижение митотической активности, благодаря наличию способных к постоянному делению клеток абсолютное количество пролиферирующих клеток значительно возрастает. Резкое увеличение количества лейкоцитов в организме больного обусловлено и удлинением сроков жизни лейкоцитов, поскольку в физиологических условиях нейтрофилы очень быстро покидают циркуляцию, а при лейкозе они находятся в периферической крови более длительное время. Однако, нельзя развитие лейкоцитоза при лейкозе свести только к этому механизму.
У здоровьк людей соотношение между депонированными в тканях лейкоцитами и лейкоцитами периферической крови составляет 60:1. У больных лейкозом резерв депонированных лейкоцитов уменьшен и при содержании клеток 6,2х10 9 /л, указанное соотношение уже 1:1.
Функциональный атипизм.
• снижена фагоцитарная активность лейкоцитов,
• снижена двигательная активность лейкоцитов
• снижена ферментативная активность лейкоцитов (пероксидазы, цитохромоксидазы, сукцинатдегидрогеназы и др.),
• снижена осмотическая стойкость лейкоцитов в случае лимфолейкоза и повышена — в случае миелолейкоза.
Анаплазия. Как опухолевые лейкозные клетки характеризуются анаплазией т.е. изменяют свою морфологию уподобляясь недифференцированным формам.
Лейкемическая метаплазия характеризуется появлением очагов кроветворения в негемопоэтических органах, при этом они первоначально обнаруживаются в органах, выполнявших кроветворную функцию в период эмбриогенеза (печени, селезенке), а затем и в других органах, что ведет к нарушению их функций.
Метастазирование — поскольку и нормальные гемопоэтические клетки способны покидать органы кроветворения и мигрировать в организме, то и лейкозные клетки, сохраняя эту способность, мигрируют и дают новые очаги измененного гемопоэза.
8. Классификация лейкозов
I. В зависимости от особенностей патогенеза и связанной с ними гематологической картинылейкозы подразделяют на острые и хронические.
II. В зависимости от того, какие кроветворные клетки вовлекаются в опухолевый процесс, лейкозы подразделяют на лимфолейкозы (поражается лимфоцитарный росток), миелолейкозы (поражается гранулоцитарный росток), эритпромиелозыи др.
III. В зависимости от содержания лейкоцитов в периферической кровилейкозы бывают лейкемическими (выраженный лейкоцитоз — от 50х10 9 / л ), сублейкемическими (умеренный лейкоцитоз от 20х10 9 /л до 50х10 9 / л), алейкемическими (содержание лейкоцитов не меняется), лейкопеническими (количество лейкоцитов уменьшается).
Основной чертой патогенеза острых лейкозов является то, что лейкозные клетки, приобретя способность к беспредельному неконтролируемому росту, полностью потеряли способность созревать, т.е. дифференцироваться в последующие формы.
В то же время при хронических лейкозах лейкозные клетки наряду со способностью к беспредельному росту сохраняют свойство созревать и давать последующие формы.
Таким образом при острых лейкозах опухолевые клетки только делятся и не созревают, при хронических — делятся и созревают. С учетом этого обстоятельства острые лейкозы следует считать более злокачественным видом заболевания
Источником острых лейкозов могут быть кроветворные клетки первых четырех классов.
Если лейкоз развивается из клеток I-III классов, не имеющих специфических морфологических и цитохимических признаков, то такой лейкоз называют недифференцированным.
Если лейкоз развивается из клеток IV класса, то с помощью морфологических и цитохимических методов можно установить клетку, от которой происходит опухоль Для этого используют семь цитохимических реакций- 1) реакцию на пероксидазу (при миелобластных-положительная, при лимфобластных- отрицательная), 2) реакцию с суданом черным на липиды (при миелобластных-положительная, при лимфобластных- отрицательная), ; 3) реакцию на кислую фосфатазу; 4) РАS-реакцию на гликоген (положительная при миелобластных и при лимфобластных – в виде глыбок); 5) реакцию на a-нафтилацетатэстеразу; 6) реакцию на хлорацетатэстеразу; 7) реакцию на сульфатированные гликозаминогликаны.
Если источником лейкозных клеток является лимфобласт, то такой лейкоз называется острым лимфобластным, если миелобласт — острым миелобластным, если монобласт — острым монобластным и т.д.
9. Виды острых лейкозов.
Характеристика картины крови при острых лейкозах.
В основу классификации острых лейкозов положены внешний вид и цитохимические особенности бластных клеток, их иммунофенотип и генетические особенности. Так, франко-американо-британская (FAB) классификация основана на оценке морфологии лейкозных клеток (строение ядра, соотношение размеров ядра и цитоплазмы). Кроме того. существуют варианты острых миелоидных лейкозов по классификации ВОЗ 1999г., а также цитогенетические и иммунофенотипические варианты острых лейкозов (см. метод. разработку).
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
Этиологиялейкозов многофакторна и до конца не выясне- на. Для объяснения возникновения данной патологии предложе-
ны радиационная, химическая, вирусная и генетическая теории. Каждая из них подтверждается отдельными фактами, но ни одна не может считаться универсальной в отношении всех известных видов лейкозов. В подтверждение радиационной теориисвиде- тельствуют факты повышения заболеваемости острым и хрони- ческим миелолейкозом у жителей Хиросимы и Нагасаки, у лиц принимавших участие в ликвидации последствий аварии на Чер- нобыльской атомной станции, у рентгенологов и радиологов, у детей, облученных in utero.
В эксперименте на животных показана возможность инду-
цировать лейкозы метилхлорантреном, диметилбензантраценом и др., что свидетельствует в пользу химической теориилейкогене- за. Повышена частота заболеваний острыми лейкозами у людей, имеющих длительный контакт с бензолом и летучими органиче- скими растворителями, полициклическими углеводородами, мышьяковистыми соединениями, азокрасками, алкилирующими цитостатическими препаратами (циклофосфан, миелосан, хлор- бутин). Среди химических веществ, способных вызывать разви- тие лейкоза, важная роль принадлежит бензолу, широко исполь- зуемому в промышленности. Хроническое действие бензола име-
ет место при длительном курении. Известно, что у мужчин, вы- куривающих 20 пачек сигарет в год, риск заболеть острым мие-
лоидным лейкозом в 3-4 раза выше, чем у некурящих. Кроме то- го, бензол может выступать в роли кокоанцерогена, провоцируя действие других канцерогенов, содержащихся в табачном дыме (уретан, нитрозамины и др.). Химиотерапевтические вещества, использующиеся для лечения злокачественных новообразований, также повышают риск развития лейкозов (хларамбуцил, нитро- зомочевина и др.). Эти же вещества способны вызывать хромо- сомные мутации. В развитии лейкозов человека возможно уча- стие эндогенных химических канцерогенов, в том числе произ- водных ароматических аминокислот, особенно тирозина и трип- тофана.
В основе вирусной теориилежат факты, свидетельствую-
щие о возможности вирусов вызывать лейкозы у животных –
птиц, мышей, крыс, хомячков, кошек, крупного рогатого скота. У
человека доказано вирусное происхождение лимфомы Беркитта
(вирус Эпштейна-Барр), Т-клеточного лимфолейкоза (ретровиру-
сы HTLV-I).У 25 % больных лимфогранулематозом (болезнь
Ходжкина) выделен вирус Эпштейна-Барр. Установлено, что в геноме этих вирусов существуют специфические гены, непосред- ственно отвечающие за транформацию нормальной гемопоэтиче- ской клетки в лейкозную. Эти гены получили название онкоге- нов. Гены клеток, гомологичные вирусным и активирующиеся при контакте с ним, получили название протоонкогенов. На дан- ный момент у человека установлена локализация более 60 прото- онкогенов, после взаимодействия с вирусом в них происходят то- чечные мутации и вызывают развитие лейкозов. В процессах пролиферации большую роль играет продукция онкобелков – факторов роста, кодируемых онкогенами.
Генетическая теорияимеет ряд убедительных аргументов.
Значительно увеличивают риск развития опухолей наличие гене-
тических дефектов. У больных с лейкозами часто выявляются
хромосомные и геномные мутации. Среди хромосомных мутаций
имеют наибольшее значение транслокации и делеции. У больных
хроническим миелолейкозом выявляется филадельфийская хро-
мосома, которая образуется в результате транслокации t (9;22)
части длинного плеча (q) хромосомы 22 в хромосому 9 и обрат-
ной транслокации части хромосомы 9 (онкогена abl) на хромосо-
му 22 с формированием химерного (гибридного) онкогена bcr/abl
(химерные гены – это гены, образующиеся на границе хромосом-
ных транслокаций). Продукт этого гена (тирозинкиназа) ведет к
фосфорилированию огромного количества протеинов, участвую-
щих в передаче сигнала с рецепторов клеточной мембраны к ге-
нетическому материалу ядра. Активация большого количества
различных сигнальных путей ведет к независимой от ростовых
факторов пролиферации, уменьшению адгезии клеток к стро-
мальному окружению и недостаточности апоптоза.
Известны случаи семейных лейкозов. При развитии лейкоза
у одного из близнецов у второго близнеца отмечается высокая
вероятность развития лейкозов (25%). К возникновению лейкозов
предрасполагают болезни, связанные с геномными мутациями
(болезнь Дауна, синдром Клайнфельтера, Тернера и др.). При бо-
лезни Дауна (трисомия 21) острый миелоидный лейкоз наблюда-
ется в 20 раз чаще, чем у здоровых лиц.
По-видимому, все перечисленные факторы действуют ком-
плексно, приводя к злокачественному перерождению гемопоэти-
Патогенез.В настоящее время общепризнанной является клональная теорияпатогенеза гемобластозов, согласно которой лейкозные клетки являются потомством одной мутировавшей ге- мопоэтической клетки-предшественницы. Ее доказательством яв- ляется обнаружение в кариотипе подавляющего большинства опухолевых клеток одних и тех же хромосомных аберраций.
Все теории развития лейкоза основаны на представлении о
ведущей роли онкогена, или гена, кодирующего фактор роста в
канцерогенезе. Согласно первой концепции вирусы вносят в
ции. Согласно другим представлениям все клетки содержат онко-
ген в заторможенном состоянии (протоонкоген), который активи-
руется вследствие мутаций либо эпигеномных нарушений регу-
ляции активности гена-репрессора под воздействием канцерогена
и коканцерогена, что приводит к безудержной клеточной проли-
Изменения генетической регуляции клетки лежат в основе
биохимических особенностей опухолевой ткани. В результате
репрессии одних генов прекращается синтез сопряженных с ними
ферментов, структурных белков и др., дерепрессия других ведет к
тому, что в клетке появляются новые типы белков, изоферментов.
Как правило, репрессируется выработка ферментов и белков, по-
зволяющих клетке выполнять специализированную функцию, и
активируются ферменты, которые обеспечивают клеточное деле-
Согласно современным представлениям лейкозы в развитии проходят два этапа: первый – образование доброкачественной моноклоновой опухоли и второй – формирование злокачествен- ной опухоли с признаками поликлоновой трансформации.
На первом этапе развития лейкозов появляется мутировав- шая клетка, обладающая способностью интенсивно пролифери-
ровать и давать потомство – клон. На этом этапе отсутствуют признаки полиморфизма, частично сохранена способность к дифференцировке, метастазирование в органы и ткани отсутству- ет.
На втором этапе опухоль становится поликлоновой, приоб- ретает черты злокачественной, утрачивая способность к диффе-
В формировании опухолевого клона и метастазировании опухоли большую роль играет подавление апоптоза, что обуслов- лено мутацией гена p53, контролирующего его активность. Клет- ки опухолевого клона созревают медленно, лишены способности к программированной гибели, дольше находятся в стадии проли- ферации и имеют преимущества в росте перед нормальными стволовыми элементами.
В патогенезе опухолевого роста различают 3 этапа:
§трансформация здоровой клетки в опухолевую (инициа-
Трансформация, или инициация, представляет образование клона мутировавших клеток под действием канцерогенов. Трансформация заключается в приобретении здоровой исходной клеткой способности беспредельно размножаться и ее передаче дочерним клеткам по наследству. Инициация – процесс много- стадийный. Трансформированные клетки могут оставаться в тка- ни длительное время в неактивной форме.
Вторым этапом в механизме канцерогенеза является промо-
ция (активизация). Она происходит под влиянием веществ-
промоторов или коканцерогенов (кротоновое масло и др.). До-
полнительное воздействие коканцерогенами (промоторами) при-
водит к размножению находящихся в латентном состоянии опу-
холевых клеток (моноклоновая стадия). Далее происходит рассе-
ление лейкозных клеток в костном мозге с угнетением нормаль-
ного гемопоэза. Большинство канцерогенов являются полными,
т.е. вызывают трансформации и промоцию.
Прогрессия – третий этап механизма канцерогенеза. Вслед-
ствие возникновения новых мутаций в лейкозных клетках, в том
числе после проведенного лечения (химиотерапия), происходит
формирование множества клонов лейкозных клеток (поликлоно-
вая стадия) и отбор наиболее автономных из них, что ведет к ма-
лигнизации заболевания. На этой стадии опухоли лейкозные
клетки становятся устойчивыми к терапии и метастазируют в
другие органы и ткани.
Лейкозы характеризуются анаплазией, гиперплазией, дис- плазией и метаплазиейкроветворной ткани.
Анаплазия – неспособность к дифференцировке (дедиффе- ренцировка), созреванию форменных элементов крови с наруше- нием их функций.
Гиперплазия– избыточная продукция клеток, находящихся
на различных стадиях созревания.
Метаплазия– перерождение нормальных очагов кроветво-
рения в костном мозге.
Дисплазия– вытеснение из красного костного мозга здоро-
вых ростков гемопоэза: эритроцитарного, лейкоцитарного и ме-
гакароцитарного, что приводит к развитию клинических синдро-
Лейкозная клетка является потомком мутированной клетки II-IV класса развития, которая способна к размножению, но не способна к дифференцировке и выполнению специфических функций. Клетка увеличена в размере (в 2-3 раза больше нормы) либо уменьшена до размера лимфоцита с увеличением ядерно- цитоплазматического соотношения, характерна деформация ядерных контуров, вакуолизация ядра, увеличение количества нуклеол до 8 и более, базофилия цитоплазмы, ее вакуолизация.
Классификация лейкозов
По патогенетическому принципу (степени нарушения дифференцировки лейкозных (опухолевых) клеток)лейкозы разделяют на острые и хронические.
К острым лейкозам относят лейкозы с полной остановкой дифференцировки и созревания гемопоэтических клеток на уров- не II-IV классов. Морфологическим субстратом опухоли и клет- ками, циркулирующими в крови, при острых лейкозах являются бластные клетки соответствующего ряда гемопоэза (миелобла- сты, лимфобласты, монобласты и др.).
Гематологическая картина острого лейкоза характеризуется
наличием в крови большого количества бластов и лейкемическим
небольшом количестве зрелых клеток и отсутствии созревающих
Иногда субстратом опухоли могут быть промиелоциты и промоноциты. При остром недифференцированном лейкозе суб- стратом опухоли являются клетки II и III классов, которые мор- фологическими методами не дифференцируются. При превыше- нии количества клеток лейкозного клона более 30% состава кост- ного мозга, как правило, они появляются в периферической кро- ви.
При хронических лейкозах отмечается частичная задержка способности к дифференцировке и созреванию кроветворных клеток. При хронических лейкозах патоморфологическим суб- стратом опухоли являются бластные клетки (IV класс), созре- вающие клетки (V класс), достигшие определенного уровня диф- ференцировки, и зрелые клетки (VI класс).
Острые и хронические лейкозы развиваются на разной кло- нальной основе. Острые лейкозы не переходят в хронические. При хроническом лейкозе возможна утрата способности диффе- ренцироваться некоторыми клонами.
Острые лейкозы
Вариантами острого лейкоза являются миелобластный, лимфобластный, монобластный, промиелоцитарный, плазмобла- стный,мегакариобластный, эритромиелоз, недифференцирован- ный и др.
При острых миелобластных лейкозах число лейкоцитов крови может достигать (100-150) х 109 /л и выше; часто оно держится на уровне (20-30) х 109/л и ниже. В мазке крови наряду с незначительным количеством зрелых сегментированных нейтрофилов нередко все поле зрения усеяно миелобластами (рис. 49).

Рис. 49. Большое содержание бластных клеток в периферической крови
У детей чаще всего (80 % случаев) встречается острый лим- фобластный лейкоз. Другие формы острых лейкозов наблюдают- ся значительно реже. Хроническим миелолейкозом дети болеют редко (5% лейкозов).
При остром лимфобластном лейкозе в крови преобладают лимфобласты (рис.50).
В 1975 г. гематологами Франции, США и Великобритании была предложена классификация (FAB-классификация) острых лейкозов на миелобластные и лимфобластные.
Морфологическая FAB-классификация острых миелобласт-
ных и лимфобластных лейкозов представлена в таблицах 13 и 14.

Рис. 50. Картина крови при остром лимфобластном лейкозе. В периферической крови присутствует большое количество бластных клеток
Таблица 13. Морфологическая FAB-классификация острых миелобластных лейкозов
| Обозначение | Морфологический подтип острого миелобластного лейкоза | Распространенность, % |
| М0 | острый малодифференцированный лейкоз | |
| М1 | острый миелобластный лейкоз без со- зревания | |
| М2 | острый миелобластный лейкоз с со- зреванием | |
| М3 | острый промиелоцитарный лейкоз | |
| М4 | острый миеломонобластный лейкоз | |
| М5а | острый монобластный лейкоз | 10-15 |
| М5в | острый монобластный лейкоз с диф- ференцировкой | |
| М6 | острый эритромиелоз | 3-5 |
| М7 | острый мегакариобластный лейкоз | редкий вариант |
Таблица 14. Морфологическая FAB-классификация острых лимфобластных лейкозов
| Обозначение | Морфологический подтип острого лимфобластного лейкоза |
| L1 | микролимфобластный острый лимфобластный лейкоз |
| L2 | острый лимфобластный лейкоз с типичными бластами |
| L3 | макролимфобластный острый лимфобластный лейкоз |
В настоящее время требованиям клиницистов больше удов- летворяет иммунологическая классификация острых лимфобла- стных лейкозов (EGIL, 1995), согласно которой выделяют острый лимфобластный лейкоз В-клеточной линии и Т-клеточной линии.
Хронические лейкозы
Среди хронических лейкозов выделяют миелолейкоз, лим- фолейкоз, моноцитарный и миеломную болезнь (плазмоцитома) и др.
При хроническом миелолейкозе наряду с резким повышени- ем общего количества лейкоцитов (до 600х109/л крови) наблюда- ется появление в периферической крови огромного количества гранулоцитов на ранних стадиях развития: миелобластов, про- миелоцитов, миелоцитов, метамиелоцитов (рис.51).

Рис. 51. Картина крови при хроническом миелолейкозе
1 – нейтрофильный промиелоцит; 2 – миелоциты; 3 – метамиелоцит;
4 – палочкоядерный лейкоцит; 5 – сегментоядерный лейкоцит
Процентное содержание зрелых и созревающих нейтрофи- лов в лейкоцитарной формуле становится преобладающим. При хронических миелолейкозах в крови имеет место также повы- шенное количество эозинофильных и базофильных миелоцитов (эозинофильно-базофильная ассоциация).
В редких случаях миелолейкоза лейкемическая картина кро-
ви может наблюдаться при нормальном и даже пониженном об-
щем количестве лейкоцитов в крови. В других случаях картина
крови может быть нормальной, а диагноз лейкоза ставится лишь
при исследовании пунктата костного мозга (алейкемический
тельным увеличением в периферической крови большого количе-
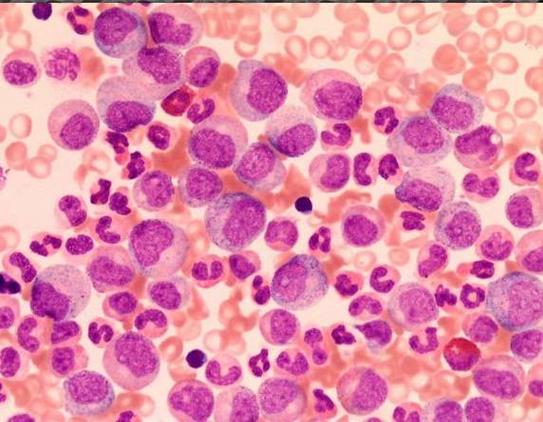
Рис. 52. Бластный криз при хроническом миелолейкозе
При хроническом лимфолейкозе преобладают зрелые лим- фоциты, присутствуют единичные лимфобласты, тени Боткина- Гумпрехта, представляющие собой разрушенные при приготов- лении мазка лимфоциты (рис. 53).
Рис. 53. Картина крови при хроническом лимфолейкозе
Классификация хронических лейкозов (Новицкий В.В., Гольдберг Е.Д., Уразова О.И., 2009):
1. Хронические миелопролиферативные лейкозы:
хронический моноцитарный (миеломоноцитарный)
хронический нейтрофильный лейкоз
хронический эозинофильный лейкоз / гиперэозино-
эритремия (истинная полицитемия)
идиопатический миелофиброз (сублейкемический мие-
2. Хронические лимфопролиферативные лейкозы:
хронические В-клеточные лейкозы:
- В-клеточный пролимфоцитарный лейкоз
множественная миелома (миеломная болезнь)
макроглобулинемия Вальденстрема болезнь тяжелых цепей
хронические Т/NK-клеточные лейкозы:
- Т-клеточный пролимфоцитарный лейкоз
- Т-клеточный лейкоз из больших гранулярных лим-
- агрессивный NK-клеточный лейкоз
Рис. 54. Частота встречаемости различных видов лейкозов в зависимости от возраста
Последнее изменение этой страницы: 2016-08-15; Нарушение авторского права страницы
Читайте также:

