Укажите физико химические особенности опухолей ткани
Исходным местом развития опухоли может быть любая ткань организма. Однако чаще опухоль развивается там, где при нормальных условиях наиболее интенсивно идет процесс размножения клеток. К таким участкам относятся зародышевый слой эпидермиса, крипты слизистых оболочек, эпителий выводных протоков желез, периваскулярная ткань и др.
Нередко опухоль начинает развиваться в тканях, измененных вследствие других патологических процессов (например, хронического воспаления), или в участках с неправильным эмбриональным развитием (например, родимые пятна). Такие участки, в которых часто начинается опухолевый процесс, принято называть предопухолевыми, или предраковыми. Рост опухоли происходит путем кариокинетического и прямого (амитотического) деления клеток. При этом наряду с нормальной картиной деления клеток часто наблюдаются патологические фигуры кариокинеза. Во многих опухолях возникают клетки с уродливыми, часто огромными ядрами и многоядерные клетки.
Строение опухолей очень разнообразное, но в общем опухоль в той или иной степени напоминает ту исходную ткань, из которой она развилась. В каждой опухоли можно различить паренхиму, т. е. специфическую кань опухоли, и соединительнотканную строму, содержащую сосуды и нервы. В одних опухолях стромы очень мало, в других, наоборот, она развита хорошо, и тогда ткань опухоли по структуре напоминает паренхиматозный орган.
Отличие опухоли от нормальной ткани состоит в атипизме строения опухоли. Различают тканевый и клеточный атипизм. Тканевый атипизм проявляется в неправильном соотношении структурных элементов опухоли. Любая ткань каждого нормального органа имеет определенную структуру: железы построены из долек, от каждой дольки отходят железистые протоки, соединяющиеся друг с другом и образующие общий выводной проток; мышцы состоят из групп волокон, идущих в определенном направлении.
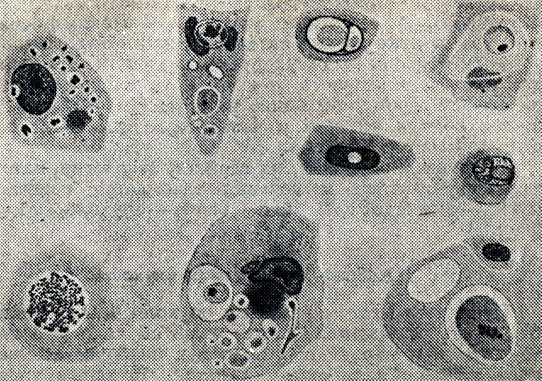
Рис. 54. Атипичные клетки рака. Видны различные патологические включения в цитоплазме
В опухолях такой четкой структуры нет. Опухоль может быть построена из железистых долек разнообразной величине и формы, протоки иногда не соединены друг с другом и ткань не образует железистого комплекса. Опухоли из мышечной ткани построены из мышечных волокон, но волокна эти идут в различных направлениях, имеют разный размер и толщину, образуют узлы, а комплексы мышц отсутствуют. Такие нарушения комплексного строения тканей называют дискомплексацией * . Иногда ткань опухоли по структуре напоминает орган, например, если опухоль построена из железистой ткани, хотя и с четкой дискомплексацией.
* ( Приставка "дис" означает расстройство. )
Клеточный атипизм характерен для клеток паренхимы опухоли и проявляется изменением размера и формы клеток, особенно их ядер. Клетки опухоли и их ядра крайне разнообразны по форме и размеру- полиморфны. Часто в клетках опухоли обнаруживают разнообразные включения (рис. 54) в виде белковых зерен, капель жира, гликогена и др.

Рис. 55. Различные варианты расположения полового хроматина в ядрах клеток кролика
Нередко в клетках опухоли видны фагоцитированные соседние опухолевые (аутофагия) клетки, эритроциты, лейкоциты. Иногда клетки опухоли настолько изменены, что трудно определить, из какой ткани они произошли. Опухолевые клетки теряют дифференцировку, свойственную зрелым тканям, они как бы возвращаются к более ранним ступеням развития. Эти свойства клеток опухоли называются анаплазией (от ana - обратно, plasis - образование). Чем меньше выражена дифференцировка опухолевых клеток, тем быстрее их рост.
Значительные отклонения в структуре клеток обнаруживаются при их делении. При этом встречаются различные нарушения числа хромосом, неправильные патологические фигуры митоза. Получены интересные данные в отношении хроматина в опухолевых тканях. В 1944 г. канадский ученый Бар обнаружил своеобразные глыбки хроматина в ядрах нервных клеток кошек. Оказалось, что у кошек они встречаются в 56 - 87%, а у котов - в 2,1 - 5,3% всех клеток. Дальнейшие исследования показали, что подобные глыбки хроматина (рис. 55) обнаруживаются у всех животных и у человека и представляют собой часть женской хромосомы X. В настоящее время установлено, что обычно "пол опухоли" по половому хроматину соответствует полу носителя опухоли. Однако в злокачественных опухолях процент клеток с половым хроматином резко меняется: чем менее зрелая опухоль, тем больше это отклонение. Определение содержания полового хроматина имеет большое значение для выяснения степени зрелости опухоли, т. е. ее злокачественности. Так, например, при саркомах костной ткани у мужчин резкое повышение количества полового хроматина свидетельствует о высокой ее злокачественности. Эти исследования необходимы и для назначения гормональной терапии. Так, если у женщин, например, в опухоли молочной железы имеется "мужской пол", то следует назначать женский половой гормон, и, наоборот, больным с опухолями "женского пола" - мужской.
В опухоли изменяются не только морфологические свойства клеток, но и их химические, физико-химические и биохимические. Для ткани опухоли по сравнению с нормальной тканью характерны некоторые особенности обмена веществ. Состав белков в ткани опухоли отличается от состава белков других тканей организма.
Опухолевым клеткам, преимущественно незрелым, свойственно расщепление углеводов без участия кислорода (анаэробно) до молочной кислоты. Анаэробное расщепление очень неэкономично-расход углеводов большой, а энергии вырабатывается мало. Кроме того, при этом образуется много недоокисленных продуктов обмена, которые поступают в кровь и могут оказывать токсическое действие. Эти вещества играют определенную роль в развитии кахексии, которая возникает при злокачественных опухолях.
Физико-химические особенности опухолевых клеток объясняются увеличением содержания в них воды до 85 - 90% массы, изменением коллоидных свойств цитоплазмы. Клетки опухоли вследствие указанных изменений по своим физико-химическим свойствам становятся близкими к молодым. Все это дает право говорить о физико-химической анаплазии. В последние годы при помощи люминесцентной микроскопии выяснено, что раковая клетка отличается от нормальной богатым содержанием нуклеопротеидов, поэтому при окраске акридиновым оранжевым раковые клетки светятся красным светом, а нормальные клетки при той же окраске-зелено-желтым. Эти особенности раковой клетки теперь используют для цитологической диагностики рака при исследовании мокроты в случае подозрения на рак легкого, мазков-отпечатков со слизистой оболочки шейки матки - при подозрении на рак и др.
В процессе онкогенеза и прогрессии клетки теряют способность к дифференцировке, как бы возвращаясь в эмбриональное состояние. Это явление получило название анаплазии. Признаки анаплазии имеются в биохимических процессах опухолевых клеток (биохимическая анаплазия), в их физико-химическом состоянии (физико-химическая анаплазия), строении и функции (морфологическая и функциональная анаплазия). Происходит также метаплазия — преобразование в новые клеточные формы.
Биохимические особенности опухолевой ткани. В основе биохимических особенностей опухолевой ткани лежат изменения генетической регуляции клетки. В результате репрессии одних генов прекращается синтез связанных с ними ферментов, структурных белков и т. п.; дерепрессия других генов приводит к тому, что в клетке появляются новые типы белков, изоферментов. Как правило, репрессируется выработка ферментов и белков, позволяющих клетке выполнять специализированную функцию, и активируются посредством дерепрессии те ферменты, которые обеспечивают клеточное деление.
Онкогенные факторы потенциально способны обусловливать не только нарушение регуляции клеточного деления, но и функций других структурных и регуляторных генов. Поэтому в опухолевой клетке наблюдается внезапная дерепрессия синтеза веществ, например гормонов, которые в норме не образуются в этой ткани. Так, в первичной карциноме легких может быть выявлен синтез кортикотропина или гонадотропина, в опухолях почек — тироксина. По той же причине в опухолях может исчезать выработка какого-либо фермента или осуществляться образование нового. Однако характерно и сходство разных опухолей по комплексу ферментов, входящих в их состав, причем этот комплекс тем меньше, чем больше дедифференциация клеток.
Важнейшей биохимической особенностью опухолевой клетки является активация синтеза нуклеиновых кислот. В опухолевых клетках по сравнению с нормальными изменяется набор ДНК-полимераз. Среди трех видов ДНК-полимераз в опухолях уменьшается количество ДНК-полимеразы 3, использующей в качестве матрицы нативную ДНК, и увеличивается количество ДНК-полимеразы 2, способной строить ДНК не только по нативной, но и по денатурированной матрице.
В опухолевых клетках качественно и количественно изменяется синтез белков. К белкам, синтез которых в опухолевых клетках резко активируется, относятся протеины митотического аппарата, в том числе крупномолекулярный белок веретена. В норме содержание белков митотического аппарата составляет около 11 % их количества в клетке, а в опухоли их количество увеличивается до 30 %.
Изменяется и обмен белков — снижается способность опухолевых клеток к переаминированию и дезаминированию аминокислот, иногда не образуются некоторые ферменты, принимающие участие в обмене аминокислот. В большинстве опухолей активируются захват аминокислот из крови и синтез белков. Катаболизм белка снижается настолько, что даже в голодающем организме белок опухоли не принимает участия в общем обмене. Кроме того, с помощью радиологического метода было доказано: если ткани голодающего организма теряют аминокислоты, опухоль “присваивает” их себе. Все это позволило охарактеризовать опухоль как “ловушку для азота”. Таким же образом опухоли захватывают и “присваивают” витамины и микроэлементы.
Особое место в биохимии опухолей занимают обмен углеводов и выработка энергии. В опухолях нередко значительно увеличивается скорость гликолиза. Интенсивный гликолиз не является специфической особенностью опухолей. Однако при сравнении активности ферментов гликолиза в опухоли и первичной ткани обнаруживается повышение активности основных ферментов гликолиза: гексокиназы, фосфофруктокиназы и пируваткиназы. В большинстве нормальных тканей наблюдается торможение преобразования пирувата в молочную кислоту при наличии кислорода и снижении интенсивности гликолиза, что называется эффектом Пастера. В опухолях же происходит аэробный гликолиз, т. е. распад углеводов до пирувата и преобразование его в молочную кислоту при наличии кислорода — отрицательный эффект Пастера.
Опухоль интенсивно захватывает глюкозу из крови. Даже при повышении концентрации глюкозы в крови до 16,7 ммоль/л (300 мг%) кровь, оттекающая от опухоли, не содержит глюкозу. Эту способность опухоли связывают со снижением активности регулированной глюкокиназы и резкой активацией гексокиназы, которая менее чувствительна к гормональной регуляции.
Энергии, получаемой опухолевыми клетками в процессе гликолиза, достаточно для обеспечения синтеза нуклеиновых кислот и клеточного деления.
В опухолях также изменяется окисление (тканевое дыхание). В целом характерна тенденция к замедлению дыхания пропорционально степени дедифференцировки клеток. При этом наблюдается эффект Кребтри: угнетение окисления при нагрузке глюкозой, что может быть результатом “борьбы” гликолитической системы ферментов опухоли с ее окислительными ферментами за неорганический фосфат, другие субстраты и коферменты.
Физико-химические особенности опухолевой ткани. Изменение физико-химических свойств опухолевых клеток является преимущественно результатом биохимической перестройки опухолевой ткани. Интенсивный гликолиз приводит к накоплению молочной кислоты. При нагрузке углеводами pH опухолевой ткани может снизиться до 6,4. В опухоли повышено содержание воды, а иногда — и некоторых электролитов, в частности солей калия. Уровень кальция и магния снижен, соотношение К+/Са2+ повышено. За счет гидратации и увеличения содержания ионов водорода, а также некоторых электролитов электропроводность опухолевой ткани повышена. При этом снижена вязкость коллоидов. Наблюдается увеличение отрицательного заряда опухолевых клеток, величина которого приближается к величине заряда лимфоцитов. Было высказано предположение, что из-за сходства зарядов лимфоциты в меньшей степени способны контролировать опухолевую ткань, чем нормальную, поэтому не атакуют опухолевые мутанты. Повышение отрицательного заряда опухолевых клеток происходит за счет увеличения количества электроотрицательных радикалов нейраминовой кислоты в наружной мембране клеток.
Степень физико-химической анаплазии соответствует степени дедифференциации и скорости роста.
Антигенные особенности опухоли. По своему антигенному составу опухолевая ткань отличается от нормальной ткани, из которой она происходит. Так, в опухолях могут быть выявлены антигены, свойственные эмбриональным тканям (опухолево-эмбриональные антигены). Г.И. Абелев показал это на примере гепатомы, в которой он обнаружил белок α-фетопротеин. При наличии этого белка в крови можно диагностировать опухоль печени до развития клинических ее признаков. В опухолях вирусного происхождения появляются индуцированные вирусами антигены, специфические для этого вируса и одинаковые в различных опухолях и у разных индивидов.
Случайные антигены возникают в индуцированных опухолях в результате мутаций. Если под влиянием одного канцерогена в организме образуется несколько первичных опухолей, то они могут вырабатывать различные случайные антигены так же, как и различные комплексы ферментов.
Появление в организме опухолевых клеток не обязательно вызывает развитие опухолевого процесса. Клоны опухолевых клеток попадают под контроль иммунокомпетентной ткани, и вследствие иммунных реакций клон с какими-либо антигенными отличиями устраняется.
Рост опухолевой ткани наблюдается в том случае, если опухолевые клетки способны избегать иммунологического контроля.
Механизмы, позволяющие избегать иммунологического контроля:
• прогрессия опухоли сопровождается потерей части антигенов, присущих нормальной клетке, — так называемым антигенным упрощением, что может способствовать выживанию опухолевых клеток и достигать такой степени, когда полностью теряются тканеспецифические и индивидуальные антигены. Остаются лишь видоспецифические антигены, к которым у каждого организма определенного вида существует толерантность;
• появление в опухолевой ткани фетальных антигенов не обусловливает иммунную реакцию вследствие того, что к этим антигенам существует иммунологическая толерантность;
• маскировка антигенов опухолей. Так, клетки хорионэпителиомы имеют нейтральную полисахаридную капсулу;
• в некоторых опухолях выявляются антигенные детерминанты, которые предупредительно стимулируют Т-супрессорную функцию, что приводит к торможению иммунной реакции против опухоли;
• канцерогенные факторы могут вызывать иммунодепрессию;
• создание перегрузки иммунной системы и угнетение иммунного ответа опухолевой тканью после достижения определенной массы.
Однако, несмотря на все механизмы избегания опухолью иммунологического контроля, трансформированные клетки разрушаются в организме и клиническое проявление опухоли отмечается значительно реже, чем трансформация клеток.
Механизмы иммунной защиты организма от опухоли. Для борьбы с опухолью в организме есть механизмы, которые подразделяются на адаптивные и неадаптивные.
Адаптивные механизмы — классические иммунные реакции, осуществляемые T- и В-лимфоцитами против опухолевых клеток, если на этих клетках есть опухолевые антигены.
Появление новых антигенов опухоли может быть обусловлено несколькими факторами:
• мутацией под влиянием мутагенов;
• индукцией опухоли вирусами (вирусные антигены);
• дерепрессией генов, что приводит к появлению в опухолевых клетках необычного для исходной ткани фермента, гормона или зачаточного антигена;
• изменением антигенов ГКГС в результате мутации или нарушения регуляции генов.
В иммунном ответе могут принимать участие лимфоциты, как ограниченные антигенами ГКГС, так и не ограниченные, причем результаты зависят от количества и качества экспрессированных антигенов ГКГС. Если в процессе онкогенеза в опухолевых клетках изменяются антигены гистосовместимости ГКГС I класса (HLA-A, HLA-B, HLA-C), такие клетки будут распознаны и уничтожены Т-киллерами без предварительной иммунной реакции. То же будет происходить при изменении антигенов гистосовместимости ГКГС II класса. Однако в этом случае антигены, не относящиеся к ГКГС, не будут распознаны на опухолевых клетках, поскольку Т-хелперы имеют антигенное ограничение и распознают антигены только на клетках, содержащих одинаковые с Т-хелперами антигены гистосовместимости ГКГС II класса. Если антигены II класса на опухолевых клетках и иммуноцитах одинаковы и отсутствуют дополнительные антигенные признаки, блокируется возможность иммунной атаки и включение механизмов адаптивного иммунитета. Антигены гистосовместимости ГКГС III класса (компоненты комплемента) необходимы для активации цитолиза клеток.
К неадаптивным механизмам (осуществляемым без участия Т-лимфоцитов и антител) защиты против опухолей относятся:
• ФНО лимфоцитов, который разрушает клетки и сосуды опухолей и действие которого усиливается γ-ИФ;
• лимфоидный токсин (ЛT) лимфоцитов;
• цитотоксический фактор натуральных киллеров (ЦФНК);
• лизосомальные ферменты лейкоцитов.
Кроме того, неадаптивные механизмы вовлекаются в адаптивные посредством Fc-фрагментов иммуноглобулинов и активации комплемента.
Функциональные особенности опухолевой ткани. Функциональная анаплазия проявляется потерей функций, выполняемых клетками до трансформации. Например, в гепатоме прекращается синтез желчных пигментов; значительно дедифференцированные быстрорастущие опухоли теряют первичные специфические функции. Частично дифференцированные опухоли, которые сохранили способность осуществлять некоторые специфические для первичной ткани процессы, теряют контроль над ними. Так, в опухоли мозгового вещества надпочечников (феохромоцитома) наблюдается неконтролируемый синтез адреналина, в опухолях половых органов может частично сохраниться чувствительность к гормональной регуляции. Наряду с дедифференцировкой и снижением эффективности контроля в опухолевых клетках может происходить необычный для первичной ткани процесс — например, синтез гликозаминогликанов или гормонов, в частности глюкокортикоидов, опухолью легких.
Злокачественность опухоли. Способность опухолевых клеток к безграничному неконтролируемому размножению еще не означает неизбежность гибели организма в случае роста опухоли, поскольку хирургическое удаление опухолевого узла обеспечивает полное излечение. Однако этому может препятствовать злокачественность опухоли, для которой характерны инфильтративный (инвазивный) рост и способность метастазировать; они обусловлены нарушением межклеточных взаимосвязей в опухолевой ткани.
Злокачественным опухолям также присущи более выраженный, чем в доброкачественных, тканевой атипизм, который проявляется нарушением нормального соотношения тканевых структур. Только у злокачественных опухолей наблюдается клеточный атипизм, характеризующийся клеточным и ядерным полиморфизмом с увеличением ядерно-цитоплазматического соотношения и усиленной базофилией ядра и цитоплазмы, которые возникают в результате значительного увеличения количества ДНК и РНК. Кроме того, злокачественные опухоли способны вызывать общее глубокое истощение организма — кахексию.
Метастазирование состоит из следующих этапов: отрыв опухолевой клетки от соседних клеток; движение в ткани, расплавление при этом компонентов соединительной ткани и сосудистой стенки; перенос с кровью или лимфой скоплений опухолевых клеток; прикрепление к сосудистой стенке в новом месте; индукция роста соединительной ткани и сосудов в новообразованную опухолевую ткань. Среди механизмов и факторов, обусловливающих метастазирование на различных его этапах, можно выделить основные:
• прекращение межклеточных контактов, изменение рецепторов мембраны и обретение подвижности, что в значительной мере связано с изменениями белков цитоскелета, в частности с их фосфорилированием протеинкиназами, к которым относится большинство продуктов жизнедеятельности онкогенов и факторов роста. Также измененяется регуляция генов, кодирующих белки цитоскелета и рецепторы мембран;
• синтез в трансформируемых клетках активатора профибринолизина — фермента, который интенсивно разрушает компоненты основного вещества соединительной ткани и сосудистой стенки, а также активирует ферменты других биологически активных систем, в частности профибринолизин. В опухолевых клетках продуцируются коллагеназы, разрушающие коллаген различных типов, в том числе IV типа, из которого состоит базальная мембрана сосудов. Опухолевые клетки, не имеющие профибринолизина, вырабатывают фактор, привлекающий моноциты, ферменты которых разрежают матрикс и способствуют метастазированию опухолевых клеток. Аналогичным образом опухолевые клетки привлекают тучные клетки, ферменты которых, в частности сериновая протеиназа и металл-протеиназа, также способствуют расщеплению матрикса, а гепарин усиливает действие ангиогенина и врастание сосудов в опухолевую ткань;
• наличие катепсинов — как встроенных в мембрану опухолевых клеток, так и в свободном состоянии расположенных в межклеточной жидкости опухолевой ткани;
• наличие в опухолевых клетках факторов, активирующих в соединительнотканных клетках синтез коллагена, гликопротеидов и других компонентов основного вещества и размножение этих клеток, врастание в опухолевый узел;
• выделение опухолевыми клетками ангиогенина и других факторов роста сосудов, что обеспечивает кровоснабжение опухолевой ткани;
• наличие в мембранах опухолевых клеток, в отличие от нормальных, открытых радикалов нейраминовой кислоты, гликопротеидов, α-D-глюкопиранозида и N-ацетил-D-галактозамина. Белок конканавалин А, а также лектины благодаря наличию открытых радикалов агглютинируют опухолевые клетки.
Опухоль — это типический патологический процесс, представляющий собой нерегулируемое беспредельное разрастание ткани, не связанное с общей структурой пораженного органа и его функциями.
Опухоль образуется в организме в результате превращения нормальных клеток в опухолевые, в которых нарушается регуляция деления. В таких клетках отсутствует или недостаточно эффективно подавляется клеточное деление, что обусловливает неудержимое размножение опухолевых клеток, или в них начинается самоподдерживающаяся стимуляция деления (аутокринный механизм -деление клетки стимулирует фактор, производимый ею самой).
Опухолевая ткань отличается беспредельным ростом. Этот процесс заканчивается только со смертью организма. Способность опухолевых клеток беспредельно размножаться передается по наследству как доминантный признак соматической наследственности и проявляется не только в организме, но и в культуре опухолевой ткани, а также при трансплантации опухоли.
Опухолевая ткань отличается от исходной ткани, из которой она произошла, по структуре, биохимическим, физико-химическим и другим признакам. Эти изменения выражают анаплазию - возврат к эмбриональному состоянию, а также метаплазию — приобретение свойств другой ткани.
Рост опухоли может быть экспансивным и инфильтративным. При экспансивном росте окружающая здоровая ткань по мере роста опухоли раздвигается, при инфильтративном — опухолевые клетки прорастают между нормальными клетками и через сосудистую стенку. Попадая в лимфу или кровь, они переносятся в другие органы и могут образовывать новые очаги опухолевого роста (метастазы). Экспансивный рост характерен для доброкачественных опухолей, а инфильтрирующий с образованием метастазов — для злокачественных опухолей.
Биохимические особенности опухолевой ткани. В основе биохимических особенностей опухолевой ткани лежат изменения генетической регуляции клетки. В результате репрессии одних генов прекращается синтез сопряженных с ними ферментов, структурных белков и др., дерепрессия других ведет к тому, что в клетке появляются новые типы белков, изоферментов. В опухолевой клетке может наблюдаться неожиданная дерепрессия синтеза веществ, которые в норме не образуются в данной ткани.
В опухолевых клетках качественно и количественно меняется синтез белков.
Меняется метаболизм белков. Снижается способность опухоле вых клеток к переаминированию и дезаминированию аминокислот иногда не образуются некоторые ферменты, участвующие в обмене аминокислот. Катаболизм белка снижается настолько, что даже в голодающем организме белок опухоли не участвует в общем межуточном обмене.
. В опухолях нередко значительно увеличена скорость гликолиза. В опухолях происходит аэробный гликолиз, т.е. распад углеводов до пирувата и превращение его в молочную кислоту в присутствии кислорода
Опухоль интенсивно захватывает глюкозу из крови. Даже при повышении содержания глюкозы в крови до 16,7 ммоль/л (300 мг%) оттекающая из опухоли кровь не содержит глюкозы.
Физико-химические особенности опухолевой ткани. Изменени физико-химических свойств опухолевых клеток является результатом биохимической перестройки опухолевой ткани. Интенсивный гликолиз приводит к накоплению молочной кис лоты. При нагрузке углеводами в опухолевой ткани может снизиться рН до 6,4. В опухоли повышено содержание воды, а иногда и некоторых электролитов, в частности солей калия. Количество кальция и магния снижено, соотношение К/Са возросло. Вследствие гидратации и увеличения содержания ионов водорода, а также некоторых электролитов, электропроводность опухолевой ткани повышена. Снижена при этом вязкость коллоидов. Наблюдается увеличение отрицательного заряда клеток опухоли, величина которого приближается к величине заряда лимфоцитов.
Совокупность характерных признаков, отличающих опухолевую ткань от нормальной и составляющих биологические особенности опухолевого роста, называют типизмом. Различают следующие виды опухолевого атипизма:
-клеточный – необычная величина, форма и строение опухолевых клеток;
-тканевой – нарушение нормальных взаимоотношений паренхимы и стромы тканей.
-в опухоли анаэробное расщепление углеводов не только идет в присутствии кислорода, но и превалирует над аэробным;
-синтез белка преобладает над распадом;
-нарушается электролитный обмен: обеднение опухоли кальцием и накопление в них калия;
-глубокие нарушения в обмене некоторых биологически-активных веществ, влияющих на процессы клеточного деления (кейлоны).
-появляются белки, являющиеся носителями чуждой для организма генетической информации (антигены).
В процессе канцерогенеза клетки утрачивают свою дифференцировку, возвращаясь как бы к эмбриональному состоянию. Это явление называется анаплазией. Признаки анаплазии имеются в биохимических процессах опухолевых клеток (биохимическая анаплазия), их физико-химическом состоянии (физико-химическая анаплазия), строении и функции (морфологическая и функциональная анаплазия). Происходит также метаплазия - превращение в новые клеточные формы.
При трансформации в клетке наряду с нарушением регуляции клеточного деления происходят комплексы изменений:
1. Клетки начинают синтезировать новые разнообразные факторы роста, устанавливается их аутокринная секреция, что поддерживает беспрерывное размножение клеток. Небольшая часть экскретируемых факторов роста действует на соседние клетки этой же ткани, на клетки стромы и сосудов (ангиогенин), которых растущая опухолевая заставляет врастать в опухолевый узел для улучшения питания опухолевой ткани.
2. В опухолевых клетках резко увеличиваются синтез и экспрессия рецепторов, в первую очередь для факторов роста.
3. Синтез ферментов, разрушающих компоненты соединительной ткани и сосудов, что обусловливает миграцию опухолевых клеток и метастазирование (активатор плазминогена, коллагеназы).
4. Изменения цитоскелет, входящие в него микротрубочки. Имеет место фосфорилирование белков цитоскелета — винкулина, вследствие чего изменяется функция этих белков, уменьшается количество межклеточных контактов, что облегчает метастазирование. Исчезает контактное торможение клеточного деления.
5. Образование ферментов, способствующих синтезу коллагена, интерстиция и сосудистых стенок, а также в опухолевых клетках встречаются и собственные ферменты, синтезирующие компоненты интерстиция. Благодаря этой группе факторов опухолевые метастазы закрепляются и растут в других органах.
Биохимические особенности опухолевой ткани.
1. Репрессия выработки ферментов и белков, позволяющих клетке выполнять специализированную функцию и активация ферментов, обеспечивающих клеточное деление.
2. Дерепрессия синтеза веществ, например гормонов, которые в норме не образуются в данной ткани.
3. Активизация синтеза нуклеиновых кислот.
4. Качественные и количественные изменения синтеза белков.
5. Меняется метаболизм белков. Снижается способность опухолевых клеток к переаминированию и дезаминированию аминокислот.
6. Увеличиваются захват аминокислот из крови и синтез белка.
7. Нарушается синтез ряда незаменимых аминокислот, например L-аспарагина.
8. Увеличивается скорость гликолиза за счет увеличения активности основных ферментов гликолиза — гексокиназы, фосфофруктокиназы и пируваткиназы.
9. Активизация аэробного гликолиза, т.е. распад углеводов до пирувата и превращение его в молочную кислоту в присутствии кислорода.
10. Опухоль интенсивно захватывает глюкозу из крови.
11. угнетается тканевое дыхание.
Антигенные особенности опухоли.
По своему антигенному составу опухолевая ткань отличается от нормальной ткани, из которой она произошла. Так, в опухолях могут обнаруживаться антигены, свойственные эмбриональным тканям (опухолево-эмбриональные антигены). В опухолях вирусного происхождения появляются индуцированные вирусами антигены, специфичные для данного вируса и одинаковые в разных опухолях и у разных индивидуумов.
Клоны опухолевых клеток попадают под контроль иммунологически компетентной ткани, что приводит к их устранению. Таким образом, рост опухолевой ткани наблюдается в результате ускользания опухолевых клеток от иммунологического контроля.
Механизмы такого ускользания от иммунологического надзора следующие:
1. Прогрессия опухоли сопровождается утратой части антигенов, имеющихся в нормальной ткани — антигенным упрощением.
2. Утрата тканевоспецифических и индивидуальных антигенов. Остаются только видоспецифические антигены, к которым у каждого организма определенного вида существует толерантность.
3. Появление в опухолевой ткани феталъных антигенов.
4. Маскирование антигенов опухолей – образование капсул.
5. Активизация опухолью Т-супрессоров, что приводит к торможению иммунной реакции против опухоли.
7. Создание перегрузки иммунологической системы и угнетение иммунного ответа опухолевой тканью после достижения
Однако, несмотря на все пути ускользания опухоли от иммунологического надзора, трансформированные клетки разрушаются в организме и клиническое проявление опухолей происходит значительно реже трансформации.
Физико-химические особенности опухолевой ткани:
1. Интенсивный гликолиз приводит к накоплению молочной кислоты.
3. Повышение содержания воды, повышение количества калия, снижение кальция и магния.
4. Повышение электропроводности опухолевой ткани.
Степень физико-химической анаплазии соответствует степени дедифференциации и скорости роста.
Функциональная анаплазия проявляется утратой, извращением одной или нескольких функций той клетки, из которой трансформировалась опухолевая, или неподчиняемостью регуляторным влияниям имеющихся функций опухолевых клеток.
Злокачественность опухоли. Способность опухолевых клеток к беспредельному неконтролируемому размножению еще не определяет неизбежность гибели организма при росте опухоли, так как хирургическое удаление опухолевого узла обеспечивает полное излечение. Однако этому может препятствовать злокачественность опухоли, которая характеризуется инфильтративным (инвазивным) ростом и способностью метастазировать.
Метастазирование – появление новых очагов опухолевого роста.
Существуют три пути метастазирования:
1. гематогенный – по кровеносным сосудам;
2. лимфогенный – по лимфатическим сосудам;
3. тканевой – непосредственно от одной соприкасающейся ткани к другой или по межтканевым пространствам.
Этапы развития метастазов:
1. инвазия – проникновение раковых клеток в сосуд или смежную ткань;
2. транспорт – перенос раковых клеток кровью или лимфой;
4. активация – размножение опухолевых клеток с формированием вторичного очага опухолевого роста (метастаза).
Таблица 2.
Последнее изменение этой страницы: 2016-08-12; Нарушение авторского права страницы
Читайте также:

