Т клетки уничтожают раковые клетки
Чтобы опасные старые клетки не накапливались и не провоцировали хронические болезни, их можно устранить с помощью Т-лимфоцитов, распознающих клеточную старость.
Со временем в наших клетках накапливаются разнообразные дефекты – в генах появляются мутации, повреждённые белки перестают работать, как надо. Обычно в ответ на дефекты и повреждения должна включаться программа клеточного суицида: клетка уничтожает сама себя, и делает это так, чтобы доставить окружающим как можно меньше беспокойства. Но часто случается иначе: программа суицида не срабатывает, и клетка продолжает стареть.
С одной стороны, в стареющей клетке отключён механизм деления, и стать раковой она не сможет. (И даже размножение раковой клетки можно остановить, если спровоцировать в ней старение.) С другой стороны, она активно выделяет в окружающую среду целый набор соединений, воспалительные сигналы, ферменты, расщепляющие другие белки и пр. – такой коктейль, выделяемый дряхлеющей клеткой, плохо влияет на окружающую ткань. Стареющие клетки провоцируют общее фоновое воспаление в организме, повышают риск атеросклероза, вредят мозгу и вообще укорачивают жизнь. В норме их должны уничтожать иммунные клетки, которые приходят, так сказать, на запах старости, то есть по следам тех молекул, которые выбрасывают из себя стареющие клетки. Но бывает, что они продолжают накапливаться, накапливаться и накапливаться.
Чтобы избавиться от них, можно использовать специальные сенолитические препараты, уничтожающие старые клетки, и поиском таких препаратов занимаются множество лабораторий по всему миру. Однако исследователи из Мемориального онкологического центра им. Слоуна–Кеттеринга поступили иначе – они улучшили собственные иммунные клетки организма, чтобы они активнее уничтожали клеточный балласт.
Собственно, авторы работы использовали метод CAR Т-лимфоцитов, где CAR означает chimaeric antigen receptor – то есть Т-лимфоциты с химерным рецептором к антигену. Т-клетки узнают, кого нужно уничтожить, с помощью поверхностных рецепторов, которые узнают определённые молекулы – антигены. Но рецепторы работают с разной эффективностью; кроме того, у Т-лимфоцитов вообще может не оказаться рецепторов к нужному антигену. Суть метода CAR Т-лимфоцитов в том, что у индивидуума берут Т-клетки и модифицируют их рецепторы так, чтобы они узнавали конкретные молекулы-антигены и узнавали их хорошо. Обычно CAR T-лимфоциты настраивают на раковые клетки, конструируя им такие рецепторы, которые узнавали бы только раковые молекулы-антигены, отсутствующие на здоровых клетках.
Можно ли Т-лимфоциты настроить на старые клетки? Для начала в старых клетках нужно найти такие белки, которые бы сидели на их наружной клеточной мембране и которые были бы свойственны только старым клеткам. У человеческих и мышиных старых клеток удалось найти восемь наиболее многообещающих в этом смысле белков, из которых выбрали рецептор uPAR, который активно участвует в деградации старой ткани и которого почти нет у нестарых клеток. (Кстати, тот же uPAR, только в растворимой форме, считается одним из маркеров разных хронических болезней, включая диабет и почечные болезни, в которых клеточное старение играет большую роль.)
Исследователи настроили мышиные Т-лимфоциты распознавать рецептор uPAR и запустили их обратно в мышей, откуда их и взяли. В статье в Nature говорится, что модифицированные Т-лимфоциты справились с задачей и уничтожили старые клетки. Причём эти старые клетки были как раз раковые, которых сначала заставили состариться, чтобы они перестали делиться. То есть CAR T-лимфоциты, нацеленные против стареющих клеток, можно использовать как дополнение к противораковой терапии – потому что всё равно раковые клетки, пусть и состарившиеся, нужно куда-то девать. Кроме того, CAR T-лимфоциты улучшили состояние печени у мышей с неалкогольным стеатогепатитом, когда в печени начинается воспаление на фоне жирового перерождения.
Модифицированные Т-лимфоциты, нацеленные против стареющих клеток, могли бы стать удачной альтернативой сенолитическим препаратам, которые, как пишет портал Nature, порой оказываются токсичны, то есть вредят не только старым клеткам, но и всем остальным. Но такие Т-лимфоциты предстоит ещё испытать на людях, и, возможно, для уничтожения человеческих старых клеток Т-лимфоцитам нужен рецептор против какого-то другого белка. Наконец, не стоит забывать, что метод CAR T-клеток пока что очень недёшев, и можно только надеяться на то, что когда-нибудь он станет более-менее обычной медицинской услугой.
Рак остается одним из самых сложных для лечения заболеваний, от которого не существует одного эффективного лекарства. При этом в многочисленных исследованиях, посвященных поиску эффективных средств от недуга, не раз упоминаются определенные продукты питания, которые разными исследователями считаются эффективными для уничтожения раковых стволовых клеток.

Это очень важно, потому что именно тот факт, что химиотерапия не уничтожает раковые стволовые клетки, считается причиной того, что у онкологических пациентов случаются рецидивы и появляются метастазы. Эти клетки, иногда называемые "материнскими клетками", составляют лишь небольшую часть всех клеток опухоли, но они имеют способность самовосстанавливаться и сопротивляются химиотерапии. Они также могут отделяться и создавать новые колонии опухолей, поэтому их уничтожение является ключом к эффективному лечению рака в долгосрочной перспективе.
Лекарств, нацеленных конкретно на эти клетки, нет, но исследователи обнаружили множество природных веществ, способных бороться с этими клетками. Naturalnews. com перечислил продукты, которые являются лучшими "убийцами" раковых клеток.
Зеленый чай
Зеленый чай уже давно используется в китайской медицине для лечения множества недугов, но только недавно исследователи раскрыли его невероятный потенциал для лечения рака. Исследователи из медицинского центра Бэйлорского университета обнаружили, что активный ингредиент зеленого чая, EGCG (epigallocatechin-3-gallate), убивает раковые стволовые клетки и, следовательно, может помочь в случаях, когда образование не поддается химиотерапии. Хотя EGCG присутствует также в черном чае, в зеленом чае его концентрация выше.
Имбирь
Доклиническое исследование показывает, что один из компонентов имбиря дает в 10 000 раз большую эффективность в борьбе со стволовыми клетками при раке молочной железы, чем популярный препарат Таксол. Компонент, который известен как 6-Shogaol, выделяется, когда корень имбиря сварен или высушен, и его концентрация, необходимая для умерщвления раковых клеток, для клеток здоровых не опасна, в отличие от традиционных препаратов, применяемых в таких случаях.
Куркума
Куркумин, компонент древней индийской специи куркума, может выборочно влиять на стволовые раковые клетки без риска воздействия на здоровые стволовые клетки, необходимые для регенерации ткани. Это вещество эффективно при раке молочной железы, раке поджелудочной железы, колоректальном раке и раке головного мозга.
Ягоды винограда
Вещество resveratrol, которое находится в коже и семенах ягод винограда, наносит "смертельный" удар по стволовым клеткам рака толстой кишки. Таковы выводы ученых из Пенсильванского университета. Они верят, что в будущем это открытие поможет научиться предотвращать рак толстой кишки, который является одним из самых распространенных ныне типов рака. Когда во время эксперимента resveratrol и выдержка из семени винограда принимались одновременно, их воздействие было чрезвычайно мощно, и при этом они не повредили здоровым клеткам.
Другие продукты, которые убивают раковые стволовые клетки
Хотя вышеозначенные продукты — одни из самых мощных противораковых природных лекарств, есть и много других со сходным эффектом. Среди них — черника, морковь, кофе, грейпфрут, мята, вишня, лук, черный перец и тимьян.
Обилие продуктов, которые могут иметь большое влияние на рак, напоминает нам, насколько эффективно и безопасно природа может помочь справиться с серьезными недугами нашего времени. Многие врачи не очень хорошо разбираются в теме, у иных же есть финансовые мотивы, чтобы продолжать настаивать на дорогих и часто опасных лекарствах. По этой причине есть большой смысл расширять свой кругозор и узнавать, что, помимо лекарственной помощи, доступно нам в борьбе с серьезными заболеваниями.
- Чем раковые клетки отличаются от нормальных?
- Каковы причины появления раковых клеток?
- Какие бывают типы генов рака?
- Основные характеристики и строение раковых клеток
- Как выглядят раковые клетки под микроскопом?
- Как развиваются раковые клетки, какие этапы проходят в своем развитии?
- Ликвидация раковых клеток: что помогает их уничтожить?

Чем раковые клетки отличаются от нормальных?
Для того чтобы организм человека правильно работал как единое целое, каждая клетка в нем должна подчиняться общим правилам и обладать некоторыми основополагающими свойствами:
Не перестает размножаться. Сколько бы своих копий ни создала опухолевая клетка, она не останавится. Злокачественная опухоль постоянно растет и распространяется в организме.
Не специализируются. Раковая клетка не становится специализированной и не выполняет полезные для организма функции. Процесс клеточной специализации называется дифференцировкой. Чем ниже степень дифференцировки, тем агрессивнее ведет себя рак.
Каковы причины появления раковых клеток?
Почему в теле конкретного человека возникли раковые клетки — вопрос во многом риторический.
Каждая живая клетка функционирует и размножается в соответствии с заложенной в ней генетической информацией. При возникновении определенных мутаций эти тонкие механизмы регуляции сбиваются, и может произойти злокачественное перерождение.
Сложно сказать, что именно привело к таким мутациям в каждом конкретном случае. Современным врачам и ученым известны лишь факторы риска, которые повышают вероятность злокачественного перерождения и развития заболевания. Вот основные из них:
- Неблагоприятная экологическая ситуация.
- Курение.
- Чрезмерное употребление алкоголя.
- Профессиональные вредности, контакт с канцерогенными веществами и различными излучениями на производстве.
- Ожирение, избыточная масса тела.
- Ультрафиолетовое излучение солнца и соляриев.
- Малоподвижный образ жизни.
- Возраст: со временем мутации накапливаются, поэтому вероятность возникновения в организме раковых клеток повышена у пожилых людей.
- Нездоровое питание: преобладание в рационе животных жиров, красного и обработанного мяса.
Ни один из этих факторов не приводит со стопроцентной вероятностью к развитию злокачественной опухоли.
Какие бывают типы генов рака?
Не все мутации одинаково опасны. К раку приводят те, которые возникают в определенных генах:
Онкогены активируют размножение клеток. Злокачественное перерождение происходит, когда они становятся слишком активны. В качестве примера можно привести ген, который кодирует белок HER2. Этот белок-рецептор находится на поверхности клетки и заставляет ее размножаться.
Мутации, которые приводят к раку, могут быть наследственными (возникают в половых клетках) и соматическими (возникают в клетках тела в течение жизни).

Основные характеристики и строение раковых клеток
Раковые клетки обладают тремя основополагающими характеристиками, за счет которых так опасны онкологические заболевания:
- Способность к бесконтрольному размножению.
- Способность к инвазии — прорастанию в окружающие ткани.
- Способность к метастазированию — распространению в организме и образованию новых очагов в различных органах.
Не всякая опухолевая клетка — раковая. Раком или карциномой называют злокачественные опухоли из эпителиальной ткани, которая выстилает кожу, слизистые оболочки внутренних органов, образует железы. Из соединительной ткани (костной, жировой, мышечной, хрящевой, кровеносных сосудов) развиваются саркомы. Злокачественные заболевания органов кроветворения называют лейкозами. Опухоли из клеток иммунной системы — лимфомы и миеломы.
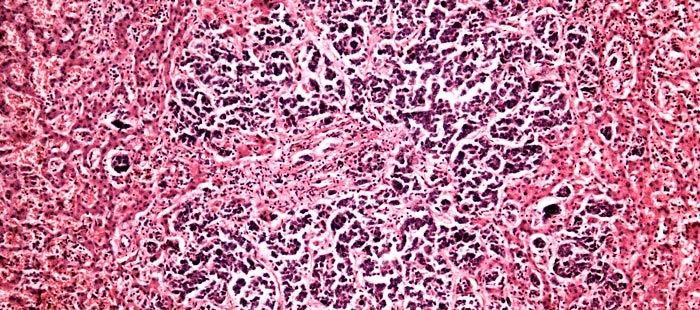
Как выглядят раковые клетки под микроскопом?
Если коротко, то они сильно отличаются от нормальных, тех, что ожидает увидеть патологоанатом, когда рассматривает под микроскопом фрагмент ткани. Раковые клетки имеют более крупные или мелкие размеры, неправильную форму, аномальное ядро. Если нормальные клетки в одной ткани все примерно одинаковых размеров, то раковые зачастую разные. Ядро содержит очень много ДНК, поэтому оно крупнее (его размеры тоже вариабельны), а при окрашивании специальными веществами выглядит более темным.
Из нормальных клеток образуются определенные структуры, например, железы. Раковые клетки располагаются более хаотично. Например, они образуют железы искаженной, неправильной формы или непонятные массы, которые на железы совсем не похожи.
Как развиваются раковые клетки, какие этапы проходят в своем развитии?
Раковые опухоли растут за счет деления клеток, которые входят в их состав. Во время деления злокачественная клетка образует две своих копии, таким образом, рост происходит в геометрической прогрессии. Например, для того чтобы образовалась опухоль размером 1 см, нужно около 30 удвоений. Через 40 удвоений новообразование достигает веса 1 кг, и этот размер считается критическим, смертельным для пациента.
Согласно современным представлениям, за рост злокачественной опухоли отвечают так называемые стволовые опухолевые клетки. Они активно делятся, в то время как другие опухолевые клетки просто существуют. Современные ученые заняты поиском методов лечения, направленных против этих стволовых клеток.
Время удвоения опухолевых клеток бывает разным. Например, при лейкозе это происходит за 4 дня, а при раковых новообразованиях толстой кишки — за 2 года. Проходит много времени, прежде чем опухоль достигнет настолько больших размеров, что станет проявляться какими-либо симптомами. Например, если у онкологического больного появились некоторые жалобы, и после этого он прожил год, вероятно, опухоль в его организме на момент появления жалоб существовала уже около трех лет, просто он об этом не знал.
Пока раковая опухоль небольшая, ей вполне хватает кислорода. Но по мере роста она все сильнее испытывает кислородное голодание — гипоксию. Чтобы обеспечить свои потребности, опухолевые клетки вырабатывают вещества, которые стимулируют образование кровеносных сосудов — ангиогенез.
По мере роста опухоли происходит инвазия — распространение раковых клеток в окружающие ткани. Они вырабатывают ферменты, которые разрушают нормальные клетки.
Некоторые из них отрываются от материнской опухоли, проникают в кровеносные и лимфатические сосуды, образуют в них вторичные очаги — метастазы. В этом самая главная опасность злокачественных опухолей. Именно метастатические очаги становятся причиной гибели многих онкологических пациентов.
Ликвидация раковых клеток: что помогает их уничтожить?
С раковыми клетками можно бороться разными способами. Например, удалить их из организма хирургическим путем. Но это возможно лишь в случаях, если опухоль не успела сильно распространиться в организме. Даже если можно выполнить радикальную операцию, никогда нет стопроцентной гарантии того, что в организме не остались микроскопические опухолевые очаги, которые в будущем станут причиной рецидива. Поэтому зачастую хирургические вмешательства дополняют адъювантной и неоадьювантной терапией.
Другие методы лечения:
В Европейской клинике применяются наиболее современные оригинальные препараты для борьбы с раком. У нас есть возможность провести молекулярно-генетический анализ опухолевой ткани, разобраться, из-за каких мутаций клетки стали злокачественными, и назначить наиболее эффективную персонализированную терапию. Свяжитесь с нами, мы знаем, как помочь.
В последние годы упоминание о Т-клетках все чаще появляется в заголовках новостей. Чтобы понять, чем прославились эти труженики, доктор биологических наук Татьяна Ткаченко рассказала, какие они бывают и чем занимаются.
При исследовании под микроскопом большинство лимфоцитов в нормальной лимфоидной ткани выглядят одинаково, однако у этих клеток разная судьба. Одна популяция — В-лимфоциты— ответственна за формирование антител и гуморальный иммунитет. Вторая — Т-лимфоциты — обеспечивает клеточный иммунитет, то есть непосредственно взаимодействует с антигенами. Эта популяция тоже неоднородна и представлена несколькими типами клеток с различными функциями.
Детство
Лимфоциты — главные клетки иммунной системы, играющие важную роль в адаптивном (не врожденном) иммунном ответе. Как В-, так и Т-лимфоциты образуются у эмбриона из гемопоэтических стволовых клеток красного костного мозга, после чего проходят дифференцировку: Т-клетки — в тимусе (вилочковой железе), В-клетки — в печени, а затем в костном мозге. В тимусе T-лимфоциты приобретают Т-клеточные рецепторы и различные поверхностные маркеры (корецепторы).
Помимо рецепторов, каждый зрелый T-лимфоцит экспрессирует один из так называемых корецепторов — CD4 или CD8, которые взаимодействуют с молекулами главного комплекса гистосовместимости (ГКГ).
Юность
Активированный Т-лимфоцит начинает делиться и образует клон. Часть клеток клона превращается в эффекторные Т-лимфоциты и активно участвует в иммунном ответе, а часть — превращается в Т-клетки памяти, которые сохраняются в неактивной форме до повторного взаимодействия с тем же антигеном. В таком случае Т-клетки памяти обеспечивают более быстрый иммунный ответ, чем при первичном контакте с антигеном.
Эффекторные Т-лимфоциты
Т-хелперы (англ. helper — помощник) усиливают адаптивный иммунный ответ. Они активируют другие клетки иммунной системы при прямом контакте, а также выделяют цитокины. Т-хелперы несут на поверхности корецептор CD4 и распознают антигены при взаимодействии их Т-клеточного рецептора с антигеном, связанным с молекулами ГКГ II класса.
Т-киллеры (англ. killer — убийца), или цитотоксические T-лимфоциты, уничтожают путем лизиса поврежденные клетки собственного организма — пораженные вирусами или бактериями, а также опухолевые клетки. Т-киллеры несут на поверхности корецептор CD8 и распознают антигены при взаимодействии их Т-клеточного рецептора с антигеном, связанным с молекулами ГКГ I класса, присутствующими на всех ядерных клетках в организме.
Т-клетки против рака
Т-клетки против аутоагрессии
Аутоиммунные заболевания обычно лечат путем общего подавления иммунитета, что грозит тяжелыми последствиями для организма больного. Более адекватным методом лечением стало бы устранение патологических иммунных факторов и, в частности, В-лимфоцитов, ответственных за синтез аутоагрессивных антител. Достичь этого можно с помощью той же технологии CAR-T, позволяющей задавать мишень для атаки Т-киллеров. Технология была испытана в лечении тяжелого аутоиммунного заболевания пузырчатки, или пемфигуса, при котором особая популяция B-лифоцитов выделяет антитела, атакующие один из белков клеточного матрикса — десмоглеин. В результате на коже и слизистых оболочках появляются гноящиеся пузыри, которые затем отслаиваются, обнажая подлежащие ткани.
В Т-лимфоциты вводили ген рецептора, содержащего фрагменты десмоглеина. Такие модифицированные Т-клетки могли связываться только с теми B-лимфоцитами, которые вырабатывали антитела к десмоглеину. После связывания трансгенные Т-киллеры уничтожали патологичные B-лимфоциты. Так происходило и в клеточной культуре, и в экспериментах на мышах, которым искусственно вводили B-лимфоциты против десмоглеина.
Т-клеточная терапия — сложная и дорогостоящая технология. Однако бóльшая часть пути в ее развитии уже пройдена, и есть надежда, что в недалеком будущем она станет доступна тем многочисленным пациентам, которые в ней нуждаются.

Открытие новых Т-клеток заставило говорить о создании универсального лечения рака.
Фото Global Look Press.
Международная группа исследователей открыла новый тип клеток иммунной системы, способных преследовать и уничтожать большинство видов раковых клеток. Открытие может совершить настоящую революцию в области иммунотерапии и привести к появлению универсального метода лечения рака, считают специалисты.
Развитие технологии CAR-T (сhimeric antigen receptor, что можно перевести как химерный рецептор антигена Т-клетки) стало одним из самых новаторских достижений в терапии рака за последние годы. Речь идёт о персонализированном лечении, при котором Т-клетки пациента собирают и перепрограммируют на "преследование" особых белков, обнаруженных на раковых клетках пациента.
В 2017 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США одобрило первое подобное лечение для молодых пациентов с редким видом рака крови и костного мозга. Но такая терапия является весьма дорогостоящей и чревата серьёзными побочными эффектами. Более того, CAR-T не показала должных результатов в лечении солидных (твёрдых) опухолей, которые встречаются в большинстве всех случаев заболевания.
Ещё одна проблема этого вида терапии заключается в том, что не существует универсального Т-клеточного рецептора (ТКР), который может справляться с самыми разными видами рака у всех пациентов. Но недавнее открытие учёных из Кардиффского университета показывает, что это неверная точка зрения.
Исследователи обнаружили Т-клетки иммунной системы, которые имеют неизвестный ранее рецептор. Последний, как предполагают специалисты, способен преследовать и уничтожать большинство раковых клеток человека. Что самое важное, "новичок" не вредит здоровым клеткам.
Считается, что недавно обнаруженная Т-клетка способна отличать раковые клетки от здоровых, поскольку она фокусируется на молекуле MR1, которая находится на поверхности большего количества раковых клеток. Что интересно, такая молекула имеется почти у всех клеток организма человека. Но, как предполагают учёные, у раковых клеток она несколько отличается, что позволяет "универсальному" ТКР эффективно нацеливаться на широкий спектр опухолей. Иными словами, новый ТКР способен отличать здоровые клетки от раковых, уничтожая только последние.
Специалисты провели исследования в лаборатории и выяснили, что Т-клетки, обладающие новым ТКР, уничтожают раковые клетки лёгких, кожи, крови, толстой кишки, молочной железы, костей, простаты, яичников, почек и шейки матки. При этом они, как было указано выше, игнорировали здоровые клетки.
Исследователи уже провели испытание на больных раком мышах, введя им Т-клетки, способные распознавать MR1. В результате они смогли "очистить" организм животных от раковых клеток. Результат можно сравнить с одобренной терапией CAR-T, которая была испытана на той же модели мышей.
"Современную терапию на основе ТКР можно применять лишь к небольшому количеству пациентов, и она подходит не ко всем онкологическим заболеваниям", – объясняет автор работы профессор Эндрю Сьюэлл (Andrew Sewell).
По его словам, новая таргетная терапия рака открывает новые горизонты, и, возможно, она приведёт к появлению "универсального" лечения этого заболевания.
"Найден единственный тип Т-клеток, который способен уничтожить множество различных типов рака. Ранее никто не верил, что такое возможно", – добавляет Сьюэлл.
На сегодняшний день учёные проводят эксперименты по определению точного молекулярного механизма, с помощью которого раннее неизвестный ТКР отличает здоровые клетки от раковых.
Профессор Сьюэлл считает, что испытания на людях могут начаться в ближайшие несколько лет, если дальнейшие проверки новой терапии на безопасность окажутся успешными.
Научная статья по итогам исследования опубликована в издании Nature Immunotherapy.
Сколько в человеческом организме клеток, не знает никто. Публикуемые в научных работах шести-, семи-, а то и восьмизначные цифры обозначают лишь приблизительную вероятность, но не реальное количество. Гораздо точнее наука установила разницу между ними - клетки сердца, легких, печени, почек, любых тканей отличаются друг от друга белками, из которых состоят, ферментами, участвующими в их функционировании, генами в их ДНК. И в "чужом" органе они работать не будут. Исключение составляют так называемые стволовые клетки, но не о них сейчас речь.
Но есть одно свойство, присущее всем клеткам, - свойство, за которое ученый с мировым именем академик РАН Владимир Скулачев образно назвал их камикадзе, - готовность в любой момент прибегнуть к "самоубийству" - запрограммированной клеточной смерти, называемой апоптозом. Название придумал древнеримский врач Гален, наблюдая осенний сброс листвы деревьями, - тоже своего рода суицид. К апоптозу клетка прибегает тогда, когда что-то в ней непоправимо сломалось и ее дальнейшее существование может навредить организму. Подчеркиваю: только может навредить, до настоящего вреда дело не доходит, поскольку тут же поступает приказ на уничтожение и запускается система умерщвления. Вот так клетки бросаются на амбразуру - все, кроме раковых.
Раковые будто пришли с другой планеты. В отличие от остальных они безудержно размножаются, пожирая ткани вокруг себя и образуя опухоль, растущую как лавина. И обладают поразительной способностью к выживанию, вот почему так трудно остановить их рост, а еще труднее вообще уничтожить. В отличие от остальных клеток, срок жизни которых исчисляется днями или неделями, раковые умирают вместе с "хозяином", в теле которого поселились и которого сами же убили. В некоторых лабораториях мира они живут в колбах уже более ста лет и чувствуют себя превосходно. И до недавнего времени считалось, что к добровольному уходу из жизни они неспособны. Российские и американские исследователи доказали, что это мнение ошибочно.
- Апоптоз, самоубийство клеток происходит по сложной, четко отработанной технологии, - рассказывает руководитель российской группы исследователей, лауреат Ленинской премии Михаил Ханин, профессор Центра теоретических проблем физико-химической фармакологии РАН. - В каждой клетке затаились и ждут своего часа особые ферменты, их называют каспазами. Это - палачи, непосредственные исполнители смертной казни. А сигнал к исполнению дают специальные рецепторы на клеточной мембране, зорко следящие за состоянием своей клетки, за ее взаимодействием с окружающими тканями и точно отмечающие момент, когда она может стать опасной для организма. Специалисты называют их жутковато - "рецепторы смерти". Отданный ими сигнал запускает длинную цепь биохимических реакций, в результате которых мирно "спящие" каспазы превращаются вдруг в бешеных убийц, уничтожающих цитоплазму, ядро и наконец сам геном клетки. Она сморщивается, уменьшает объем, после чего ее съедают окружающие здоровые клетки, используя ее ткани в своем развитии. Так сказать, своего рода безотходная технология.
Уже 30 лет биологи интенсивно изучают механизм апоптоза. И довольно далеко продвинулись в этой работе. Главное, выяснили, как запускается в действие огромная, многоэтапная цепочка биохимических реакций, несущая роковой приказ клетке на самоуничтожение, где одни белки и ферменты передают эстафету другим, на определенных этапах к ним примыкают третьи, четвертые, пятые и еще другие, которые вроде бы и не имеют прямого отношения к поставленной задаче, но без их присутствия приказ до цели не дойдет. Более того, исследователи научились сами запускать цепную реакцию апоптоза, провоцируя "рецепторы смерти" давать сигнал на уничтожение, и вполне работоспособные клетки послушно кончают самоубийством. Теперь остался последний шаг: от обычных клеток перейти к раковым.
Заставить раковую клетку покончить с собой. На первый взгляд - задача из области фантастики. Ведь цель этих клеток не оберегать организм, в котором они живут, а, наоборот, уничтожать окружающие ткани, пожирая их и перерабатывая в собственные белки, чтобы питать ими постоянно растущую опухоль. Так что, логически рассуждая с позиций здравого смысла, у раковых клеток вовсе не должно быть механизма апоптоза, а если он почему-то есть, то должен быть просто неработоспособным. Вот таким предположением поделился я со своим собеседником, чем вызвал у него откровенную усмешку.
- Неблагодарное это занятие - пытаться разгадать загадки природы, опираясь на обывательскую логику здравого смысла, - сказал Михаил Ханин. - Природа мыслит другими категориями, учитывая в своих решениях множество факторов, которые, на наш взгляд, никакого отношения к данной проблеме не имеют. Вот так и с раковыми клетками. Казалось бы, зачем им апоптоз, если их предназначение разрушать организм, а не оберегать его? Тем не менее в каждой раковой клетке, как и в любой другой, есть механизм самоуничтожения. И он безотказно срабатывает, если суметь его запустить.
В последней фразе - суть проблемы. Раковые клетки - отнюдь не сестры-близнецы, у каждого вида рака они свои. И по-разному противостоят попыткам запустить механизм апоптоза. Большинство клеток бешено сопротивляются, другие поддаются команде на уничтожение так же, как и обычные клетки, а третьи даже легче. Вот почему медицина достигла определенных успехов в лечении онкологических заболеваний. Некоторые болезни подчас излечиваются полностью, развитие других сильно замедляется. Сегодня медики считают, что все виды рака можно излечить апоптозом, тем более что механизмы его запуска давно освоены. Это, в частности, всем известные - радиационное облучение и химические токсичные вещества, которые не просто сами разрушают раковые клетки, как считалось раньше, а заставляют "рецепторы смерти" дать роковой сигнал. И чем раньше обнаружены скопления раковых клеток, начавших превращаться в опухоль, тем меньше их живучесть, тем слабее сопротивление сигналу на смерть. Есть и другие способы запуска апоптоза, только вот беда: ни один из них не дает стопроцентного эффекта. Один и тот же рак на одной и той же стадии у одного больного иногда излечивается полностью, у второго просто прекращается рост опухоли, а у третьего он лишь слегка замедляется. К тому же при одном запуске апоптоза результаты одни, при другом у того же вида рака бывают совсем другие. Поэтому не всегда можно предсказать заранее, что лучше поможет данному больному: облучение или химиотерапия? Почему же так происходит? А дело в том, что для науки до сих пор остается "черной дырой" средний этап апоптоза - процессы, происходящие между подачей сигнала на смерть и до разрушения клетки.
- Задача медицины - подавить сопротивление раковых клеток сигналу саморазрушения,- говорит Михаил Александрович,- добиться его неукоснительного выполнения. На это и направлена наша работа совместно с американскими коллегами из клиники Мейо в городе Рочестер (штат Миннесота), которой руководит выдающийся исследователь апоптоза, доктор философии и медицины, профессор Скотт Гарольд Кауфманн. И решаем мы эту проблему с двух разных сторон, соединив, казалось бы, далекие друг от друга вещи - биохимию и математику.
Надо думать, природе пришлось немало потрудиться, чтобы решить головоломную задачу - как изменить главное свойство обычной клетки при перерождении ее в раковую, не изменяя ее строения. Ведь механизм апоптоза никуда не выбросишь, он остается в клетке, задачи которой теперь кардинально меняются: не оберегать организм, а разрушать его. И апоптоз должен не мешать этому процессу, но тем не менее быть готовым и к разрушению самой клетки на случай, так сказать, непредвиденных ситуаций. Природа решила эту задачу, сделав раковый апоптоз сложнейшей нелинейной системой, в которой участвует огромное количество белков, где одни способствуют самоубийству клеток, другие не мешают, а третьи препятствуют. И во всей этой запутанной паутине различных биохимических процессов скрывается некий единственный процесс, который и приводит к окончательному результату - смерти клетки. Природе он известен, и она им иногда пользуется: иначе чем объяснить редкие случаи самоизлечения рака, ставящие медиков в тупик? Науке же пока известно, что этот процесс существует и у каждого вида рака он свой. Его и необходимо вычленить, выявить участвующие в нем белки, определить влияние каждого из них на общую динамику системы. Более того, необходимо определить скорость каждой из десятков и сотен биохимических реакций, входящих в систему апоптоза данного вида рака, без чего невозможно научиться управлять этим процессом. По сравнению со всей этой работой поиски пресловутой иголки в стоге сена - задачка для первоклассников. И исследования американских биохимиков грозили затянуться на десятки лет, если бы к ним не пришли на помощь российские математики.
- В последние годы математические и компьютерные модели занимают все большее место в биологических лабораториях, показав себя весьма эффективным методом исследования динамики сложных биохимических систем, - отмечает профессор Ханин. - А если говорить просто, то все, что биохимики создают в своих колбах и на что у них уходят недели и месяцы, а бывает, и годы, мы воспроизводим на экране компьютера, за считаные минуты проигрывая вариант за вариантом.
Конечно, это сказано слишком просто. На деле же идет сложнейшая работа - скрупулезный перебор на компьютерных моделях всех биохимических реакций, входящих в систему апоптоза, и их сочетаний. Определение их скоростей и других параметров, сверка полученных данных с теми, что успели получить коллеги за океаном - если сошлось, значит, правильно. Вот так белок за белком определяется одна из возможных цепочек от "рецепторов смерти" до раковых клеток. Но как определить, та ли это цепочка, по которой приказ на смерть дойдет до адресата, не потеряв силы, и разбудит "спящих" каспаз, заставив их приступить к своей палаческой работе? Или в нее попали белки лишние, не поддерживающие приказа, а то и препятствующие ему? Поэтому полученные варианты тестируются великим принципом оптимальности, которым руководствуется природа, создавая все свои творения. Он гласит, что все, что делается, должно происходить с минимальными затратами времени и энергии. Поэтому исследователи четко знают, что им надо искать, - цепочку биохимических реакций, содержащую минимальное количество белков, по которой сигнал на смерть доходит до палачей-каспаз за минимальное время и с минимальными потерями энергии. А вот получение этих данных позволит медикам создать систему управления механизмом апоптоза, действующую при лечении больных с максимальной эффективностью.
Читайте также:

