Разработка лекарственных средств от рака
Однако в последние 10-15 лет невероятными темпами развиваются новые виды антираковой терапии. В мировую медицину пришли современные биотехнологии, благодаря которым на патологический процесс можно воздействовать на уровне генов и молекул. Это открывает перед врачами и пациентами невиданные возможности: вместо массовой терапии больные получили шанс на персонализированное лечение.
Немногие фармацевтические компании в мире вплотную занимаются разработкой и внедрением новых технологий в борьбе с раковыми заболеваниями. В этом списке в основном присутствуют глобальные биофармацевтические концерны, такие как Roche Holding (Швейцария), Bristol-Myers Squibb (США), транснациональная фармкомпания Merck Sharp & Dohme (MSD) (США), англо-шведская фармацевтическая компания AstraZeneca. Единственной отечественной компанией, относящейся к этому списку, стала российская биотехнологическая компания BIOCAD.
Итак, какие новые разработки готова предложить наука для борьбы с раком? Наибольшее внимание ученых и врачей сегодня привлекают препараты на основе моноклональных антител, препараты на основе малых молекул, генная и CAR-T терапия, а также комбинированный подход, использующий все перечисленные методы.
Познакомимся поближе с новыми путями терапии раковых заболеваний, созданными с помощью биотехнологии.

Ученые подумали: а что если пометить раковые клетки произведенными на заводе антителами, чтобы они начали восприниматься как чужеродные и включали защитную реакцию организма, которая их уничтожит так же, как ежедневно уничтожает сотни инфекционных агентов?
Моноклональные антитела избирательно соединяются с чужеродными или сверхпредставленными белками на поверхности клетки опухоли и приводят к ее распознаванию и нацеливанию на нее иммунной системы, тормозят рост опухоли, дополнительно активируют иммунные клетки, маркируют, тормозят рост или маркируют для последующей лучевой терапии. Таргетная (направленная) терапия приводит к значительному повышению эффективности и снижению количества и тяжести побочных реакций.
Механизмов воздействия с помощью моноклональных антител на опухоль множество:
Еще одно направление научных разработок – создание антител, которые способны связываться сразу с двумя мишенями-антигенами. То есть если в одном участке белка раковой клетки была мутация, то антитело все равно свяжется со вторым участком, другими словами – не упустит врага. Это поможет пациентам, нечувствительным к определенным препаратам.
Колоссальный потенциал у биспецифических антител, которые распознают разные антигены (то есть их чувствительность к специфическим клеткам повышается). Они способны использовать эффект синергии нескольких механизмов действия.
Исход болезни зависит во многом и оттого, насколько рано она будет выявлена, поэтому необходима регулярная диагностика в соответствии с полом и возрастом. Например, при прохождении диспансеризации шанс на раннее выявление онкологического заболевания будет выше, чем без нее. А при первых признаках неблагополучия, не откладывая, обращайтесь к врачу!
– Есть ли новые методы терапии и какой из них наиболее эффективный?
– Онкология бурно развивается, но она опирается на три основные методики: хирургия, лучевая терапия, системная лекарственная терапия. Первые два метода остаются базой в лечении большинства новообразований на ранних стадиях, так как обладают мощным воздействием на опухоль. Но как только она дает метастазы, за ними уже не может угнаться ни нож хирурга, ни ионизирующий луч. Здесь в дело вступает лекарственное лечение. Потенциально, где бы ни находилась опухолевая клетка, ее должно настигнуть лекарство, попавшее в организм. Вопрос в том, как сделать эту терапию более эффективной и безопасной?
Современная онкология дает шанс на излечение того, что считалось смертельным еще 15-20 лет назад. Если излечения добиться не удается, мы получаем возможность контролировать болезнь в течение многих лет. Появились новые эффективные медицинские технологии: таргетная терапия (использование препаратов, блокирующих определенные пути стимуляции опухолевой клетки) – как в виде малых молекул, проникающих внутрь клетки, так и антител к конкретной мишени на поверхности опухолевой клетки, иммунотерапия (препараты, активирующие собственный иммунитет для борьбы с опухолью). Но пока нет ответа на вопрос: какая из имеющихся методик лучше? Главное – это грамотный врач-онколог, эффективно эти методики применяющий.
Также идут клинические испытания иммунотерапии следующего уровня, разработанной в стенах той же компании, – искусственно модифицированных клеток иммунной системы (CAR-Т клеток), обладающих потрясающей результативностью при лечении некоторых злокачественных опухолей крови.
– Российские врачи и пациенты сталкиваются с проблемой замены зарубежных препаратов на отечественные – более дешевые, но менее эффективные.
– Страна происхождения – не определяющий фактор. Препарат должен быть в первую очередь эффективным! А цена рассматривается как аргумент только при доказанном качестве. Если отечественный препарат произведен с пониманием того, что ему надо будет выдержать конкуренцию по правилам, принятым в развитых странах мира, то этот препарат, скорее всего, будет столь же эффективен и безопасен, как и препараты, произведенные за рубежом. И этому в отечественной науке уже сейчас есть доказательства.
Кандидат химических наук и руководитель экспертного отдела Inbio Ventures Илья Ясный – о том, как были открыты одни из самых важных лекарственных препаратов последних лет в онкологии и как эти исследования поддерживали частные некоммерческие фонды.
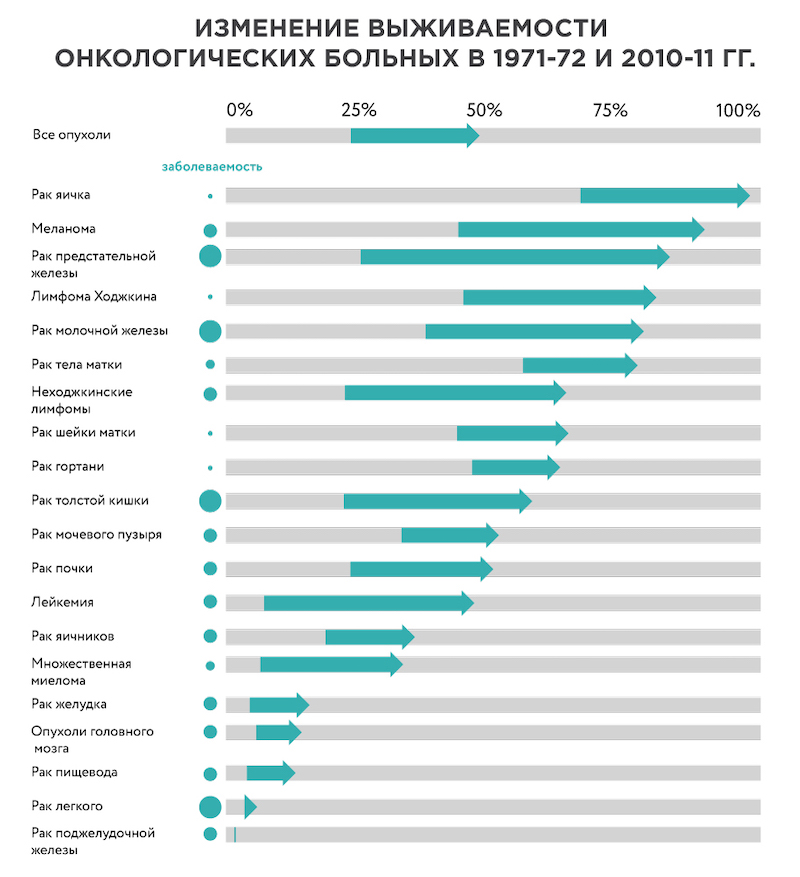
С 1970-х годов число онкологических больных, живущих более 10 лет после постановки диагноза, увеличилось вдвое. Особенные успехи достигнуты в лечении рака предстательной железы, некоторых видов лимфом, меланомы, рака молочной железы. C другой стороны, прогресс в лечении рака желудка, легкого и особенно поджелудочной железы пока невелик (Рисунок 1).
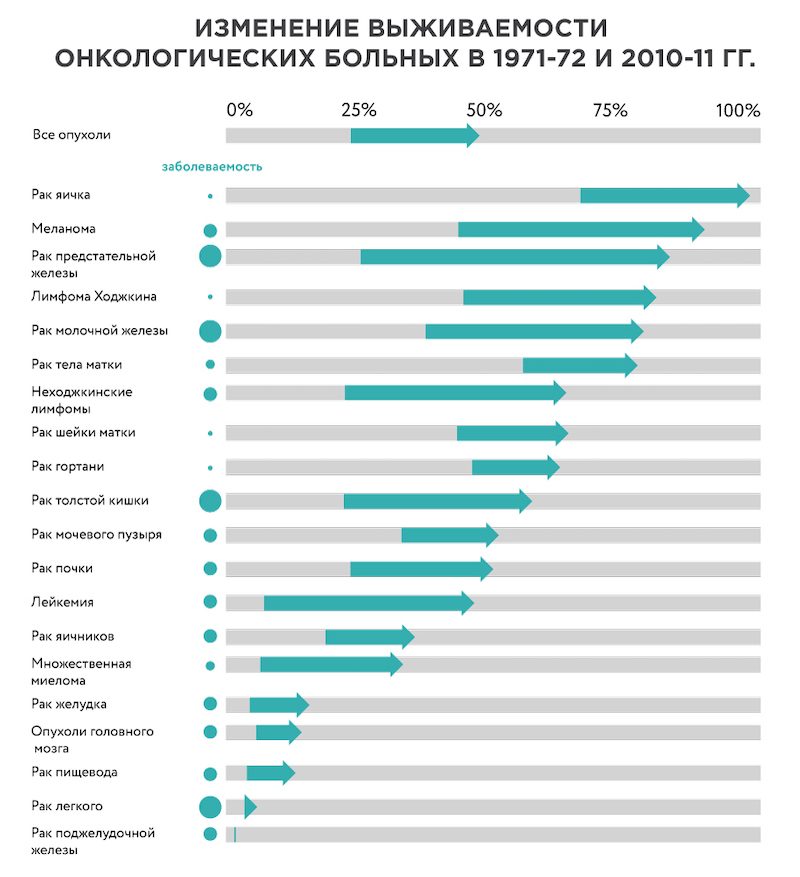
Рисунок 1. Увеличение 10-летней выживаемости при разных видах онкологических заболеваний в Великобритании с 1970-х по 2010-е годы. Источник картинки.
Почему возникает рак? Ответ на этот вопрос известен в общих чертах, но детали того, из-за чего у каждого конкретного человека возникла злокачественная опухоль, обычно неизвестны. В целом рак возникает тогда, когда какая-то клетка организма выходит из-под контроля и начинает неограниченно делиться, образуя опухоль. Такие клетки теряют свою специализацию и перестают реагировать на сигналы, которые бы заставили умереть здоровую клетку. Кроме того, они приобретают подвижность и способность метастазировать, то есть мигрировать в отдаленные участки организма и образовывать там новые опухоли.
В принципе, каждая делящаяся клетка организма может претерпеть злокачественное перерождение и дать начало онкологическому заболеванию. Как правило, это происходит в результате генетической мутации, которая может быть спонтанной или вызванной внешними причинами, например, облучением или вирусным заболеванием. Разовьется рак или нет в каждом конкретном случае – невозможно предсказать, так как исход зависит от множества факторов. К ним относятся и наследственность человека, и влияние среды, в которой он рос и живет, и состояние его организма, в частности, иммунной системы.
Даже в здоровом организме постоянно спонтанно возникают переродившиеся клетки, способные к неограниченному размножению. Но если у человека в порядке иммунная система, то она обеспечивает постоянный надзор за аномальными клетками и уничтожает их. Поэтому раковые клетки используют специальные ухищрения, чтобы защититься от иммунной системы организма. Опухоль выстраивает несколько линий обороны, и даже способна ставить себе на службу клетки иммунной системы, которые пришли ее убить.
Рак будет проявляться совершенно по-разному – в зависимости от того, какая именно клетка и в каком органе дала сбой. По малоизученным пока причинам некоторые из злокачественных опухолей растут гораздо быстрее, чем другие. Часть опухолей скорее дают метастазы, а главное – хуже подвергаются терапии. Ведь раковые клетки – в полном соответствии с законами эволюции – под воздействием лекарства либо умирают, либо мутируют и становятся неуязвимы для данных препаратов, и опухоль продолжает расти. Именно поэтому опухоль, которая уменьшилась под действием терапии, иногда снова начинает увеличиваться, и такие рецидивы (то есть повторное возникновение болезни) сложнее лечить.
В снижении смертности от онкологических заболеваний важную роль сыграли несколько факторов: это и улучшение методов хирургического лечения и радиотерапии, и появление новых лекарств, и профилактика, и развитие диагностики – многие опухоли лечатся лучше, если они обнаружены на ранней стадии.
В целом, создание лекарств – очень дорогое и длительное занятие, связанное с высоким риском провала. Разработка лекарственного кандидата начинается с поиска мишени – как правило, белка в организме, воздействие на который приведет к желаемому терапевтическому эффекту. Так, в случае рака это может быть белок, отвечающий за рост клеток. В идеале он должен присутствовать в злокачественных клетках и отсутствовать в здоровых. После того, как такая возможная мишень найдена, наступает этап проверки предположения, что воздействие на неё действительно приведёт к положительному эффекту и не вызовет нежелательных явлений.
Выбранную молекулу подвергают оптимизации для улучшения ее свойств, проверяя ее способность связываться с мишенью и вызывать нужные эффекты в клетках. Наконец выбранный кандидат в лекарство тестируют на животных, проверяя его эффективность в условиях модели заболевания и безопасность. Если препарат обладает достаточно хорошим соотношением безопасности и эффективности, он выходит в клинические исследования, то есть начинаются исследования с участием людей.
Как правило, препарат проходит три фазы клинических исследований, в которых принимают участие всё больше людей. На первой фазе тестируют безопасность препарата, на второй – подбирают дозу, режим введения и получают первые свидетельства эффективности. На третьей фазе проводят подтверждающие исследования эффективности. Если доказывается безопасность и эффективность препарата для лечения заболевания, его регистрируют и выпускают на рынок. В случае рака эффективными обычно считаются препараты, которые продлевают жизнь пациентов в среднем хотя бы на 10% по сравнению с существующей терапией.
Онкология относится к одной из самых рискованных областей разработки лекарств – только 5-8% препаратов, начинающих клинические исследования, доходят до регистрации. В среднем этот процесс занимает более 7 лет, и расходы составляют примерно 1,5 миллиарда долларов США. Понятно, что на ранней стадии исследований стартапу или научной группе, разрабатывающим новое лекарство, бывает трудно найти деньги на ключевые эксперименты, потому что с высокой вероятностью проект придется закрыть. Однако если никто не будет вкладываться в такие ранние рискованные исследования, то не будут появляться и новые лекарства. Один из способов, которым это противоречие решается в мире, – финансирование ранних разработок частными некоммерческими фондами, такими как российский РакФонд.
Вероятно, самый известный и крупный частный некоммерческий фонд в онкологии – Cancer Research UK (CRUK, Фонд исследований рака Великобритании). Он существует практически полностью на частные пожертвования и тратит на исследования рака более $500 млн в год. Благодаря поддержке Cancer Research UK до рынка дошел препарат абиратерон, который помогает миллионам пациентов, страдающим раком предстательной железы. Этот препарат предназначен для лечения метастатического рака предстательной железы: он ингибирует (то есть блокирует) производство гормона тестостерона, который стимулирует рост клеток этого рака.
Довольно давно было известно, что рост раковой опухоли простаты зависит от тестостерона, поэтому удаление яичек помогает его остановить, но ненадолго. Поскольку другие клетки в организме, например, клетки надпочечников, также производят тестостерон, которого хватает для стимуляции роста опухоли. Начались попытки найти молекулу, совсем выключающую синтез тестостерона.
В начале 1980-х годов ученые выяснили, что одна из стадий синтеза тестостерона в организме катализируется (то есть ускоряется) ферментом цитохром p450 17A1 (или CYP17). Ученые Института исследований рака в Сарри (Surrey), Великобритания, предположили, что известный противогрибковый препарат кетоконазол (он и сейчас продается в аптеках) – ингибитор CYP17 – может помочь и против рака предстательной железы. Оказалось, что он действительно задерживает рост опухоли, но действует не на всех пациентов, обладает побочными эффектами и очень быстро выводится из организма. Поэтому медицинские химики начали поиск аналогов кетоконазола, которые обладали бы его преимуществами, однако не имели бы таких недостатков.
В 1995 году вышла статья, в которой впервые была опубликована структура молекулы абиратерона, – самого сильного и при этом избирательного ингибитора CYP17 из всех полученных.
Потребовалось еще 16 лет исследований до его регистрации в 2011 году.
В конце 1990-х годов на средства Cancer Research UK было проведено первое клиническое исследование абиратерона, которое показало, что новый препарат действительно снижает уровень тестостерона в организме человека почти до нуля. Однако к тому моменту другие компании уже обнаружили, что комбинации некоторых известных препаратов также прекращают выработку тестостерона в яичках и других тканях организма, и начали использовать их для лечения рака предстательной железы. Предпосылок к тому, что абиратерон сможет повысить продолжительность жизни людей по сравнению с этим препаратами, не было, и никто не хотел рисковать и вкладывать в дальнейшую разработку абиратерона без знания его механизма действия и уверенности в том, что он будет эффективнее существующих лекарств.
Только к середине 2000-х появились данные о том, что клетки рака предстательной железы, лишаясь тестостерона от других тканей организма, начинают вырабатывать свой собственный! И тут вспомнили об абиратероне, который, в отличие от существующих препаратов, оказался способен прерывать синтез тестостерона и в раковых клетках. После ряда клинических исследований препарат был зарегистрирован сначала для пациентов, уже прошедших химиотерапию, а в 2016 году – и для тех, кто ее не получал, что обеспечило доступ к препарату для большого числа пациентов. Конечно, у препарата есть нежелательные явления, всё-таки он снижает уровень тестостерона почти до нуля, но польза от него значительно превосходит риск.
Важную роль в поддержке этой разработки сыграла финансовая и организационная помощь Cancer Research UK: все клинические исследования фазы 1 и 2 были выполнены на средства этой организации, и только самое большое и дорогое исследование фазы 3 – на деньги фармацевтического гиганта Johnson & Johnson. Пример абиратерона доказывает, насколько значимы лабораторные исследования для успеха препаратов в клинических исследованиях, и объясняет, почему РакФонд считает вложения в них столь важными.
Другой пример частного некоммерческого фонда – Leukemia & Lymphoma Society (LLS) в США, вкладывающего средства в исследования в области онкогематологии. Из 21 препарата, зарегистрированного американским агентством FDA в 2018 году, фонд участвовал в разработке 19. Только в 2018 году LLS вложил в исследования $48 млн, а суммарно, начиная с 1949 года – более $1,2 млрд.
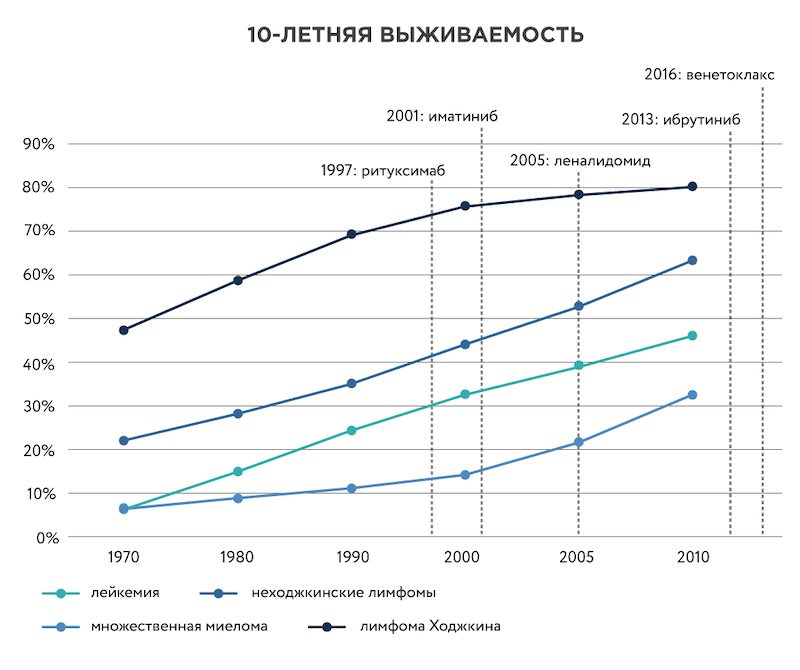
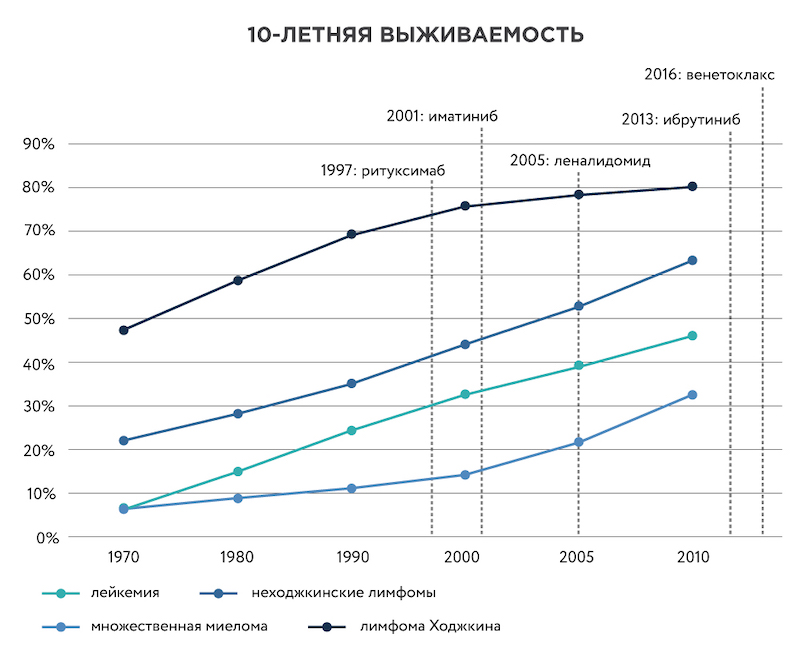
Рисунок 2. Рост 10-летней выживаемости при онкогематологических заболеваниях. Красными пунктирными линиями показан момент регистрации препаратов, созданных при участии Leukemia & Lymphoma Society. Данные по выживаемости с сайта Cancer Research UK.
Поддержка фонда сыграла важную роль в разработке таких лекарств, как иматиниб (торговое название препарата – Гливек), ритуксимаб (Мабтера), леналидомид (Ревлимид) и других. Благодаря этим препаратам диагноз лимфомы, миеломы и некоторых видов лейкемии, как правило, уже не считается приговором. У большинства пациентов детского возраста можно вылечить или длительно успешно контролировать эти злокачественные заболевания. В 2017 году были зарегистрированы первые препараты клеточной иммунотерапии острого лимфобластного лейкоза и лимфомы, получаемые с помощью генной инженерии – Kymriah и Yescarta. В их разработке LLS также принял непосредственное участие.
Однако исследования продолжаются, потому что у части детей и взрослых, особенно пожилых, не удается добиться ответа на терапию. Нужны более эффективные и безопасные лекарства.
Деятельность таких фондов, как Cancer Research UK, Leukemia & Lymphoma Society и РакФонда, направлена на финансирование ранних рискованных исследований лекарств и средств терапии. Не все из них докажут свою эффективность, однако именно эти усилия повышают вероятность, что еще одно лекарство от рака, которое сможет спасти жизни множества людей, будет разрботано.

Причиной смерти пациента-испытателя назвали неожиданную реакцию организма на экспериментальный препарат производства "Биокад". Ранее фармзавод удостоился похвалы Минздрава за "фантастические результаты" в лечении опухолей. Лекарство должно было появиться на рынке ещё год назад. Не остановит ли смерть добровольца исследования и когда ждать отечественное лекарство от рака — в расследовании Лайфа.
Одна из самых секретных разработок российской медицины попала в неприятную историю, которая могла бы так и остаться в стенах петербургской лаборатории. Рассказываем, как российские учёные изобретали молекулу для лечения меланомы и рака лёгких и с какими трудностями столкнулись.
1. Экспериментальный препарат стал главной темой онкологического конгресса
В ноябре 2018 года состоялся XXII Российский онкологический конгресс. Представители фармзавода "Биокад" и врачи рассказали об успешных испытаниях на людях новейшего отечественного лекарства от рака. Он заставляет иммунные клетки атаковать опухоль.
Речь о препарате под кодовым названием BCD-100. Это одна из самых засекреченных разработок отечественной фармацевтики — не разглашают даже имена учёных, разработавших молекулу (основное действующее вещество).
Препарат показал ошеломляющие результаты в лечении неоперабельной меланомы. Когда опухоль даёт метастазы, зловредные клетки проникают в окружающие органы и там формируют вторичные очаги болезни. Справиться с метастазирующей меланомой гораздо труднее. Однако BCD-100 сумел полностью убрать подобные опухоли у 7% пациентов. Ещё у 29% пациентов размер опухоли уменьшился не меньше чем на треть. В исследовании участвовало 126 онкобольных с неоперабельной меланомой. Испытания финансировал сам "Биокад".
Меланома (рак кожи)
Не самый частый, но один из самых агрессивных видов рака (≈74 тысяч больных в РФ). С 1950-х мировая заболеваемость выросла на 600%
Однако пациентов ждут серьёзные побочные эффекты, которые стали сюрпризом и для врачей — препарат-то новый.
"Внедрение [иммунотерапии], по-русски сказать, взорвало химиотерапевтам мозг. Мы столкнулись со спектром сложных и не понятных для нас [побочных] реакций. Может поражаться любой орган: начиная от щитовидной железы и заканчивая воспалением сосудов".
онколог центра им. Блохина Михаил Федянин
Но в декабре 2018 года НИИ онкологии им. Н.Н.Петрова (Санкт-Петербург) презентовал новые данные о результатах того же исследования.
У пациентов, принимавших BCD-100, чаще воспалялась щитовидная железа, чем у пациентов, принимающих аналогичные зарубежные препараты. Об этом заявил на конференции Федянин, то же впоследствии подтвердил и химиотерапевт из НИИ онкологии им. Н.Н. Петрова Алексей Новик. Его выступление находится в открытом доступе. Однако другие показатели побочных явлений не сильно отличались от уже выпущенных на рынок аналогов, так что Новик осторожно назвал BCD-100 "не менее безопасным", чем ему подобные.
2. Летальный исход, о котором умолчали
В ноябрьском выступлении доктор Федянин коротко обмолвился: были описаны смертельные случаи после приёма подобных препаратов. Одна из причин летальности — воспаление сердечной мышцы (миокардит).
Ни Федянин, ни Новик подолгу не останавливались на опасностях подобного рода препаратов. Врачи не упомянули и о смертельном случае с одним из пациентов-добровольцев. А самое главное, этого не сделала медицинский директор фармзавода "Биокад" Юлия Линькова.
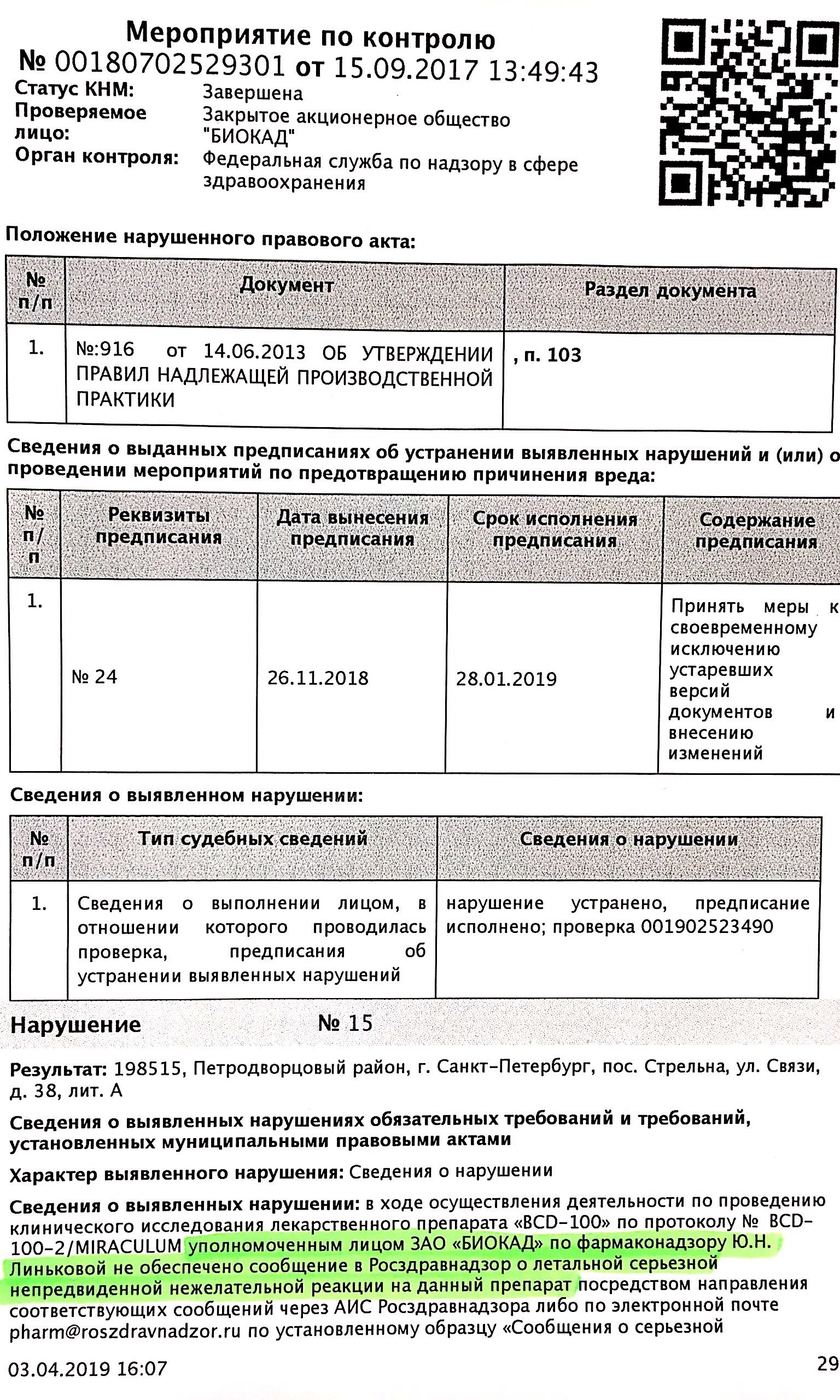
Представители завода "Биокад" вовремя не проинформировали государственные службы о смерти пациента из-за приёма BCD-100. Об этом говорится в материалах проверки Росздравнадзора, которые попали в Лайф из прокуратуры.
"В ходе клинического исследования препарата BCD-100 по протоколу Miraculum уполномоченное лицо ЗАО "Биокад" Юлия Линькова [не сообщила] в Росздравнадзор о летальной непредвиденной нежелательной реакции на данный препарат".
Материалы проверки Росздравнадзора от 26.11.18
Линькова обязана была уведомить о произошедшем либо через защищённую информационную систему Росздравнадзора, либо просто по электронной почте.
В том же предписании Росздравнадзор отмечает, что ни в 2017-м, ни в 2018-м в адрес ведомства вообще не поступало данных о безопасности трёх других препаратов, которые разрабатывает "Биокад".
Недавние исследования показали — больше половины российских медиков не сообщают в Росздравнадзор о побочных эффектах на препараты, с которыми столкнулись их пациенты. Ещё 8% вообще считают, что рассказывать о нежелательных реакциях нецелесообразно.
3. В надежде на "чудо"
Ещё в 2016 году министр здравоохранения Вероника Скворцова назвала результаты использования BCD-100 фантастическими. Протоколу, по которому исследовали лекарство, даже придумали соответствующее метафорическое название. С латыни "miraculum" переводится как " чудо". И действительно, с некоторыми пациентами BCD-100 сотворил чудо.
У 64-летней пациентки из Питера был опухолевый очаг в лёгком
Через несколько месяцев после приёма BCD-100 опухоль заметно уменьшилась в объемах. Это видно на снимках НМИЦ им. Н.Н.Петрова.
Но для других пациентов чудо обернулось проблемами или трагедией. Побочные эффекты от BCD-100 испытывали 80% пациентов, заявил на ноябрьской конференции доктор Федянин.
Чтобы разобраться, как работает BCD-100, важно понимать принцип работы иммунной системы человека.
Очень упрощённо иммунитет можно описать как систему "свой-чужой". Некоторые клетки крови умеют распознавать чужеродные бактерии и опасные тела и уничтожать их. Такой тип иммунных клеток называют Т-лимфоцитами. Получается эдакий "иммунный спецназ", который способен проникать через стенки сосудов в окружающие ткани и проводить там боевые действия против чужаков.
На поверхности Т-лимфоцита живёт белок PD-1, который отвечает за восприятие чужеродных клеток. Раковые же клетки "прячутся" от лимфоцитов, обманывая белок PD-1. Лимфоциты начинают думать, что раковая клетка — "своя", и не трогают смертельную опухоль.
Учёные по всему миру ломают головы над тем, как взломать маскировку и обучить лимфоциты распознавать в раковой клетке врага. Как уверяют создатели Miraculum, именно это им и удалось.

Создатели препарата рассчитывают, что его можно будет использовать не только для лечения меланомы и рака лёгких, но и других видов онкологии.
Поначалу на заводе "Биокад" рассчитывали выпустить лекарство на рынок в 2018 году. Сейчас сроки отодвинулись до 2022 года. Причин может быть множество: от недостаточного финансирования до неожиданно вскрывшихся проблем при использовании препарата.
В одном из интервью представители завода сравнивали цены на зарубежные аналогичные препараты. Выходило, что лечиться израильскими либо японскими средствами стоит примерно 9 миллионов рублей за курс. Отечественные разработчики обещали существенно меньшую цену за курс BCD-100. Возможно, в разы.
Хронология разработки препарата
4. Человечество писало кровью правила исследований препаратов
Лайф попросил эксперта, который много лет занимается клиническими исследованиями, рассказать о морально-этической стороне испытаний препаратов на людях. Вот что рассказала исполнительный директор Ассоциации организаций по клиническим исследованиям Светлана Завидова.
"Человечество двигалось к системе регулирования через лекарственные трагедии. Где-то, конечно, своим умом доходили, но в основном двигателем послужил негативный опыт, который и приводил к разработке тех или иных правил. Правила писали "на крови".
Светлана Завидова, Ассоциация по клиническим исследованиям
Один из первых мировых законодательных актов на тему регулирования исследований препаратов появился в США в 1938 году. Взяться за его разработку пришлось после того, как из-за неподтверждённого по критериям безопасности препарата сульфаниламида погибло 107 человек, большинство из которых — дети. Именно после этой трагедии фармпроизводителей обязали подтверждать безопасность лекарств. В том числе и на пациентах.
Исследования на людях идут в три фазы и длятся годами. В первую, как правило, включают только здоровых добровольцев. Вторая фаза — это испытания на пациентах, страдающих от конкретного заболевания. Обычно в них участвует несколько сотен человек. Третья фаза — самая масштабная: здесь в выборку могут включить несколько тысяч больных. Именно на третьей фазе появляется большинство данных о побочных реакциях и их частоте. Все добровольцы подписывают информированное согласие, соглашаясь на все риски (вплоть до летального исхода). Для многих пациентов участие в испытаниях — последний шанс.
Только при успешном завершении третьей стадии препарат регистрируют в госорганах и завозят в аптеки.
Второй случай изучают в медвузах как пример халатного отношения к безопасности препарата в угоду его продаваемости. Препарат талидомид в середине ХХ века был одним из самых продаваемых успокоительных и снотворных. Особенно его рекомендовали беременным и кормящим матерям, чтобы справляться с ночной бессонницей, утренней тошнотой и беспокойством. При этом никакие тесты влияния таблеток на плод не проводились. Препарат активно продавался в Европе. Через несколько лет стали чаще рождаться дети с патологиями: у новорожденных не было рук, ног либо ушей.
Ещё год потребовался властям нескольких стран, чтобы увязать страшную статистику с популярностью талидомида. Всё это время компания-производитель не признавала связи между этими событиями и продолжала рекламировать лекарство как безопасное.
5. Биокад: мы ничего не пытались скрыть!
Действия петербургской фармацевтической компании, которая не сообщила в Росздравнадзор о смерти пациента, на первый взгляд выглядят попыткой скрыть негатив во избежание репутационных и иных потерь. Однако в "Биокаде" заявляют, что специально ничего не утаивали.
"Первично полученные данные не соответствовали определению "Серьёзная непредвиденная нежелательная реакция". После получения дополнительных сведений информация была передана в Росздравнадзор".
Юридический департамент ЗАО "Биокад"
— Предположение о том, что ЗАО "Биокад" пыталось скрыть летальный случай, не соответствует действительности, поскольку данная информация сообщалась в ряд компетентных органов и учреждений, — добавили представители фармзавода. — Компания провела внутреннюю проверку, по результатам которой были детализированы внутренние процедуры.
Один из корпусов завода "Биокад" в Петербурге.
Компания "Биокад" создана в 2001 году. Это одна из крупнейших биотехнологических компаний России, где разрабатывают, изучают и производят новые типы лекарств. В штате трудятся более 1800 человек. Компания фокусируется на препаратах для терапии онкологических и аутоиммунных заболеваний, также ведёт разработки в области терапии других социально значимых заболеваний.
19 апреля 2019 года Национальный медицинский исследовательский центр радиологии Минздрава сообщил об увеличении числа онкобольных в стране. На первом месте в России рак лёгких. Каждый год онкологией заболевают около 600 тысяч человек. Всего в России на онкологическом учёте стоят 3,6 миллиона человек.

Исследователи берут кровь у животного, привитого антигеном-мишенью, и выделяют из нее иммунные клетки, несущие гены антител
Исследователи берут кровь у животного, привитого антигеном-мишенью, и выделяют из нее иммунные клетки, несущие гены антител
Полученный генетический материал находится в библиотеках антител — пробирках с прозрачной жидкостью, внутри которых — миллиарды разных вариантов антител
Полученный генетический материал находится в библиотеках антител — пробирках с прозрачной жидкостью, внутри которых — миллиарды разных вариантов антител
С помощью вирусов бактерий — фагов — ученые сужают число вероятных кандидатов. Затем выбирают из них два-три лучших варианта и переносят их на бактерии. Бактерии размножаются, и каждая несет на себе генетическую информацию одного варианта антитела

С помощью вирусов бактерий — фагов — ученые сужают число вероятных кандидатов. Затем выбирают из них два-три лучших варианта и переносят их на бактерии. Бактерии размножаются, и каждая несет на себе генетическую информацию одного варианта антитела
Из бактерий выделяют генетический материал и расшифровывают
Из бактерий выделяют генетический материал и расшифровывают
Затем исследователи с помощью биоинформатических методов строят 3D-модель антитела, точечно меняя некоторые аминокислоты, чтобы улучшить свойства полученных белковых соединений и сделать их похожими на белок человека

Затем исследователи с помощью биоинформатических методов строят 3D-модель антитела, точечно меняя некоторые аминокислоты, чтобы улучшить свойства полученных белковых соединений и сделать их похожими на белок человека
Исследователи берут кровь у животного, привитого антигеном-мишенью, и выделяют из нее иммунные клетки, несущие гены антител
Полученный генетический материал находится в библиотеках антител — пробирках с прозрачной жидкостью, внутри которых — миллиарды разных вариантов антител
С помощью вирусов бактерий — фагов — ученые сужают число вероятных кандидатов. Затем выбирают из них два-три лучших варианта и переносят их на бактерии. Бактерии размножаются, и каждая несет на себе генетическую информацию одного варианта антитела
Из бактерий выделяют генетический материал и расшифровывают
Затем исследователи с помощью биоинформатических методов строят 3D-модель антитела, точечно меняя некоторые аминокислоты, чтобы улучшить свойства полученных белковых соединений и сделать их похожими на белок человека
Читайте также: