Промисан при раке яичника
Рецидивом в медицине называют возобновление заболевания — появление его признаков и симптомов после периода ремиссии — состояния, при котором все проявления болезни исчезают.
Риск рецидива рака яичников очень велик, так как эта опухоль — очень злокачественная, поэтому даже после самого полного и эффективного курса терапии в организме могут сохраняться раковые клетки, способные со временем вновь образовать опухоль.
Да, это возможно с помощью современных методов профилактики:
- полного физического и психологического восстановления после терапии;
- наблюдения у гинеколога-онколога;
- здорового образа жизни;
- приема противоопухолевых БАДов.
Физическое восстановление достигается с помощью физической активности, длительных пеших прогулок, физкультуры, плавания, йоги, танцевальной аэробики.
Психологическая реабилитация (устранения тревожности и страха за будущее) обеспечивается индивидуальной и групповой психотерапией. Аутотренинг и медитация также помогают выключать отрицательные эмоции и выработать позитивный настрой.
Даже в состоянии ремиссии крайне важно наблюдаться у гинеколога-онколога который может разработать индивидуальный план профилактики рецидива.
Здоровый образ жизни включает:
- отказ от табакокурения и прекращение чрезмерного употребления алкоголя (допускается только 1-2 дозы в неделю);
- физические упражнения и другую физическую активность (не менее 2,5 часов в неделю);
- нормальный сон (не менее 7-8 часов) и полноценный отдых;
- устранение хронического стресса;
- нормальный вес с ИМТ (индексом массы тела) не более 25-30%
- правильное питание.
Это простое, сбалансированное, по белкам, жирам и углеводам, содержащее достаточное количество витаминов и микроэлементов питание, которое включает:
- овощи из семейства крестоцветных (различные виды капусты, в первую очередь, брокколи);
- все другие овощи, в том числе лук и чеснок;
- фрукты (прежде всего, виноград) и мед;
- молочнокислые продукты — творог, сыр, кефир и т.д;
- яйца (куриные и перепелиные);
- рыбу (лосось, треска, пикша) и мясо (телятина, птица, кролик);
- морепродукты, в том числе бурые водоросли;
- различные крупы (овес, гречка, рис);
- бобовые (сою, фасоль и др.);
- орехи (кроме миндаля) и семечки;
- зеленый чай, травяные и фруктовые чаи, соки, минеральные воды;
- специи (кайенский перец, куркума) и растительные масла;
- хлеб из муки грубого помола.
Желательно полностью исключить из рациона:
- жирные молочные продукты;
- все жареные, острые, соленые и сладкие блюда;
- маргарин и животные жиры;
- жирные бульоны и супы;
- сдоба и свежие хлебобулочные изделия из белой муки;
- все, что относится к фастфуду;
- колбасные изделия и копчености;
- консервы и маринады;
- грибы;
- кофе и сладкие газированные напитки.
Примером такого здорового и полноценного питания является так называемая средиземноморская диета.
Проводить профилактику можно с помощью некоторых биологически активных добавок. Полезными при риске рецидива рака яичников считаются карнитин, омега-3-жирные кислоты, ресвератрол, кверцетин. Уже доказано противоопухолевое воздействие на клетки яичника, молочной железы, шейки матки индол-3-карбинола и эпигаллокатехин-3-галлата. Два последних вещества есть в Промисане, поэтому правильное питание рекомендуется дополнять этим БАДом и принимать его по 2 капсулы 2 раза в день во время еды в течение 6 месяцев.
Промисан — это инновационная биологически активная добавка c научно доказанным противоопухолевым действием. Этот единственный в своем роде БАД, который содержит сразу два активных компонента, воздействующих на клетки яичника, молочной железы, шейки матки и некоторых других органов на молекулярном уровне.
Эти вещества — индол-3-карбинол (I3C) — пищевой индол из овощей семейства крестоцветных (например, брокколи) и эпигаллокатехин-3-галлат (EGCG) — наиболее активный из катехинов зеленого чая, абсолютно безвредны для нормальных клеток и в тоже время они:
- подавляют процесс образования и деления раковых клеток,
- восстанавливает противоопухолевые защитные механизмы;
- приводят к естественной гибели уже имеющихся в организме опухолевых клеток.
I3C и EGCG, как уникальные биологически активные противоопухолевые вещества растительного происхождения, уже давно используются практикующими врачами и их пациентами в Европе и США в качестве наиболее эффективного природного средства для профилактики рака.
В экспериментальных, клинических и эпидемиологических исследованиях была доказана противоопухолевая активность Промисана при многих предопухолевых и опухолевых процессах в органах женской репродуктивной системы и других органах, как у женщин, так и мужчин.
Поэтому Промисан назначается как эффективное средство для профилактики:
- рецидива рака яичников;
- наследственного рака яичников.
Также Промисан корректирует метаболические нарушения при многих онкологических заболеваниях.
Промисан рекомендуется принимать по 2 капсулы 2 раза в день во время еды в течение 6 месяцев. С целью эффективной профилактики рецидива наследственного рака яичников курс Промисана желательно проводить ежегодно.
В начале этого заболевания симптомы отсутствуют, поэтому рак яичников на ранних стадиях может обнаружить только врач при проведении УЗИ.
Обычно жалобы у женщины появляются, когда метастазы рака яичников проникают в соседние органы, то есть уже развивается метастатический рак яичников. Первые симптомы чаще всего следующие:
- вагинальные кровотечения;
- боль в низу живота и/или в нижней части спины;
- вздутие живота, чувство распирания, тяжести в брюшной полости;
- ощущение быстрого насыщения во время еды, изжога, тошнота;
- изменение стула (запор, диарея), учащение мочеиспускания.
Затем возникают и другие признаки рака яичников — усталость, похудание, отеки конечностей, увеличение живота за счет скопления в нем жидкости, одышка.
Обычно подозрение на рак яичников возникает во время УЗИ органов малого таза при скрининговом плановом исследовании или целенаправленной диагностике при вышеописанных жалобах, а также при обследовании по другому поводу.
Диагноз подтверждается с помощью биопсии яичника — взятия образца тканей для исследования под микроскопом с целью обнаружения раковых клеток. Это может быть сделано с помощью следующих процедур:
- пункции яичника с помощью длинной тонкой иглы (выполняется редко);
- лапароскопии — исследования брюшной полости с помощью специальной трубки с оптическим устройством на конце, которая водится в брюшную полость через прокол в области живота;
- лечебно-диагностического хирургического вмешательства (операции по удалению яичника).
Иногда в запущенных случаях диагноз также подтверждается с помощью прокола живота и исследования содержащийся в нем жидкости, в которой обнаруживаются раковые клетки.
Cтадии рака яичников определяют с помощью КТ и МРТ области малого таза и брюшной полости. План диагностики может включать маммографию, эндоскопию желудочно-кишечного тракта, рентгенографию или грудной клетки. Кроме обычных лабораторных исследований, назначается анализ крови на онкомаркер рака яичников CA125.
Современное лечение рака яичников включает хирургию и химиотерапию.
Основной метод терапии — циторедуктивная хирургия — хирургическая методика, которая позволяет полностью удалить рак яичника. Операция предусматривает удаление обеих яичников и всей видимой опухолевой ткани в области фаллопиевых труб, матки, соседних структур. Нередко требуется повторная хирургическая операция.
Однако лишь небольшой процент женщин с I стадией можно вылечить только с помощью хирургии. Химиотерапия проводится при раке яичников практически всем пациенткам. После операции назначается несколько курсов комбинированной химиотерапии — интенсивного лечения, которое включает 2-3 различных препарата, уничтожающих раковые клетки, оставшиеся в организме после операции. Это позволяет достичь состояния ремиссии или полностью излечить рак яичников. После основного курса часто проводится консолидирующая и поддерживающая химиотерапия с целью предотвращения рецидива.
Иногда химиотерапия выполняется перед операцией, чтобы было легче удалить опухоль и метастазы вовремя операции. Рак яичника после операции иногда лечат с помощью внутрибрюшинной химиотерапии. Также применяется гипертермическая внутрибрюшинная химиотерапия (промывание брюшной полости раствором химиотерапевтических препаратов, нагретым до температуры 40-43°С).
- Главная
- О раке
- О лечении рака
- Личные истории
- Сообщество
- Курсы
- Глоссарий
- Основное
- Документы
- Блоги
- Персоны
- Новости
- Портал
- О нас
- Поддержка и консультации
- Для врачей
- О раке
- О лечении рака
- Личные истории
- Сообщество
- Курсы
- Глоссарий
А.В. Жаров, Г.Р. Кравченко, Л.Ф. Чернова, Т.Н. Губайдуллина
Челябинский окружной клинический онкологический диспансер.
454087, Россия, г. Челябинск, ул. Блюхера,42, e-mail: roc_chel@mail.ru
Проблема рака яичников является одной из наиболее сложных в современной онкогинекологии. За последние годы смертность от рака яичников остается стабильно высокой и занимает одно из первых мест в структуре смертности от онкологических заболеваний женской репродуктивной системы. Это обусловлено как бессимптомным течением заболевания на ранних стадиях и недостаточной специфичностью методов современной диагностики неопластических процессов яичников, так и отсутствием четко выбранной этиопатогенетической концепции этого вида злокачественных новообразований.
Заболеваемость раком яичников в 2009 году в России составила 16,84 на 100 тысяч женского населения, а смертность - 10,17. Летальность больных в течение первого года жизни –26,4% [12].
На I-II стадии заболевания приходилось 34,4% пациенток, с III-IV стадиями заболевания было выявлено 62,8% больных [10].
Общеизвестно, что одной из главных причин высокой смертности при злокачественных опухолях является их несвоевременное обнаружение. Причина этого заключается в недостаточном распространении в нашей стране скрининговых программ по раннему выявлению рака репродуктивных органов. Одновременно с этим необходимо совершенствовать существующие и разрабатывать новые подходы к адекватной молекулярной противоопухолевой терапии, а также шире внедрять методы первичной и вторичной профилактики [1,2,3].
Совершенствование традиционных методов борьбы с раком (хирургическое вмешательство, лучевая терапия и химиотерапия), а также благодаря революционным открытиям и достижениям в молекулярной биологии, генетике, биохимии, иммунологии и вирусологии, позволило значительно расширить представления о молекулярно-генетической природе рака и глубже понять патогенетические механизмы опухолевого роста [5,13].
К настоящему времени известна довольно обширная (около 40) группа природных соединений, блокирующих развитие гипер- и неопластических процессов в эпителиальных тканях, высокая эффективность которых доказана в экспериментальных и клинических исследованиях. Показано, что такие вещества, являются нетоксичными, а, следовательно, безопасными для здоровых органов и тканей, обладают множественной противоопухолевой активностью, то есть воздействуют на несколько ключевых звеньев процесса канцерогенеза. Особенно успешным оказалось сочетание некоторых из них [6,12].
Уникальность этого препарата обусловлена его способностью блокировать молекулярные механизмы, приводящие к патологической пролиферации, опухолевому неоангиогенезу и повышению инвазивной активности трансформированных клеток.
Промисан – это таргетный (избирательный) продукт растительного происхождения, обладающий хорошей переносимостью и высоким уровнем безопасности при длительном применении. Токсические эффекты, характерные для химиотерапевтических препаратов, у промисана отсутствуют. Препарат выступает своеобразным помощником, усиливающим действие химиопрепаратов, потому что блокирует ряд факторов роста и формирование гормональных метаболитов, которые являются одним из важных моментов, связанных с ростом опухоли.
Промисан – это средство, восстанавливающее чувствительность резистентных опухолей к лекарственным препаратам, блокирует рост опухолей: деление опухолевых клеток, метастазирование, рост сосудов к опухоли [1,7].
В настоящем исследовании проведена оценка эффективности комплексного лечения двух групп больных распространёнными формами рака яичников: с включением промисана и без него.
Целью нашего исследования явилось улучшение результатов лечения больных распространёнными формами рака яичников путём включения в схему комплексного лечения препарата промисан.
Исследование проведено на базе гинекологического отделения Челябинского окружного клинического онкологического диспансера за период с 2007 по 2010 год. Контрольная группа была набрана за период с 2007 по 2009 годы. Основная группа - за период с 2009 по 2010 год включительно, когда стали активно применять для комплексного лечения больных раком яичников препарат промисан.
В исследовании участвовали 53 пациентки с распространёнными формами рака яичников (III-IV стадии). Основную группу составили 23 пациентки, которым проведено комплексное лечение по плану: от 2-х до 6-ти циклов НАПХТ с интервалом 3 недели по схеме СР (цисплатин 100 мг/м 2 + циклофосфан 750 мг/м 2 ) с последующим хирургическим этапом лечения и 4-6 циклами АПХТ по той же схеме. На всём протяжении лечения больные принимали промисан по 2 капсулы 2 раза в день. Контрольную группу составили 30 пациенток, которым проведено комплексное лечение по тому же плану, но без промисана.
До проведения планируемого лечения с целью уточнения распространенности опухолевого процесса и оценки общего состояния пациенток в обеих группах были выполнены: общие и биохимические анализы крови и мочи, ЭКГ, рентгенологические и ультразвуковые методы исследования, компьютерная томография, морфологическая верификация диагноза, исследование опухолевого маркёра СА-125.
Во время проведения исследования для мониторинга общего состояния пациенток и динамики опухолевого процесса были использованы все вышеописанные методы диагностики.
После проведения хирургического этапа была уточнена распространённость опухолевого процесса, объём остаточной опухоли. Оценка непосредственных результатов лечения основывалась на изучении общего самочувствия пациенток в каждой группе, переносимости проводимого лечения, уменьшения размеров первичного очага и метастазов, исчезновения плеврита и асцита, снижении показателей опухолевого маркёра СА-125.
Отдалённые результаты лечения по группам установлены на основании длительности безрецидивного периода, одногодичной выживаемости.
Возраст больных варьировал от 36 до 69 лет. Средний возраст пациенток в основной группе составил 53,1±1,3 года, в группе контроля – 54,3±1,2 года. Сравниваемые группы больных по возрастному критерию репрезентативны. Различия статистически незначимые (р>0,05). Распределение больных по возрасту в процентах представлено на рисунке 1.
Распределение больных по стадиям согласно классификации TNM в основной группе было следующим: Т 3 N Х М 0 - 20 (86,9%), Т 3 N Х М 1 - 3 (13,1%). В контрольной: Т 3 N Х М 0 - 25 (83,3%), Т 3 N Х М 1 - 5 (16,7%) человек. Различия статистически незначимые (р>0,05). В обеих группах преобладали больные с III стадией заболевания. Значение М1 обусловлено положительными цитологическими находками, полученными при пункции плевральной полости (клетки аденокарциномы) при одно- или двусторонних экссудативных плевритах, либо обнаруженными при УЗИ, КТ/МРТ метастазами в печени. Распределение больных по стадиям в процентах представлено на рисунке 2.
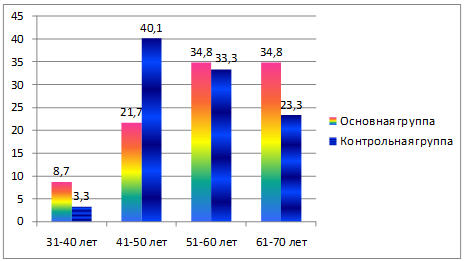
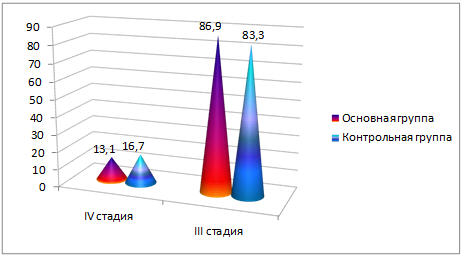
Рис. 2. Распределение больных по стадиям основной и контрольной группах (в процентах).
По гистологической структуре опухоли распределение больных в основной группе было следующим: серозная аденокарцинома - 20 (87,0%), муцинозная аденокарцинома - 2 (8,7%), железисто-солидный рак - 1 (4,3%). В контрольной группе: серозная аденокарцинома – 27 (90,0%), муцинозная аденокарцинома - 2 (6,67%), железисто-солидный рак – 1 (3,33%). В обеих группах преобладали больные с серозной аденокарциномой. Различия статистически незначимые (р>0,05). Распределение больных по гистологическому варианту опухоли в процентах представлено на рисунке 3.
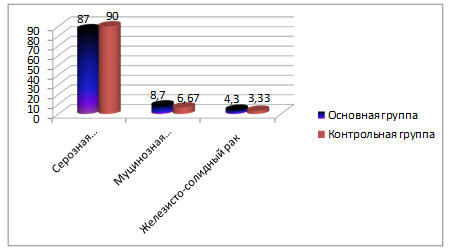
Рис. 3. Распределение больных по гистологической структуре опухоли основной и контрольной группах (в процентах).
Распределение больных по степеням дифференцировки опухоли в основной и контрольной группах показало статистически значимые различия (р Таким образом, в основной группе после 2-х циклов НАПХТ удалось выйти на хирургическое лечение у каждой третьей пациентки, а в контрольной лишь у каждой пятой. Кроме того, в основной группе 6 (26,1%) больным удалось выполнить оперативное вмешательство с оптимальной циторедукцией (объёмом остаточной опухоли менее 2 см), в сравнении с контрольной группой, где только 2 (6,7%) пациенткам было выполнено оперативное вмешательство с объёмом остаточной опухоли менее 2 см.
Больным, которые не вышли на хирургическое лечение после двух циклов НАПХТ, было продолжено лекарственное лечение до четырёх. После 4-х циклов НАПХТ средний показатель СА-125 у больных основной группы составил 28,3±3,7 Ед/мл (СА-125 минимальное значение – 0 Ед/мл, СА-125 максимальное значение – 41,7±6,3 Ед/мл). В группе контроля средний показатель СА-125 составил 35,7±5,3 Ед/мл (СА-125 минимальное значение – 0 Ед/мл, СА-125 максимальное значение – 57,1±6,9 Ед/мл). Различия по сравниваемым группам статистически незначимые (р>0,05).
После 4-х циклов НАПХТ 14 (60,9%) пациенткам основной группы было выполнено оперативное вмешательство в объёме экстирпации матки с придатками и резекции сальника. Из них 8 (34,5%) больным с оптимальной циторедукцией (объём остаточной опухоли менее 2 см) и у 6 (26,1%) больных объём остаточной опухоли превышал 2 см. В контрольной группе 18 (60,0%) больным произведен хирургический этап лечения. Из них 15 пациенткам произведена экстирпация матки с придатками, резекция сальника, 2 - экстирпация матки с придатками, биопсия сальника, и 1 больной – двусторонняя аднексэктомия, резекция сальника. Оперативное вмешательство с оптимальной циторедукцией было проведено 7 (23,3%) пациенткам, с неоптимальной циторедукцией 11 (36,7%) больным.
В основной группе 1 (4,3%) больной оперативное лечение было выполнено после 6 циклов НАПХТ в объеме экстирпация матки с придатками и резекции сальника. Визуально остаточной опухоли не определялось. СА-125 у данной пациентки перед операцией составлял 16,8 ЕД/мл. В контрольной группе 6 (20,0%) пациенткам после 6 циклов НАПХТ было выполнено оперативное вмешательство в неполном объеме. Трём из них – экстирпация матки с придатками, двум – двусторонняя аднексэктомия, резекция сальника и одной больной – только резекция сальника. Объём остаточной опухоли более 2 см был у всех пациенток.
В целом после проведения 2-6 курсов НАПХТ 15 (65,2±10,1%) больным основной группы удалось провести оперативное лечение с оптимальной циторедукцией и 9 (30,0±7,7%) пациенткам контрольной группы, пробных операций в основной группе не было. Различия статистически высоко значимые (р Рис.7. Кривая Каплана-Мейера, оценивающая одногодичную выживаемость больных контрольной группы – 65,2±3,1%.
Одногодичная выживаемость больных распространенными формами рака яичников в основной группе составила 78,9±2,3%, контрольной - 65,2±3,1% (Р=0,408). Таким образом, имеется отчётливая тенденция к увеличению выживаемости у пациенток, которым на протяжении комплексной терапии в схему лечения был включён препарат промисан.
Выводы:
1. Промисан хорошо переносится всеми больными и не увеличивает частоту и тяжесть побочных реакций и осложнений комплексного лечения больных с распространёнными формами рака яичников.
2. После проведения 2-6 курсов НАПХТ 15 (65,2±10,1%) больным основной группы (с промисаном) удалось провести оперативное лечение с оптимальной циторедукцией опухоли и лишь 9 (30,0±7,7%) пациенткам контрольной группы (без промисана), пробных операций в основной группе не было (р 3. Клиническими проявлениями прогрессирования заболевания были: в большинстве случаев – это рецидивы в малом тазу в 21,7% случаев у больных основной группы и в 30% у больных контрольной группы; метастазы в забрюшинные лимфатические узлы – в 8,7% в основной группе и 10% в контрольной группе; метастазы в легкие и печень незначительно превалировали у больных основной группы по сравнению с контрольной (4,3%, 8,7% и 3,3%, 6,7% соответственно).
4. Одногодичная выживаемость пациенток, получавших промисан, на 13,7% больше чем у пациенток, которые не получали промисан (78,9% и 65,2% соответственно) Р=0,408.
Промисан — единственное негормональное средство для профилактики рака органов женской репродуктивной системы, которое обладает множественной противоопухолевой активностью, не влияя при этом на здоровые органы и ткани. Промисан создан учеными НИИ молекулярной медицины Московской медицинской академии им. И. М. Сеченова.
Промисан — это таргетный (избирательный) продукт растительного происхождения. Он обладает хорошей переносимостью и высоким уровнем безопасности даже при длительном применении. У Промисана отсутствуют токсические эффекты, к которым обычно приводят химиотерапевтические препараты от рака.
Состав Промисана и принцип его работы
Препарат выпускается в виде капсул по 550 мг. В его состав входят два основных действующих вещества: индол-3-карбинол (I3C) и эпигаллокатехин-3-галлат (EGCG). Давайте разберем подробнее, как они работают в организме человека:
- Индол-3-карбинол. Его природным источником являются некоторые овощные культуры семейства крестоцветных, например, белокочанная и брюссельская капуста, брокколи. Исследование индол-3-карбинола началось еще в 1970-х годах. За прошедшие десятилетия были открыты уникальные свойства этого нутриента, за которые ученые считают его одним из наиболее полезных продуктов для долголетия. Научно доказано воздействие индол-3-карбинола на ключевые механизмы развития опухолей молочной железы, эндометрия, яичников.
- Эпигаллокатехин-3-галлат — это вытяжка из листьев зеленого чая, известного своим положительным влиянием на организм человека. Эпигаллокатехин-3-галлат —природный антиоксидант. Он повышает сопротивляемость и защитные свойства организма, оказывает противовоспалительное действие, но, самое главное, может подавлять образование и рост новых опухолевых клеток.
похожее по теме
Защита от рака: что нужно знать женщинам об индол-3-карбиноле
Промисан — эффективное средство от рака. Он усиливает действие химиопрепаратов, так как блокирует ряд факторов роста и формирования гормональных метаболитов, которые участвуют в процессе роста опухоли. Промисан можно принимать длительными курсами без негативных последствий, в то время как гормональные препараты при раке вызывают достаточно серьезные побочные эффекты.
Инструкция по применению препарата
Капсулы Промисан назначаются для профилактики рака, предотвращения рецидивов онкологических заболеваний или в составе комплексного лечения. Средство можно принимать совместно с химиотерапией.
В исследованиях пациенток с раком женских репродуктивных органов Промисан доказал свою эффективность в терапевтической дозировке по 2 капсулы 2 раза в день при длительности курса — 6 месяцев.
Точную схему приема назначает специалист-онколог, ориентируясь на состояние организма пациентки и другие условия. Так, например, препараты при раке молочной железы часто комбинируют. Их совместное влияние на заболевание должно быть максимально результативным. Для этого врач подбирает оптимальное сочетание разных средств.
Противопоказания к применению Промисана: индивидуальная непереносимость отдельных компонентов, беременность и кормление грудью, прием лекарств для снижения кислотности желудочного сока.
Опыт применения Промисана
Нельзя сказать, что препараты для профилактики рака сегодня широко представлены на фармацевтическом рынке. Однако к их числу относится Промисан — средство с доказанной эффективностью.
Промисан уже 8 лет активно применяется для профилактики и лечения онкологии. За это время он получил много положительных отзывов от пациентов с распространенными формами рака яичников и молочной железы. В международном издании была опубликована работа заслуженного врача России, академика РАН, доктора медицинских наук, профессора, руководителя института онкогинекологии и маммологии Ашрафяна Льва Андреевича. В ней описано исследование и показаны результаты комплексного лечения с включением Промисана в схему терапии. В этом исследовании женщины, принимавшие таблетки Промисан совместно с проведенной химиотерапией, получили обнадеживающие результаты. Препарат протестирован, прошел многочисленные исследования и призван ускорить выздоровление.
Рак яичников (РЯ) относится к группе социально значимых локализаций злокачественных новообразований и занимает седьмое место в структуре распределения злокачественных опухолей у женщин в Российской Федерации. В 2012 году в России впервые выявлено 12935 человек и умерло 7789 от данного заболевания [2].
До 80% пациенток выявляется в III и IV стадиях заболевания, когда имеются множественные имплантационные метастазы по париетальной и висцеральной брюшине с накоплением асцитической жидкости, канцероматоз плевры с наличием плеврита, поражение забрюшинных, паховых и медиастинальных лимфатических узлов, метастазы в паренхиматозных органах. Это ведёт к тому, что каждая четвёртая пациентка с РЯ умирает, не прожив и года после установления диагноза. Практически все больные с распространёнными формами заболевания после специального лечения и достижения ремиссии в конце концов выходят на рецидив заболевания и погибают. В данной ситуации для практикующего врача важен период времени, свободный от прогрессирования опухолевого процесса, и каждый продлённый месяц жизни пациентки.
После серьёзного прорыва в лечении больных РЯ, связанного с появлением в начале 80-х годов препаратов платины, а затем таксанов, существенных изменений до настоящего времени не произошло.
В последние годы предпринимаются попытки индивидуализации лечения больных РЯ на основании изучения молекулярно-биологических и генетических характеристик опухоли. Большое внимание в настоящее время уделяется разработке новых химио- и биотерапевтических препаратов направленного действия, позволяющих селективно воздействовать только на белки, участвующие в канцерогенезе и определяющие способность опухоли к прогрессии и метастазированию.
Одним из таких биотерапевтических препаратов является Промисан, содержащий два активных соединения - это пищевой индол-3-карбинол (I3C) и флавоноид эпигаллокатехин-3-галлат (EGCG). Он способен блокировать молекулярные механизмы, приводящие к патологической пролиферации, опухолевому неоангиогенезу, снижает инвазивный и метастатической потенциал трансформированных клеток и активирует их апоптоз. Кроме того, препарат способен усиливать действие химиотерапевтических препаратов и восстанавливать чувствительность резистентных опухолей к лекарственным средствам [1].
Препарат Промисан – это таргетный продукт, обладающий хорошей переносимостью и высоким уровнем безопасности при длительном применении. Токсические эффекты, характерные для химиотерапевтических препаратов, у него отсутствуют 4.
В настоящем исследовании проведена оценка эффективности комплексного лечения двух групп больных распространёнными формами рака яичников: с включением в схему терапии препарата Промисан и без него.
Цель исследования
Улучшение клинических показателей течения заболевания у больных распростра-нённым раком яичников путём включения в схему комплексного лечения препарата Промисан.
Материалы и методы
Исследование проведено на базе гинекологического отделения Челябинского областного клинического онкологического диспансера за период с 2008 по 2011 год. Выполнялось рандомизированное исследование, в котором пациентки распределялись по группам лечения случайным образом (методом конвертов) и имели одинаковую возможность получить препарат Промисан.
В исследовании участвовали 64 пациентки с распространёнными формами РЯ (III-IV стадии). Основную группу составили 30 больных, которым проведено комплексное лечение по следующему плану. На первом этапе проводилось от 2 до 6 циклов неоадъювантной полихимиотерапии (НАПХТ) с интервалом в 3 недели по схеме СР (цисплатин 100 мг/м2 + циклофосфан 750 мг/м2). На втором - выполнялось хирургическое вмешательство. На третьем этапе проводилась адъювантная полихимиотерапия (АПХТ) от 2 до 6 циклов по той же схеме. На всём протяжении лечения больные принимали препарат Промисан по 2 капсулы 2 раза в день. Контрольную группу составили 34 пациентки, которым проведено комплексное лечение по тому же плану, но без препарата Промисан. Окончательный эффект оценивался после 8 циклов ПХТ и хирургического лечения.
Для уточнения распространенности опухолевого процесса и оценки общего состояния больных до проведения планируемого лечения были выполнены: общие и биохимические анализы крови и мочи, ЭКГ, рентгенологические и ультразвуковые методы исследования, компьютерная томография, морфологическая верификация диагноза (пункция опухоли под УЗИ-контролем, цитологическое исследование пунктата заднего свода, плевральной и асцитической жидкости), исследование опухолевого маркёра СА-125. Во время проведения исследования для мониторинга общего состояния пациенток и динамики опухолевого процесса были использованы все вышеописанные методы диагностики.
Оценка непосредственных результатов лечения основывалась на изучении общего самочувствия больных в каждой группе, переносимости проводимого лечения, уменьшения размеров первичного очага и метастазов, исчезновения плеврита и асцита, снижении показателей опухолевого маркёра СА-125. После проведения хирургического этапа уточнялась распространённость опухолевого процесса и эффективность НАПХТ. При этом оценивался объём остаточной опухоли и лекарственный патоморфоз новообразования.
Отдалённые результаты лечения по группам установлены на основании длительности периода, свободного от прогрессирования опухолевого процесса, и трехлетней выживаемости.
Возраст больных варьировал от 49 до 61 года. Средний возраст пациенток в основной группе составлял 51,4±2,6 года, в группе контроля - 50,8±1,9 года. Сравниваемые группы больных по возрастному критерию репрезентативны.
В исследование были включены пациентки, которым по распространённости опухолевого процесса, по нашему мнению, начинать лечение было целесообразно с НАПХТ, а не с операции. Это больные с большими, ограниченно смещаемыми или несмещаемыми опухолевыми конгломератами, наличием асцита и/или плеврита. Распределение по стадиям согласно классификации TNM в основной группе было следующим: Т3NХМ0 - 28 (93,3%), Т3NХМ1 - 2 (6,7%). В контрольной: Т3NХМ0 - 30 (88,3%), Т3NХМ1 - 4 (11,7%) человек. Различия статистически незначимые (р>0,05). В обеих группах преобладали пациентки с III стадией заболевания. Значение М1 обусловлено положительными цитологическими находками, полученными при пункции плевральной полости при экссудативном плеврите либо обнаруженными при УЗИ, КТ/МРТ паренхиматозных метастазов в печени. Общее состояние больных в группах, несмотря на распространённый опухолевый процесс, было оценено по шкале ECOG-BОЗ в 1-2 балла.
По гистологической структуре опухоли распределение больных в основной группе было следующим: серозная цистаденокарцинома - 24 (80,0%), муцинозная цистаденокарцинома - 4 (13,3%), железисто-солидный рак - 2 (6,6%) случая. В контрольной группе: серозная цистаденокарцинома - 28 (82,3%), муцинозная цистаденокарцинома - 4 (11,7%), железисто-солидный рак - 2 (5,8%) наблюдения. В обеих группах преобладали больные с серозной цистаденокарциномой. В целом по группам различия оказались статистически незначимые (р>0,05).
Анализ по степеням дифференцировки опухоли показал следующее. В основной группе преобладали больные с умеренно дифференцированными вариантами опухоли 14 (46,6%), низкую степень дифференцировки имели 12 (40,0%) человек и высоко дифференцированный вариант оказался у 4 (13,4%) пациенток. В контрольной группе больных с низкой и умеренной степенью дифференцировки оказалось одинаковое количество - по 14 (41,2%) человек. У 6 (17,6%) пациенток опухоль имела высокую дифференцировку. Распределение больных по степеням дифференцировки опухоли показало статистически незначимые различия.
Таким образом, по основным параметрам, характеризовавшим больных и опухолевый процесс, сравниваемые группы были сопоставимы.
Результаты и обсуждение
В результате проведенного лечения, после 8 циклов ПХТ и хирургического вмешательства, у 22 (73,3%) больных основной и у 18 (52,9%) контрольной группы данных о наличии опухоли не было. Это свидетельствует об отчетливой тенденции к лучшему регрессу опухоли у пациенток с включением в схему лечения препарата Промисан. К завершению 3 года без признаков опухолевого процесса в каждой группе оставалось по 2 человека.
1. Измеримые очаги – опухолевый очаг размером более 10 мм, выявляемый при КТ или МРТ с шагом 5 мм или менее. Опухолевый очаг размером более 20 мм, измеренный с помощью КТ или МРТ с шагом 10 мм или менее. Опухолевый очаг более 20 мм, выявляемый при рентгенографии легких.
2. Неизмеримые очаги – очаги, не входящие в п. 1, а также следующие очаги: метастазы в кости, лептоменингеальное поражение, асцит, плеврит, перикардит, лимфангоит, поражение полых органов.
Оценка эффекта по RECIST для измеримых очагов.
1. Полный ответ – исчезновение всех измеримых очагов.
2. Частичный ответ – уменьшение суммарных максимальных размеров всех измеримых очагов на 30% и более.
3. Прогрессирование – увеличение суммарных минимальных размеров всех измеримых очагов на 20% и более или появление новых очагов.
4. Стабилизация – увеличение очагов менее, чем при прогрессировании, или уменьшение менее, чем при частичном ответе.
Критерии ответа на лечение для неизмеримых очагов.
1. Полный ответ – исчезновение всех неизмеримых очагов с нормализацией опухолевых маркеров.
2. Частичный ответ/стабилизация – сохранение хотя бы одного неизмеримого очага и/или повышение опухолевых маркеров.
3. Прогрессирование – явное прогрессирование неизмеримых очагов или появление новых очагов.
Общий ответ на лечение оценивался исходя из комбинации оценок измеримых и неизмеримых очагов, результаты представлены на рисунке 1.
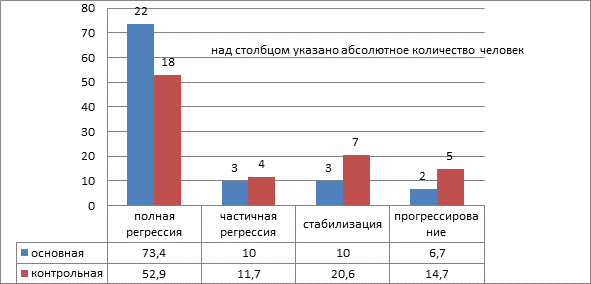
Рис. 1. Общий ответ на лечение больных с распространёнными формами рака яичников
Из представленных данных видно, что в основной группе пациенток есть тенденция к улучшению результатов лечения. У этих больных полная регрессия опухоли наблюдалась на 20,5% наблюдений чаще, чем в контрольной группе. Частичная регрессия и стабилизация опухолевого процесса, наоборот, в контрольной группе была выше на 12,3% случаев. Это объясняется тем, что, во-первых, в основной группе было больше пациенток с полной регрессией опухоли. Во-вторых, в основной группе частота прогрессирования опухолевого процесса на фоне специального лечения была на 8% ниже, чем в контрольной.
Таким образом, у больных, получавших в процессе специального лечения препарат Промисан, чаще наблюдали полную регрессию опухоли и реже прогрессирование опухолевого процесса.
Thigpen J.T. et al. (1994) предложили характеристику больных по четырём вариантам течения РЯ (рецидивирующий, резистентный, персистирующий, рефрактерный) [6].
Рецидивирующий РЯ - эта группа включает пациенток, которые достигли полной регрессии опухоли при проведении химиотерапии первой линии с включением производных платины, у которых прогрессирование наступило не ранее чем через 6 месяцев после прекращения лечения.
Резистентный РЯ - полная регрессия опухоли при проведении химиотерапии первой линии, но прогрессирование наступило ранее чем через 6 месяцев после прекращения лечения.
Персистирующий РЯ - у больных достигнута частичная регрессия при проведении химиотерапии первой линии с включением препаратов платины, но сохраняются проявления болезни.
Рефрактерный РЯ - в группу входят больные, у которых не отмечено эффекта от проведения первой линии химиотерапии с включением препаратов платины, а также пациентки, у которых отмечено прогрессирование заболевания на фоне химиотерапии первой линии.
На рисунке 2 представлено распределение больных распространёнными формами РЯ по вариантам течения заболевания с учетом времени, свободного от прогрессирования и числа пациенток.
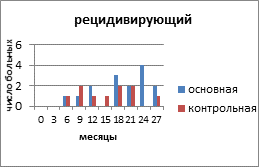
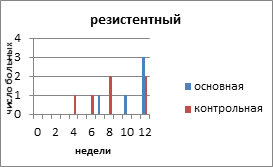
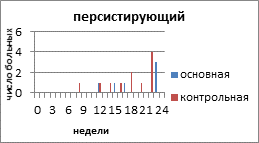
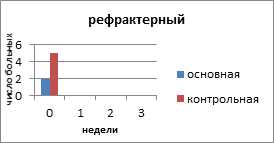
Рис. 2. Распределение больных распространёнными формами рака яичников по вариантам течения заболевания
Клиническими проявлениями прогрессирования заболевания были: местные рецидивы в малом тазу и брюшной полости, метастазы в забрюшинные лимфатические узлы, отдалённые метастазы в печень, легкие. В основной группе у 15 (50%) пациенток зарегистрирован рецидивирующий РЯ, в контрольной - у 10 (29,4%) человек. Рецидив выявлен на основании роста опухолевого маркёра СА-125, а затем был доказан клинически и инструментально. Время, свободное от прогрессирования опухолевого процесса, в контрольной группе с рецидивирующим РЯ составило 19 месяцев, а в контрольной - 15,6 месяца. Статистический анализ показал, что у пациенток с рецидивирующим РЯ, получавших препарат Промисан, видна отчетливая тенденция к увеличению продолжительности безрецидивного периода (Р=0,058).
С резистентным РЯ в основной группе было 5 (16,6%) больных, в контрольной - 6 (17,4%) пациенток. Минимальное время до индикации опухоли в основной группе было 12 недель, максимальное - 23 недели. В контрольной группе соответственно 8 и 22 недели. Время, свободное от прогрессирования, в контрольной группе с резистентным РЯ составило 10,6 недели, а в контрольной - 8,3 недели.
Персистирующий РЯ в основной группе наблюдали у 6 (20%) пациенток, в контрольной - у 11 (32,3%) больных. Время от завершения запланированного лечения с достигнутой стабилизацией опухолевого процесса до начала прогрессирования составило 12 недель в основной и 8 недель в контрольной группе. К концу 3 года умерли все больные с персистирующим РЯ, как в основной, так и в контрольной группе.
Рефрактерный РЯ отмечен у 2 (6,6%) больных основной и 5 (14,7%) пациенток контрольной группы. Все пациентки умерли в течение года от момента установления диагноза и начала специального лечения.
В целом на менее агрессивное течение РЯ (рецидивирующий) в основной группе приходилось 15 (50%) больных, в контрольной – 10 (29,4%) пациенток. На более агрессивное течение (резистентный, персистирующий, рефрактерный) соответственно - 13 (43,3%) и 22 (64,7%) больных. Более благоприятные результаты общего ответа опухоли на лечение больных РЯ и уменьшение агрессивных вариантов течения заболевания в группе с применением препарата Промисан положительно отразилось и на показателях выживаемости и смертности.
Трехлетняя выживаемость пациенток в основной группе составила 63,3±3,7% наблюдений, в контрольной - 47,05±4,2% случаев, при серьёзной тенденции к улучшению показателя в основной группе (р=0,089). Смертность больных в основной группе на первом году жизни составила 3 (10,0%) человека, в контрольной - 5 (14,7%). На втором умерло 8 (26,6%), в основной и 12 (35,3%) пациенток в контрольной группе. На третьем году жизни - 11 (36,6%) в основной и 18 (52,9%) больных в контрольной группе. Различия статистически незначимые (р>0,05), но имеется чёткая тенденция к меньшему числу смертей к третьему году наблюдений в основной группе.
Заключение
Включение в комплексную терапию больных распространёнными формами РЯ препарата Промисан позволило усилить ответ опухоли на проводимое специальное лечение, добиться более благоприятного течения заболевания и тем самым улучшить отдалённые результаты лечения. Резюмируя всё вышесказанное можно констатировать следующее.
1. У больных основной группы отмечены лучшие непосредственные результаты лечения, т.к. полная регрессия опухоли была на 20,5% больше, чем в контрольной группе, а прогрессирование опухолевого процесса на фоне специального лечения на 8% меньше.
2. В основной группе чаще наблюдали менее агрессивное течение РЯ. Так, рецидивирующий РЯ зарегистрирован у 15 (50%) пациенток, в то время как в контрольной - у 10 (29,4%) человек. Кроме того, период, свободный от прогрессирования опухолевого процесса, с рецидивирующим РЯ был длиннее и соответственно составил 19 и 15,6 месяца.
3. Одновременно отмечено и улучшение отдалённых результатов лечения. У пациенток, принимавших препарат Промисан, трёхлетняя выживаемость была 63,3% наблюдений, а у больных, его не принимавших, - 47,05% случаев.
Рецензенты:
Привалов А.В., д.м.н., профессор, заместитель главного врача по инновационным технологиям Челябинского онкологического клинического диспансера, г. Челябинск;
Читайте также:

