Молекулярные маркеры рака легкого

Цена:
Авторы работы:
Научный журнал:
Год выхода:
МОЛЕКУЛЯРНАЯ БИОЛОГИЯ, 2011, том 45, № 2, с. 203-217
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МАРКЕРЫ В ДИАГНОСТИКЕ
П. П. Лактионов2, В. В. Власов2
Научно-исследовательский институт онкологии Сибирского отделения Российской академии медицинских наук,
Институт химической биологии и фундаментальной медицины Сибирского отделения Российской академии наук,
Новосибирск, 630117 Поступила в редакцию 19.05.2010 г. Принята к печати 31.05.2010 г.
В обзоре рассмотрены современные подходы (генетические, эпигенетические, белковые, транскриптомные, протеомные, метаболомные, c участием микроРНК) к выявлению опухолевых маркеров рака легкого (РЛ) различной природы. Основное внимание уделяется, как наиболее перспективным, эпигенетическим маркерам, поскольку эпигенетическая модификация является одним из наиболее ранних событий опухолевой трансформации. Особое место в обзоре занимают сведения об онкомаркерах, циркулирующих в биологических средах организма. Эти маркеры могут быть использованы для малоинвазивной диагностики заболевания до его клинического проявления, для скрининга групп риска, мониторинга ремиссии опухоли после терапии, а также для уточнения диагноза при использовании клинико-инструментальных методов обследования. Обсуждается возможность разработки на основе внеклеточных ДНК, циркулирующих в крови, диагностических маркеров для раннего выявления РЛ, для предсказания эффективности противоопухолевых препаратов, а также для мониторинга состояния после специфического клинического лечения.
Ключевые слова: рак легкого, диагностика, онкомаркеры, циркулирующие ДНК.
MOLECULAR-GENETIC MARKERS IN LUNG CANCER DIAGNOSTICS, by A. A. Ponomaryova1, E. Y. Rykova2*, N. V. Cherdyntseva1, E. L. Choinzonov1, P. P. Laktionov2, V. V. Vlassov2 (1Cancer Research Institute, Siberian Division, Russian Academy of Medical Sciences, Tomsk, 634001 Russia; 2Institute of Chemical Biology and Fundamental Medicine, Siberian Division, Russian Academy of Sciences, Novosibirsk, 6330117 Russia; *е-mail: rykova@niboch.nsc.ru). The major approaches to different lung cancer marker development are outlined in the review, including genetic, epigenetic, protein, transcryptomic, proteomic, metabolic, and miRNA markers. As far as epigenet-ic changes are among the earliest events in malignant transformation, methylated markers are thoroughly discussed. Special attention is given to minimally invasive tumor markers, which could be detected in easily accessible biological fluids, because they can be useful for screening and early diagnostics of cancer (before its clinical manifestation) as well as for verification of standard methods of diagnostics. Extracellular nucleic acids, circulating in blood (cirNA), are highlighted as the potential source of material for the early lung cancer diagnostics, prediction of antitumor treatment efficiency, post-treatment monitoring and disease prognosis.
Keywords: lung cancer, diagnostics, tumor markers, circulating DNA.
Рак легкого (РЛ) — наиболее распространенная форма злокачественных новообразований (12.8% в структуре онкологической заболеваемости населения мира), занимающая первое место по общей летальности от онкологических заболеваний у мужчин (1.18 млн. в год) [1].
В России ежегодно вновь регистрируется свыше 63 тыс. больных раком легкого. Соотношение заболевших мужчин и женщин составляет 10 : 1.1, смертность у мужчин составляет 30.1%, у женщин — 6.7%
* Эл. почта: rykova@niboch.nsc.ru.
[2]. Реалии современного социума, связанные со старением населения, курением, загрязнением воздуха, вносят свой вклад в повышение заболеваемости РЛ [3]. Прогноз эффективности терапии РЛ в ближайшем будущем неутешителен. Высокая смертность связана преимущественно не с трудностью терапии, а с отсутствием эффективных подходов к выявлению этой опухоли на ранних стадиях. Обнаружение РЛ на поздних стадиях существенно понижает вероятность успешного лечения, в то время как при раннем его выявлении показатели выживаемости возрастают в несколько раз (рис. 1).
Рис. 1. Клинико-морфологические характеристики рака легкого и прогноз заболевания [4, 5]. НМРЛ — немелкокле-точный рак легкого; МРЛ — мелкоклеточный рак легкого; ПКРЛ — плоскоклеточный рак легкого; КРЛ — крупноклеточный рак легкого; АК — аденокарцинома.
В клиническую практику недавно внедрены новейшие чувствительные методы компьютерной, по-зитронно-эмиссионной томографии, аутофлуорес-центной бронхоскопии. Однако использование этих методов для диагностики РЛ не привело к снижению смертности [6] — из-за низкой эффективности именно ранней диагностики методами инструментального анализа. Используемые же в настоящее время патоморфологические критерии неэффективны как для диагностики ранних стадий, так и для дифференциальной диагностики доброкачественных и злокачественных процессов [3]. Необходимо искать и разрабатывать чувствительные и специфичные методы диагностики, которые бы были основаны на изучении молекулярных опухолевых маркеров, вовлеченных в формирование и прогрессию РЛ [7, 8].
Опухолевые маркеры — это такие биологические характеристики, которые могут сами влиять на клиническое течение и предсказывать исход онкологического заболевания, а также позволяют проследить ответ на терапевтическое вмешательство [9]. Этапы трансформации клеток в раковые и опухолевой прогрессии определяются накоплением в геноме изменений, возникающих в результате нарушения нормального его функционирования под действием наследуемых мутаций и канцерогенных факторов [10]. Трансформированные клетки обладают способностью выживать в организме за счет изменения сигнальных путей, которые потенциально онкоген-ны. Это: (1) независимые или автономные сигналы к росту; (2) нечувствительность к сигналам, ингиби-рующим рост; (3) невосприимчивость к сигналам апоптоза; (4) неограниченный потенциал к пролиферации; (5) способность поддерживать ангиогенез;
(6) способность к инвазии и метастазированию [11]. Молекулярные изменения, ответственные за приобретение указанных свойств, могут использоваться в качестве онкомаркеров.
Онкомаркеры по их природе и по методам выявления можно разделить на несколько типов: генетические (мутации, изменение копийности генов, экспрессии мРНК), эпигенетические (изменение профиля метилирования ДНК), протеомные (изменение уровня и профиля белковой экспрессии), метаболические (изменение уровня и спектра низкомолекулярных метаболитов), профиль синтеза и уровень микроРНК (миРНК) [11—16]. Ведутся поиски оптимальных онкомаркеров не только в опухолевых тканях, поскольку практически все типы ассоциированных со злокачественной трансформацией нарушений синтеза биополимеров обнаруживаются в биологических жидкостях организма. Это позволяет разрабатывать малоинвазивные методы диагностики рака, основанные на использовании легкодоступного биологического материала (кровь, мокрота, лаваж и др.) [7, 17—24].
БЕЛКОВЫЕ МАРКЕРЫ ПРИ РАКЕ ЛЕГКОГО
В табл. 1 приведены данные о белковых онкомар-керах, которые используются в клинической практике в качестве дополнительных критериев при диагностике и мониторинге РЛ [5].
Увеличение концентрации белковых онкомарке-ров в сыворотке крови и ткани опухоли детектируется при помощи специфичных иммунохимических и иммуногистохимических методов. Однако чувствительность используемых в настоящее время сероло-
Таблица 1. Характеристика белковых маркеров рака легкого (РЛ), использующихся в клинической практике
Ген Маркер Характер нарушений при РЛ Метод детекции
C-MYC, N-MYC** с-тус, ^тус (участие в процессах роста, дифференцировки и апоптоза клеток) Гиперэкспрессия Амплификация ИГХ
Ki-67** Ю-67 (контроль пролиферации клеток) Гиперэкспрессия То же
* Широко используются в клинической практике. ** Потенциальные онкомаркеры.
ИФА — иммуноферментный анализ; ИГХ — иммуногистохимический анализ.
гических маркеров РЛ невысока. Например, при не-мелкоклеточном раке легкого (НМРЛ) чувствительность первичной диагностики по маркерам CEA, NSE, CYFRA 21-1 составляет 55, 38 и 65%, а специфичность — 70, 97 и 87% соответственно. При мелкоклеточном раке легкого (МРЛ) чувствительность по тем же маркерам составляет 43, 49 и 36%, а специфичность 76, 95 и 96% соответственно [25—27]. Поэтому их использование для ранней диагностики РЛ ограничено и, в основном, они применяются для оценки эффективности лечения, мониторинга течения заболевания и для раннего выявления рецидива опухоли. Иммуногистохимический метод оценки белковых маркеров в ткани опухоли используют для уточнения диагноза и прогноза клинического тече-
ния. В табл. 1 представлены маркеры, эффективность которых в настоящее время интенсивно изучается [5].
В связи с низкой диагностической информативностью онкомаркеров актуальна проблема поиска более эффективных белковых маркеров на основе сове
Для дальнейшего прочтения статьи необходимо приобрести полный текст. Статьи высылаются в формате PDF на указанную при оплате почту. Время доставки составляет менее 10 минут. Стоимость одной статьи — 150 рублей.
- ЦИРКУЛИРУЮЩИЕ МИКРОРНК КРОВИ ПРИ РАКЕ ЛЕГКОГО: ПЕРСПЕКТИВЫ ИСПОЛЬЗОВАНИЯ ДЛЯ ДИАГНОСТИКИ, ПРОГНОЗА И ОЦЕНКИ ЭФФЕКТИВНОСТИ ТЕРАПИИ
ВЛАСОВ В.В., ЗАПОРОЖЧЕНКО И.А., ЛАКТИОНОВ П.П., МОРОЗКИН Е.С., ПОНОМАРЕВА А.А., РЫКОВА Е.Ю., ЧЕРДЫНЦЕВА Н.В. — 2015 г.
БЕРЕСТЕНЬ С.Ф., БУКУРОВА Ю.А., КАРПОВ В.Л., КРАСНОВ Г.С., ЛИСИЦЫН Н.А., НИКИТИНА И.Г. — 2013 г.
КИСЕЛЕВ ФЕДОР ЛЬВОВИЧ — 2014 г.
ВТОРУШИН С.В., ГЕРАЩЕНКО Т.С., ДЕНИСОВ Е.В., ЗАВЬЯЛОВА М.В., ЛИТВЯКОВ Н.В., ПЕРЕЛЬМУТЕР В.М., ЦЫГАНОВ М.М., ЧЕРДЫНЦЕВА Н.В. — 2013 г.
Комплексное лабораторное исследование, направленное на определение наличия злокачественного новообразования легких, степени его распространенности, оценки эффективности лечения и возможности развития рецидивов.
Рак легкого; злокачественные опухоли легкого; комплексное лабораторное обследование.
Синонимы английские
Lung cancer; comprehensive laboratory examination.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Детям в возрасте до 1 года не принимать пищу в течение 30-40 минут до исследования.
- Детям в возрасте от 1 до 5 лет не принимать пищу в течение 2-3 часов до исследования.
- Исключить из рациона жирную пищу в течение 24 часов до исследования.
- Не принимать пищу в течение 8 часов до исследования, можно пить чистую негазированную воду.
- Исключить физическое и эмоциональное перенапряжение в течение 30 минут до исследования.
- Не курить в течение 24 часов до исследования.
Общая информация об исследовании
К лабораторным маркерам рака легких относятся некоторые специфические вещества, определение которых позволяет предположить наличие злокачественного новообразования, степень его распространенности и оценить проводимое лечение. Это опухолевые маркеры, которые чаще всего являются сложными белками или пептидами, гликопротеинами. Они синтезируются опухолевыми клетками или окружающими опухоль нормальными клетками в повышенных концентрациях.
Раковый эмбриональный антиген (РЭА) является гликопротеином и относится к классу онкоэмбриональных маркеров. Преимущественно синтезируется в органах желудочно-кишечного тракта плода, а после рождения его уровень резко снижается. Он также обнаруживается в тканях органов пищеварения и у взрослых людей, но в значительно меньшем количестве. Определение уровня РЭА используется для диагностики ряда злокачественных опухолей. К ним относятся рак толстой и прямой кишки, поджелудочной железы, легкого, молочной железы. В большинстве случаев РЭА является показателем аденогенных опухолей, в частности аденокарциномы и крупноклеточного рака легкого. Его определение используется в составе комплексной диагностики для определения стадии заболевания, оценки эффективности лечения у больных с раком легкого с исходно повышенным уровнем РЭА, для мониторинга возможности развития рецидивов рака. Следует отметить, что концентрация РЭА увеличивается у 20-50 % больных с доброкачественными заболеваниями кишечника, поджелудочной железы, печени и легких, при пневмонии, бронхитах, туберкулезе, эмфиземе, муковисцидозе, а также при некоторых аутоиммунных заболеваниях. Показатель повышается при обострении болезни, но в случае улучшения самочувствия возвращается к норме. При злокачественном же процессе уровень РЭА неуклонно растет на протяжении всего периода заболевания.
Антиген плоскоклеточной карциномы (SCCA) является гликопротеином с молекулярной массой 48 кДа и маркером плоскоклеточного рака. В норме небольшое количество антигена вырабатывается внутри клеток эпителия кожи, шейки матки, анального канала и не высвобождается во внеклеточное пространство. При плоскоклеточном раке отмечается увеличение секреции антигена опухолевыми клетками, что, возможно, играет роль в процессах инвазии и метастазирования карциномы. Повышение концентрации антигена может отмечаться при плоскоклеточном раке шейки матки, пищевода, легкого, влагалища. У больных плоскоклеточным раком легкого чувствительность показателя составляет 50-60 %, а специфичность около 80 %. Определение данного маркера может быть использовано для оценки эффективности лечения у больных с раком легкого с исходно повышенным уровнем SCCA и для мониторинга больных плоскоклеточным раком для доклинического выявления рецидивов заболевания. Показатель может быть повышен при некоторых доброкачественных заболеваниях кожи, при туберкулезе.
Нейронспецифическая энолаза (НСЕ/NSE) – это одна из структурных разновидностей фермента энолазы, участвующего в процессах гликолиза. У плода он обнаруживается в клетках нервной и легочной ткани, у взрослых людей – преимущественно в нейроэндокринных образованиях. Повышение NSE часто наблюдается при мелкоклеточном раке легкого, а также при медуллярном раке щитовидной железы, феохромоцитоме, нейроэндокринных опухолях кишечника и поджелудочной железы и нейробластоме. Мелкоклеточный рак легкого (МКРЛ) по сути является анапластическим процессом и обладает нейроэндокринными свойствами. Например, для этого вида рака характерна секреция адренокортикотропного гормона (АКТГ), антидиуретического гормона (АДГ), а также нейронспецифической энолазы. Другие виды рака легкого объединяются под общим названием немелкоклеточный рак легкого (НМРЛ). Эта группа заболеваний, в отличие от МКРЛ, не обладает нейроэндокринными свойствами, и для нее не характерна продукция избыточного количества NSE. Данный маркер обладает высокими показателями чувствительности (44-87 % в зависимости от стадии заболевания) и специфичностью для мелкоклеточного рака легкого. Его определение рекомендуется для дифференциальной диагностики опухолей легкого и для оценки эффективности лечения. Данный лабораторный показатель оказывается особенно полезным, когда рутинные методы диагностики не могут быть выполнены из-за тяжести заболевания или сопутствующей патологии.
Раковый антиген СА 19-9 является высокомолекулярным гликопротеином, который в норме вырабатывается клетками эпителия желудочно-кишечного тракта. Его уровень повышается практически у всех пациентов с опухолями желудочно-кишечного тракта и особенно поджелудочной железы.
Раковый антиген СА 72-4 – это высокомолекулярный муциноподобный гликопротеин, который вырабатывается во многих тканях плода и в норме практически не обнаруживается у взрослого человека. Производство СА 72-4 увеличивается практически у всех пациентов со злокачественными опухолями железистого генеза, особенно при раке желудка, муцинозном раке яичников. Уровень представленных маркеров может быть повышен при опухолях иной локализации: колоректальном раке, раке легких, а также заболеваниях печени (гепатитах и циррозе), доброкачественных опухолях яичников, воспалительных заболеваниях желудочно-кишечного тракта. Они являются неспецифичными показателями и могут использоваться в качестве дополнительных маркеров злокачественных процессов в комплексной диагностике рака легких.
Для чего используется исследование?
- Для комплексной диагностики рака легкого;
- для дифференциальной диагностики форм рака легкого: плоскоклеточная карцинома, мелкоклеточный, немелкоклеточный рак легкого;
- для оценки стадии онкологического процесса;
- для оценки эффективности лечения (оперативного и консервативной терапии) у больных с раком легкого;
- для мониторинга возможности развития рецидивов рака легкого в процессе длительного наблюдения после завершения лечения.
Когда назначается исследование?
- При подозрении на злокачественное новообразование легких или иных локализаций и мониторинге состояния в процессе диагностированного заболевания.
Что означают результаты?
Отдельно для каждого показателя, входящего в комплекс:
- рак легкого;
- рак другой локализации: рак толстой и прямой кишки, поджелудочной железы, молочной железы, рак шейки матки, влагалища, пищевода, нейробластома, феохромацитома;
- заболевания легких: пневмония, бронхит, туберкулез, эмфизем, муковисцидоз;
- заболевания печени: гепатит, цирроз, печеночная недостаточность;
- хроническая почечная недостаточность;
- панкреатит;
- аутоиммунные заболевания.
- хирургическое удаление злокачественной опухоли;
- успешная терапия онкологического заболевания;
- ремиссия доброкачественной опухоли.
Что может влиять на результат?
- Пол;
- возраст;
- наличие сопутствующей патологии;
- терапевтическое и хирургическое лечение.
- Отрицательный результат анализа не исключает наличия онкологического заболевания легких.
- Диагностика рака легкого является комплексной и основана на клинических проявлениях заболевания, результатах лабораторных и инструментальных исследований.
Кто назначает исследование?
Онколог, пульмонолог, терапевт, врач общей практики, хирург.
Онкомаркерами называют вещества, которые вырабатываются раковыми опухолями и выделяются ними в биологические среды человеческого организма, в которых они могут быть обнаружены с помощью лабораторных методов диагностики. Выявление онкологических маркеров в биологическом материале пациента в настоящее время является одним из критериев постановки диагноза онкопатологии.
Виды онкомаркеров
Раковые клетки возникают в процессе нарушения деления или дифференциации (специализации) здоровых клеток человеческого организма. Этот процесс называют атипизмом, а раковые клетки – атипичными. От здоровых клеток организма они отличаются структурой и метаболизмом.
В результате метаболических изменений на поверхности раковой клетки и внутри нее образуется множество соединений, нехарактерных для здоровых клеток, а также веществ, которые синтезируются у человека в норме, но в гораздо меньших количествах.
Но не каждое вещество, вырабатываемое атипичными клетками, может играть роль онкомаркера.
«,Идеальным», онкомаркером считаются только те соединения, которые:
- обладают 100%-ной специфичностью, то есть выявляются только при онкопатологиях,
- имеют 100%-ную клиническую чувствительность, то есть определяются уже на ранних стадиях рака,
- являются признаком гетерогенности опухоли, то есть признаком одновременного присутствия в опухоли клеток различной степени зрелости и морфологии,
- быстро распадаются, чтобы по ним можно было определять эффективность консервативной терапии.
Кроме этого, количество онкомаркера в биологической жидкости должно соответствовать размеру опухоли и стадии заболевания, чтобы была возможность по его концентрации в биоматериале судить о вероятном прогнозе. Чаще всего онкологические маркеры лабораторно определяют в крови пациента, реже – в экссудате, биоптате, моче.
Онкологическими маркерами наличия карциномы могут быть:
![]()
антигены раковых клеток и антитела к ним,- гормоны,
- ферменты,
- продукты обмена – креатинин, гидроксипролин, полиамины,
- белки плазмы – церулоплазмин, бета-2-микроглобулин, ферритин, цитокины,
- продукты распада клеток и другие соединения.
На сегодняшний день нет ни одного «,идеального», маркера, но в клинической практике свое значение все же нашли около двух десятков соединений, которые обладают достаточной диагностической или прогностической значимостью.
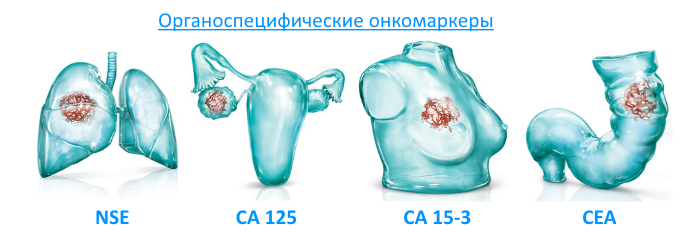
Определение онкомаркеров при раке легких
Показаниями к назначению исследования онкологических маркеров при подозрении или наличии карциномы легких у пациента являются:
- Проведение дифференциальной диагностики опухолей, например, доброкачественных от злокачественных.
- Обнаружение локализации первичной опухоли при наличии отдаленных метастазов.
- Установление стадии процесса.
![]()
Определение степени дифференцирования карциномы.- Оценка эффективности проводимого лечения (консервативного или оперативного): снижение концентрации маркера после терапии или операции свидетельствует об успешности лечения, снижение концентрации показателя после предыдущего его повышения указывает на эффективность второй линии лечения, длительное нахождение концентрации маркера на низком уровне указывает на период ремиссии, повышение уровня онкомаркера после его снижения свидетельствует о рецидиве патологии, отсутствие нарастания уровня показателя после проведенного лечения говорит о частичном успехе лечения, устойчивое нахождение концентрации онкомаркера на стабильно высоком уровне на фоне проводимого лечения указывает на резистентность опухоли и неблагоприятный прогноз.
- Определение прогноза.
В зависимости от морфологического строения, клинического течения и чувствительности к лучевой и химиотерапии рак легких разделяют на гистологические типы:
- Мелкоклеточный (мелкоклеточная карцинома).
- Немелкоклеточный: аденокарциному, плоскоклеточную карциному, крупноклеточный рак.
- Смешанный гистологический тип.
Основными независимыми показателями для определения гистологического типа рака легких являются:
- при мелкоклеточном раке – NSE, ProGRP,
- при аденокарциноме и крупноклеточном раке – CYFRA 21.1, CEA,
- при плоскоклеточной карциноме – SCCA, CYFRA 21.1, CEA,
- при неустановленном гистологическом типе – РЭА, CYFRA 21.1, NSE, ProGRP.
Определение уровней этих показателей онкологии проводится с помощью иммуноферментного анализа крови на рак легких. Рассмотрим такие онкомаркеры:
-
Онкомаркер NSE. Концентрация онкомаркера NSE в сыворотке крови свыше 100 мкг/л с большой долей вероятности указывает на наличие мелкоклеточной карциномы легких, поэтому этот маркер используют для его обнаружения, дифференциальной диагностики с другими видами рака (немелкоклеточным раком легких, нейроэндокринными опухолями, раком печени, лимфомами, семиномами) и контроля эффективности проводимого лечения.
Показатель ProGRP. ProGRP является специфичным маркером мелкоклеточной карциномы. Благодаря тому, что он обладает высокой чувствительностью, его часто используют для постановки диагноза рака легких на ранних стадиях. Высокая вероятность рака легких определяется при уровне ProGRP свыше 200 нг/л, а его повышение до 300 нг/л и выше указывает на высокую вероятность мелкоклеточной карциномы.
Однозначным диагностическим критерием мелкоклеточного рака является концентрация этого маркера более 500 нг/л.
Маркеры CYFRA 21.1 и SCCA. Для проведения дифференциальной диагностики новообразований в легких используют онкомаркер CYFRA 21.1.
Этот маркер рака легких является высокочувствительным при немелкоклеточных типах онкопатологии. SCCA менее чувствителен, чем CYFRA 21.1, но при плоскоклеточном раке его диагностическая значимость намного выше: при его уровне свыше 2 мкг/л с вероятностью 95% указывает на наличие именно этого типа рака.
К дополнительным онкомаркерам легких при подозрении на рак относятся:
- СА125.
- ТРА.
- ТРS.
- TU-M2 PK.
Эти показатели не являются независимыми маркерами рака легких, однако в комбинации с основными они повышают чувствительность онкодиагностики.
Для постановки диагноза злокачественного новообразования в легких применяют рентгенологические и эндоскопические методы, биопсию с гистологией и цитологией. Онкомаркеры рака легких в современной онкологии также являются неотъемлемой диагностической процедурой.
Кроме того, практикующие онкологи часто применяют анализ онкомаркеров легких для оценки эффективности проводимой консервативной терапии или оперативного лечения, а также для контроля ремиссии.
Биология XX века расшифровала молекулярные основы жизни.
Со всей очевидностью продемонстрировано, что любой живой организм состоит из многообразных раздельных форм.
Тем самым удалось существенно приблизиться к практическому решению ряда принципиальных вопросов, которые связаны с диагностикой и лечением онкологических заболеваний.
Показательно, что ранее присуждения Нобелевской премии Кери Мюллису за открытие в 1983 году полимеразной цепной реакции (ПЦР), ученый был награжден премией Международной федерации клинической химии и лабораторной медицины. Действительно, как убеждают теоретические расчеты, использование метода ПЦР позволяет обнаружить наличие у пациента опухолевого очага размером от 0,01 мм3.
Применение молекулярно-биологических технологий диагностики в практической онкологии подчинено решению следующих вопросов:
• диагностика наследственных форм рака;
• определение молекулярных маркеров ранних (доклинических) стадий развития опухоли;
• диагностика молекулярных маркеров неблагоприятной динамики заболевания;
• поиск опухолевых маркеров рецидива опухоли, а также выявление микрометастазов;
• определение полиморфных молекулярных маркеров, ассоциирующихся с повышенным риском развития того или иного типа опухоли. Фундаментальные исследования молекулярных основ канцерогенеза выявили ключевую роль в нем повреждения дезоксирибонуклеиновой кислоты (ДНК).
Определены и наиболее значимые в данном случае эффекты:
• хромосомные перестройки и мутации генов;
• онкогенное влияние ряда вирусов, способных взаимодействовать с геном клеток и встраиваться в молекулу ДНК.
Можно считать доказанным, что делеции определенных участков хромосом обуславливают заболевания различными типами рака (Табл.1).
Таблица 1. Хромосомные мутации при основных злокачественных новообразованиях.

Не менее ясно, что мутации таких генов, как BRCA1, BRCA2, TP53, CHEK2, ATM, PIK3CA, ING4 вовлечены в процесс канцерогенеза при раке молочной железы; HRAS1, CDKN2A, p14ARF/p15 — при раке мочевого пузыря; RNASEL, ELAC2, MSR1, RTEN, KLF6, FEZ1 — при раке предстательной железы; VHL, TP53, CDKN2A — при раке почки.
К настоящему времени изучено большое количество онкогенов или доминантных раковых генов, активация которых вызывает злокачественную трансформацию клетки. Таким образом, в организме инициируется процесс формирования ее опухолевого клона.
Пристальное внимание уделяют классу антионкогенов или генам-супрессорам, продукты, которых угнетают митотическую активность клеток.
Наиболее мощным и универсальным в данном случае является ген p53, который в геноме человека размещен на коротком плече хромосомы 17 (локус 17p13.1). Соответствующий ген кодирует биосинтез ядерного фосфопротеида, включающего 393 аминокислотных остатков. Указанное соединение выполняет регуляторную роль в цикле клеточного деления. Продукт гена p53 также отвечает за процесс апоптического самоустранения клеток, которые получили критические повреждения ДНК.
Дезорганизация нормального функционирования гена p53 сопряжена с утратой контроля над клеточным циклом. В результате этого клетки, несмотря на имеющиеся повреждения молекулы ДНК, продолжают активно пролиферировать, что приводит к развитию опухоли.
Установлено наличие тесной взаимосвязи между инактивацией гена p53 и возникновением свыше 50 видов различных злокачественных новообразований (рак легкого, молочной железы, шейки матки, яичников и др.).
Ген RB1, который также входит в класс генов-супрессоров опухолевого роста, оказался первым геном, на примере которого Кнудсон еще в 1971 году сформулировал двухударную теорию канцерогенеза.
Первое из них — мутация, приводящая к образованию клетки, для которой повышен риск злокачественной трансформации. Подробные мутации могут возникать как в соматических, так и в половых (герминальных) клетках. При обнаружении носительства герминальной мутации в гене RB1 у плода, риск развития ретинобластомы составляет 90%.
Структурные изменения, затрагивающие ген RB1, и/или потеря гетерозиготности в области 13q14 были обнаружены в таких опухолях, как мелкоклеточный рак легкого (15%), опухоли яичников, молочной железы (25%), что подчеркивает роль RB1 в регуляции нормального функционирования различных тканей.
Наличие тесной взаимосвязи отдельных генов в регуляции процессов пролиферации, дифференцировки и апоптоза клетки, позволяет считать вероятным их комплексное повреждение при канцерогенезе.
В связи с этим неизменно актуальные поиски причинно-следственной связи инактивации соответствующих генов с процессом опухолевой трансформации.
Изучение механизмов возникновения и прогрессирования опухоли позволило охарактеризовать значение не только структурных изменений генов, но и эпигенетических (функциональных) факторов их регуляции (изменения, не влияющие на нуклеотидную последовательность ДНК, но сопряженные с нарушением экспрессии гена).
В результате дисбаланса метилирования наступает блокировка синтеза белковых продуктов, которые необходимы для физиологической регуляции клеточного цикла, процессов дифференцировки и апоптоза. Все это приводит к опухолевой трансформации клетки.
Аномальное метилирование как механизм, приводящий к инактивации генов-супрессоров опухолевого роста, впервые был описан для гена RB1 (Sakai et al., 1991).
Для ДНК-диагностики сейчас используют разнообразные методы скрининга мутаций. Наиболее доступна идентификация мутаций, изменяющих длину амплифицированных фрагментов, которые затем выявляют при электрофоретическом анализе.
Протяженные делеции могут быть выявлены с помощью анализа полиморфизма длин рестрикционных фрагментов (ПДРФ) или с использованием дозового блотгибридизационного анализа.
С целью поиска точковых мутаций, небольших делеций и инсерций в исследуемых генах используют множество различных подходов, основанных на методе полимеразной цепной реакции. Продукты амплификации являются объектами дальнейшего поиска мутаций с помощью ряда методов, позволяющих выявлять различные структурные изменения.
Метод метилчувствительной полимеразной цепной реакции
Для определения метилирования уже известных последовательностей ДНК применяют метод метилчувствительной ПЦР (МЧ-ПЦР).
Метилспецифическая полимеразная цепная реакция (МС-ПЦР) — метод, позволяющий оценивать состояние метилирования индивидуальных CpG-островков независимо от расположения сайтов узнавания метилчувствительных рестриктаз и особенностей метилирования аллей различного родительского происхождения.
Необходимым условием проведения исследований в области функциональной геномики и протеомики является наличие технологий и специализированного оборудования для высокопроизводительного анализа многокомпонентных биологических микрочипов (биочипов). Разработка биочиповой технологии стала возможной благодаря достижениям в области промышленного производства миниатюрных устройств, несущих многие десятки тысяч функциональных элементов на поверхностях ограниченной площади.
Идея использовать для гибридизационного анализа ДНК плоские стеклянные слайды-пластины (ДНК-биочипы) с иммобилизованными на них синтетическими олигонуклеотидами возникла в конце 1980-х — начале 1990-х годов в связи с необходимостью проведения структурного анализа протяженных фрагментов геномной ДНК.
Биочип, как правило, представляет собой слайд-пластинку площадью от 0,1 до 10 см3 с фиксированными на поверхности в виде индивидуальных микроточек (диаметр от 10 до 500 мкм) образцами биологически активных веществ.
Современные технологии микропечати позволяют наносить на биочип десятки тысяч индивидуальных образцов нуклеиновых кислот, белков, пептидов, полисахаридов, культур клеток, микроорганизмов и т.д. При этом необходимые количества индивидуальных препаратов составляют подчас лишь триллионные и миллиардные доли грамма (пико- и нанограммы).
Практически любые органические субстанции после несложной предварительной обработки могут быть подвергнуты анализу с помощью биочипа. Для этого экстрагированные из препаратов и химически модифицированные нуклеиновые кислоты (ДНК и рибонуклеиновая кислота (РНК)) или белки должны быть перенесены на поверхность микрочипа, с тем, чтобы осуществить регистрацию процессов межмолекулярных взаимодействий на поверхности биочипа за счет использования флуоресцентных, хемилюминесцентных или масс-спектрометрических методов.
С известной условностью можно выделить три основных типа ДНК-биочипов используемых в качестве диагностического инструмента:
• биочипы для сравнительного гибридизационного генетического анализа;
• биочипы для исследования уровней экспрессии генов;
• биочип для выявления мутаций и участков (сайтов) полиморфизма.
В настоящее время накоплен огромный объем информации, характеризующие профили экспрессии генов в клетках нормальных тканей, опухолевых клеточных линиях и трансформированных клетках из опухолевых тканей. Полученные данные включают в специализированные базы данных, которые содержат программные средства, помогающие правильно интерпретировать результаты сравнительных анализов профилей экспрессии в контексте известных биохимических схем.
Если принимать во внимание только максимально перспективные исследования, уже сейчас не трудно выделить шесть научно-прикладных направлений молекулярной диагностики в онкологии:
• идентификация маркеров, которые характерны для пусковых стадий опухолевого роста;
• обнаружение генетических нарушений, сигнализирующих о реальности неблагоприятного прогноза развития заболевания и высокой инвазивности опухоли (выраженность ее метастатического потенциала, невосприимчивость к рационально назначаемой терапии, короткая продолжительность достигаемых периодов ремиссии, значительное ухудшение качества жизни пациента);
• диагностика наличия микрометастазов;
• тестирование наследственных форм опухоли;
• поиск маркеров (полиморфных форм ДНК), определяющих эффективность химиотерапии и назначения таргетных препаратов (таргетная терапия основана на коррекции молекулярных дефектов, которые возникают в геноме клетки при опухолевой трансформации);
• анализ ДНК-полиморфизмов, повышающих риск развития конкретного типа опухоли в группах риска.
Необходимым итогом молекулярно-генетических исследований онкологии должно стать создание комплексной диагностической системы, которая будет эффективно интегрировать новейшие достижения молекулярной генетики, фундаментальной и прикладной биохимии, а также клинической онкологии.
Читайте также:



