Множественная миелома и злокачественные плазмоклеточные новообразования
Медицинский эксперт статьи

Множественная миелома (миеломатоз; плазмоклеточная миелома) является плазмоклеточной опухолью, которая продуцирует моноклональный иммуноглобулин, который внедряется и разрушает близлежащие кости.
Наиболее частыми проявлениями болезни являются боль в костях, почечная недостаточность, гиперкальциемия, анемия, рецидивирующие инфекции. Для диагностики необходимо наличие М-протеина (часто имеется в моче и отсутствует в сыворотке), деструктивных изменений в костях, определения легких цепей в моче, повышенного содержания плазматических клеток в костном мозге. Обычно требуется биопсия костного мозга. Специфическая терапия включает стандартную химиотерапию (обычно с алкилирующими препаратами, глюкокортикоидами, антрациклинами, талидомидом) и высокодозный мелфалан с аутологичной трансплантацией стволовых клеток периферической крови.
Заболеваемость множественной миеломой составляет от 2 до 4 на 100 000 населения. Соотношение мужчин и женщин составляет 6:1, большинство больных старше 40 лет. Заболеваемость чернокожих в 2 раза больше, чем белых. Этиология неизвестна, хотя определенную роль играют хромосомные и генетические факторы, облучение, химические соединения.

[1], [2], [3], [4], [5], [6]
Код по МКБ-10
Патофизиология множественнной миеломы
Плазмоклеточные опухоли (плазмоцитомы) продуцируют IgG примерно у 55 % и IgA примерно у 20 % больных множественной миеломой. У 40 % этих больных обнаруживается протеинурия Бенс-Джонса, которая представляет собой наличие свободных моноклональных к или X легких цепей в моче. У 15-20 % больных плазматические клетки секретируют только протеин Бенс-Джонса. Эти больные имеют более высокую частоту остеодеструкции, гиперкальциемии, почечной недостаточности и амилоидоза, по сравнению с другими больными, имеющими миелому. Миелома IgD встречается примерно в 1 % случаев.
Диффузный остеопороз или локальные деструкции костной ткани развиваются чаще в тазовых костях, позвоночнике, ребрах и черепе. Повреждения вызваны замещением костной ткани распространяющейся плазмоцитомой или активацией остеокластов цитокинами, которые секретируются злокачественными плазматическими клетками. Как правило, остеолитические повреждения носят множественный характер, но иногда обнаруживаются солитарные внутрикостные опухоли. Внекостные плазмоцитомы встречаются редко, но могут обнаруживаться в любых тканях, особенно тканях верхних дыхательных путей.
Обычно имеется гиперкальциемия и анемия. Часто встречается почечная недостаточность (миеломная почка), которая обусловлена заполнением почечных канальцев белковыми массами, атрофией эпителиальных клеток канальцев и развитием интерстициального фиброза.
Повышенная чувствительность к бактериальным инфекциям обусловлена снижением продукции нормального иммуноглобулина и других факторов. Вторичный амилоидоз встречается у 10 % больных с миеломой, наиболее часто у пациентов, имеющих протеинурию Бенс-Джонса.
Симптомы множественнной миеломы
Упорные боли в костях (особенно в позвоночнике и грудной клетке), почечная недостаточность, рецидивирующие бактериальные инфекции являются наиболее типичными проявлениями множественной миеломы. Часто встречаются патологические переломы. Деструкции тел позвонков могут приводить к компрессии спинного мозга и параплегии. Преобладающим симптомом часто является анемия, которая может служить единственной причиной для обследования больного, часть больных имеют проявления синдрома гипервязкости (см. ниже). Часто встречаются периферическая нейропатия, кистевой туннельный синдром, аномальная кровоточивость, симптомы гиперкальциемии (например, полиурия, полидипсия). Лимфаденопатия и гепатоспленомегалия нетипичны для больных с множественной миеломой.
Диагностика множественнной миеломы
Множественная миелома подозревается у больных старше 40 лет с наличием необъяснимых болей в костях (особенно ночью или во время отдыха), других типичных симптомов или наличием лабораторных отклонений, таких как повышенный уровень белка в крови и моче, гиперкальциемия, почечная недостаточность или анемия. Обследование состоит из определения стандартных показателей крови, электрофореза белков, рентгенологического обследования и исследования костного мозга.
Варианты проявлений множественной миеломы
Плазмоцитомы обнаруживаются вне костного мозга
Солитарная костная плазмоцитома
Единичный костный очаг плазмоцитомы, который обычно продуцирует М-протеин
Остеосклеротическая миелома (POEMS синдром)
Полинейропатия (хроническая воспалительная полинейропатия), органомегалия (гепатомегалия, спленомегалия, лимфаденопатия), эндокринопатия (например, гинекомастия, атрофия яичек), М-протеин, изменения кожи (например, гиперпигментация, повышенный рост волос)
Отсутствие М-протеина в сыворотке и моче, наличие М-протеина в плазматических клетках
Стандартные показатели крови включают общий анализ крови, СОЭ и биохимический анализ крови. Анемия имеется у 80 % больных, обычно нормоцитарно-нормохромная с формированием множества агглютинатов, включающих обычно от 3 до 12 эритроцитов.
Количество лейкоцитов и тромбоцитов обычно нормальное. Часто имеется повышение уровня мочевины, сывороточно креатинина и мочевой кислоты, СОЭ может превышать 100 мм/ч. Анионный интервал иногда низкий. Гиперкальциемия присутствует на момент постановки диагноза у 10 % больных.
Производится электрофорез белков сыворотки и в случае отсутствия определенного результата осуществляется электрофорез белков 24-часового концентрата мочи. У 80-90 % больных при электрофорезе белков сыворотки определяется М-протеин. У оставшихся 10-20 % больных обычно определяются свободные моноклональные легкие цепи (белок Бенс-Джонса) или IgD. У этих больных почти всегда определяется М-протеин при электрофорезе белков мочи. Электрофорез с иммунофиксацией идентифицирует класс иммуноглобулина М-протеина и часто определяет белок легкой цепи, если иммуноэлектрофорез белков сыворотки был ложноотрицательным. Электрофорез с иммунофиксацией рекомендуется выполнять в случаях, если электрофорез белков сыворотки был негативным при наличии веских оснований для подозрения на миелому.
Рентгенографическое обследование включает обзорные снимки костей скелета. В 80 % случаев имеется диффузный остеопороз или литические изменения костей округлой формы. Радионуклидное сканирование костей обычно не информативно. МРТ может обеспечить более детальную картину и рекомендуется при наличии болей и неврологических симптомов и отсутствии данных на обычной рентгенографии.
Выполняется также аспирация и биопсия костного мозга, при которых выявляются диффузное распределение или скопления плазматических клеток, что свидетельствует о наличии костномозговой опухоли. Поражение костного мозга обычно неравномерное и чаще определяется повышенное количество плазматических клеток с разной степенью созревания. Иногда количество плазматических клеток бывает нормальным. Морфология плазматических клеток не зависит от класса синтезируемого иммуноглобулина.
У больного, имеющего М-протеин в сыворотке крови, есть основания предполагать наличие миеломы при уровне протеинурии Бенс-Джонса больше 300 мг/24 ч, остеолитических повреждениях (без признаков метастатического рака или гранулематозного заболевания) и наличии повышенного содержания плазматических клеток в костном мозге.

[7], [8], [9], [10], [11], [12], [13], [14], [15]
К кому обратиться?
Лечение множественнной миеломы
Больные нуждаются в серьезном поддерживающем лечении. Амбулаторная поддерживающая терапия помогает сохранить плотность костной ткани. Анальгетики и паллиативные дозы лучевой терапии (18-24 Гр) могут облегчить боль в костях. Однако лучевая терапия может препятствовать проведению курсовой химиотерапии. Все больные должны также получать бифосфонаты, которые уменьшают риск развития осложнений со стороны скелета, облегчают боль в костях и обладают антиопухолевой активностью.
Адекватная гидратация является профилактикой повреждения почек. Даже больные с длительной, массивной протеинурией Бенс-Джонса (10-30 г/сутки) могут сохранить функцию почек, если они поддерживают диурез более 2000 мл/ сутки. У больных с протеинурией Бенс-Джонса дегидратация, сопровождающая введение высокоосмолярного внутривенного контраста, может вызвать острую почечную недостаточность.
Для лечения гиперкальциемии используются обильная гидратация и бифосфонаты, иногда совместно с преднизолоном 60-80 мг внутрь в сутки. Хотя большинство больных не нуждаются в приеме аллопуринола, прием 300 мг в сутки показан при наличии почечной недостаточности или симптомов гиперурикемии.
Показано проведение профилактической вакцинации против пневмококковой инфекции и гриппа. Назначение антибиотиков производится при документированной бактериальной инфекции и не рекомендуется рутинное профилактическое назначение антибиотиков. Профилактическое введение внутривенного иммуноглобулина может снизить риск инфекционных осложнений, обычно назначается больным с частыми рецидивирующими инфекциями.
Рекомбинантный эритропоэтин (40 000 ЕД подкожно 3 раза в неделю) применяют у больных с анемией, не корригируемой химиотерапией. Если анемия приводит к нарушениям со стороны сердечно-сосудистой системы, используют трансфузии эритроцитной массы. При развитии синдрома гипервязкости проводится плазмаферез. Проведение химиотерапии показано для уменьшения сывороточного или мочевого М-протеина. Постцитостатическая нейтропения может способствовать развитию инфекционных осложнений.
Стандартная химиотерапия обычно состоит из курсов перорального мелфалана [0,15мг/(кг х сут) внутрь] и преднизолона (20 мг 3 раза в день) каждые 6 недель с оценкой ответа через 3-6 месяцев. Полихимиотерапия может проводиться с применением различных режимов с внутривенным введением препаратов. Эти режимы не улучшают долговременную выживаемость по сравнению с комбинацией мелфалана и преднизолона, но могут обеспечивать более быстрый ответ у больных с дисфункцией почек. Проведение аутологичной трансплантации гемопоэтических стволовых клеток показано больным моложе 70 лет с адекватной функцией сердца, печени, легких и почек со стабильным течением болезни или хорошим ответом после нескольких курсов стандартной химиотерапии. Этим больным проводится начальная химиотерапия винкристином, доксорубицином и дексаметазоном или дексаметазоном с талидомидом. При необходимости назначения миелоидного ростового фактора препараты, угнетающие функцию костного мозга, алкилирующие агенты и препараты нитрозомочевины не назначаются. Проведение аллогенной трансплантации с немиелоаблативными режимами кондиционирования (например, низкие дозы циклофосфомида и флударабина или лучевой терапии) у некоторых больных может улучшать выживаемость без признаков заболевания до 5-10 лет вследствие снижения токсичности и наличия иммунного аллогенного антимиеломного эффекта. Этот метод показан больным моложе 55 лет с хорошим физиологическим резервом. При рецидиве или рефрактерной миеломе применяются новые препараты (талидомид, иммуномодуляторные препараты, ингибиторы протеасом), эффективность этих препаратов в качестве терапии 1-й линии изучается.
Поддерживающая терапия проводится нехимиотерапевтическими препаратами, включая интерферон, которые обеспечивают продолжительный эффект, но имеют некоторые побочные действия. Применение глюкокортикоидов в качестве поддерживающей терапии изучается.
Множественная миелома — это злокачественная опухоль лимфоидной природы, для которой характерна триада признаков:
- Колонизация костного мозга опухолевыми плазматическими клетками.
- Возникновение очагов расплавления костной ткани (деструкция кости).
- Обнаружение в крови и/или моче специфического белка — моноклонального глобулина.
Основу миеломы составляют плазматические клетки (дифференцированные В-лимфоциты, плазмоциты). Они секретируют особый белок — моноклональный иммуноглобулин, он же М-белок, М-компонент, М-протеин, который негативно влияет на организм, приводя к развитию тяжелых симптомов. Кроме того, колонизация плазмоцитами костного мозга приводит к нарушению кроветворения и очаговому расплавлению костной ткани.
- Симптомы множественной миеломы
- Виды множественной миеломы
- Стадии и прогноз при множественной миеломе
- Причины множественной миеломы
- Диагностика множественной миеломы
- Как лечится множественная миелома
- Диета и питание при миеломе
Симптомы множественной миеломы
В начальных стадиях множественная миелома протекает бессимптомно. По мере увеличения количества опухолевых клеток, заболевание прогрессирует и могут развиваться следующие симптомы:

Виды множественной миеломы
Существует несколько классификаций миеломной болезни. По степени распространенности опухолевых поражений выделяют:
- Диффузная форма множественной миеломы. Происходит инфильтрация костного мозга без костных разрушений (остеодеструкции).
- Диффузно-очаговая форма миеломы. Помимо инфильтрации костного мозга имеются очаги деструкции костей.
- Множественно-очаговая форма миеломы. Есть очаги остеодеструкции, но нет диффузного поражения костного мозга. В этом случае при исследовании пунктата возможно получение нормальной миелограммы.
- Редкие формы миеломы — склеротическая, висцеральная и др.
Также множественная миелома классифицируется на основе иммунохимического типа опухоли. Основным фактором здесь является вид патологического иммуноглобулина, определяемого в крови и моче. Выделяют G, A, D, E, M-миелому, миелому Бенс-джонса, биклональную и несекретирующую.
Стадии и прогноз при множественной миеломе
Стадирование множественной миеломы определяется на основании 4-х параметров: количество М-компонента, уровень гемоглобина, уровень кальция, степень поражения костей. Стадии:
- 1 стадия миеломы – легкая анемия (гемоглобин более 100 г/л), кальций в норме, низкий М-белок, менее 5 очагов поражения костей. Средняя продолжительность жизни таких пациентов составляет 6,5 лет.
- 2 стадия миеломы – анемия средней степени тяжести, кальций повышен до 3 ммоль/л, количество очагов остеолизиса не превышает 20, уровень М-компонента: 35 IgG
Причины множественной миеломы
Причиной развития миеломной болезни являются мутации в клетках-предшественницах В-лимфоцитов. Что приводит к этим мутациям, до конца неизвестно. Но выделяют несколько факторов риска, при наличии которых вероятность развития заболевания превышает общепопуляционную:
- Возраст старше 40 лет.
- Мужской пол.
- Принадлежность к негроидной расе.
- Наличие моноклональной гаммапатии — у каждого сотого такого пациента развивается миелома.
- Вторичные иммунодефициты — ВИЧ, прием иммуносупрессивной терапии.
- Наличие миеломы среди близких кровных родственников.
- Наличие в анамнезе радиационного воздействия, в том числе лучевой терапии.
Диагностика множественной миеломы
Диагностика миеломы предполагает оценку жалоб пациента и проведение инструментальных методов диагностики:
- Лабораторные исследования — помимо рутинных анализов выполняется биопсия костного мозга и/или опухолевой ткани, определение β2-микроглобулина и др.
- Рентген костей или компьютерная томография костей для поиска очагов остеодеструкции.
- Иммунофенотипирование и цитогенетическое исследование опухолевых клеток для определения прогноза и составления плана лечения.
Диагноз множественной миеломы выставляется на основании следующих критериев:
- Уровень плазмоцитов в костном мозге или опухолевом биоптате превышает 10%.
- В крови и моче определяется М-белок (кроме несекретирующей формы множественной миеломы).
- Присутствуют признаки поражения внутренних органов миеломными клетками — гиперкальциемия, анемия, поражение костей, почечная недостаточность.
Как лечится множественная миелома
Множественная миелома сегодня считается неизлечимым заболеванием. Усилия медицины направлены на то, чтобы сдержать рост опухоли, продлить и улучшить качество жизни таких больных.
Выделяют следующие виды лечения миеломы:
- Стандартная химиотерапия. Назначается пациентам, которым противопоказана высокодозная полихимиотерапия. Средняя продолжительность жизни после нее 29 месяцев. В стандартную схему первой линии входит мелфалан и преднизолон. Более эффективные схемы включают талидомид, леналидомид или бортезомиб (относительно новые противоопухолевые препараты).
- Высокодозная полихимиотерапия (ВПХТ) с последующей пересадкой кроветворных стволовых клеток ТГСК (как аутологичных, так и донорских). Данное лечение позволяет достичь полной ремиссии у большинства пациентов (до 75%), но к сожалению, в течение 2-5 лет отмечается прогрессирование заболевания. Более эффективным является проведение двойного курса ВПХТ с ТГСК (тандемная ВПХТ). Она позволяет добиться пятилетней безрецидивной выживаемости у 90% пациентов. Но такое тяжелое лечение могут перенести не все пациенты, поэтому показания к нему ограничены.
- Поддерживающая терапия. Даже ВПХ не может предотвратить развитие рецидива, назначается лечение, которое призвано подавлять клон злокачественных клеток. С этой целью используются интерфероны. Они помогают продлить медиану безрецидивной выживаемости до 42 месяцев.
- Борьба с осложнениями. Лечение боли — назначение сильных аналгезирующих препаратов, лучевая терапия. Хирургические операции проводятся при компрессионных переломах позвонков. Коррекция осложнений, вызванных угнетением кроветворения — переливание эритромассы и назначение эритропоэтина, применение антибиотиков при повышении температуры. Проведение гемодиализа, плазмофереза, назначение бисфосфонатов для контроля гиперкальциемии.

Диета и питание при миеломе
Особой диеты при множественной миеломной болезни не требуется, за исключением периода прохождения химиотерапии. Учитывая то, что основным побочным эффектом такого лечения является потеря аппетита, тошнота и рвота, требуется легкое и, вместе с тем, калорийное сбалансированное питание. Более подробные рекомендации пациенту дает лечащий врач.
Миелома – это патология крови, имеющая злокачественный характер. Развивается болезнь в костном мозге из переродившихся клеток крови. Заболевание относят к парапротеинемическим гемобластозам. Онкологический процесс сопровождается повышенным продуцированием атипичных белков иммуноглобулина. Встречается миелома достаточно редко, чаще страдают люди с тёмным оттенком кожи. Выявить болезнь на начальном этапе сложно, поэтому лечение часто начинается уже в запущенной стадии.
Характеристика заболевания
Миелома характеризуется злокачественным процессом активного разрастания в полости спинного мозга моноклональных плазмоцитов, продуцирующих патологический белок – парапротеин. Болезнь представляет собой непрекращающееся созревание и перерождение В-лимфоцитов в плазмоциты. Плазмоцит – это клетка, секретирующая иммуноглобулин. При миеломе моноклональные плазмоциты не погибают, а продолжают размножаться. Увеличение количества патогенов перемещается в костный мозг, что провоцирует снижение основных элементов крови.
Атипичные иммуноглобулины проникают в ткани других органов, накапливаясь в межклеточном пространстве. В первую очередь, патогены накапливаются в тканях почек, печени, селезенки и т.д. – органах с повышенным кровоснабжением.
Миеломная болезнь связана с замещением здоровых клеток атипичными иммуноглобулинами. Патогенез патологических плазмоцитов с выработкой биологически активных веществ вызывает развитие следующих эффектов:
- повышается уровень остеокластов, что провоцирует ломкость и хрупкость костей позвоночника, конечностей и т.д.;
- снижаются защитные функции организма;
- увеличивается уровень эластичных волокон с фиброгенами, что приводит к постоянному образованию капиллярных кровотечений и синяков;
- печёночные клетки активно разрастаются, провоцируя снижение свёртываемости крови;
- нарушенный белковый состав вызывает заболевания почек.
При миеломной болезни рост моноклональных плазмоцитов не контролируется и их уровень постоянно увеличивается. Из-за этого процесса миелома относится к злокачественным патологиям крови – гемобластозам.
Возникает заболевание обычно у взрослых людей после 40 лет. У мужчин болезнь диагностируется чаще, чем у женщин. Опухоль растёт медленно – до появления первых симптомов может пройти более 20 лет. После постановки диагноза, по наличию сопутствующей симптоматики человек живет в среднем в пределах 2 лет. Поэтому миелома часто воспринимается как рак крови.
Разновидности миеломы
Классификация миеломной болезни основывается на структурном составе опухоли с расположением атипичных патогенов в зоне костного мозга.
В зависимости от количества очагов поражения различают формы:
- Солитарная форма определяется единичным очагом в любом участке кости с костным мозгом или на ткани лимфатического узла, что является главным отличием от множественной миеломы.
- Множественная миелома отличается формированием нескольких очагов поражения с наличием костного мозга. Встречается чаще всего в области лопаток, ребер, костях черепа, в кистях, ногах и т.д.
Обычно диагностируется поражение организма множественной патологией. Многочисленная концентрация патогенных новообразований в организме имеет схожие признаки проявления с солитарной.
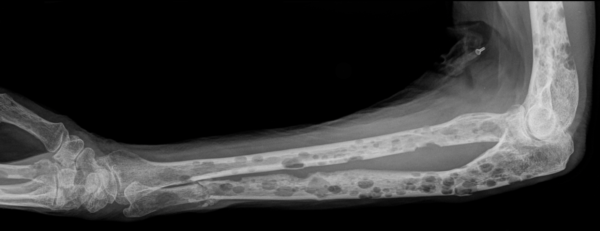
В зависимости от клеточной структуры выделяют виды:
- Плазмоклеточная миелома отличается высоким уровнем зрелых плазмоцитов, вырабатывающих парапротеин. Патология развивается медленно, но постоянный процесс выработки белка затрудняет курс терапии. Плазматический миеломатоз распространяется на другие органы и системы.
- Плазмобластной тип характеризуется преобладанием плазмобластов, секретирующих белок в незначительном объёме. Дифференциальная патология отличается быстрым ростом и легко поддаётся терапии.
- Полиморфноклеточный и мелкоклеточный вид отличаются разрастанием плазмоцитов на ранних сроках формирования болезни. Считаются самыми опасными формами по степени роста и распространения в организме.
При множественной патологии различают диффузную и диффузно-очаговую форму.
Согласно иммунохимическим признакам вырабатываемых парапротеинов различают:
- заболевание лёгких цепей – миелома Бенс-Джонса;
- с высоким содержанием определенного типа белка (А, G и M-градиент) – миеломы A, G и M;
- несекретирующая форма;
- диклоновый вид;
- миелома М.
Болезнь протекает в 3 стадии:
- на 1 стадии обычно признаки отсутствуют;
- 2 стадия характеризуется появлением выраженных симптомов;
- на 3 стадии наблюдается распространение атипичных клеток в других органах.
Признаки заболевания
На начальном этапе болезнь развивается скрытно – выраженная клиника отсутствует. При раке клетки постепенно распространяются по организму, поражая внутренние полости плоских костей – зону лопаток, позвонков и черепа, а также трубчатые кости.
В медицинской практике есть примеры диагностирования миелосаркомы – онкологического процесса, формируемого тельцами белого кровотока. При дальнейшем развитии на поверхности костей появляются наросты овальной формы с мягкой эластичной консистенцией, что приводит к разрушению костной структуры.
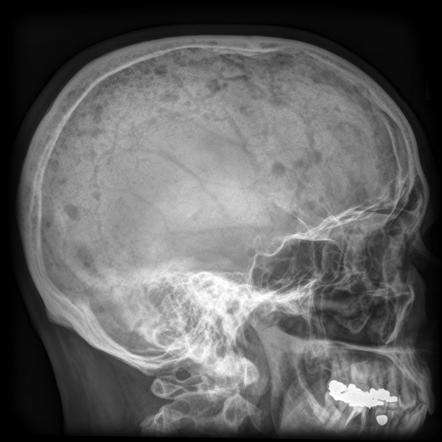
В основном присутствуют следующие симптомы миеломы:
- нарушения в работе органов пищеварения;
- температура тела постоянно меняется – может подняться до термальных показаний и сразу снизиться;
- мышечная слабость на фоне быстрой утомляемости;
- показатели основных элементов крови характеризуют признаки анемии;
- наблюдаются частые болезни инфекционного характера;
- болевые синдромы в области мягких тканей с чувством дискомфорта;
- частый сердечный ритм – 100-120 ударов в минуту;
- в зоне подреберья присутствует чувство тяжести;
- сильные боли в области головы;
- гиперкальциемия позвонка приводит к внутренним изменениям структуры;
- миеломаляция развивается, когда дифференцированная опухоль сдавливает соседние ткани;
- нефропатия развивается при поражении почечных клеток.
При появлении первых симптомов болезни нужно обратиться к врачу и пройти обследование организма, чтобы определить тип патологии. Лечение на начальном этапе формирования гарантирует положительный эффект и быстрое выздоровление.
Причины появления патологии
Причины возникновения опухоли врачам точно не известны. Считается, что болезнь передается по наследству. Спровоцировать выработку атипичных патогенов могут следующие факторы:

- пожилой возраст пациента;
- наследственная предрасположенность;
- воздействие радиоактивных веществ;
- взаимодействие с химическими соединениями и канцерогенными веществами;
- болезни инфекционного характера;
- стрессовое состояние;
- генетические нарушения;
- заболевания крови – гепатит, анемия.
Вызвать структурные изменения в костном мозге может любой фактор внутренних изменений организма или влияние внешних признаков.
Диагностика заболевания
Чтобы поставить точный диагноз, пациенту рекомендуется лабораторная и инструментальная диагностика организма. Тлеющая болезнь в области спинного мозга может протекать длительное время бессимптомно. Если выявить миелому на ранних сроках, можно вылечиться быстрее и полностью.
Врач для обследования больного использует лабораторные и рентгенологические методы:
- проводится общий осмотр, собирается история болезни и полный анамнез;
- общий анализ крови при миеломе выявляет высокий уровень СОЭ с пониженным гемоглобином, тромбоцитозом, эритроцитов и альбумином;
- анализ мочи показывает повышенное содержание кальция и белка;
- рентген назначается для исследования структурных изменений костей;
- компьютерная (КТ) и магнитно-резонансная томография (МРТ) дают детальную информацию патологии;
- назначается процедура трепанобиопсии костного мозга с последующим проведением цитологического исследования.
Особое внимание уделяется количественному уровню иммуноглобулина в составе крови. На КТ можно определить степень поражения других органов. Болезнь по симптоматике часто выглядит как рак крови, поэтому врачи более тщательно исследуют организм больного с исключением возможных патологий.

Лечение болезни
Лечит болезнь гематолог в условиях стационара, и поддерживая контроль состояния пациента. Миелома и болезнь Вальденстрема считаются родственными, но с наличием серьёзных различий. Обе патологии успешно лечатся в Германии, Израиле и в России лучшими гематологическими центрами. Эффективным методом терапии патологии является пересадка костного мозга – проводится с использованием донорских стволовых клеток.
За опухолью на начальном этапе врачи предпочитают просто наблюдать, не используя терапевтические процедуры. Пациент регулярно сдает кровь и мочу на исследование состава на предмет патологических изменений.
При появлении выраженных симптомов болезни применяется химиотерапия с использованием лекарственных препаратов из группы цитостатиков. Процедура может быть стандартной или высокодозной. Часто используются следующие препараты – Мелферан, Циклофосфан, Карфилзомиб, Сарколизин, Бортезомиб и Леналидомид. Для больных в возрасте 65 лет применяется лекарство – Алкеран, Преднизолон, Циклофосфан или Винкристин. Костная миелома эффективно лечится с использованием бисфосфонатов – Аредией, Бондронатом и Бонефосом.
Облучение гамма-лучами рекомендуется при наличии болевых синдромов или диагнозе костной патологии с присутствием серьезных очагов разрушений, в курсе терапии солитарной миеломы и во время последней стадии, в качестве паллиативного метода. Дополнительно назначают Дексаметазон.
Иммунотерапия заключается в приеме альфа2-интерферона большими дозами на протяжении нескольких лет – это позволяет предотвратить нежелательные последствия и рецидив. При диагнозе почечной недостаточности применяются диуретики, специальное питание и плазмаферез (переливание крови). Процедура гемодиализа – очищенная лимфома обогащается необходимыми микроэлементами. Антибиотики требуются при наличии воспалительных процессов.
Хирургическое вмешательство используется во время поражений позвоночника, нервных окончаний и кровеносных сосудов. Также может применяться для фиксации скелетных костей при переломах.
Рекомендуется выполнять все клинические рекомендации лечащего врача – это позволит предотвратить тяжелые осложнения и остановить онкологический процесс.
Диета
Для положительного эффекта в процессе терапевтических процедур пациенту назначается специальная диета. Сбалансированный рацион питания снимает излишнюю нагрузку с органов пищеварительного тракта и восполняет витаминный дисбаланс.
Больному рекомендуется исключить из рациона:
- сладкие мучные продукты;
- выпечку из белой муки;
- жирную и жареную пищу на растительном масле;
- сладости на основе шоколада;
- супы на бульоне из жирных сортов мяса;
- маринованые и копчёные продукты;
- блюда из бобовых, перловки и пшена;
- молоко с кисломолочными продуктами;
- сладкие газированные напитки с квасом и соки из тетрапака.

Питаться рекомендуется часто и маленькими порциями. На фоне лейкоцитарной нормы можно употреблять варёные куриные яйца, рыбу, говядину и кролика с курицей в отварном виде. Печень можно тушить с небольшим количеством сметаны, каши на воде, овощи варёные или на пару и вчерашний хлеб.
Пониженный лейкоцитарный ряд разрешает употребление рисовой каши без молока, суп из риса на бульоне из нежирных сортов мяса, продукты с высоким содержанием кальция и витаминов В и С.
Во время курсов химиотерапии нужно поддерживать норму потребления жидкости на уровне 3 литров – ягодные компоты, кисели, отвар из ягод шиповника, зелёный чай.
Правильный и сбалансированный рацион питания позволяет увеличить продолжительность жизни больного.
Прогноз терапии
Сколько проживет конкретный пациент, точно сказать не сможет ни один врач. На процент выживаемости влияет ряд факторов – стадия и тип патологии, физическое состояние больного на фоне психологического настроя.
Прогноз жизни в среднем составляет от 3 до 5 лет. В каждом случае срок индивидуален. Большую роль играет самочувствие пациента и процесс терапии – правильные и своевременные процедуры увеличивают срок жизни.
Врачи советуют обращаться в поликлинику при появлении любых подозрительных симптомов – это гарантирует раннее обнаружение болезни и полное выздоровление с предотвращением негативных последствий.
Читайте также:

