Чувствительность препарата к раковым клеткам
- Как проводится исследование опухоли на чувствительность к химиопрепаратам?
- Какие преимущества предоставляет этот анализ?
- Как я узнаю, что это подходит мне?
- Какие методы используются для проведения анализа?
- Что входит в отчёт по данным анализа?
- Какой образец нужен, чтобы провести это исследование?
- Где проводится это исследование?
- Когда я смогу получить результаты исследования?
Научные открытия и технологические достижения сделали возможным исследовать опухоль на молекулярном уровне. С помощью тщательного анализа генетической информации и белков конкретной опухоли может быть сформирован так называемый молекулярный отпечаток вашей опухоли.
Узнайте, как последние революционные открытия в генетике и молекулярной биологии позволяют врачам получить данные для персонализированного подхода к лечению именно вашего рака. В результате исследования опухоли мы узнаем о наиболее эффективных лекарствах в каждом конкретном случае.
Как проводится исследование опухоли на чувствительность к химиопрепаратам?
Проводимое исследование различает клеточные компоненты, играющие наиболее важную роль в распространении рака. Их иногда еще называют биомаркеры. Биомаркеры составляют тот самый молекулярный отпечаток, специфический для данного пациента. Этот отпечаток в последующем сравнивается с данными доказательной медицины из современной медицинской литературы.
Данные предоставляются в виде отчета. Этот отчет поможет вашему врачу найти ту самую терапию, дающую максимальный шанс благоприятного исхода заболевания и максимально эффективную программу борьбы против опухоли.
Отчет также содержит информацию о препаратах, которых следует избегать. С помощью этой информации ваш врач примет решение о том протоколе лечения, который подходит именно вам, исходя из данных о вашей опухоли и общего состояния вашего здоровья.
Вы можете получить наиболее эффективную терапию, чтобы атаковать рак и минимизировать воздействие на здоровые клетки.
Для согласования порядка проведения анализа на чувствительность опухолей к химиопрепаратам звоните по телефону +7 (495) 151-14-53+7 (861) 200-29-568 800 100 14 98 или направьте запрос по электронной почте hospital@euroonco.ru

Какие преимущества предоставляет этот анализ?
Данные анализа на чувствительность к химиопрепаратам помогут вашему врачу сделать выбор между уже существующими протоколами лечения заболевания. Более того, они могут помочь выбрать ту терапию, которая обычно не применяется при данном виде заболевания, но может иметь положительный эффект, исходя из конкретного уникального отпечатка вашей опухоли. Этот отпечаток сопоставляется с самыми последними и лучшими данными современной медицинской литературы, чтобы определить все возможные варианты лечения, которые потенциально могут помочь.
Некоторая информация в данных вашего профиля может указать на ваше возможное участие в клиническом исследовании новых препаратов лечения того или иного заболевания.
Как я узнаю, что это подходит мне?
Проведение анализа возможно для любой плотной опухоли, например:
Чаще всего этот анализ используется у пациентов, которым стандартная терапия уже проводилась, но без должной эффективности. Также это подходит людям с метастатическим раком или пациентам с редкими или агрессивными опухолями.
Даже если вы уже проходите терапию, вам все равно может помочь этот анализ. Ваш онколог способен оценить предоставленную в отчете информацию, чтобы выбрать максимально подходящую вам терапию.
Какие методы используются для проведения анализа?
Анализ опухоли включает в себя разные техники определения биомаркеров вашей опухоли. Команда ученых использует те же самые технологии, которыми пользуются ученые с мировыми именами, публикующиеся в научных изданиях. Все данные, предоставляемые отчетом, основаны на принципах доказательной медицины. Технологии, которые мы используем, включают в себя
- иммуногистохимию,
- флуоресцентную гибридизацию in situ,
- хромогенную гибридизацию in situ
- секвенирование (анализ последовательности ДНК) последнего поколения.

Что входит в отчёт по данным анализа?
В отчёт включены результаты вашего анализа, описания препаратов, которые могут или не могут потенциально вам помочь. Помимо этого, отчет содержит сопроводительные данные из клинических исследований, на основе которых он составлялся. В приложении к отчету предоставляется краткое изложение в понятной для пациента форме. Отчёт направляется непосредственно вашему врачу.
Какой образец нужен, чтобы провести это исследование?
Исследование проводится на ткани, которую получают в результате хирургического удаления опухоли или из образца, взятого во время биопсии. Так как биомаркеры вашей опухоли могут изменяться с течением времени, лучше предоставить самый последний образец для анализа. Если же недавнего образца нет, мы все равно можем провести это исследование. Если у вас нет на руках такого образца, то скорее всего там, где вы проходили лечение, образцы сохранены в архиве. Ваш врач может их запросить.
Где проводится это исследование?
Все исследования проводятся в лаборатории Caris, которая находится в Фениксе, Аризона, США. Все лаборатории сертифицированы, работают только лицензированные техники, ученые, патологи и врачи.
Когда я смогу получить результаты исследования?
В среднем от момента получения образца до подготовки отчета по результатам проходит 10–15 дней. Результаты тут же отправляются вашему врачу для обсуждения дальнейшей стратегии.
Цитокинотерапия при онкологии – самый безопасный метод лечения, поскольку цитокины действуют прицельно на злокачественную опухоль, поэтому не вызывают побочных реакций. Цитокины являются специфическими белками наподобие гормонов, вырабатываемыми разными клетками человеческого организма. Наибольшее число цитокинов синтезируется клетками лимфатической системы – лимфоцитами.
Такую терапию проводят даже при четвертой стадии онкологии, и могут совмещать с традиционной химической и лазерной терапией или проводить отдельно от них. Во время исследований было выявлено, что большая часть новообразований сопровождается определенными нарушениями иммунного ответа, которые и устраняются посредством цитокинотерапии.
Что такое цитокинотерапия
Много кто не знает, что такое цитокинотерапия, ведь зачастую раковые заболевания лечатся путем приема химических препаратов, облучения и проведения операций. Цитокинотерапия в онкологии , это новый метод в борьбе с раковыми образованиями, при котором доктора активируют личные защитные противораковые системы человеческого организма. Для этого применяются синтезированные белки – цитокины. В организме они вырабатываются кровяными клетками и иммунитетом, поэтому на активации иммунной системы и базируется метод цитокинотерапии. Данный метод используют в лечении различных заболеваний в области онкологии и других областях. Цитокинотерапия хорошо помогает при раке простаты, меланомах, при опухоли легких, груди, и при других патологиях онкологий, вплоть до рака головного и спинного мозга. Также введение цитокинов возможно при гинекологических болезнях, вирусных инфекциях, рассеянном склерозе, опоясывающем лишае и многих других заболеваниях.
Обследования пациентов свидетельствуют, что цитокинотерапия также улучшает состояние пациентов с ВИЧ/СПИД. Цитокинотерапия используется комплексно с другими методами лечения, предпочтительными при той или иной патологии. К таким методам могут относиться химиотерапия, радиотерапия, хирургическое вмешательство.
Эффективность лечения цитокинами
При лечении рака цитокинотерапией положительного результата можно добиться в тридцати – шестидесяти процентах случаев, что зависит от некоторых факторов:
- На какой стадии была обнаружена онкология,
- Где именно локализован опухолевый очаг,
- От морфологического строения новообразования,
- Насколько онкопроцесс распространился по организму,
- От общего состояния больного, его возраста.

Чем выше стадия онкологии, тем менее эффективным будет терапия, однако даже при запущенных стадиях этот метод лечения рака позволяет приостановить прогрессирование болезни и продлить жизнь пациенту. Успешным считается лечение, при котором цитокины воздействуют на опухоль, уменьшая ее размер, останавливая развитие, устраняя агрессивность.
Классификация цитокинов
По результатам клинико-лабораторных показателей обнаружено больше 200 цитокинов, вырабатываемых в человеческом организме, и это число постоянно увеличивается.
Цитокины классифицируются по нескольким признакам.
В зависимости от механизма биологического действия они бывают:
- Регулирующими воспалительные реакции,
- Отвечающими за работу иммунитета на клеточном уровне,
- Восстанавливающими гуморальную иммунную систему.
По характеру воздействия цитокины, которые применяются в онкологической практике, бывают:
- интерлейкинами – регулируют функцию иммунитета,
- интерферонами – ведут борьбу с вирусами, останавливают развитие инфекционных процессов, регулируют иммунитет,
- факторами некроза опухоли (альфа-НФО и бета НФО) – регулируют клеточный обмен и оказывают токсическое воздействие на раковые клетки,
- хемокинами – участвуют в нормальном передвижении по организму лейкоцитов,
- факторами роста – способствуют росту здоровых клеток и замене старых клеток на молодые,
- колониестимулирующими факторами – отвечают за дифференциацию, размножение и рост клеток кровеносной системы.
Противоопухолевая активность цитокинов достигается путем комбинирования их различных групп. При онкологии в большинстве клинических случаев необходимо введение цитокинов в организм, поскольку иммунитет больного человека не в состоянии самостоятельно их вырабатывать и выздоровление может наступить только от чужеродных белков.
Онкоиммунология и цитокинотерапия
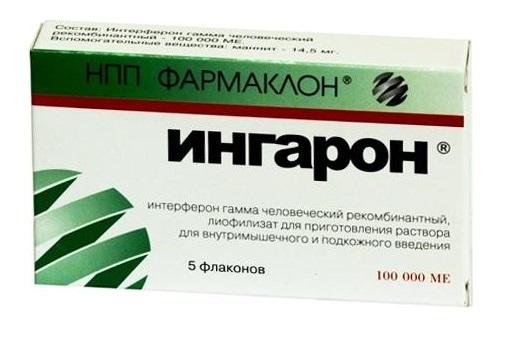
Химическая терапия обладает большей токсичностью, чем ФНО, что доказано клиническими исследованиями, потому цитокинотерапия начала применяться в онкоиммунологии как альтернатива химиотерапии. К тому же возможности химиотерапии могут быть ограничены высокой стадией и тяжелым общим состоянием больного. При онкологии четвертой стадии химиотерапия может усугубить состояние пациента, поэтому ему назначаются такие препараты, как Ингарон и Рефнот как в отдельности, так и комплексно. Применение данных препаратов приводит к усиленной выработке организмом собственного интерферона, что помогает продлить жизнь человеку.
К преимуществам цитокинотерапии относятся:
- Лекарства вводят внутримышечно или подкожно, поэтому терапию можно проводить даже дома,
- Препараты действуют прицельно, не повреждая здоровые клетки,
- Возможно применение цитокинов для предотвращения рецидива и метастазирования,
- Цитокины понижают побочные эффекты химиотерапии,
- Синтезированные белки не оказывают на организм токсического воздействия.
При лечении опухоли на раннем этапе развития таким методом онкоиммунологии как цитокинотерапия, возможно полное избавление от патологии.
Функции цитокинов в организме
В борьбе с онкологическими и другими заболеваниями цитокинотерапия выполняет функцию клеточно-системного взаимодействия. 
Цитокины в организме:
- регулируют интенсивность и продолжительность реакций иммунитета,
- поддерживают гемостаз (динамическое постоянство),
- способствуют согласованной работе нервной и эндокринной систем с иммунитетом,
- принимают участие в кроветворении,
- стимулируют рост здоровых клеток и подавляют размножение патологических,
- определяют выживаемость клеток,
- развивают аутоиммунные реакции,
- регулируют воспалительные процессы.
Главным преимуществом цитокинов является то, что они активируют рецепторы иммунной системы, и помимо борьбы с онкологией, они участвуют в регенерации тканей, регулируют нормальное течение физиологических функций.
Положительное действие
Положительное действие цитокинотерапии обусловлено следующим:
- Когда препараты начинают воздействовать на новообразование, в организме начинается запуск цитостатического действия – апоптоза. При этом опухоль может регрессировать или исчезнуть.
- При запуске в клетках новообразования ареста клеточного цикла опухоль стабилизируется или частично регрессирует.

Хороший результат при цитокинотерапии зависит от того, насколько клетки новообразования чувствительны к данным белкам. Лечение проводится курсами с последующей оценкой состояния пациента.
- При начальной чувствительности опухоль и метастазы уменьшаются и, так же в этом случае возможен полный регресс новообразования. Если это произошло, то через некоторое время пациенту назначается повторное прохождение курса.
- При умеренной чувствительности клеток рака к вводимым препаратам опухоль и метастазы уменьшаются. В таком случае также необходимо повторное введение цитокинов.
- При лекарственной устойчивости опухолевых клеток к цитокинам докторам всё же удается стабилизировать онкологический процесс. В некоторых случаях новообразование покрывается соединительнотканной оболочкой и перестает расти.
- Около двадцати процентов пациентов остаются нечувствительными к лечению цитокинотерапией. У таких больных новообразования не прекращают роста, но применение цитокинов может улучшить общее состояние пациента и сделать более эффективными другие методы лечения.
Если применять любые способы терапии совместно с введением цитокинов, то эффективность лечения и переносимость пациентом облучения и химических препаратов будет намного выше.
Побочные проявления
При терапии онкологии цитокинотерапией изредка возможны побочные реакции, но они незначительны:
- у десяти процентов больных через несколько часов после укола может на два или три градуса повыситься температура тела, которая просто снижается посредством приема жаропонижаюшего препарата,
- на месте инъекции может покраснеть кожа и ощущаться боль, поэтому нужно колоть препараты поочередно в разные места,
- при больших новообразованиях во время терапии может начаться распад опухоли, уменьшить интоксикацию можно путем перерыва в лечении от одного до трех дней.
После прохождения курса цитокинотерапии больного повторно обследуют и при необходимости повторяют курс.
Возможно в скором времени терапия онкологии цитокинами станет в один ряд с химиотерапией, лучевой терапией и оперативным вмешательством, ведь эффект от такого лечения в большинстве случаев положительный.

Онкологические заболевания в настоящее время остаются одним из страшных недугов, угрожающих жизни. Но с развитием современных технологий и появлением новых методов лечения онкологии, борьба с этим недугом стала очень успешной.
Лечение рака в Израиле стоит на самом высоком уровне по сравнению с другими странами мира. Во многом играет положительную роль ранняя диагностика онкозаболеваний в Израиле – благодаря использованию всех существующих инновационных технологий и методик диагностирования онкологических заболеваний, израильские врачи с высочайшей точностью ставят диагноз, что позволяет подобрать наиболее подходящую методику для терапии.
На сегодня медицина Израиля продвинулась еще на один шаг в лечении злокачественных и доброкачественных опухолей. В местных клиниках проводят дополнительный метод диагностирования, позволяющий с максимальной точностью определить реакцию образования на предполагаемый протокол химиотерапии.
Преимущества анализа на чувствительность опухоли к химиотерапии
Проверка реакции образования на химические препараты делают с целью определения протокола лечения, подходящего непосредственно пациенту. Этот анализ позволяет предсказать реакцию на все химические лекарства еще до начала терапии и тем самым исключить неэффективные для данного вида патологии.
Ученые давно выяснили, что разные люди с одинаковым видом онкологии на той же самой стадии, получающие одинаковое лечение, реагируют совершенно по-разному. Поэтому в Израиле к каждому больному используют индивидуальный подход и подбирают методологию, подходящую именно ему.
Описываемый метод диагностики предусматривает исследование белков и генетической информации конкретной опухоли, формируя некий молекулярный снимок исследуемого новообразования. После этого полученный снимок сравнивают с медицинскими данными и результаты вносят в отчет, который помогает врачу определить наилучший протокол терапии, обеспечивающий максимально положительный исход заболевания. Кроме того, некоторые показатели могут свидетельствовать о возможности участия пациента в экспериментальном лечении или клиническом испытании новых препаратов.
Показания к проведению анализа
- рак молочной железы
- меланома
- рак яичников
- колоректальный рак
- рак легкого
- агрессивные ил редкие опухоли
- рак с метастазами
Анализ выполняют и в случаях, если химиотерапия применялась ранее или применяется в настоящее время. В таких случаях проверка поможет определить правильность назначения и оценку эффективности химического воздействия.
Исследование проводится на ткани, полученной в результате хирургического удаления новообразования или из образца биопсии. Биомаркеры патологической ткани могут изменяться с течением времени, поэтому используют самый последний образец.
Результаты проверки заносятся в отчет вместе с перечислением химиопрепаратов, которые могут быть эффективными или неэффективными для пациента. Все сопутствующие результаты диагностики вносятся в отчет в обязательном порядке.
Успехи последних двух десятилетий в терапии злокачественных заболеваний, особенно острых лейкозов и лимфом у детей, связаны с введением высоко агрессивной программной полихимиотерапии. Детально разработанные программы, включающие адекватную сопроводительную терапию, направленную на борьбу с высокой токсичностью лечения, привели к изменению патоморфоза и течения этих заболеваний: в настоящее время при остром лимфобластном лейкозе выздоравливает 70-75%, при остром миелобластном лейкозе — 40-50% детей, а при неходжкинской лимфоме бессобытийная выживаемость у детей составляет более 75%.
Как показывает анализ причин неэффективности программной полихимиотерапии при острых лейкозах и лимфомах у детей, смерть, связанная с осложнениями агрессивной химиотерапии и неадекватностью сопроводительного лечения, наступает примерно в трети таких случаев, неуспех лечения в остальных обусловлен первичной и вторичной резистентностью опухолевых клеток к химиотерапии.
Таким образом, резистентность опухолевых клеток к химиотерапии является ведущей причиной неэффективности современных методов программного лечения, а преодоление лекарственной резистентности опухолевых клеток — основной резерв повышения результативности терапии, направленной на максимальную санацию организма от опухолевых клеток.
Первичная и вторичная резистентность опухолевых клеток к химиотерапии — процессы многофакторные, сложные, зависящие как от индивидуальных особенностей циторедуктивного действия препаратов, так и от биологических свойств самих опухолевых клеток. Анализ этих процессов необходим для понимания путей и разработки методов преодоления лекарственной резистентности клеток опухоли к терапии.
Для понимания причин лекарственной резистентности опухолевых клеток необходим анализ условий реализации цитотоксического действия химиотерапии.
Условия реализации цитотоксического действия химиопрепаратов:
- Проникновение в клетку.
- Наличие внутриклеточных мишеней для действия препарата.
- Внутриклеточная трансформация в активную форму.
- Достижение адекватной внутриклеточной концентрации.
- Способность клетки к апоптозу.
У каждого цитостатического препарата имеются свои механизмы и приоритеты в реализации киллерной функции.
Целью этого очерка является анализ общих механизмов взаимодействия антилейкемических препаратов с биологическими структурами опухолевых клеток и поиск ключевых моментов этого взаимодействия, нарушения в которых делают невозможным осуществление цитотоксической функции химиотерапии.
Остановимся последовательно на каждом условии реализации цитоксического эффекта.
Проникновение препарата в опухолевую клетку
Существуют следующие механизмы поступления препаратов в опухолевые клетки:
- Пассивная диффузия;
- Использование специфических носителей;
- Использование высокоактинных рецепторов.
Каждый препарат имеет свои приоритетные пути поступления, некоторые пользуются одновременно всеми. Так, Метотрексат (МТХ) использует все вышеперечисленные пути проникновения в клетку. Однако пассивная диффузия выражена в большей степени при создании высокой экстраклеточной концентрации путем введении больших доз МТХ, например, детям с вновь диагностированным В-ОЛЛ.
При использовании средних доз или длительном введении высоких доз преимущественными путями проникновения МТХ в лейкемические клетки является соединение с носителем-фолатом и/или со специфическим рецептором. Снижение активности последних нередко обуславливает резистентность лейкемических клеток к метотрексату в рецидиве ОЛЛ и при манифестации Т-ОЛЛ.
Наличие внутриклеточных мишеней для действия препаратов.
Для реализации цитотоксического действия препарата необходимо наличие в опухолевой клетке мишени для его действия. Так, например, для МТХ такой мишенью является фермент дегидрофолатредуктаза, участвующий в синтезе нуклеотидов и аминокислот, необходимых для образования белка и ДНК. При редукции этого фермента под действием активной формы МТХ опухолевая клетка теряет способность к репарации ДНК и погибает.
Однако в некоторых опухолевых клетках, например, при ОМЛ для репарации ДНК и белка могут использоваться другие метаболические пути, их характеризует низкий уровень фермента дегидрофолатредуктазы, с чем может быть связана резистентность таких клеток к метотрексату.
Некоторые антилейкемические препараты (этопозид, тенипозид, антрациклины, амасакрин, митоксантрон) осуществляют свой цитотоксический эффект через подавление внутриядерных энзимов Топоизомеразы-1 и 2 (Торо-1 и 2). Эти энзимы следят за правильным пространственным расположением ДНК: Торо-1 контролирует начало репликации ДНК, Торо-2 — завершение репликации и окончательное оформление структуры и топологии вновь образованной ДНК. Медикаментозная ингибиция этих энзимов в клетках с их высокой экспрессией ведет к быстрой апоптотической гибели клеток.
Подавление или модуляция активности топоизомераз — частый феномен в лейкемических клетках, особенно в рецидиве заболевания. Теоретически это является основанием для развития резистентности к вышеперечисленным химиопрепаратам. В настоящее время доказана связь резистентности к терапии этопозидом и антрациклинами при ОМЛ с низким содержанием Торо-2 в лейкемических клетках этих больных, подобной корреляции при ОЛЛ и НХЛ получить не удалось.
Внутриклеточная трансформация в активную форму
Многие химиопрепараты для реализации цитотоксического эффекта нуждаются во внутриклеточной активации. Нарушения в этих механизмах обуславливает их неэффективность. Рассмотрим это на нескольких примерах. На рис.3.1 приведены события, превращающие МТХ в активную форму — Метотрексатполиглютамат (MTXPG). Это происходит под действием внутриклеточного фермента фолиополиглютамат синтетазы (FPGS), другой лизосомальный фермент — гаммаглютаматгидролаза (GGH) — обладает противоположным действием, расщепляя MTXPG. Первичная резистентность лейкемических клеток при ОМЛ к МТХ обусловлена сочетанным метаболическим дефектом опухолевых клеток: снижение активности FPGS и повышение активности GGH.

Рисунок 3.1. Внутриклеточная трансформация метотрексата в активную форму: МТХ - метотрексат; MTXPG - метотрексатполиглютамат (активная форма); FPGS - фолиополиглютамат синтетаза (фермент); GGH - гаммаглкламатгидролаза (фермент)
Происхождение вторичной резистентности к метотрексату у лейкемических клеток в рецидиве ОЛЛ другое — резкая активация фермента GGH. Исходя из этих данных, представляется актуальным поиск новых антифолатов, не зависящих в своем действии от дефектов метаболизма метотрексатполиглютамата.
Антагонисты пуриновых оснований (6-меркаптопурин и тиогуанин) также требуют внутриклеточной активации. Этот процесс представлен схематически на рис.3.2.

Рисунок 3.2. Внутриклеточная трансформация 6-MP в активную форму: 6-МР - 6-меркаптопурин; HGPRT - гипоксантил гуанин фосфорибозил трансфераза (фермент)
Перевод 6-МР и тиогуанина в активную форму происходит под действием внутриклеточного фермента гипоксантил-гуанин-фосфорибозилтрансфераза (HGPRT), ингибируют этот переход ферменты: фосфатазы и 5-нуклеотидаза.
Резистентность к 6-МР при ОАЛ связана с высокой активностью внутриклеточных ферментов 5-нуклеотидазы и фосфатазы, но не с понижением активности HGPRT.
Достижение адекватной внутриклеточной концентрации
К таким белкам относятся: Р-гликопротеин (P-gp), раньше и лучше всех изученный транспортный белок белок множественной лекарственной резистентности (MRP); белок легочной резистентности (LRP), впервые выделенный из клеточных линий немелкоклеточного рака легкого, не содержащих P-gp и MRP. При исследованиях, проведенных на клеточных линиях, было показано, что синтез этих белков кодируется соответсвующими генами: P-gp является продуктом MDR-1-гена, локализованного на 7 хромосоме, гены кодирующие MRP и LRP, располагаются на 16 хромосоме, в регионах р13.1 и р11.2 соответственно.
Были разработаны способы молекулярно-генетического определения содержания белков лекарственной резистентности, позволившие изучать и модулировать их активность. Так, были идентифицированы препараты, способные блокировать активность белков лекарственной резистентности и повышать внутриклеточную концентрацию цитостатиков, они получили название "хемосинтетайзеры". В таблице 3.2 перечислены основные хемосинтетайзеры, используемые для блокирования тех или иных транспортных белков.
Таблица 3.2. Хемосинтетайзеры

Из приведенных в табл. 3.2 препаратов только первые два (Циклоспорин-А и Вероапамил) находят пока клиническое применение. Использовать хомосинтетайзеры в клинике следует с большой осторожностью, т.к. функция рассмотренных выше транспортных белков является общебиологическим феноменом, они экспрессированы в норме во многих клеточных системах, участвующих в выведении токсических продуктов из организма (клетки печени, почек, кишечного эпителия и др.), подавление их активности в этих системах может явиться серьезным осложнением такой терапии.
Многочисленные данные о структуре и функции белков MDR получены, в основном, в эксперименте, сведения об их роли в формировании первичной и вторичной рефрактерности к терапии лейкозов и лимфом в клинике, особенно у детей, немногочисленны и противоречивы. Особого внимания заслуживает публикация кооперативного исследования отдела детской гематологии/онкологии Университетского госпиталя Врийе (Нидерланды), группы COALL (Гамбург, Германия), группы ALL-Rez BFM (Берлин, Германия), группы AML-BFM (Мюнстер, Германия).
Было изучено клиническое и прогностическое значение экспрессии P-gp, MRP и LRP у 141 ребенка с ОЛЛ и 27 детей с ОМЛ. Сравнивали внутриклеточное содержание этих белков в острой фазе и рецидиве, при разных формах острого лейкоза, изучали его корреляцию с клиническими факторами риска и тестом цитотоксичности ex vivo. Проведенные исследования убедительно доказывают отсутствие значения белков P-gp и MRP в развитии лекарственной резистентности при острых лейкозах у детей.
Белок LRP, по-видимому, участвует в формировании некоторых форм лекарственной резистентности у детей: его экспрессия была выше при ОМЛ, по сравнению с ОЛЛ, в рецидивах выше, чем в острой фазе; была выявлена значимая обратная корреляционная связь с чувствительностью к даунорубицину.
Таким образом, исследования последнего времени позволяют считать несколько преувеличенной установленную ранее в эксперименте роль белков MDR в формировании лекарственной резистентности, по крайней мере, при острых лейкозах у детей.
Способность клеток к апоптозу
Реализация циторедуктивного эффекта химиотерапевтических средств, независимо от конкретных механизмов их действия, происходит чаще всего через активацию в опухолевых клеток программы апоптоза.
С этой точки зрения, резистентность опухолевых клеток к терапии может быть следствием двух процессов: неспособности химиопрепарата запустить программу апоптоза (недостаточная внутриклеточная концентрация активной формы препарата и/или отсутствие внутриклеточных мишеней, воспринимающих действие препарата и включающих программу апоптоза) и нарушения в механизмах апоптоза в опухолевых клетках.
Апоптоз — это физиологическая клеточная смерть, происходящая путем самопереваривания. Программа апоптоза может быть включена множеством внешних и внутренних сигналов и направлена на освобождение от старых или наработанных в излишке клеток.
Способность к спонтанному апоптозу лейкемических клеток ex vivo коррелирует с их лекарственной чувствительностью.
Определение уровня способности к спонтанному апоптозу лейкемических клеток при ОМЛ является хорошим тестом чувствительности клеток к химиотерапии.
Как показали исследования последних лет, противоопухолевые химиопрепараты включают апоптоз, в основном, через две сигнальные системы: ген Р-53 и FAS-R/TNF.
Антиметаболиты (6-меркаптопурин, метотрексат) и химиопрепараты, мишенью для действия которых являются топоизомеразы (этопозид, тенипозид) вызывают апоптоз опухолевых клеток через активацию Р-53.
Однако повреждение ДНК цитотоксическими агентами может найти свою реализацию и в обход Р53 гена (см.рис 3.3).

Рисунок 3.3. Схематический путь апоптоза при повреждении ДНК
Дело в том, что повреждение ДНК цитотоксическими агентами вызывает активацию атаксия-телеангиоэктазия-мутировавшего протеина (ATM), у которого имеется 3 мишени действия, ген Р53 только одна из них. Две другие (продукты онкогенов с-аbl и chk-1) ответственны за остановку клеток в фазах G1 и G2 с возможной последующей репарацией повреждения ДНК. Компоненты активации этих путей рассматриваются как возможные мишени для разработки новых лекарственных средств, усиливающих противоопухолевую активность агентов, повреждающих ДНК.
Как представлено на схеме (см.рис.3.3), при прохождении сигнала повреждения ДНК только ген Р53 отвечает за развития апоптоза.
В процессе опухолевой трансформации нередко происходит мутация в гене Р-53, отменяющая его проапоптотическую функцию. Обычно эта мутация сопровождается делецией 17р хромосомы, где картирован ген Р-53. Такая трансформация делает опухолевую клетку невосприимчивой к ДНК-токсическим препаратам. Мутация Р-53 гена чаще наблюдается в солидных опухолях (рак толстой кишки, простаты), реже при лейкозах и лимфомах, но всегда сопровождается лекарственной резистентностью и характеризуется плохим прогнозом.
Так, при исследовании 330 детей с ОЛЛ мутация в Р-53 была обнаружена при постановке диагноза всего у 10 детей (
В настоящее время онкологи исходят из концепции, что только раннее выявление злокачественной опухоли и ее адекватное лечение обеспечивают стойкий и длительный клинический эффект. Практика онкологической службы показала, что только диспансерный метод, являющийся достижением отечественного здравоохран.
Общеизвестно, что дистантное распространение по лимфатическим и кровеносным сосудам (метастазирование) — это высшее выражение автономности опухоли, главный отличительный признак злокачественного процесса и наиболее частая причина смерти больных. Способность к метастазированию позволяет опухо.
Морфологическое исследование опухоли играет ведущую роль в определении прогноза и выборе оптимальной тактики лечения онкологического больного. Патоморфолог информирует клинициста о характере опухопи (доброкачественная или злокачественная), ее гистологической принадлежности, степени дифференц.
Цитологический метод, основанный на микроскопическом изучении и оценке клеточного материала, полученного различным способом из патологического очага, является ветвью онкоморфологии. Цель цитологического исследования — установить правильный диагноз злокачественных опухолей любой локализации и в любой.
Химиотерапия обычно применяется как метод лечения первично-распространенных форм, рецидивов и метастазов злокачественных опухолей. Наряду с этим она может проводиться в дополнение к локальному лечению опухоли (удаление, облучение) вне зависимости от его радикальности. Подобная химиотерапия, .
Хирургический метод лечения злокачественных опухолей остается доминирующим, хотя его отдаленные результаты можно считать удовлетворительными лишь в I-II стадии заболевания, а в остальных — операция рассматривается как обязательный компонент специального лечения. Совершенствование хирургической техни.
Читайте также:

