Лимфоплазмоцитарная лимфома что это такое
Лимфоцитарная лимфома – новообразование, происходящее из лимфоцитов, клеток, присутствующих в крови, в костном мозге и в лимфоузлах. Наиболее ярко выраженной ее разновидностью является лимфоплазмоцитарная лимфома (макроглобулинемия Вальденстрема) – вялотекущая лимфома, которая была впервые описана шведским врачом Яном Вальденстремом в 1944 году. Ежегодно от 3 до 5 человек из 1 000 000 заболевают лимфоплазмоцитарной лимфомой. Лимфоцитарная лимфома составляет около 1-2% всех случаев рака крови. Заболевание чаще встречается у мужчин, чем у женщин.
В чем суть заболевания?

Типичными признаками лимфоцитарной лимфомы являются головокружение и головные боли
Макроглобулинемия Вальденстрема – это злокачественное заболевание лимфатической системы. При лимфоплазмоцитарной лимфоме в костном мозге, лимфатических узлах или селезенке злокачественно измененные В-лимфоциты (подтип белых кровяных клеток) бесконтрольно размножаются.
В международной классификации болезней 10-го пересмотра (МКБ-10) лимфоплазмоцитарная лимфома обозначается кодом C88.0.
Причины
Точные причины развития заболевания неизвестны. Хотя опухолевые клетки имеют изменения в генах, никто не знает, что вызывает эти генетические изменения. В 20% случаев у пациентов с болезнью Вальденстрема есть родственник первой степени, у которого также была диагностирована лимфома.
Лимфоцитарная лимфома относится к группе индолентных (медленнорастущих) В-клеточных лимфом: это различие важно, потому что схема лечения медленнорастущих и быстрорастущих злокачественных новообразований отличается.
Основные факторы риска:
- возраст старше 65 лет;
- уровень гемоглобина ниже 11 г/дл;
- концентрация тромбоцитов ниже 100 г/л;
- бета-2-микроглобулин более 3 мг/л;
- концентрация антител класса М выше 70 г/л.
Симптомы
Усталость и снижение способности концентрировать внимание – наиболее распространенные признаки лимфоплазмоцитарной лимфомы (70% пациентов) и мелкоклеточной лимфоцитарной лимфомы. Они вызваны тем, что клетки лимфомы подавляют нормальное кроветворение в костном мозге, что может привести к анемии.
Из-за отсутствия тромбоцитов у пациентов могут возникать поверхностные кровотечения на коже или в других органах (10% пациентов).
Диагностика

Лучевая диагностика ( компьютерная и магнитно-резонансная томография) позволяет выявить наличие опухолевых образований в различных частях тела, которые не доступны врачу при внешнем осмотре
Вначале врач собирает анамнез и проводит физический осмотр пациента. Диагноз ставится на основе клинических, лабораторных, иммунологических и генетических данных.
Для установления диагноза лимфоцитарной лимфомы требуется взять образец ткани костного мозга и отправить на гистологическое исследование. Биопсия проводится под анестезией. Как правило, образец ткани берут на гребне подвздошной кости.
Ткань увеличенных лимфатических узлов также должна быть исследована специалистом по лимфоме. Если возможно, лимфатический узел следует полностью удалить хирургическим путем. Если пораженный лимфатический узел труднодоступен, более крупные образцы тканей можно альтернативно взять с использованием биопсии пуансона. Образцы, полученные с помощью тонкой иглы, недостаточны для точной диагностики.
В лабораторных анализах наблюдается увеличение количества моноклонального иммуноглобулина М. Гистологическое и цитологическое исследование костного мозга выявляет увеличение зрелых лимфоцитов при лимфосаркоме этого вида.
После определения вида лимфомы рекомендуется провести дополнительные обследования: компьютерную томографию, ПЭТ-КТ, МРТ, рентгенографию и ультразвуковое исследование.
Благодаря этим методам визуализации местоположение злокачественной опухоли можно определить более точно, что особенно важно для лучевой терапии.
Классификация
Для определения стадии индолентной лимфоцитарной лимфомы используют классификацию по Анн-Арбор:
- I стадия: вовлечение одного лимфоузла или органа вне лимфатической системы;
- II стадия: вовлечение одного или нескольких лимфатических узлов на одной стороне диафрагмы с или без поражения других тканей;
- III стадия: поражение двух или более лимфоузлов на обеих сторонах диафрагмы с поражением органов вне лимфатической системы;
- IV стадия: поражение нескольких лимфоузлов с одновременным поражением органов.
Также выделяют бессимптомную (А) форму болезни и форму с выраженными симптомами (В).
Лечение
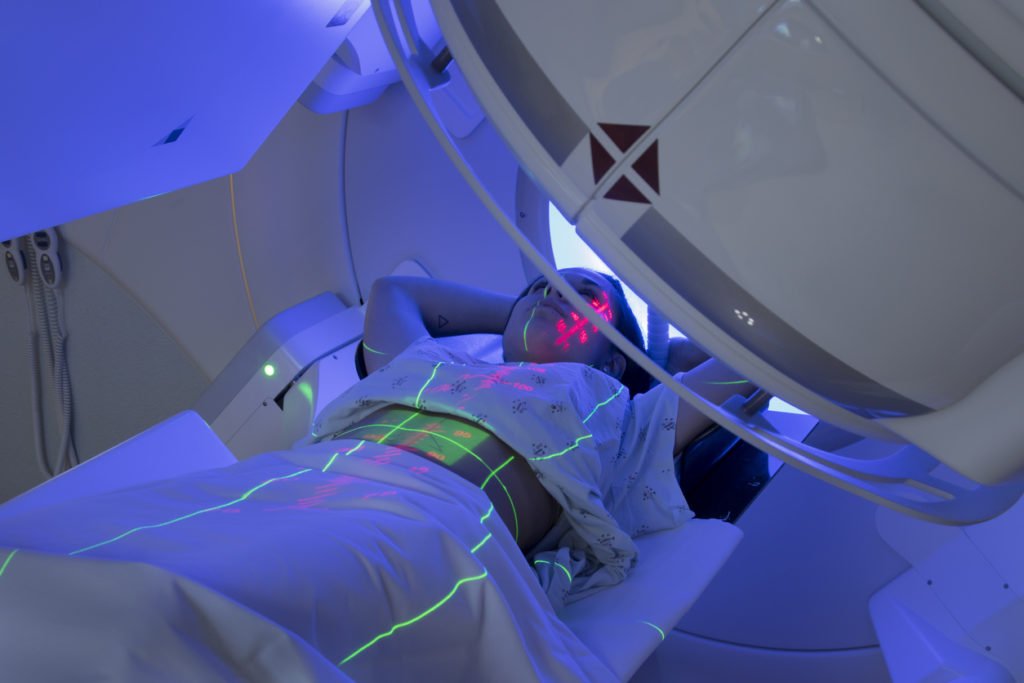
Выбор программы лечения зависит от вида лимфомы и состояния больного
У пациентов с незначительными или развивающимися симптомами требуется немедленно начать терапию. Другой причиной срочного начала лечения являются изменения в картине крови – анемия.
Если лечение необходимо, существует несколько вариантов подавления болезни. Однако полностью вылечиться невозможно.
- химиотерапия;
- радиотерапия;
- трансплантация стволовых клеток;
- поддерживающая терапия – плазмаферез;
- комбинация химиотерапии и плазмафереза.
Ионизирующее излучение повреждает ДНК раковых клеток. Излучение повреждает не только ДНК опухолевых клеток, но и здоровых тканей. Здоровые клетки лучше способны восстанавливать ДНК, чем раковые: эта разница в регенерации ДНК является самой большой при относительно низкой дозе излучения. Чтобы использовать эту разницу, излучение часто делится на множество небольших количеств (фракций) и проводится в течение нескольких дней.
В начале пациентам назначают иммунохимиотерапию: это комбинация химиопрепарата (например, Бендамустина) и моноклонального антитела. Другие эффективные методы лечения включают Ритуксимаб в сочетании с ингибитором протеасомы. Этот активный ингредиент ингибирует распад белка в клетках лимфомы и, таким образом, препятствует их выживанию (происходит накопление ненужного белка).
Для молодых пациентов высокодозная химиотерапия и трансплантация костного мозга – еще один способ приостановить развитие болезни. Обычно берутся стволовые клетки от самого пациента и после химиотерапии, неповрежденные, обратно вводятся в кровоток. Стволовые клетки от здоровых доноров используются только в исключительных случаях и у молодых пациентов с клинически агрессивным течением, так как лечение имеет высокие риски и побочные эффекты.
Схема лечения зависит от возможных сопутствующих заболеваний, возраста и общего физического состояния конкретного пациента. Пациенты страдают от повышенной вязкости крови, поэтому рекомендуется выполнить плазмаферез до начала иммунохимиотерапии.
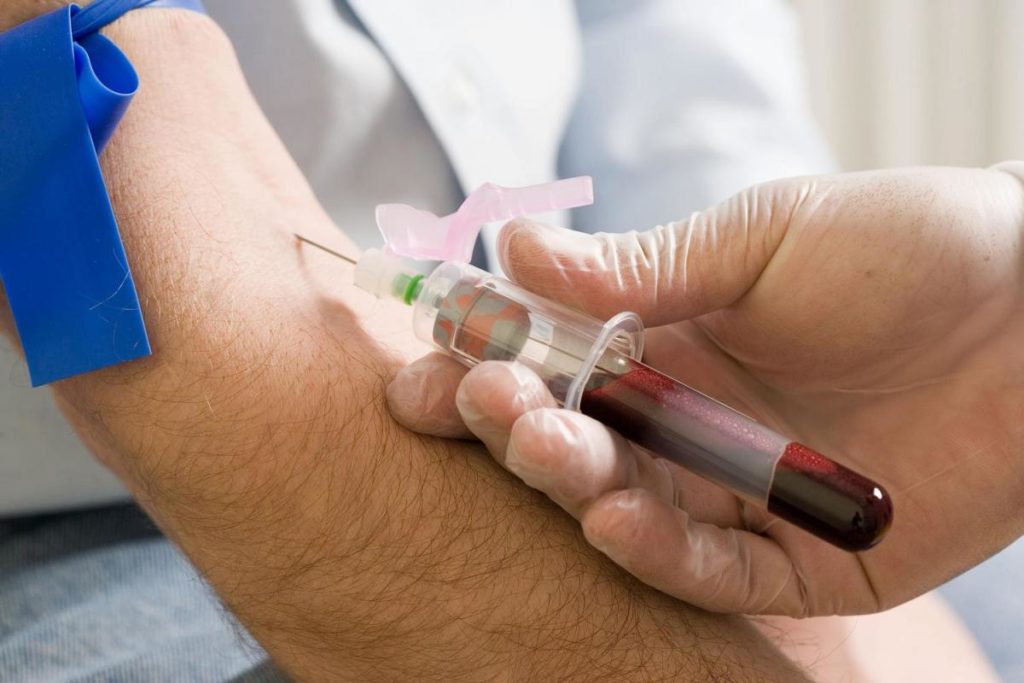
Снижение количества эритроцитов или тромбоцитов в крови – один из признаков недуга, поэтому общий анализ крови необходим для преждевременного выявления заболевания
Для достижения долгосрочных эффектов от лечения необходимо регулярно проверять состояние пациента. Такие контрольные проверки необходимо проводить каждые три месяца в первые два года после окончания терапии. С третьего года обследование проводится с ежегодными интервалами. Во время последующих обследований также рассматривается вопрос о том, возникают ли долгосрочные побочные эффекты.
Следующие исследования рекомендуется проходить всем пациентам с лимфоплазмоцитарной лимфомой:
- физический осмотр;
- общий и биохимический анализы крови;
- анализы на концентрацию лактатдегидрогеназы;
- обследование печени и почек;
- рентгенографическое и ультразвуковое обследование;
- контроль лабораторных данных (IgM) и участков заболевания, которые были заметны до лечения.
Прогноз пациентов с лимфоцитарной лимфомой
Как и в случае с другими лимфомами, описанные выше методы лечения помогают устранить симптомы, но неспособны полностью вылечить пациента. В некоторых случаях у пациентов не развиваются клинические симптомы в течение многих лет, хотя болезнь медленно прогрессирует. Цель терапии – максимально подавить заболевание и сохранить качество жизни пациентов.
Отсутствие нормальных лимфоцитов приводит к синдрому дефицита антител, что приводит к развитию иммунодефицита и частому возникновению сопутствующих инфекций.
В общей сложности 50% пациентов выживают после 10 лет с момента постановки диагноза; некоторые из них имеют высокое качество жизни даже после более чем 20 лет жизни.
При возникновении любых симптомов пациентам с лимфомой в обязательном порядке необходимо обращаться за консультацией к врачу, чтобы избежать развития опасных для жизни последствий.
Различают два основных типа лимфом - болезнь Ходжкина, названную так по имени автора, описавшего это заболевание, и неходжкинские лимфомы.
Неходжкинские лимфомы (лимфосаркомы) (НХЛ) развиваются из лимфоидной ткани, которая выполняет защитную функцию организма. Лимфоидная ткань, представлена лимфоцитами и имеется в лимфатических узлах, селезенке, вилочковой железе, аденоидах, миндалинах, костном мозге и желудочно-кишечном тракте.
Среди лимфоцитов выделяют В-клетки и Т-клетки, из которых могут развиваться НХЛ.
При этом В-клеточные лимфомы встречаются чаще (85%) по сравнению с Т-клеточными (15%).
Классификация неходжкинских лимфом
Наиболее часто используется Европейско-американская классификация, разработанная в рамках Всемирной организации здравоохранении (ВОЗ).
По этой классификации НХЛ подразделяются в зависимости от их клеточной принадлежности.
Диффузная В-крупноклеточная лимфома составляет 31% от общего числа лимфом. Эта лимфома возникает наиболее часто после 60 лет и отличается быстрым ростом. При этом 40-50% больных удается полностью излечить.
Фолликулярная лимфома, на которую приходится 22% от общего числа НХЛ. Этот вид лимфомы диагностируется обычно в возрасте около 60 лет и характеризуется медленным ростом. Длительная (5-летняя) выживаемость больных колеблется в пределах 60-70%. Со временем фолликулярная лимфома может превратиться в быстрорастущую диффузную лимфому.
Хронический лимфоцитарный лейкоз/мелкоклеточная лимфоцитарная лимфома. На эти родственные заболевания приходится 7% от общего количества лимфом. Они отличаются медленным ростом, но плохо поддаются лечению. Тем не менее больные с этими заболеваниями могут жить в течение 10 лет. Иногда возможно превращение их в быстрорастущие лимфомы.
Лимфома из клеток мантийной зоны (6%) чаще поражает мужчин в возрасте около 63 лет. Этот тип лимфомы хотя и растет не очень быстро, однако лишь 20% больных живет в течение 5 лет.
Экстранодальные В-клеточные лимфомы маргинальной зоны - MALT-лимфомы (8%). Средний возраст больных - около 60 лет. Часто выявляется в желудке, отличается медленным местным ростом. Хорошо излечивается на ранних стадиях.
Нодальная В-клеточная лимфома маргинальной зоны (2%). Характеризуется медленным ростом. Многие больные с ранними стадиями заболевания могут быть полностью излечены.
Селезеночная В-клеточная лимфома маргинальной зоны встречается у пожилых больных, чаще мужского пола. Нередко лечение не назначается до появления выраженных симптомов в результате увеличения селезенки.
Первичная медиастинальная В-клеточная лимфома (2%) возникает в средостении преимущественно у женщин в возрасте 30-40 лет и характеризуется быстрым ростом. 50% больных могут быть излечены.
Лимфома Беркитта и беркиттоподобная лимфома(2%) возникает в 90% случаев у мужчин в возрасте около 30 лет. Отличается быстрым ростом. При интенсивной химиотерапии 50% больных могут быть полностью излечены.
Лимфоплазмоцитарная лимфома (макроглобулинемия Вальденстрема) составляет 1% от общего числа НХЛ. Заболевание отличается медленным течением, но полностью его излечить нельзя. Тем не менее большинство больных живут более 5 лет.
Волосатоклеточный лейкоз относится к очень редким заболеваниям и выявляется у пожилых людей. Характеризуется медленным ростом. Некоторые больные не нуждаются в лечении.
Первичная лимфома центральной нервной системы (ЦНС) может поражать как головной, так и спинной мозг. Ранее эта опухоль считалась очень редкой, однако в настоящее время она выявляется чаще у больных СПИДом. 30% больных живут 5 и более лет.
Т-лимфобластная лимфома/лейкоз из клеток-предшественников (2%). Это заболевание можно рассматривать как лимфому или лейкоз. Различие зависит от количества опухолевых клеток в костном мозге. В случае выявления менее 25% опухолевых клеток ставится диагноз лимфомы, а более 25% - лейкоза.
75% больных составляют мужчины, а остальные 25% - женщины. Средний возраст пациентов - 25 лет. Если костный мозг не поражен, то вероятность излечения высокая, а при его вовлечении в процесс вероятность излечения не превышает 20%.
Периферические Т-клеточные лимфомы (7%) подразделяются на несколько видов:
Кожная Т-клеточная лимфома (грибовидный микоз, синдром Сезари) составляет менее 1% среди всех лимфом и выявляется в возрасте 50-60 лет. Выживаемость больных в течение 5 лет колеблется от 5 до 58% в зависимости от скорости роста опухоли.
Ангиоиммунобластная Т-клеточная лимфома характеризуется быстрым ростом и неблагоприятным прогнозом.
Экстранодальная Т-клеточная лимфома из естественных киллеров, назальный тип встречается во всех возрастных группах. Исход заболевания зависит от степени распространения опухолевого процесса.
Т-клеточная лимфома с энтеропатией возникает у людей, чувствительных к клейковине - белку пшеничной муки. Прогноз (исход) заболевания неблагоприятный.
Т-клеточная панникулитоподобная лимфома подкожной клетчатки вначале растет медленно, но со временем может стать быстрорастущей опухолью. Химиотерапия дает лишь частичный эффект.
Анапластическая крупноклеточная лимфома, Т/0-клеточная (2%) чаще возникает у молодых людей. Химиотерапия позволяет излечить многих больных.
Частота возникновения неходжкинских лимфом (нхл)
Более 90% НХЛ диагностируется у взрослых больных. Чаще всего НХЛ возникают в возрасте 60-70 лет. Риск возникновения этой опухоли увеличивается с возрастом.
Персональный риск возникновения НХЛ в течение всей жизни составляет приблизительно 1 к 50.
С начала 70-х годов отмечено почти двукратное увеличение частоты НХЛ. Это явление трудно объяснить. В основном это связывают с инфекцией, вызванной вирусом иммунодефицита человека. Частично такое увеличение можно связать с улучшением диагностики.
С конца 90-х годов наблюдается стабилизация частоты возникновения НХЛ.
НХЛ чаще выявляются у мужчин по сравнению с женщинами.
В 2002 году в России было выявлено 5532 случая НХЛ у взрослых больных.
В США в 2004 году по предварительным данным ожидается 53370 случаев НХЛ у взрослых и детей.
Факторы риска возникновения неходжкинских лимфом
Факторы риска могут быть генетическими (наследственными), связанными с образом жизни и окружающей средой.
Возраст является самым важным фактором риска возникновения НХЛ. Большинство случаев НХЛ диагностируется у людей старше 60 лет.
Врожденные нарушения иммунной системы предрасполагают не только к инфекциям, но и повышают риск развития НХЛ у детей и молодых взрослых.
Ожирение может повысить риск НХЛ.
Радиация увеличивает вероятность возникновения лейкоза, рака щитовидной железы и НХЛ. У больных, получавших лучевую терапию по поводу злокачественной опухоли, позднее повышается риск развития НХЛ. Этот риск еще более повышается при применении комбинации химиотерапии и облучения.
Бензол, гербициды и инсектициды ассоциируются с повышенным риском возникновения НХЛ.
Приобретенный иммунодефицит, вызванный применением различных препаратов у больных по поводу пересадки органов, повышает риск развития НХЛ.
Инфекции, вызванные вирусом иммунодефицита человека, сопровождаются увеличением риска возникновения некоторых типов НХЛ.
Вирус Эпштейна-Барр ассоциируется с повышенным риском развития лимфомы Беркитта и других лимфом, особенно у больных СПИДом.
Бактерия Helicobacter pylori, вызывающая язву желудка, может также привести к лимфоме той же локализации.
Устранение (по возможности) известных факторов риска может в известной степени содействовать профилактике этого заболевания.
Диагностика неходжкинских лимфом
Внимательное отношение к появившимся необычным признакам и симптомам может помочь в ранней диагностике НХЛ.
НХЛ могут сопровождаться различными симптомами в зависимости от месторасположения опухоли.
Увеличенные лимфатические узлы на шее, в подмышечной, надключичной или паховой областях могут быть легко обнаружены как врачом, так и самим больным.
При возникновении опухоли в вилочковой железе или лимфатических узлах грудной полости возможно сдавление трахеи, что приводит к кашлю, одышке и отеку верхней половины тела и лица.
Поражение лимфатических узлов живота вызывает увеличение его размеров как за счет опухолевых узлов, так и скопления жидкости. Сдавление кишки может вызывать явления частичной или полной кишечной непроходимости, что приводит к тошноте, рвоте и боли в животе.
Лимфома желудка сопровождается болью в верхних отделах живота, тошнотой, рвотой и снижением аппетита.
При НХЛ головного мозга больные отмечают головную боль, тошноту, рвоту, судороги и пр.
В случае лимфомы кожи появляется зуд, подкожное уплотнение красновато-багрового цвета.
Кроме местных симптомов могут отмечаться и общие симптомы в виде необъяснимого похудения, повышения температуры, сильных потов, особенно по ночам, и выраженного зуда кожи. Указанные симптомы указывают на наличие распространенного опухолевого процесса и ухудшают прогноз (исход) заболевания.
Следует иметь в виду, что увеличение лимфатических узлов может быть связано также с инфекцией. В связи с этим нередко назначаются антибиотики. Если в течение нескольких недель не отмечается уменьшения размеров лимфатических узлов, следует провести детальное обследование: Биопсия (взятие кусочка опухоли для исследования) является окончательным методом диагностики лимфомы. При этом биопсию могут выполнять как иглой, так и с помощью небольшой операции.
Пункция и биопсия костного мозга необходимы для выяснения наличия в нем опухолевых клеток.
Спинномозговая пункция дает возможность обнаружить опухолевые клетки в спинномозговой жидкости.
Кроме того, проводятся иммуногистохимические, цитометрические, цитогенетические и молекулярно-генетические исследования клеточного субстрата с целью уточнения типа лимфомы, что важно для определения прогноза заболевания и выбора тактики лечения.
Рентгенография грудной клетки дает возможность выявить увеличенные лимфатические узлы и вилочковую железу, а также жидкость в плевральных полостях.
Компьютерная томография (КТ) особенно целесообразна при лимфомах области головы, шеи, грудной полости, живота и области таза, так как позволяет детально изучить опухоль и окружающие органы и ткани.
Магнитно-резонансная томография (МРТ) особенно целесообразна при исследовании головного и спинного мозга.
Сканирование с галлием-67 позволяет обнаружить поражение лимфатических узлов, внутренних органов и костей.
Сканирование костной системы с помощью технеция-99 выявляет костные поражения, вызванные лимфомой.
Ультразвуковое исследование (УЗИ) дает возможность детально изучить лимфатические узлы, печень, селезенку и почки.
Определение стадии (степени распространения) неходжкинских лимфом
После детального обследования, включающего все вышеперечисленные методы, уточняется стадия лимфомы (сI - по IV) в зависимости от степени распространения опухолевого процесса.
При наличии у больного общих симптомов к стадии добавляется символ Б (или латинская буква В), а при их отсутствии - символ А.
Для прогнозирования скорости роста опухоли и эффективности лечения разработан международный прогностический индекс (МПИ), который учитывает 5 факторов, включая возраст больного, стадию заболевания, поражение не только лимфатических узлов, но и других органов, общее состояние больного, уровень лактатдегидрогеназы (ЛДГ) в сыворотке крови.
К благоприятным прогностическим факторам относятся: возраст менее 60 лет, стадии I-II, отсутствие поражения органов, хорошее общее состояние, нормальные уровни ЛДГ.
К неблагоприятным прогностическим факторам относятся: возраст пациента выше 60 лет, стадии III и IV, поражение лимфатических узлов и органов, неудовлетворительное общее состояние и повышение уровней ЛДГ.
Лечение неходжкинских лимфом
Оперативный метод имеет ограниченное применение у больных НХЛ. Обычно операция заключается в удалении части опухоли для исследования с целью уточнения диагноза.
Лишь в случае изолированного поражения какого-либо органа, например, желудка возможно хирургическое вмешательство. Однако и в этом случае предпочтение нередко отдается лучевому методу.
У больных НХЛ обычно используется наружное облучение источниками высоких энергий. У больных с I и II стадиями НХЛ облучение может быть основным методом лечения, однако чаще всего применяется комбинация химиотерапии и облучения.
Лучевую терапию можно использовать в качестве паллиативного (временно облегчающего) метода при поражении головного и спинного мозга, а также для уменьшения боли в случае сдавления нервных окончаний.
Лучевая терапия может вызывать незначительные изменения со стороны кожи и повышенную утомляемость.
Другие побочные эффекты связаны с местом облучения.
Так, лучевая терапия на область живота может приводить к энтеропатии и поносу.
Облучение грудной клетки может вызвать повреждение легочной ткани и затруднение дыхания.
Облучение легких, особенно у курильщиков, иногда приводит к развитию рака той же локализации.
Серьезные побочные эффекты облучения головного мозга проявляются через 1-2 года и включают головную боль и нарушение памяти.
Необходимо иметь в виду, что побочные эффекты химиотерапии могут усугубляться при применении облучения.
Под химиотерапией подразумевается применение противоопухолевых препаратов для уничтожения опухолевых клеток. При этом используются многие препараты и их комбинации (сочетания).
Лечение проводится в виде курсов с интервалами 2-4 недели. Химиотерапия может проводиться как в отделении, так и в поликлинических (амбулаторных) условиях в зависимости от сложности лечения, его побочных действий, состояния больного и других факторов.
Больной может получать одну или несколько схем лечения в зависимости от эффективности терапии.
Противоопухолевая терапия уничтожает опухолевые клетки, но одновременно повреждает и нормальные быстро делящиеся клетки, к которым относится костный мозг, слизистая оболочка полости рта и желудочно-кишечного тракта, волосяные фолликулы. Выраженность побочных эффектов зависит от типа, общей и суммарной дозы препарата, а также длительности химиотерапии.
В результате лечения у больного могут возникнуть: облысение, появление язв во рту, повышенная восприимчивость к инфекциям за счет снижения количества лейкоцитов, кровоточивость в результате снижения числа тромбоцитов, утомляемость при снижении уровня эритроцитов, потеря аппетита.
Указанные побочные явления являются временными и проходят после прекращения лечения.
В настоящее время имеется возможность профилактики и лечения осложнений химиотерапии назначением противорвотных препаратов, антибиотиков, факторов роста, стимулирующих выработку лейкоцитов, противовирусных и противогрибковых препаратов и т.д.
Для профилактики инфекционных осложнений необходимо:
- избегать контактов с инфекцией
- носить хирургические маски больными, посетителями и персоналом
- использовать хирургические стерильные перчатки
- тщательно мыть руки
- не употреблять сырые овощи и фрукты, а также продукты, которые могут содержать микробы
- не контактировать с детьми, которые чаще взрослых являются носителями инфекций
Синдром лизиса (распада) опухоли возникает в результате быстрого эффекта химиотерапии у больных с крупными лимфомами. Содержимое распавшихся опухолевых клеток попадает в кровоток и нарушает функцию почек, сердца и центральной нервной системы (ЦНС). Предотвратить такое состояние можно за счет назначения большого объема жидкости и таких препаратов как сода, аллопуринол.
Химиотерапевтические противоопухолевые препараты способны напрямую повреждать почки, печень, яички, яичники, головной мозг, сердце и легкие. Однако применение современных средств профилактики и лечения позволяет избежать большинство таких осложнений.
Наиболее серьезным осложнением химиотерапии является возникновения второго злокачественного заболевания, в частности лейкоза. К счастью, такое осложнение у больных лимфомами встречается редко.
Для иммунотерапии используются вещества, которые в норме вырабатываются иммунной системой. Эти вещества способны уничтожить лимфомные клетки, замедлить их рост или активизировать иммунную систему больного для эффективной борьбы с лимфомой.
Интерферон является гормоноподобным веществом, который вырабатывается лейкоцитами для борьбы с инфекцией. В настоящее время имеются различные виды интерферона. Применение интерферона может вызвать приостановку роста или сокращение лимфомы. Препарат обычно используют в комбинации с химиотерапией.
Из побочных эффектов лечения интерфероном следует отметить повышенную утомляемость, повышение температуры, озноб, головную боль, боль в мышцах и суставах, изменение настроения.
Моноклональные антитела. Антитела вырабатываются иммунной системой для борьбы с инфекциями. Моноклональные антитела производятся в лабораторных условиях и применяются для борьбы с клетками лимфомы.
При неэффективности стандартной терапии у больных лимфомами в ряде случаев применяют трансплантацию костного мозга или периферических стволовых клеток. Это позволяет использовать высокие дозы химиопрепаратов для уничтожения резистентных опухолевых клеток.
Различают трансплантацию аутологичных (от самого больного) и аллогенных (от донора) клеток костного мозга или периферической крови. Поражение костного мозга или периферической крови лимфомными клетками исключает возможность использования аутологичной трансплантации.
Костный мозг или периферические стволовые клетки получают от больного или донора до начала интенсивной химиотерапии или облучения, а затем вновь возвращают больному после проведенного лечения для восстановления показателей крови. Через 2-3 недели начинают повышаться показатели лейкоцитов, а затем - тромбоцитов и эритроцитов.
Побочные эффекты и осложнения трансплантации костного мозга и периферических стволовых клеток подразделяются на ранние и поздние. Ранние побочные эффекты принципиально не отличаются от таковых при назначении химиотерапии высокими дозами.
Лимфоплазмоцитарную лимфома (ЛПЛ) является редким типом рака , который развивается медленно и поражает в основном пожилых людей. Средний возраст на момент постановки диагноза составляет 60.
Лимфомы являются рак лимфатической системы, часть иммунной системы, которая помогает бороться с инфекциями. В лимфомы, белые клетки крови, либо В-лимфоциты или Т-лимфоциты, вырастают из-под контроля из-за мутации. В ЛПЛ, ненормальные В-лимфоциты размножаются в вашем костном мозге и вытесняют здоровые клетки крови.
Есть около 8,3 случаев на ЛПЛ на 1 млн людей в Соединенных Штатах и Западной Европе. Это чаще встречается у мужчин , и у европеоидов.
лимфому Ходжкина и лимфома не-Ходжкина различаются по типу клеток, которые становятся злокачественными.
- Лимфомы Ходжкина имеют специфический вид аномальной клеточной настоящее время , называется ячейкой Рида-Штернберга.
- Многие типы лимфом неходжкинских отличаются , где раковые заболевания начинаются и генетические и другие характеристики злокачественных клеток.
ЛПЛ является неходжкинской лимфомой , которая начинается в В - лимфоцитах. Это очень редкий лимфом, содержащее лишь около 1 до 2 процентов все лимфа.
Наиболее распространенным типом LPL является Вальденстрема макроглобулинемии (WM) , которая характеризуется аномальным продуцированием иммуноглобулина (антитела). WM иногда ошибочно называют идентичны ЛПЛ, но на самом деле это подмножество ЛПЛ. О 19 из 20 людей с ЛПЛ имеют иммуноглобулин ненормальность.
Когда ЛПЛИ вызывают В-лимфоциты (В-клетку) перепроизводства в вашем костном мозге, меньше нормальные клетки крови производится.
Как правило, B клетки перемещаются из вашего костного мозга в селезенку и лимфатические узлы. Там, они могут стать плазматическими клетками продуцировать антитела для борьбы с инфекциями. Если у вас нет достаточного количества нормальных клеток крови, она ставит под угрозу вашу иммунную систему.
Это может привести к:
- анемия , нехватка красных кровяных клеток
- нейтропения , нехватка типа белых кровяных клеток (называемых нейтрофилы), что увеличивает риск заражения
- тромбоцитопения , дефицит тромбоцитов крови, что увеличивает кровотечения и кровоподтеки рисков
ЛПЛ является медленным ростом рака, и около одной трети людей с ЛПЛ не имеет какие - либо симптомов , в то время они диагностированные.
До 40 процентов людей с ЛПЛ имеет легкую форму анемии.
Другие симптомы могут включать в себя ЛПЛ:
- слабость и усталость (часто вызвано анемией)
- лихорадка, ночная потливость и потеря веса (как правило, связаны с В-клеточных лимфом)
- затуманенное зрение
- головокружение
- нос кровоточит
- кровоточащие десны
- ушибы
- повышенная бета-2-микроглобулин, маркер крови для опухолей
Около 15 до 30 процентов из тех , с ЛПЛ имеют:
Причина LPL конца не изучена. Исследователи изучают несколько возможностей:
- Там может быть генетический компонент, как о 1 в 5 человек с WM есть родственник , который имеет LPL или подобный тип лимфомы.
- Некоторые исследования обнаружили , что ЛПЛ могут быть связаны с аутоиммунными заболеваниями , такими как синдром Шегрена или с вирусом гепатита С , но и другие исследования не показали эту ссылку.
- Люди с ЛПЛ обычно имеют определенные генетические мутации, которые не унаследовали.
Диагноз ЛПЛ трудно и обычно один из после исключения других возможностей .
ЛПЛ может походить на другие лимфомы В-клетки с подобными типами дифференциации клеток плазмы. Они включают:
Врач осмотрит вас физически и попросить вашу медицинскую историю. Они закажут работу крови и, возможно, костный мозг или биопсию лимфатического узла, чтобы смотреть на клетки под микроскопом.
Ваш врач может также использовать другие тесты , чтобы исключить подобные виды рака и определение стадии вашего заболевания. Они могут включать в себя рентген грудной клетки , КТ , ПЭТ - сканирование и ультразвук .
LBL является медленный рост рака. Вы и ваш врач может решить подождать и контролировать вашу кровь регулярно перед началом лечения. По данным Американского онкологического общества (ACS) , люди , которые задерживают лечение , пока их симптомы не являются проблематичными имеют одинаковую продолжительность жизни , как люди , которые начинают лечение , как только они диагностированы.
Некоторые препараты, которые работают по-разному, или комбинации препаратов, могут быть использованы, чтобы убить раковые клетки. Они включают:
- хлорамбуцил (Leukeran)
- флударабин (Флудара)
- бендамустин (Treanda)
- циклофосфамид (Цитоксан, Procytox)
- дексаметазон (Decadron, Dexasone), ритуксимаб (Ритуксан) и циклофосфамида
- бортезомиба (Velcade) и ритуксимаб, с или без дексаметазона
- циклофосфамид, винкристин (онковином) и преднизолон
- циклофосфамид, винкристин (онковином), преднизон, и ритуксимаб
- талидомид (Thalomid) и ритуксимаб
Конкретная схема препаратов будет варьироваться в зависимости от общего состояния здоровья, ваших симптомов, а также возможных будущих обработок.
Биологические препараты терапии являются техногенные вещества, которые действуют как ваша собственная иммунная система, чтобы убить клетки лимфомы. Эти препараты могут быть объединены с другими методами лечения.
Некоторые из этих искусственных антител, называемых моноклональных антител, являются:
- ритуксимаб (Ритуксан)
- Ofatumumab (Arzerra)
- алемтузумаб (Campath)
Другие биологические препараты иммуномодулирующих препаратов (IMiDs) и цитокины.
Целевые препараты терапии направлены блокировать определенные клеточные изменения, которые вызывают рак. Некоторые из этих препаратов были использованы для борьбы с другими видами рака, и в настоящее время исследуются для LBL. В общем, эти препараты блокируют белки, которые позволяют лимфоидные клетки продолжать расти.
Это более новая обработка , что ACS говорит , может быть вариант для молодых людей с LBL.
В общем, кроветворные стволовые клетки удаляются из кровотока и хранили в замороженном виде. Затем высокие дозы химиотерапии или облучения используются, чтобы убить все клетки костного мозга (нормальные и раковые), а исходные кроветворные клетки возвращают в кровоток. может исходить от человека Стволовые клетки лечат (аутологичных), или они могут быть переданы кем-то, кто является близким матч к человеку (аллогенных).
Имейте в виду, что пересадка стволовых клеток все еще находятся в экспериментальной стадии. Кроме того, есть краткосрочные и долгосрочные побочные эффекты от этих трансплантатов.
Читайте также:

