Ультразвуковая абляция при лечении онкологии
О.Э. Карпов, П.С. Ветшев, С.В. Бруслик, П.С. Серебряник, Е.А. Слабожанкина
ФГУ Национальный медико-хирургический центр им. Н.И. Пирогова Росздрава, Москва
В статье приведены основные физические принципы и обоснование лечебного воздействия высокоинтенсивного фокусированного ультразвука. Показаны возможности применения новой неинвазивной технологии в паллиативном лечении пациентов с новообразованиями. Приведены первые результаты применения HIFU-технологии в НМХЦ им. Н.И. Пирогова.
Ключевые слова: ультразвуковая абляция, HIFU-технология.
Увеличение продолжительности жизни онкологических больных в результате инновационных хирургических и химиотерапевтических подходов, стремление к поддержанию достойного качества жизни делают актуальным расширение спектра паллиативных вмешательств. Тем более что в Российской Федерации злокачественные новообразования преимущественно выявляются в III-IV стадии. В последние десятилетия стали применяться такие минимально инвазивные методики, как суперселективная внутриартериальная химиоэмболизация артерий, питающих опухоль, криоабляция, лазерная и радиочастотная абляции. Каждый из этих методов имеет свою терапевтическую нишу и не свободен от ряда недостатков, самым неприятным из которых является высокая частота рецидивов. Кроме того, хоть минимальное, но всё-таки хирургическое вмешательство невозможно у ослабленного пациента и требует серьёзной предоперационной подготовки.
В 1950 г. впервые Frank Fry и соавт. [5] успешно применили High Intensive Focused Ultrasound – HIFU-технологию – для разрушения патологического очага в головном мозге пациента с болезнью Паркинсона, не повреждая при этом здоровые ткани. До конца ХХ века препятствием для развития метода являлось не только несовершенство аппаратов, но и невозможность контролировать сам процесс воздействия. Первые промышленные установки, лишённые вышеназванных недостатков, появились в 1997 году, и уже в начале следующего века во многих странах (Германия, Италия, Франция, Япония, Австралия и др.) новая неинвазивная технология, основанная на использовании высокоинтенсивного фокусированного ультразвука, стала применяться в клинической практике [6]. Самый большой опыт УЗ-абляции для лечения новообразований различной локализации накоплен в Китае [7,10].
Принцип действия лечебного высокоинтенсивного фокусированного ультразвука такой же, как и в диагностике, и основан на способности ультразвуковой волны проходить сквозь ткани, не повреждая их. Фокусировка ультразвуковой волны с помощью специальной линзы приводит к повышению температуры и развитию тканевого коагуляционного некроза (локальный очаг повреждения) [1,8,9]. Несмотря на использование при этом более низких, чем в диагностических целях, частот (0,8-3,5 МГц), энергетический уровень ультразвуковой волны на несколько порядков выше, чем при стандартном диагностическом УЗИ.
Важно отметить, что известные до настоящего времени виды абляции опухолей (радиочастотная, криогенная, лазерная, микроволновая) требуют непосредственного контакта с опухолью, в связи с этим для подведения энергии используются специальные проводники – аппликаторы [8]. При ультразвуковой абляции необходимости во введении специальных проводников нет – лечение осуществляется без нарушения целостности кожных покровов или слизистой оболочки – неинвазивно.
Повреждающее действие HIFU достигается с помощью сочетанного действия трёх механизмов: первый – превращение механической энергии в тепловую, второй – запуск кавитации и третий – прямое повреждение сосудов, питающих опухоль [2,3]. После повышения температуры в очаге выше 90°С в течение всего 1 секунды развивается немедленная термическая гибель клеток, приводящая к коагуляционному некрозу. Инерциальная кавитация менее предсказуема, обычно она происходит синхронно с термокоагуляцией. В результате циклических колебаний тканей, вызванных ультразвуком, возникают эффекты сжатия и разрежения. Во время разрежения газ выходит из раствора, образуя пузырьки, которые мгновенно лопаются, и также происходит некротизация тканей. Кроме того, воздействие высокоэнергетического фокусированного ультразвука вызывает прямое повреждение питающих опухоль сосудов, что нарушает трофику ткани опухоли [11,12].
В настоящее время HIFU применяется для лечения пациентов с солидными новообразованиями печени, молочных желез, почек, предстательной железы, фибромиомами матки.
Существуют устройства двух типов: экстракорпоральные и контактные. Аппараты для экстракорпорального лечения оборудованы низкочастотными с более высокой интенсивностью излучения датчиками большого диаметра, в отличие от контактных, работающих на сверхкоротком расстоянии с высокой частотой и более низкой интенсивностью. Для контактной терапии используются трансректальные датчики (заболевания предстательной железы), гинекологические и специализированные, применяемые в отоларингологии.
Для проведения ультразвуковой абляции в настоящее время используют несколько промышленных моделей аппаратов. Наибольший терапевтический спектр имеет полифункциональная модель для экстракорпорального лечения, разработанная в Китае (Модель JC Focused Ultrasound Therapeutic System, Chongqing HAIFU Technology Company, China). Для наведения и интраоперационного контроля в аппарате применяется ультразвук. Лечебный датчик представлен пьезоэлектрической 12 см линзой с фокусным расстоянием 10-16 см и изменяющейся частотой излучения от 0,8 до 1,6 МГц. Излучение достигает очень большой интенсивности – до 20 000 Вт/см 2 .
Перед проведением УЗ-абляции проводят обязательное обследование пациента, в том числе: морфологическую верификацию, КТ или МРТ с внутривенным контрастированием, УЗИ с цветовым доплеровским картированием и, при целесообразности, определение онкомаркеров.
Процедура дистанционной УЗ-абляции проходит в два этапа. Первый этап является наиболее важным для успешного проведения лечебного воздействия – выполнение разметки. В ходе её определяют глубину расположения и достижимость опухоли, ее структуру, взаимоотношение с окружающими органами, а также производят предварительное разделение опухолевого узла на отдельные срезы.
Второй этап – непосредственно лечение, которое обычно начинают с центральных срезов, путем единичных пробных соникаций (воздействий) с использованием низких энергий. Для поэтапной обработки всего опухолевого очага по выбранным в ходе разметки срезам, постепенно, по мере прогревания узла, повышается энергия и смещается зона фокуса. В ходе манипуляции за счет формирования очага деструкции изменяется эхогенность образования (рис.1).
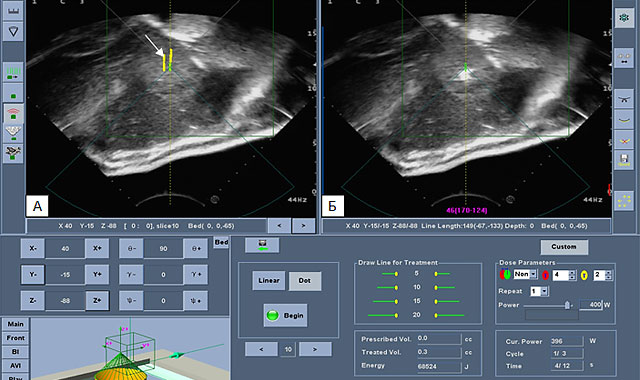
Рис.1. Ультразвуковая интраоперационная сканограмма. А – зона воздействия обозначена стрелкой.
Б – серошкальные изменения в метастатическом очаге в печени (собственное наблюдение).
Для технического выполнения процедуры морфологическое строение опухоли, ее размеры, количество очагов не имеют значение. Хоть именно эти критерии существенно влияют на продолжительность жизни пациента. Одним из важных преимуществ УЗ-абляции считается возможность воздействия на опухоли, расположенные вблизи крупных сосудов (рис.2) и в печеночно-двенадцатиперстной связке (рис.3).
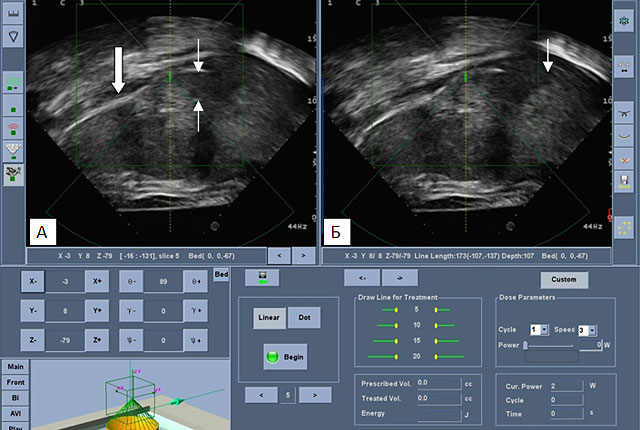
Рис.2. Ультразвуковая интраоперационная сканограмма метастаза в печени, расположенного вблизи НПВ.
Узкими стрелками на рис. А и Б – образование в печени, широкая стрелка на рис. А – НПВ (собственное наблюдение).
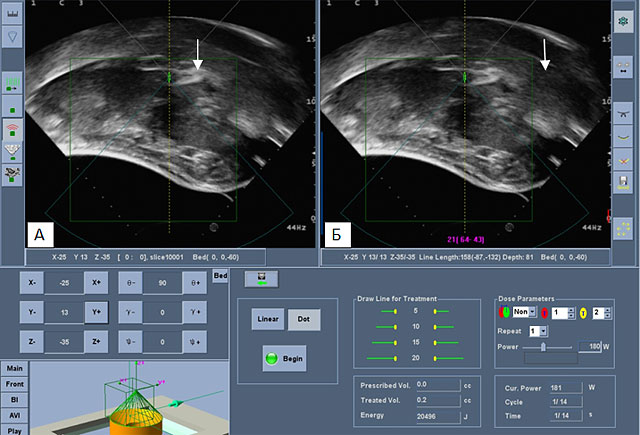
Рис.3. Ультразвуковая сканограмма метастаза в лимфатические узлы печеночно-двенадцатиперстной связки.
Обозначен стрелками на рис. А и Б (собственное наблюдение).
В течение 7 суток после воздействия в зону очага деструкции мигрируют полиморфноядерные лейкоциты, с последующим образованием содержащих незрелые фибробласты грануляций и формированием по периферии зоны некроза новых капилляров (рис.4).
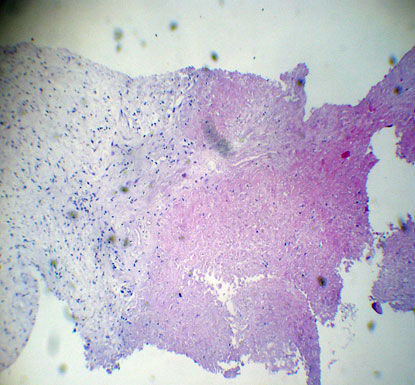
Рис.4. Микрофото. Морфологическая картина некроза метастатического узла (1) после выполнения УЗ-абляции и нейтрофильной инфильтрации прилежащей ткани печени (2); на границе зоны некроза и ткани печени отсутствуют признаки опухолевого роста (3) (окраска гематоксилин-эозин; ув.×80).
Далее в течение двух недель периферическая часть зоны воздействия замещается пролиферирующей фиброзной тканью [4,9]. Стадийность и сроки фиброза в зоне воздействия пока детально не изучены, однако морфологические исследования достоверно свидетельствуют о постепенном сморщивании ткани, подвергшейся воздействию HIFU, и замещению некротической ткани фиброзной.
Для оценки результатов воздействия (определения васкуляризации, объема опухоли и прочего) используют УЗИ с цветовым доплеровским картированием, КТ с внутривенным контрастированием или МРТ, позитронно-эмиссионную томографию.
В 2009 г. в НМХЦ им. Н.И. Пирогова HIFU-технология была использована у 43 пациентов с метастазами различных злокачественных новообразований в печень, у 2 – с гемангиомами печени, 2 – аденомы крючковидного отростка поджелудочной железы и 2 – опухоль тела поджелудочной железы, метастаз в надпочечник – 1.
Клиническое наблюдение пациентки А, 32 года
В декабре 2008 г. по поводу рака прямой кишки T3N1M1 с метастазами в печени была выполнена передняя резекция прямой кишки, резекция 3-8 сегментов печени.
Морфологически: умеренно-дифференцированная аденокарцинома.
У больной отмечалось незначительное снижение уровня гемоглобина до 98 г/л, показатели функции печени и почек в пределах нормы.
После предварительной разметки на аппарате HIFU пациентке под эндотрахеальным наркозом с наложением искусственного гидроторакса справа была выполнена УЗ-абляция метастаза в печени. Пролечено 7 срезов со средней энергией 284 Вт. Операцию перенесла удовлетворительно.
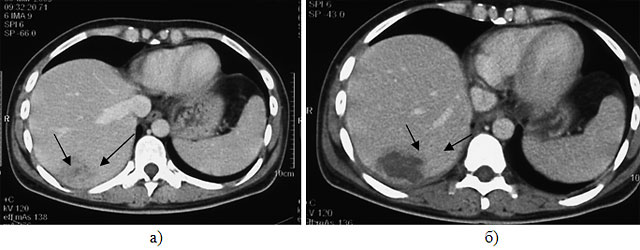
Рис.5. Компьютерная томограмма органов брюшной полости с внутривенным контрастированием до (а) и после (б)
выполнения ультразвуковой абляции метастаза печени (стрелками указан очаг в печени).
При контрольной КТ органов брюшной полости с внутривенным контрастированием через неделю после операции (рис.5) отмечено уменьшение накопления контрастного препарата в узле, зона абляции – 85%, что достаточно для полной регрессии опухоли [1,10,13,14].
Наблюдение за данной пациенткой продолжается в течение 9 месяцев. За данный срок, на фоне продолжающейся химиотерапии, прогрессирования заболевания не выявлено. Отмечено уменьшение размеров (более чем на 50%) метастаза в печени после УЗ-абляции.
Клиническое наблюдение пациента А, 67 лет
В феврале 2008 г. по поводу низкодифференцированного плоскоклеточного рака пищевода с метастазами в регионарные лимфатические узлы выполнена экстирпация с пластикой трубкой, выкроенной из большой кривизны желудка. Адьювантной терапии не проводилось.
При контрольном ультразвуковом исследовании в апреле 2009 г. в печени в проекции 5, 7 и 7-8 сегментов определяются гипоэхогенные образования с ровными, четкими контурами, неоднородной структуры, перинодулярным кровотоком, размерами 4.9×5.7 см (7-8 сегмент); 4.2×4.4 см (7 сегмент), и 4.0×3.0 см (5 сегмент).
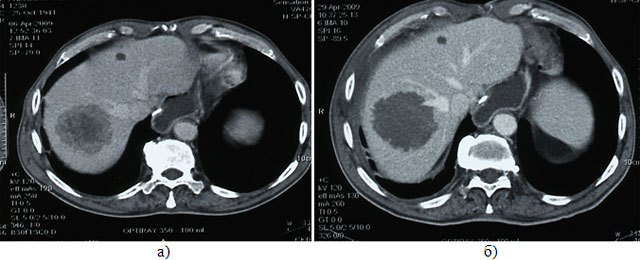
Рис.6. Компьютерная томограмма органов брюшной полости с внутривенным контрастированием до (а) и после (б)
выполнения ультразвуковой абляции метастаза печени.
По данным обследования отмечается незначительное повышение уровня печеночных ферментов. Пациенту после предварительной разметки на аппарате HIFU под эндотрахеальным наркозом с наложением искусственного гидроторакса справа была выполнена УЗ-абляция одного метастаза в печени. Пролечено 10 срезов со средней энергией 398 Вт. Операцию пациент перенес удовлетворительно.
При контрольном обследовании через неделю после операции изменений в биохимическом анализе крови не выявлено. По данным КТ органов брюшной полости с внутривенным контрастированием отмечено отсутствие накопления контрастного препарата в узле, зона абляции составила 100% (рис.6).
Наблюдение за пациентом продолжается в течение 6 месяцев. Через 3 месяца после УЗ-абляции данными чрескожной чреспеченочной биопсии подтверждено наличие некроза в обработанном очаге в печени. На фоне продолжающейся химиотерапии прогрессирования заболевания не отмечено.
Таким образом, приведенные клинические наблюдения демонстрируют реальные возможности применения HIFU-технологии у пациентов с распространёнными злокачественными заболеваниями с паллиативной целью.
Наши первые результаты использования фокусированной ультразвуковой абляции в лечении опухолей паренхиматозных органов брюшной полости и забрюшинного пространства подтверждают данные большинства специалистов о безопасности, эффективности и хорошей переносимости метода [3,8,15,16].
Мы продолжаем дальнейшее накопление клинического материала для всесторонней клинической оценки метода, его ближайших и отдаленных результатов, обоснования применения его и при других локализациях новообразований.
Сайт использует файлы cookies для более комфортной работы пользователя. Продолжая просмотр страниц сайта, вы соглашаетесь с использованием файлов cookies, а также с обработкой ваших персональных данных в соответствии с Политикой конфиденциальности.
Радиочастотная абляция — это удаление патологически измененных тканей выжиганием электрическим током определенной частоты — радиочастоты. Ток создается электрическим генератором, а подается к патологическому участку внутри органа по электроду, форма которого определяется технической задачей и размером новообразования. В некоторых ситуациях используется несколько электродов.
- Что представляет РЧА
- Насколько радикальна абляция
- При каких заболеваниях применяется радиочастотная абляция
- Какие осложнения могут быть?
- Какая абляция считается успешной?
Что представляет РЧА
Радиочастотная абляция или РЧА приводит к электрическому ожогу, но без электротравмы, как бывает при ударе молнии или соприкосновении с открытым электрическим проводом, щадящее воздействие медицинской процедуры обусловлено частотой воздействующего на человека тока.
Нагревание тканей при РЧА приводит к их коагуляции, аналогично свертыванию молока. Температура нагрева электродом тканей зависит от цели вмешательства: при злокачественных процессах опухолевые массы доводят до температуры кипения, для снятия боли в позвоночнике при радикулите достаточно воздействовать на нервное окончание 42°С, для прижигания проводящих путей сердца при аритмии бывает довольно 60°С.
РЧА инвазивный метод, то есть предполагает внедрение внутрь организма. Поскольку в патологическую зону внедряют электрод небольшого диаметра — это малоинвазивная методика. Вмешательство хирургического толка, поэтому требуется обезболивание, но не глобальное — не наркоз, а кратковременная анестезия: внутривенная или спинномозговая.
Результат радиочастотной абляции не быстрый, как при традиционной хирургии, от ожога до формирования полноценного соединительнотканного рубца проходит несколько месяцев. Сама манипуляция занимает несколько минут: при лечении злокачественной опухоли — около четверти часа, при купировании радикулита — до 2 минут, при аритмии и для облитерации варикозной вены — секунды. Со скоростью воздействия связана краткость периода послеоперационного восстановления пациента — не более суток, и минимальный болевой синдром после процедуры. Всё это отражается на стоимости лечения, поэтому РЧА дешевле традиционной операции.
Врачи Европейской клиники о радиочастотной абляции:

Насколько радикальна абляция
Основное достоинство метода РЧА в возможности удаления патологических изменений без разреза тканей. Тем не менее, радиочастотная абляция может совмещаться с открытой операцией через классический разрез, в некоторых клинических ситуациях для более точного подведения электродов используют эндоскопию — лапароскопию.
При доброкачественных процессах, при дисплазии и облигатном предраке РЧА абсолютно адекватна и позволяет полностью и навсегда вылечить заболевание.
Радиочастотную абляцию даже при раке и метастазах можно делать несколько раз, так после первой манипуляции через несколько часов или дней можно повторить процедуру, чтобы довести коагуляцию до идеала или повторить вмешательство при рецидиве через несколько месяцев или лет. Частота манипуляции определяется онкологической целесообразностью.
Не подвергается сомнению онкологическая радикальность при комбинировании РЧА с открытой операцией, что практикуется при удалении злокачественных опухолей внутренних органов, когда абляции подвергают очаги, иссечь которые технически невозможно. Хирургически иссекается всё, что можно удалить, на остальные опухолевые массы воздействуют электротоком, повышая шансы больного с процессом большой распространенности на полное излечение.
При каких заболеваниях применяется радиочастотная абляция
Основные показания для РЧА — злокачественные новообразования внутренних органов и предраковая гинекологическая патология. Вклад абляции в онкологию переоценить невозможно, потому что методика расширила возможности терапии метастатических и рецидивных процессов, технически не подлежащих удалению, в том числе у пациентов с ограничениями к оперативным вмешательствам из-за возрастных изменений и сопутствующих хронических болезней.
Особенно активно РЧА применяется в онкологии:
- при единичных метастазах рака разных органов в печени, в том числе вместе с одновременной резекцией другой доли;
- при почечноклеточном раке, когда у больного только одна почка или вторая в достаточной мере не функционирует, а также при невозможности операции из-за исходного нездоровья пациента;
- при 1-2 стадиях немелкоклеточного рака легкого у отягощенных возрастными болезнями или тяжелой хронической патологией пациентов, а также при нескольких метастазах в разных долях легкого или при рецидиве после операции;
- при злокачественных опухолях костей, особенно растущих в позвоночнике, и вызывающих очень сильные боли метастазах;
- при саркомах мягких тканей и раке предстательной железы, а также при осложнениях после облучения прямой кишки и многих других состояниях.
Абляция дает отличные результаты при предраковых процессах шейки матки и эндометрия, полностью излечивает при угрожающем озлокачествлением пищеводе Барретта.
Основное ограничение во всех ситуациях — размер новообразования, для легких не более 4 сантиметров, для других областей не больше 7 см, но лучшие результаты достигаются при среднем диаметре — до 5 см.
Второе ограничение — локализация не рядом с крупными сосудами, во-первых, возможна тепловая травма, во-вторых, происходит быстрое охлаждение участка из-за кровотока, что снижает результативность РЧА.
Третье противопоказание — нарушение свертываемости крови и инфекции.
Какие осложнения могут быть?
Радиочастотная абляция — вмешательство с проникновением во внутренние органы, поэтому возможно кровотечение или образование гематомы, но вероятность их развития меньше процента. Частота таких типично хирургических осложнений выше при открытом способе вмешательства, нежели при чрескожном введении электродов. При сочетании с операцией возрастает и вероятность кровотечения, но тоже меньше 10%.
Характерная для манипуляции нежелательная реакция — постабляционный синдром, обусловлена ответом организма на вмешательство с электрическим ожогом, а также всасыванием продуктов клеточного распада при коагуляции белков. Продолжительность синдрома — от нескольких часов до двух суток. Пациентов беспокоит слабость, реже — болезненность в зоне манипуляции, умеренное повышение температуры.
В подавляющем большинстве случаев РЧА переносится хорошо, если и случается постабляционный синдром, то в легкой форме на 1-2 дня. Однозначно, положительный результат вмешательства на порядки превышает вероятность осложнений.
Какая абляция считается успешной?
Эффективность вмешательства оценивается по результату, но РЧА локальное воздействие и не способно приостановить появление метастазов в других анатомических зонах, поэтому не исключает последующей химиотерапии.
После вмешательства результат контролируется несколько раз на первой неделе и в дальнейшем регулярно выполняется УЗИ или КТ, отслеживающие процесс формирования некроза и его переход в рубец. На определенных этапах потребуется МРТ с контрастированием, дающая более точную информацию о течении процесса.
Итог любой РЧА — образование на месте опухоли рубца, но на это требуется несколько месяцев.
Локальное воздействие на метастаз или первичную опухоль с помощью высокочастотного электрического тока в 80-90% гарантирует отсутствие злокачественных клеток в зоне вмешательства, но не предотвращает общее прогрессирование рака. Абляция применяется при невозможности хирургического лечения, то есть в неоперабельной ситуации, и не только уничтожает опухоль, но позволяет пациенту жить лучше и дольше, чем без неё, а нередко становится радикальным способом лечения рака.
Эффективность РЧА и её своевременность зависимы от опыта и таланта специалиста, её выполняющего, от доступных ему диагностических возможностей. В нашей клинике имеется всё для высококвалифицированной медицинской помощи и экспертного качества эндоскопической хирургии в онкологии.
Как ультразвук лечит рак
HIFU (англ. High Intensity Focused Ultrasound) – высокоинтенсивный сфокусированный ультразвук. Сущность HIFU-метода при абляции (удалении) новообразований заключается в местном узконаправленном воздействии на ткани организма сфокусированным ультразвуковым пучком. При этом в тканях, являющихся объектом терапии, происходит ряд процессов, вызывающих термический некроз очага заболевания.
Врач управляет операцией с помощью специального аппарата, способного фокусировать волны ультразвука в необходимом объеме. Тепловая энергия вырабатывается только в нужном участке, не затрагивая соседние здоровые ткани и области, через которые проходит ультразвуковая волна. Воздействие обычно продолжается доли секунд и охватывает участок тканей (спот) размером около 10 кубических миллиметров. При необходимости выполняется несколько подходов. Варьируя продолжительность и интенсивность сеанса, врач может уничтожить с помощью пучка ультразвука опухоль любого размера и формы.

Важными преимуществами HIFU-терапии являются возможность многократного применения без существенных побочных эффектов, а также отсутствие необходимости в госпитализации пациента. С помощью ультразвука можно лечить самые разные опухоли: печени, почек, молочных желез, предстательной железы и других органов и тканей.
При HIFU-лечении возникают два вида воздействия: тепловое и нетепловое. Под влиянием фокусированного ультразвука температура в заданной точке повышается до 60-90 градусов, и раковые клетки умирают – это тепловой эффект от терапии. Нетепловое воздействие при высоких интенсивностях заключается в эффекте акустической кавитации.
При лечении ультразвуковой терапией полностью отсутствуют побочные эффекты, которые возникают при лучевой или радиотерапии рака, так как нет самого факта облучения. Уровень HIFU-энергии во много раз выше, чем при УЗИ-диагностике, и все же он не сравним с адронной терапией или рентгеном. В связи с этим в HIFU-лечении нет ограничений по продолжительности сеанса. Метод может применяться как самостоятельно, так и в комплексе с другими вариантами лечения. Все перечисленные нюансы делают HIFU-терапию достаточно универсальным методом для лечения рака у людей любого возраста и состояния здоровья.
История метода и состояние HIFU в России
Сегодня HIFU-терапия успешно применяется в клиниках многих стран Европы и Азии. История ее изучения началась в 1942 году, когда была опубликована первая работа о возможностях HIFU. Позже в США братья Фрай используют фокусированный ультразвук для лечения неврологических заболеваний. В 1956 году А.К. Буров впервые предлагает применять HIFU для лечения онкобольных. Однако технологии мониторинга в то время были недостаточными, чтобы применить метод на практике. С развитием УЗИ и МРТ (магнитно-резонансной томографии) эффективный контроль за процедурой стал возможен, и началось ее повсеместное применение и развитие. За последние десятилетия получен большой опыт использования HIFU, в том числе и в России.
В апреле 2018 года Новосибирский приборостроительный завод (НПЗ) и СПбПУ приступили к созданию отечественного аппаратно-программного комплекса для диагностирования и терапии новообразований с помощью HIFU . Научная часть проекта и разработка прототипа комплекса выполняется Лабораторией ультразвуковых технологий СПбПУ. Производиться комплекс будет на базе НПЗ.
HIFU-комплекс будет состоять из силового электронного модуля, медицинской стойки с монитором и панелью управления, роботизированного манипулятора, ультразвукового блока с комбинированным диагностическо-терапевтическим пьезопреобразователем и кресла для пациента с устройством иммобилизации.
HIFU-терапия очень востребована в нашей стране, ведь ежегодно от рака умирают около 300 тысяч россиян, и борьба с онкозаболеваниями носит статус национального приоритета.

-
Содержимое:
- HIFU абляция онкологии простаты – что это
- Показания и противопоказания к HIFU
- Как проводится HIFU лечение рака простаты
- Подготовительный этап
- Ход ультразвукового лечения
- Состояние пациента после HIFU
- Плюсы и минусы лечения рака простаты HIFU
Современные способы диагностики позволяют дифференцировать онкозаболевание предстательной железы на ранних стадиях развития. В этот период опухолевый процесс имеет строгую локализацию развития и обычно не выходит за пределы капсулы, что открывает возможности для применения малоинвазивных операций.
HIFU терапия при раке простаты получила широкое применение благодаря своей результативности и минимальному количеству побочных эффектов после удаления злокачественной опухоли.
HIFU абляция онкологии простаты – что это
Принцип методики HIFU достаточно простой. Раковая опухоль обрабатывается ультразвуком с высокой частотой воздействия. Сфокусированная волна нагревает ткани до температуры 100-110°С, что и приводит к началу некротических явлений.

Лечение простаты ультразвуком превосходит по своей результативности обычную полостную операцию и простатэктомию. Хирургическим скальпелем невозможно подобным образом бережно удалить злокачественную опухоль, не повредив здоровые ткани.
Оборудование для HIFU простаты состоит из нескольких элементов:
- Хирургический стол.
- Система визуального контроля – с помощью ультразвукового датчика врач во время операции полностью контролирует направленность воздействия и следит за ходом удаления опухоли.
- Источник направленного ультразвука.
- Блок управления – система позволяет выбрать необходимую интенсивность воздействия и зону обработки тканей.
Высокоинтенсивный фокусированный ультразвук при лечении рака предстательной железы позволяет быстро удалить злокачественное образование любого объема в течение 60-180 минут.
HIFU терапия рака простаты назначается на 1-2 стадии онкологии, классифицированной 6-7 баллами по Глисону. Показания к проведению ультразвуковой хирургии:
- Отсутствие инфильтрации и метастазирования.
- Локализация опухоли в пределах простатической капсулы.
После появления метастаз в других органах, HIFU терапия не проводится по причине малой эффективности. Лучшие результаты были получены при лечении локализованного рака 1-2 степени, с низкой агрессивностью.
Результативность ультразвукового удаления опухоли превышают 80%. Четыре пациента из пяти после оперативного вмешательства прожили дольше 8 лет.
Как проводится HIFU лечение рака простаты
Перед проведением ультразвукового лечения пациента госпитализируют приблизительно за сутки. В условиях клиники больного подготавливают к операции. Перед HIFU терапией, приблизительно за 6-7 часов требуется отказаться от приема пищи и воды. Непосредственно перед удалением опухоли ставят очистительную клизму.
Для успешного проведения HIFU терапии используется мировой опыт выполнения хирургических операций. Современные методики обеспечивают наилучший результат ультразвукового хирургического вмешательства и позволяют выделить три основных этапа лечения:
- Подготовку.
- Ультразвуковое удаление опухоли.
- Реабилитация.
HIFU терапия в лечении рака предстательной железы эффективна только при отсутствии метастазирования и инфильтрации в соседние органы. Пациента готовят к операции и определяют, насколько в его случае будет целесообразной ультразвуковая абляция.
Предоперационные мероприятия проходят в несколько этапов:
- Дифференциальная диагностика — абляция предстательной железы высокоинтенсивным ультразвуком эффективна исключительно на ранней стадии онкозаболевания. Пациенту предлагают сделать пункцию для определения степени агрессивности по Глисону, пройти МРТ, чтобы дифференцировать стадию развития рака.
- Выбор типа анестезии — HIFU абляция простаты выполняется под общим наркозом. Ввиду особенностей организма пациента: наличия аллергических реакций, нарушений в работе сердечно-сосудистой системы, проведение хирургической операции может проходить под эпидуральной анестезией.
Для уменьшения стресса, непосредственно перед абляцией рекомендован прием седативных средств. - Психологическая подготовка — пациенту объясняют ход операции, рассказывают о возможных осложнениях после HIFU терапии. В конце консультации получают письменное согласие на проведение абляции.
Хирургическая операция проходит следующим образом:
- Устанавливается цистостома в мочевой пузырь. Дренаж необходим для отвода жидкости. Приблизительно на 3-4 день после проведения операции трубку вынимают, мочеиспускание нормализуется.
- В прямую кишку вводят ультразвуковой датчик, предварительно смазанный гелем.
- Под контролем УЗИ намечается зона воздействия.
- Проводится выжигание опухоли ультразвуком. Лучами медленно обрабатываются злокачественные ткани. Фокусированный ультразвук высокой интенсивности нагревает ткани до температуры выше 100°С, что провоцирует некроз опухоли.
Узконаправленный луч обеспечивает высокую точность хирургических манипуляций с максимальной погрешностью не более 1-2 мм.
Последствия абляции связаны с появлением отечности вследствие повреждения тканей предстательной железы. Возможные осложнения в постоперационный период носят временный характер и проходят самостоятельно.
Сразу после абляции онкологической опухоли наблюдаются следующие побочные последствия:
- Гематурия — кровь в моче присутствует в течение нескольких недель после удаления опухоли. С жидкостью из организма отходят омертвевшие ткани. Пациенту рекомендуется пить большое количество воды, чтобы облегчить диурез.
- Нарушение оттока мочи — осложнение связано с развитием отечности предстательной железы. Через месяц после HIFU простата выглядит как полностью здоровая железа: уменьшается в размерах, все некротические процессы полностью останавливаются.
В период реабилитации наблюдаются следующие осложнения: подтекание мочи, частые ночные позывы в туалет. Постепенно состояние нормализуется. - Ректальные симптомы — восстановление организма после HIFU занимает несколько месяцев. В этот период наблюдаются: жидкий стул, обострение или развитие геморроя.
Перечисленные осложнения носят временный характер и постепенно проходят без необходимости в дополнительной терапии.
Долгосрочные осложнения включают:
- Непроизвольное мочеиспускание, возникающее при кашле, резких движениях.
- Нарушение эректильной функции, импотенция.
- Бесплодие.
Эффективность HIFU абляции составляет 80-83%. Несмотря на высокую результативность, существует вероятность осложнений, требующих повторной госпитализации пациента.
Обратиться за медицинской помощью необходимо при следующих симптомах:
- Сильный болевой синдром, не проходящий после приема анальгетиков и спазмолитиков.
- Температура, озноб, рвота.
- Кровотечения.
- Длительная задержка мочи.
Положительные результаты HIFU лечения местнораспостранненого рака простаты намного превышают все риски, связанные с проведением операции. На ранних стадиях онкозаболевания ультразвуковое лечение практически не имеет аналогов по своей эффективности, небольшому периоду реабилитации и минимальному количеству осложнений.

Клинически доказано, что ультразвук дает положительные результаты свыше, чем в 80% случаев. Методика абляции достаточно новая, поэтому возможность испытать длительность терапевтического воздействия отсутствует.
На данный момент статистика указывает на несколько онкологических результатов лечения пациентов с раком предстательной железы при помощи HIFU терапии:
- Продолжительность жизни увеличивается в среднем на 8 лет.
- Вероятность рецидива раковой опухоли сразу после операции не более 17-20%.
Всемирно известные урологические центры и клиники с успехом используют метод ультразвуковой терапии около 10 лет. В России HIFU абляцию проводят всего в нескольких больницах.
Урологические клиники по лечению рака простаты ультразвуком:
- Израиль — Tel Aviv CLINIC; МЦ им. Рабина; Ассута и др.
- Россия — опыт в проведении абляции имеют специалисты НИИ Урологии и клиники урологии Фронштейна.
Прежде чем выбрать медицинский центр, где будет проходить операция, стоит учесть отзывы пациентов, вероятные риски, профессионализм врачей и стоимость лечения HIFU. В Израиле ультразвуковое вмешательство обойдется приблизительно в 20000$. В России подобное лечение будет стоить 3500-5000$.
Отсутствие негативного влияния ультразвука на простату, точность иссечения тканей, минимальное количество побочных эффектов делает HIFU терапию одной из самых востребованных малоинвазивных методик. Популярность ограничивает возможность применения способа исключительно на ранних стадиях онкологии и относительно высокая стоимость операции.
Читайте также:

