Прогресс в лечении рака за последние 10 лет
Возможно ли обмануть рак? Ученые уверены, в арсенале организма есть антитела, способные расправиться со смертоносными клетками. Но, если бы все было так просто… Болезнь и сама может обмануть организм, замаскировавшись под здоровые клетки. В результате, частичное или полное отсутствие болевых синдромов позволяет онкозараженным клеткам развиться до неоперабельной стадии. Только в минувшем году онкология забрала юмориста Михаила Задорнова, всемирно известного оперного баритона Дмитрия Хворостовского, американского певца Чарльза Бредли, композитора Владимира Шаинского и еще тысячи людей по всему миру.

Данные о ежегодном росте числа онкобольных шокируют. Согласно статистике, через 15 лет каждый житель планеты будет болен раком. Об этом в интервью Пятому каналу рассказал Юрий Покровский, кандидат медицинских наук.

Самый распространенный вид борьбы с раком — хирургическое вмешательство. Удаление пораженного органа может излечить пациента, если только опухоль не пустила метастазы, тогда грядет череда курсов химиотерапии и постоянное беспокойство — поможет ли…
Открытие, способное уничтожить одну из самых опасных форм онкологии — рак головного мозга, сделали ученые из лондонского Университета Лидса и Института изучения рака. Именно рак мозга убил певицу Жанну Фриске и баритона Дмитрия Хворостовского. Ученые выяснили, что с опухолью могут бороться некоторые типы вирусов. Об этом сообщил журнал Science Translational Medicine. В ходе исследования реовирусов, оказалось, что они способны преодолевать гемато-энцефалический барьер, защищающий мозг позвоночных от микроорганизмов.

Девять онкопациентов получали капельницы с реовирусом, после курса им удалили опухоли хирургическим путем. Ученые исследовали удаленные клетки рака и установили, что вирус смог размножиться и атаковать пораженные клетки, тем самым активировав иммунную систему на борьбу с опухолью. Принцип действия нового метода раскрыл соавтор исследования профессор Алан Мельчер:

Вирус быстро распознал рак, и иммунитет начал свою борьбу с ним. Исследователи полагают, что вирусные капельницы станут хорошим подспорьем в сочетании с другими методами лечения. Идею высоко оценил Евгений Черемушкин, старший научный сотрудник Института клинической онкологии ОНЦ РАМН.


Видео: youtube / New Scientist
Победа над болезнью не всегда позволяет вернуться к прежней жизни. В петербургском онкоцентре постоянно ведется работа по реабилитации пациентов, победивших недуг. Специалисты этого медучреждения изобрели инновационный метод голосового протезирования, который уже называют главным достижением 2017 года. Врачи вернули голос 80 пациентам, пережившим рак гортани, при котором полностью удаляется трахея и человек теряет способность говорить.

Действительно, ученые доказали, что не только банальное курение может вызвать рак, но и, например, увеличение груди, а именно, воздействие силиконового импланта на организм. Злую шутку могут сыграть и лекарства. Так Минздрав предписал указывать на некоторых препаратах для лечения аденомы простаты и облысения, что они могут привести к раку груди у мужчин, так как содержат опасное вещество финастерид. Таких примеров много. Спровоцировать меланому — рак кожи — может агрессивное солнце. Опасность повсюду и надо быть на чеку.
Достижения науки за минувшее десятилетие, которые сегодня используют врачи
2 января 2020 10:55
Раньше открытия генетиков не имели практического применения в клинической медицине, но в последние годы генетика сделала огромный рывок. В первую очередь речь идет о лечении онкологических заболеваний, но не только их.
Например, теперь у врачей есть возможность находить у онкологического больного специфичные для раковых клеток генетические изменения и воздействовать на них точечно — это называется таргетная терапия или биологическое лечение. Также можно определить, есть ли у пациента мутации, которые могут стать основой для позитивного прогноза при иммунотерапии. Соответственно, врачи сегодня заранее подбирают пациенту лекарства, которые с высокой вероятностью помогут в его конкретном случае. (О подобном обследовании я уже рассказывал раньше).
Еще один пример — лечение рака груди, самого распространенного онкологического заболевания у женщин и второго по распространенности после рака легкого онкологического заболевания в целом. До недавнего времени все женщины, заболевшие раком молочной железы, на ранних стадиях, когда еще нет метастаз, получали оперативное, гормональное (в гормоноположительных случаях) лечение и химиотерапию. В развитых странах около десяти лет назад появилась возможность проводить генетические исследования, которые позволяют определить необходимость и, главное, полезность химиотерапии для конкретной заболевшей женщины. Однозначно доказано, что 70% пациенток с эстрогеноположительной опухолью было достаточно оперативного лечения и гормонотерапии, химиотерапия им была не нужна.
К сожалению, в странах бывшего СССР генетическое исследование гормонозависимого рака молочной железы до сих пор не стало стандартом, даже в самых дорогих и престижных клиниках.
Обычная химиотерапия оказывает системное влияние на весь организм человека, уничтожая как раковые, так и здоровые клетки. Это и опасно, и очень тяжело переносится пациентами. В последнее десятилетие в клиническую практику ввели новые препараты биологической и иммунотерапии, действующие по иным принципам:
Биологические препараты действуют точечно, уничтожая только генетически измененные раком клетки организма и не затрагивая здоровые. Например, Зельбораф (Zelboraf) блокирует серин-треонин киназу, которая кодируется геном BRAF, а тот, в свою очередь, является ответственным за развитие меланомы. Пациенту делают генетическое исследование и, если подтверждается мутация BRAF, Зельбораф становится спасением.
В 2018 году впервые в истории американский госрегулятор FDA разрешил к применению в рядовой клинической практике CAR-T, метод генетического перепрограммирования Т-клеток иммунной системы для лечения острого лейкоза (лейкемии). Под давлением неопровержимых результатов клинических исследований впервые был прорван барьер, запрещающий модификацию человеческого генома. Метод стали использовать и для лечения и других заболеваний. С тех пор — а прошел всего год — уже появились генетические препараты для лечения, например, врожденной слепоты и неходжкинских лимфом.
Как-то так сложилось, что, в отличие от рака, вирусного гепатита не боятся — а зря, ведь он не менее опасен и коварен. Гепатит С протекает так же бессимптомно, как рак, обычно обнаруживается на поздних стадиях и приводит к тяжелейшим последствиям для здоровья, а нередко и к летальному исходу — все как и при онкологии. Люди зачастую годами и даже десятилетиями носят в себе этот вирус и узнают о болезни на стадии цирроза или рака печени, когда уже поздно. Если верить статистике, каждый 12-й читатель этой статьи либо болен, либо является носителем вируса гепатита, хотя и не догадывается об этом. По той же статистике, гепатиты B и C являются основной причиной цирроза и рака печени: около 80% случаев онкологических заболеваний печени происходят по их вине.
Вирус гепатита С Иллюстрация: Centers for Disease Control and Prevention
Еще пару лет назад лечение заболевания продолжалось год и было связано с большим количеством неприятных побочных эффектов, а результативность его была низка — выздоравливали не более 40% пациентов. В последние годы появились новые антивиральные препараты, напрямую действующие на цикл жизни вируса и уничтожающие его. Курс лечения может включать в себя как один препарат (монотерапия), так и сочетание нескольких лекарств. Причем процент полного выздоровления на сегодняшний день — от 90 до 100, с практически отсутствующими побочными эффектами.
ВИЧ-инфекция — одно из самых серьезных современных заболеваний. За последние 20 лет от него умерли около 36 миллионов человек.
Сегодня продолжительность и качество жизни ВИЧ-инфицированных пациентов уже практически такие же, как у среднего здорового человека. Другими словами, человек, принимающий грамотно подобранные для него современные препараты, может жить полноценной жизнью и рожать здоровых детей. Болезнь, которая еще недавно была острой, прогрессирующей и смертельной, стала таким же контролируемым хроническим заболеванием, как, например, сахарный диабет.
К сожалению, для российских пациентов со СПИДом возможности лечения за счет государства до сих пор ограниченны. Тем не менее революционные изменения в медицине дают нам всем надежду на будущее.

Я уверен, что к 2025 году учёные онкологи разработают лечебные терапии для большинства, если не всех видов рака.
Конечно, я несколько рискую, делая подобные заявления. Но в сфере исследования рака мы движемся к лучшим, более безопасным терапиям невероятно быстро, и я взволнованно предвкушаю будущие результаты. Я убеждён, что нужно высоко ставить планку, исполнять и реализовывать, и не должно быть оправданий, если мы не выдержим продвижения в таком темпе.
2017 стал знаковым в ускорении лечения рака, новыe лекарства получили одобрение FDA. В том числе были одобрены два вида терапий CAR T клетками – тип иммунотерапии рака, который использует собственные иммунные клетки пациента, запрограммированные на атаку и уничтожение раковых клеток. Все мы в Центре Исследований Рака Фреда Хатчинсона воодушевлены такими известиями. Это успешная проверка, того, над чем мы и наши коллеги по всему миру работали в течение десятилетий. Что ещё важнее, это означает терапию, потенциально способную спасти жизнь некоторым раковым пациентам с исторически ограниченными вариантами лечения.
Между прочим, ключевая фраза в этом предложении – некоторые пациенты. Клеточные иммунотерапии Kymriah и Yescarta были одобрены для лечения типа прогрессивного педиатрического лейкоза и агрессивной неходжкинской лимфомы соответственно. И мы знаем, что, хотя эти две терапии и являются большим шагом вперёд по сравнению с ранее доступными методами лечения, однако не все пациенты реагируют на них. И из тех, кто реагирует, некоторые испытывают серьёзные побочные эффекты.
А ведь остаётся ещё гораздо больше пациентов и видов рака, которые нужно лечить, и лечить безопасно. Иммунотерапия обещает заняться этими прочими видами рака, но одного этого подхода недостаточно для полного успеха. Нам нужно объединить множество знаний из разных областей, новые методы исследования, технологии сбора и анализа больших данных, чтобы суметь вылечить большее количество пациентов.
Исследователи нашего центра тестируют раковые терапии завтрашнего дня в лаборатории и в ходе клинических исследований. В прошлом году мы увидели замечательные научные достижения наших лабораторий, которые намекают на то, что нас ждёт в будущем. Начиная с 2018 года, мы с коллегами внимательно следим за несколькими перспективными направлениями исследований и лечения рака – и, конечно же, делаем всё возможное, чтобы способствовать скорейшему их развитию.
Я занимаюсь исследованием рака всю свою карьеру и вижу больше прогресса в этой сфере за последние несколько лет, чем за предыдущие пятьдесят. И я с нетерпением жду, что же принесёт нам 2018 год.
Иммунотерапия нового поколения
Недавнее известие о приобретении компанией Celgene компании Juno Therapeutics является хорошим примером того, как развивается отрасль иммунотерапии. Наука, стоящая за иммунотерапией Juno, восходит к десятилетиям доклинических исследований в Центре Фреда Хатчинсона, где наши учёные обнаружили, что отдельные типы иммунных клеток обладают мощной и устойчивой противоопухолевой активностью.
С целью сделать иммунотерапию рака более безопасной мы очень тщательно изучаем некоторые серьёзные побочные эффекты и инфекции, возможные после лечения CAR T клетками. Понимание и борьба со специфической токсичностью, связанной с CAR T терапией будет ключом к тому, чтобы успешно реализовать этот метод для большего числа пациентов.
По мере того, как мы продолжаем совершенствовать наши текущие подходы к иммунотерапии, мы также проверяем нашу клеточную иммунотерапию в новых клинических испытаниях и на иных типах рака, чтобы применить эту мощную технологию к большему числу нуждающихся пациентов. Наше внимание было сосредоточено на различных формах рака крови, хотя недавно мы запустили исследование, которое включает пациентов с раком лёгких и тройным отрицательным раком молочной железы, а также другое исследование для пациентов с меланомой. В 2018 году мы расширим поле нашего внимания, включив в него ещё многие виды опухолей, в том числе яичников, лёгких, головы и шеи, рака желудка, множественной миеломы и многие иные типы рака крови.
На данный момент у нас идут 12 клинических испытаний клеточной иммунотерапии, и ещё 21 испытание должно скоро начаться. Мы работаем с 11 промышленными партнёрами в области иммунотерапии, от глобальных производителей, таких как Eli Lilly and Company, до биотехнологических компаний, таких как Minerva Biotechnologies, и, конечно же, наших партнёров, иммунотерапевтических стартапов, Juno Therapeutics и Adaptive Biotechnologies. По мере расширения наших испытаний и в целях удовлетворения потребностей пациентов, наш специализированный центр выращивания клеток производит в среднем от 200 до 600 миллионов клеток в день.
По мере развития иммунотерапии, расширение её ранних успехов с лейкемий на опухоли будет самым сложным, и при этом самым важным делом. Исследователи центра Фреда Хатчинсона продвигаются вперёд, применяя иммунотерапию к опухолям, таким как рак молочной железы и лёгких. Одни из самых волнующих событий – несколько недавних достижений касающихся редкой опухоли, известной как клеточная карцинома Меркеля, исследования, которые привели к первому одобрению FDA иммунотерапии для этого рака, а также показали многообещающие намёки на мощь комбинированной иммунотерапии. Исследования этой редкой опухоли закладывают основу будущих достижений в лечении иных, более распространённых раков, которыми мы также займёмся в новых клинических испытаниях.
Нам нужно объединить множество знаний из разных областей, новые методы исследования, технологии сбора и анализа больших данных, чтобы суметь вылечить большее количество пациентов.
Могут ли облачные вычисления вылечить рак?

Облачные вычисления намного расширили пути и средства изучения рака. От научного сотрудничества в реальном времени между странами и континентами до управления данными любого масштаба, облачные технологии поддержат ключевые усилия, такие как точная онкология, расширенная визуализация данных и другие передовые исследования, которые приблизят нас к излечению рака.
Поскольку мы продолжаем находить новые связи между генами и типами опухолей, точные онкологические подходы к лечению рака станут более важными и потребуют как минимум терабайт или больше данных на одного пациента – достаточно, чтобы заполнить память восьми новейших смартфонов. В прошлом году исследование в центе Фреда Хатчинсона привело к запуску нового клинического испытания высокоточного лекарственного подхода против рака предстательной железы и выявило определённые генетические изменения, которые могут вдохнуть новую жизнь в старый лейкозный препарат.
В декабре вместе с нашими партнёрами из UW Medicine мы основали Институт Точной Медицины Brotman Baty, и очень рады, что приняли в нём участие. Как я уже отмечал во время открытия, этот институт является ещё одним примером новой роли Сиэтла как центра по лечению рака.
Как Национальный Институт Рака, так и Национальные Институты Здоровья недавно инициировали проекты по сбору данных, объединяющие экспертов по работе с данными, облачных технологов и экспертов в области биоинформатики, чтобы стимулировать совместные усилия по использованию облачных и информационных инструментов в крупномасштабных проектах. Мы ожидаем, что эти усилия продолжат набирать силу в 2018 году, и мы в центре Фреда Хатчинсона работаем с лучшими облачными провайдерами в нескольких проектах с интенсивным использованием данных, которые используют машинное обучение и облачные вычисления для ускорения исследований и улучшения результатов на пациентах.
Например, мы используем методы глубокого обучения для анализа магнитно-резонансных изображений, которые идентифицируют маркеры рака молочной железы. Мы также используем искусственный интеллект для улучшения результатов у пациентов, которые получают химиотерапию, и создаём платформу следующего поколения для участия пациентов, переживших трансплантацию стволовых клеток крови. Следите за достижениями в этих и иных областях, как мы используем облачные технологии в лечении рака.
Недавним захватывающим событием стало объявление о партнёрстве между Adaptive Biotechnologies и Microsoft, которое сосредоточится на использовании искусственного интеллекта для анализа последовательностей рецепторов Т-клеток у пациентов со спектром заболеваний, включая рак, задействующих иммунную систему. Т-клетки являются глазами нашей иммунной системы. Но нам нужен искусственный интеллект для обеспечения виртуальной реальности, позволяющей нам через секвенирование рецепторов Т-клеток видеть то, что они видят, и разрабатывать диагностику и персонализированную терапию основываясь на этом видении.
Инфекционные заболевания – связи тянутся к раку и далее
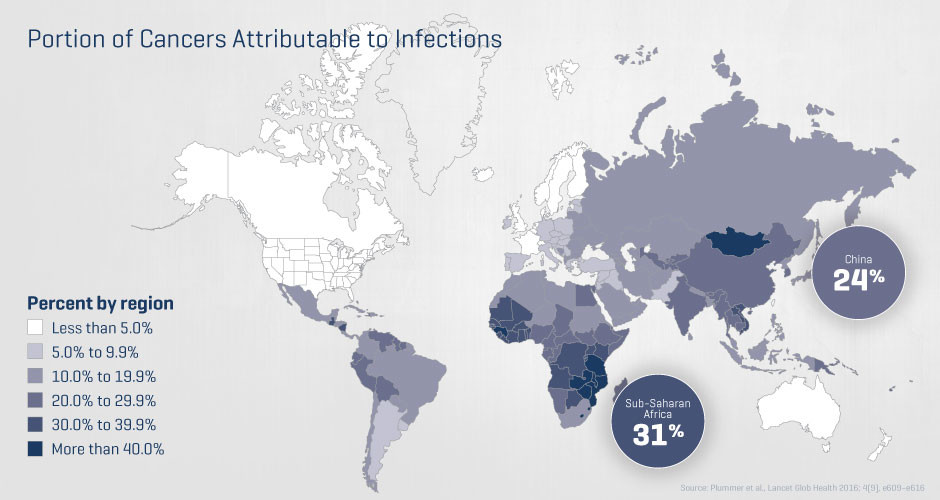
Каждый пятый рак во всем мире может быть связан с инфекционными заболеваниями. Мы в центре Фреда Хатчинсона давно поняли сложные связи между инфекцией и раком; в прошлом году мы запустили интегрированный исследовательский центр, посвящённый изучению этих связей с целью предотвращения многих видов рака, являющихся тяжёлым бременем для человечества. Мы также рассматриваем новые партнёрства в государственном и частном секторах для дальнейших изысканий в сфере пересечения инфекционных заболеваний и рака.
Что касается профилактики ВИЧ, последние два года были знаменательными для основанной на базе центра Фреда Хатчинсона Сети Испытаний ВИЧ Вакцин – HIV Vaccine Trials Network, которая начала четыре беспрецедентных по эффективности испытания профилактики ВИЧ в 2016 и 2017 годах. Исследования по тестированию новых вакцин и других способов профилактики ВИЧ-инфекции соберут вместе 12 200 добровольцев по всему миру. Мы все с нетерпением ожидаем окончательных результатов исследования в 2020 и 2021 годах.
Я занимаюсь исследованием рака всю свою карьеру и вижу больше прогресса в этой сфере за последние несколько лет, чем за предыдущие пятьдесят. И я с нетерпением жду, что же принесёт нам 2018 год.
Я жду общения с вами в следующем году и приглашаю вас поделиться своими
мыслями.
С уважением,
Гари Джиллиланд, MD, PhD, президент и директор Fred Hutchinson Cancer Research Center
Перевод выполнил Ник Сестрин, группа SENS Volunteers
Присылаем лучшие статьи раз в месяц
Скоро на этот адрес придет письмо. Подтвердите подписку, если всё в силе.
- Скопировать ссылку
- ВКонтакте
- Telegram
![]()
- Сайт
- Medium
Похожие публикации
- 1 февраля 2019 в 00:25
Вакансии
AdBlock похитил этот баннер, но баннеры не зубы — отрастут
Комментарии 15
А у нас. А мы. В ядерный пепел. А я все маме расскажу.
![]()
![]()
Иммунотерапия дороже. Представьте — надо взять мышку, подсадить ее потомкам человеческие гены, вырастить это потомство, ввести ему маркеры опухоли, добиться иммунного ответа, выделить антитела к опухоли… Курс Ниволумаб+Ипилимумаб, согласно вики, стоит под 200k$. Бывает не один курс на лечение.
Однако тут вопрос, кто за это платит. В клинических испытаниях лекарства оплачивает спонсор. Потом есть госпрограммы и страховки. Так что все может быть не так и страшно в финансовом плане.
Кстати, есть компании, которые специализируются на редких болезнях. По ощущениям, сейчас это направление быстро развивается, но пруфов не могу привести, моя выборка невелика
![]()
Главный недостаток нынешней иммунотерапии – персонализация и, как результат, высокая цена и сложность реализации, ибо иммунные клетки пациента нужно извлечь, запрограммировать и ввести обратно в организм. Поэтому сейчас учёные разрабатывают новое поколение универсальной иммунотерапии, не требующей извлечения клеток, – так называемые противораковые вакцины. В них активация иммунных клеток происходит прямо в организме, например, при помощи комбинации малых молекул.
![]()
![]()
![]()
Ещё одно новое и очень перспективное направление – имунотерапия, когда берут собственные иммунные клетки пациента и программируют их при помощи генной инженерии на распознавание и уничтожение раковых клеток, а затем вводят обратно в организм. Технология прекрасно показала себя в клинических испытаниях, и несколько терапий на её основе уже одобрены к клиническому использованию в Европе и США. Пока, правда, её применение ограничено лишь лимфомами и лейкозами, но учёные активно работают в направлении опухолей.
Главный недостаток нынешней иммунотерапии – персонализация и, как результат, высокая цена и сложность реализации, ибо иммунные клетки пациента нужно извлечь, запрограммировать и ввести обратно в организм. Поэтому сейчас учёные разрабатывают новое поколение универсальной иммунотерапии, не требующей извлечения клеток, – так называемые противораковые вакцины. В них активация иммунных клеток происходит прямо в организме, например, при помощи комбинации малых молекул.
Учёные с большим оптимизмом смотрят на будущее иммунотерапии.
Гари Джиллиланд, президент и директор Fred Hutchinson Cancer Research Center
Поскольку раковые клетки – как и любые иные типы тканей – имеют уникальные белковые маркеры, проблемы их поиска и уничтожения очень похожи на аналогичные у сенесцентных клеток, а также на проблемы высокоспецифичной и эффективной доставки в генной терапии. Поэтому успехи OncoSENS во многом зависят от успехов в этих сферах. Например, компания Oisin Biotechnologies планирует использовать свою систему распознавания и уничтожения сенесцентных клеток в борьбе с раком, просто перепрограммировав её на иные маркеры! Это ещё один пример универсальности SENS подхода.
Но это всё временные решения. Наиболее радикальным и эффективным решением, полностью исключающем образование рака, было бы WILT (Whole-body Interdiction of Lengthening of Telomeres) – полное вырезание генов теломеразы из всех (по крайней мере из всех активно делящихся – в первую очередь из стволовых) клеток организма и регулярный их пересев. Увы, пока её применение невозможно по двум причинам. Во-первых, специфичность распознавания и эффективность доставки в генной терапии всё ещё низки, и если в случае сенесцентных клеток уничтожение всего лишь 50% их уже приводит к радикальному омоложению организма, то в случае рака – всего одна упущенная клетка пустит насмарку всё лечение. Во-вторых, вырезание теломеразы приведёт к быстрому истощению пулов стволовых клеток и необходимости их регулярного пересева каждые несколько лет.
![]()
К счастью, популяций стволовых клеток, требующих регулярного пересева, немного. В первую очередь это кроветворные клетки, эпителиальные клетки кишечника и лёгких и клетки эпидермиса кожи.
Несмотря на различные проблемы, реализация WILT движется медленно, но уверенно. Например, недавно группа учёных из SENS показала на мышах, что регулярный пересев кроветворных клеток с вырезанной теломеразой прекрасно работает в крови. Увы, из-за малой выборки уникальная работа так и не была опубликована. Аналогичное исследование по регулярному пересеву клеток эпителия кишечника начали в лаборатории Graca Almeida-Porada в Институте Регенеративной Медицины Wake Forest. Оно показало неплохие результаты, но его закрыли из-за закончившегося финансирования.
![]()
Каждый пятый рак во всем мире может быть связан с инфекционными заболеваниями.
Я из Казахстана, объясните карту, чем мы тут так отличаемся от остальных стран? Отец болен лимфолейкозом, препарат Ибрутиниб стоит 8 тыс. уе, это на 1 месяц, пить нужно регулярно, в перечне бесплатных нет, занимаюсь тем, что ищу просроченные по всему СНГ или открытые пачки с рук по более доступным ценам
![]()
Каждый пятый рак во всем мире может быть связан с инфекционными заболеваниями.
Я из Казахстана, объясните карту, чем мы тут так отличаемся от остальных стран? Отец болен лимфолейкозом, препарат Ибрутиниб стоит 8 тыс. уе, это на 1 месяц, пить нужно регулярно, в перечне бесплатных нет, занимаюсь тем, что ищу просроченные по всему СНГ или открытые пачки с рук по более доступным ценам
Только полноправные пользователи могут оставлять комментарии. Войдите, пожалуйста.
Однако в последние 10-15 лет невероятными темпами развиваются новые виды антираковой терапии. В мировую медицину пришли современные биотехнологии, благодаря которым на патологический процесс можно воздействовать на уровне генов и молекул. Это открывает перед врачами и пациентами невиданные возможности: вместо массовой терапии больные получили шанс на персонализированное лечение.
Немногие фармацевтические компании в мире вплотную занимаются разработкой и внедрением новых технологий в борьбе с раковыми заболеваниями. В этом списке в основном присутствуют глобальные биофармацевтические концерны, такие как Roche Holding (Швейцария), Bristol-Myers Squibb (США), транснациональная фармкомпания Merck Sharp & Dohme (MSD) (США), англо-шведская фармацевтическая компания AstraZeneca. Единственной отечественной компанией, относящейся к этому списку, стала российская биотехнологическая компания BIOCAD.
Итак, какие новые разработки готова предложить наука для борьбы с раком? Наибольшее внимание ученых и врачей сегодня привлекают препараты на основе моноклональных антител, препараты на основе малых молекул, генная и CAR-T терапия, а также комбинированный подход, использующий все перечисленные методы.
Познакомимся поближе с новыми путями терапии раковых заболеваний, созданными с помощью биотехнологии.

Ученые подумали: а что если пометить раковые клетки произведенными на заводе антителами, чтобы они начали восприниматься как чужеродные и включали защитную реакцию организма, которая их уничтожит так же, как ежедневно уничтожает сотни инфекционных агентов?
Моноклональные антитела избирательно соединяются с чужеродными или сверхпредставленными белками на поверхности клетки опухоли и приводят к ее распознаванию и нацеливанию на нее иммунной системы, тормозят рост опухоли, дополнительно активируют иммунные клетки, маркируют, тормозят рост или маркируют для последующей лучевой терапии. Таргетная (направленная) терапия приводит к значительному повышению эффективности и снижению количества и тяжести побочных реакций.
Механизмов воздействия с помощью моноклональных антител на опухоль множество:
Еще одно направление научных разработок – создание антител, которые способны связываться сразу с двумя мишенями-антигенами. То есть если в одном участке белка раковой клетки была мутация, то антитело все равно свяжется со вторым участком, другими словами – не упустит врага. Это поможет пациентам, нечувствительным к определенным препаратам.
Колоссальный потенциал у биспецифических антител, которые распознают разные антигены (то есть их чувствительность к специфическим клеткам повышается). Они способны использовать эффект синергии нескольких механизмов действия.
Исход болезни зависит во многом и оттого, насколько рано она будет выявлена, поэтому необходима регулярная диагностика в соответствии с полом и возрастом. Например, при прохождении диспансеризации шанс на раннее выявление онкологического заболевания будет выше, чем без нее. А при первых признаках неблагополучия, не откладывая, обращайтесь к врачу!
– Есть ли новые методы терапии и какой из них наиболее эффективный?
– Онкология бурно развивается, но она опирается на три основные методики: хирургия, лучевая терапия, системная лекарственная терапия. Первые два метода остаются базой в лечении большинства новообразований на ранних стадиях, так как обладают мощным воздействием на опухоль. Но как только она дает метастазы, за ними уже не может угнаться ни нож хирурга, ни ионизирующий луч. Здесь в дело вступает лекарственное лечение. Потенциально, где бы ни находилась опухолевая клетка, ее должно настигнуть лекарство, попавшее в организм. Вопрос в том, как сделать эту терапию более эффективной и безопасной?
Современная онкология дает шанс на излечение того, что считалось смертельным еще 15-20 лет назад. Если излечения добиться не удается, мы получаем возможность контролировать болезнь в течение многих лет. Появились новые эффективные медицинские технологии: таргетная терапия (использование препаратов, блокирующих определенные пути стимуляции опухолевой клетки) – как в виде малых молекул, проникающих внутрь клетки, так и антител к конкретной мишени на поверхности опухолевой клетки, иммунотерапия (препараты, активирующие собственный иммунитет для борьбы с опухолью). Но пока нет ответа на вопрос: какая из имеющихся методик лучше? Главное – это грамотный врач-онколог, эффективно эти методики применяющий.
Также идут клинические испытания иммунотерапии следующего уровня, разработанной в стенах той же компании, – искусственно модифицированных клеток иммунной системы (CAR-Т клеток), обладающих потрясающей результативностью при лечении некоторых злокачественных опухолей крови.
– Российские врачи и пациенты сталкиваются с проблемой замены зарубежных препаратов на отечественные – более дешевые, но менее эффективные.
– Страна происхождения – не определяющий фактор. Препарат должен быть в первую очередь эффективным! А цена рассматривается как аргумент только при доказанном качестве. Если отечественный препарат произведен с пониманием того, что ему надо будет выдержать конкуренцию по правилам, принятым в развитых странах мира, то этот препарат, скорее всего, будет столь же эффективен и безопасен, как и препараты, произведенные за рубежом. И этому в отечественной науке уже сейчас есть доказательства.
Читайте также:

