Новое в лечении хронического лейкоза
2020. Tafasitamab - новый препарат от рака крови - на подходе

Американская фармакомпания Incyte выкупает у немецкого биотек-стартапа MorphoSys права на препарат Tafasitamab почти за $2 млрд. Это препарат на основе антител для лечения B-клеточной лимфомы, хронического лимфоцитарного лейкоза (ХЛЛ) и В-клеточной неходжкинской лимфомы. Препарат усиливает работу иммунных B-клеток, которые цепляются к раковым клеткам и привлекают макрофаги для их уничтожения. На данный момент Tafasitamab проходит последнюю стадию клинических испытаний и его эффективность сравнима с более дорогой CAR-T терапией. Incyte надеется выпустить препарат в продажу уже в этом году.
2019. В России создали нейропроцессор для диагностики рака крови

Российский научно-технический центр Модуль разработал нейросетевое устройство, которое умеет анализировать микроснимки анализа крови и выявлять атипичные клетки, которые могут быть связаны со злокачественным заболеванием кроветворной системы. Нейросеть обучалась на массиве данных лаборатории патологической анатомии одной из малазийских клиник. Разработчики говорят, что точность диагноза от нейросети составляет 98%, а анализ проводится всего за несколько секунд. В перспективе нейросеть Модуля сможет определять раковые клетки по результатам биопсии других видов рака. Сейчас устройство готовят к сертификации FDA в США.
2017. В США одобрили вторую генную терапию для лечения рака крови

Американский регулятор FDA одобрил вторую генную терапию для борьбы с раком крови: препарат Yescarta (компании Kite Pharma). Он предназначен для лечения агрессивной лимфомы у взрослых. Первым одобренным антираковым генотерапевтическим препаратом стал Kymriah (компании Novartis). В Yescarta применяется та же технология (CAR-T), что и в первой генной терапии. Она редактирует иммунные Т-клетки так что они начинают атаковать раковые клетки. Стоит Yescarta немного дешевле - 373 тыс. долларов для одного пациента. Причем есть потенциал к снижению этой стоимости, т.к. в США - более 7 тысяч пациентов в год, которым подходит эта технология. А чем больше пациентом покупают препарат, тем дешевле он становится.
2017. Антираковая генотерапия CAR-T сертифицирована в США
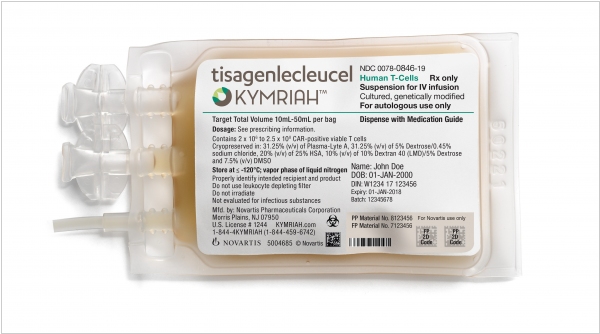
Технология CAR-T и препарат Kymriah (Кимрия) швейцарской компании Novartis, которая уже доказала свою эффективность в лечении острого лимфобластного лейкоза, была сертифицирована американским регулятором FDA (что еще раз подтверждает ее действенность). Суть технологии в том, что врачи берут образец белых кровяных телец пациента, а потом в лаборатории перепрограммируют их в убийц опухолей. Затем клетки возвращают в тело, где они быстро группируются и уничтожают раковые клетки. Конечно, стоимость такого лечения - не всем по карману - $475,000. Правда, Novartis обещает вернуть деньги, если организм пациента не отвечает на лечение.
2017. Наночастицы перепрограммируют Т-клетки прямо в организме для борьбы с лейкемией
2017. Лекарство Гливек показывает отличные результаты в лечении лейкоза
2016. Персонализированная вакцина остановила рак крови

Медицинский центр Beth Israel Deaconess, расположенный в Бостоне, провел успешные клинические испытания новой вакцины, изготавливаемой из собственных клеток пациента, которая предназначена для лечения острого миелоидного лейкоза. Вакцина использует технологию иммунотерапии, т.е. стимулирует собственные имунные Т-клетки для уничтожения опухоли. Испытания начались 4 года назад, когда 17 пациентам со средним возрастом 63 года начали вводить вакцину после сеансов химиотерапии. В результате 12 из них до сих пор показывают ремиссию. На фото - руководитель проекта - Дэвид Авиган.
2016. Технология Cellectis вылечила уже второго ребенка от лейкемии

Франко-американская компания Cellectis, похоже, заняла лидирующую позицию на многообещающем рынке иммунотерапии рака. В конце прошлого года ее технология TALEN (основанная на методе CAR-T) помогла вылечить годовалую девочку от лейкемии, а недавно они объявили о второй успешной операции, проведенной в том же лондонском госпитале. Смысл технологии в том, что ДНК иммунных клеток (Т-лимфоцитов) модифицируется в пробирке, а затем они вводятся в организм, где уничтожают поврежденные при лейкемии кровяные клетки. Есть еще три перспективных стартапа, разрабатывающих подобные технологии (Novartis, Juno Therapeutics и Kite Pharma). Но отличие технологии Cellectis в том, что она использует донорские Т-клетки, т.е. потенциально может создать универсальный и дешевый препарат, который можно быстро ввести любому пациенту.
2015. Генная инженерия и иммунотрапия спасли девочку от лейкемии
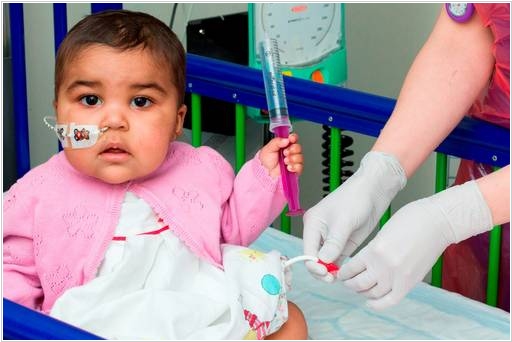
В Лондонской больнице Грейт-Ормонд-Стрит врачи использовали уникальный метод CAR-T для лечения лейкемии (рака крови) у маленькой девочки Лейлы (1 год). Химиотерапия и пересадка костного мозга ей не помогли, поэтому медики решились испробовать новый вид иммунотерапии. Они взяли иммунные клетки донора, генетически-модицифировали их так чтобы они распознавали и уничтожали раковые клетки и при этом сами не воспринимались иммунной системой, как чужеродные, и ввели их в организм девочки. Через три месяца Лейле снова пересадили костный мозг: здоровые иммунные клетки распознали генно-модифицированные клетки как чужеродные и уничтожили их. Таким образом, сейчас в организме девочки не осталось генетически модифицированных клеток. Пока о полном излечении Лейлы говорить рано, но она жива и хорошо себя чувствует. Полноценные клинические испытания этой технологии начнутся в 2016 году. Технология разработана французской биотехнологической компанией Cellectis.
2014. Создан искусственный костный мозг для выращивания стволовых клеток крови
Все клетки крови (эритроциты, лейкоциты. ) формируются из так называемых гемопоэтических стволовых клеток, которые, содержатся в костном мозге человека. И иногда человеку требуется замена этих стволовых клеток. Например, при лейкемии, когда собственные стволовые клетки превращаются в раковые. Или после лучевой терапии, когда собственные стволовые клетки погибают. В таких случаях проводят трансплантацию костного мозга, и это очень-очень дорогая операция, в основном из-за сложности поиска совместимого донора. В России с этим делом - вообще комедия. Вот было бы здорово, если б можно было взять у человека чуть-чуть стволовых клеток крови, размножить их в лаборатории, а потом ввести обратно в костный мозг. Именно над такой идеей работают ученые из нескольких ведущих научных центров Германии. И у них уже кое-что получилось. Они создали искусственную пористую структуру, имитирующую губчатое вещество кости в области кроветворного костного мозга. ***
2013. В Ханты-Мансийске проводят трансплантацию стволовых клеток при лечении рака крови
Югорский научно-исследовательский институт клеточных технологий, созданный четыре года назад, вроде-как успешно применяет свою технологию лечения рака крови с помощью стволовых клеток. На базе Сургутской ОКБ они провели уже 34 трансплантации стволовых клеток, и говорят, что все пациенты до сих пор живы. Кроветворные стволовые клетки НИИ получает от доноров (из костного мозга и пуповинной крови), проводят ДНК анализ (для определения совместимости) и хранит этот материал в своем криобанке. Затем стволовые клетки добавляют в кровь пациента каким-то уникальным методом. По словам Сергея Щукина, заместителя директора Департамента здравоохранения Югры, стоимость пересадки стволовых клеток на западе - порядка 420 тысяч долларов. А у нас по стране, хотя такие операции - редкость, но делаются они бесплатно, за счет средств бюджета.


При поражении опухолью в кровь начинают вырабатываться незрелые мутированные лейкоциты, которые постоянно делятся и полностью заполняют пространство, мешая здоровым клеткам. Также мутированные лейкоциты не выполняют свою защитную функцию.

Лейкемия лечится или нет
Первый вопрос, возникающий у людей, которые столкнулись с подозрением на рак крови, лейкемия лечится или нет.
Всем известно, что это тяжёлое и серьёзное заболевание, но, пока оно не коснётся определённого человека, мало кто вникает во все тонкости. Это вполне свойственно человеческой натуре.
Но на самом деле информацией по этой теме не стоит пренебрегать, так как этот недуг приобретает масштабное распространение и, к сожалению, часто ему подвергаются маленькие дети.
Существуют проверенные медикаментозные методы, используя которые, можно контролировать болезнь и добиваться ремиссии

Причины заболевания
Возможными причинами заболевания являются:
- нарушения в хромосомном аппарате и структуре клетки;
- воздействие повышенного уровня радиации на протяжении длительного периода времени;
- взаимодействие с токсичными препаратами и химическими веществами;
- вредные привычки, в том числе курение;
- после проведенной химиотерапии;
- генетическая предрасположенность.

Виды лейкемии
Лейкозы бывают острыми и хроническими. При острой форме начинают быстро делиться незрелые белые клетки, болезнь развивается в короткие сроки.
Хроническая лейкемия прогрессирует медленнее, в течение нескольких лет, при этом лейкоциты сначала созревают, затем становятся аномальными.
Заболевание классифицируют в зависимости от того, какие клетки поражены – лимфоциты, которые не содержат гранул, или миелоциты – молодые клетки с зернистой структурой.
Таким образом, выделяют четыре вида лейкозов:
- Острый миелоидный. Подвержены заболеванию и взрослые, и дети.
- Острый лимфобластный. Чаще болеют дети, хотя встречается и у взрослых.
- Хронический лимфоцитарный. Обычно развивается у людей от 55 лет.
Миелоидная лейкемия. Характеризуется быстрым ростом миелоидных клеток, в результате они накапливаются в периферической системе.

Симптомы лейкоза
Симптомы лейкоза, особенно в начале, очень неспецифичны и эти признаки легко пропустить. Поэтому мы рекомендуем вам очень внимательно относиться к тому, если вы:
- чувствуете выраженную слабость;
- быстро утомляетесь;
- страдаете от головных болей;
- не хотите есть;
- чувствуете боли в костях;
- отметили, что появилась сыпь и непонятные синяки;
- появились носовые кровотечения, кровят десна;
- теряете вес;
- часто болеете инфекционными заболеваниями.
Конечно, один-два эти симптома можно просто отнести, например, на рабочую нагрузку. Однако не упустите тяжелую болезнь, не рискуйте своей жизнью – раз заметили признаки, то приходите к нам на диагностику. Чем раньше вы начнете лечение заболеваний крови – тем больше шансов на ваше выздоровление.

Стадии
Отдельно нужно рассмотреть основные стадии лейкоза.
- Начальная. Чаще всего диагностируется у пациентов, которые страдают анемией.
- Развернутая. Тут уже проявляются все симптомы.
- Ремиссия. Может быть полная или неполная. Характеризуется повышением бластных клеток максимум на 5% именно в костном мозге (при их отсутствии в крови).
- Рецидив. Может развиваться как в костном мозге, так и иных органах. Стоит сказать о том, что каждый последующий рецидив опаснее предыдущего.
- Последняя. В таком случае у больного развиваются язвенно-некротические процессы, а также происходит угнетение кроветворения.

Шансы на выздоровление
В настоящее время диагноз лейкемия не является приговором, как это было раньше. Ответ на вопрос, лечится ли лейкоз, зависит от определенных факторов:
- разновидности заболевания;
- своевременной диагностики;
- характера поражения тканей и органов;
- возрастных особенностей;
- других возможных рисков.
Таким образом, важно тщательно и внимательно следить за состоянием своего здоровья. Максимальной гарантии того, что лейкемия лечится, у специалистов на данный момент нет, однако благодаря современной медицине существует немалое количество методов дают возможность продлить жизнь пациента на несколько десятков лет.

Лечение острых форм лейкемии
Острые лимфолейкозы у маленьких деток вылечиваются в 95%. Почти у 70% переболевших признаков заболевания нет минимум в течение пяти лет.
При лечении острой лимфобластной формы используется химиотерапия на основе трех препаратов. Если после использования химиотерапии возникает рецидив заболевания, врач советует использовать пересадку стволовых клеток при соответствующих показаниях, решение зависит от пациента.
При лечении миелоидной формы используется сильная лекарственная терапия в несколько курсов. Иногда применяется трансплантация костного мозга. Чем выше возраст пациента, тем ниже вероятность выздоровления.

Лечение хронической лейкемии
В отличие от острой формы заболевания, хроническая не требует такого срочного вмешательства. Она развивается медленнее и способы ее лечения отличаются. Прежде всего идет период наблюдения. На ранних стадиях симптомы практически незаметны, но наблюдение врача просто обязательно.
Таким пациентам тоже назначают привычное лечение, но в случае с трансплантологией клетки могут брать из организма пациента. Также применяют биологическую терапию, помогая организму улучшить защитные функции. К пациентам применяют и привычные методы лечения.

Методы лечения
Способ борьбы с недугом подбирается, исходя из его стадии и формы. При хронической лейкемии используют терапию, ориентированную на приостановление развития болезни, поддержание защитных функций организма и предотвращение осложнений. Кроме того, многих пациентов интересует, лечится или нет острый лейкоз крови. Стоит сказать, что при грамотном подходе, симптомы этой формы недуга также можно устранить. Для этого используют:
Химиотерапию. Она уничтожает раковые клетки. Лучевую терапию. Она разрушает пораженные клетки посредством рентгеновского излучения.
Пересадку стволовых клеток. С помощью этого метода восстанавливается образование здоровых клеток.
Прежде чем приступить к оперативному вмешательству, проводят химиотерапию. Она необходима для того, чтобы освободить место для новых, здоровых клеток костного мозга.

Профилактические меры
Чтобы избежать патологии необходимо:
- выбирать место проживания с насколько возможно более благополучной экологией,
- пациенты, у которых родственники болели раком, должны раз в полгода сдавать кровь на обследование;
- такая же рекомендация касается людей, у которых есть генные поломки, превышающие нормы.
Лейкоз является злокачественным заболеванием, которое часто называют раком крови. При заболевании красный костный мозг вырабатывает лейкозные клетки – патологические кровяные тельца. Почему это происходит в организме человека, ученые до настоящего времени так и не установили.
No related posts.
Врач с 36 летним стажем работы. Медицинский блогер Левио Меши. Постоянный обзор животрепещущих тем по психиатрии, психотерапии, зависимостям. Хирургии, онкологии и терапии. Беседы с ведущими врачами. Обзоры клиник и их врачей. Полезные материалы по самолечению и решению проблем со здоровьем. Посмотреть все записи автора Левио Меши
Основным методом лечения хронического лимфолейкоза является химиотерапия. Верификация диагноза хронического лимфолейкоза не всегда является показанием для проведения противоопухолевой терапии. В ряде случаев (обычно в дебюте заболевания) оправдана выжидательная тактика, так как доказано, что раннее начало лечения не увеличивает выживаемость больных хроническим лимфолейкозом.
Показания к началу химиотерапии:
1) синдром опухолевой интоксикации (проливные ночные поты, лихорадка выше 38 °С, снижение массы тела);
2) анемия или тромбоцитопения, обусловленные опухолевой инфильтрацией костного мозга;
3) аутоиммунная гемолитическая анемия или тромбоцитопения (при отсутствии ответа на глюкокортикостероиды);
4) выраженная лимфоаденопатия и/или спленомегалия с компрессией органов и тканей с нарушением их функций;
5) время удвоения абсолютного лимфоцитоза в периферической крови меньше 12 месяцев;
6) гипогаммаглобулинемия, сопровождающаяся рецидивирующими инфекционными осложнениями;
7) массивная лимфоцитарная инфильтрация костного мозга;
8) лейкоцитоз больше 150 • 10 9 /л;
9) стадия III—IV по классификации К. Rai.
Основным препаратом для лечения хронического лимфолейкоза является хлорбутин (хлорамбуцил, лейкеран). Существует 2 основных режима назначения препарата:
1) малые дозы (0,07 мг/кг массы тела через день в течение 14 дней; курс повторяется каждые 28 дней);
2) большие дозы (0,7 мг/кг один раз в неделю).
Эффект достигается у 2/3 больных, побочное действие практически отсутствует. После получения ответа на лечение проводится поддерживающая терапия в дозе 10-15 мг 1-3 раза в неделю.
Применение хлорбутина позволяет быстро снизить количество лейкоцитов, однако уменьшение лимфатических узлов и селезенки достигается не всегда. Поэтому при преобладании в клинической картине лимфоаденопатии и спленомегалии с умеренным лейкоцитозом может использоваться комбинированная терапия хлорбутином и преднизолоном (преднизолон 30-70 мг в сутки + хлорбутин 10-20 мг в сутки) курсами по 5-14 дней с перерывами 2-4 недели.
При непереносимости хлорбутина, резистентности к препарату, а также у лиц моложе 60 лет можно применять циклофосфан в дозе 2-3 мг/кг в сутки ежедневно внутрь или 1000 мг внутривенно каждые 2 недели. Эффективность препарата сравнима с хлорбутином, однако возможны побочные эффекты (диспепсия, геморрагический цистит).
Преднизолон в дозе 30-60 мг/м2 внутрь ежедневно назначается при аутоиммунной гемолитической анемии или тромбоцитопении. После достижения эффекта доза глюкокортикостероидов постепенно уменьшается до полной отмены препарата.
При неэффективности монотерапии и прогрессировании заболевания (а в ряде случаев — и в качестве индукционного курса) возможно проведение полихимиотерапии по программам СОР (циклофосфан, винкристин, преднизолон) или CHOP (СОР+адриабластин). У пожилых пациентов с сопутствующими заболеваниями сердечно-сосудистой системы доза адриабластина редуцируется (программа мини-СНОР).
Непосредственный эффект комбинированного лечения хороший, однако достоверного увеличения медианы выживаемости по сравнению с пациентами, получавшими монохимиотерапию, не отмечено. Следует иметь в виду также более выраженную токсичность программ полихимиотерапии по сравнению с монотерапией.
Стандартные режимы монохимиотерапии и полихимиотерапия увеличивают продолжительность жизни больных в среднем на 2-3 года.
В последние годы в клиническую практику внедрено новое поколение цитостатических препаратов для лечения хронического лимфолейкоза — аналоги пуриновых нук-леозидов (флударабин, пентостатин, кладрибин).
Наибольшее распространение получил флударабин, который может использоваться как при резистентности к другим цитостатикам (эффективность 50-60%, частота полных ремиссий 25%), так и для первичной терапии (эффективность 80%, частота полных ремиссий 40-50%). Флударабин назначается внутривенно (болюсом или капельно) ежедневно в дозе 25 мг/м2 в течение 5 дней. В среднем необходимо проведение 6 курсов лечения с 28-дневными интервалами между ними.
Основным побочным эффектом является выраженная миелосупрессия с возможным развитием инфекционных осложнений, реже отмечаются аутоиммунная гемолитическая анемия и нейротоксичность. В целом флударабин переносится хорошо и в настоящее время рассматривается как наиболее эффективный препарат для лечения больных хроническим лимфолейкозом как в виде монотерапии, так и в сочетании с другими препаратами (чаще всего с циклофосфаном, митоксантроном и ритуксимабом).
Последние несколько лет характеризуются активным внедрением для лечения хронического лимфолейкоза моноклональных антител: анти-CD20 (Mabthera, Rituximab) и анти-CD52 (Campath-1, Alemtuzumab). Мабтера в настоящее время используется в комбинации с флударабином и алкилирующими агентами при проведении химиотерапии первой линии. При проведении химиотерапии второй линии применяются комбинация мабтеры, пентостатина и циклофосфана и другие режимы.
Анти-CD52 (Campath-1, Alemtuzumab) рекомендуется для проведения химиотерапии второй линии в виде монотерапии или в сочетании с другими цитостатиками.

Современные химиотерапевтические подходы к лечению хронического лимфолейкоза:
I. Химиотерапия 1-й линии:
— Флударабин ± ритуксимаб
— Хлорбутин ± преднизолон
— Циклофосфан ± преднизолон
— СОР (циклофосфан. винкристин, преднизолон)
— FC (флударабин, циклофосфан) ± ритуксимаб
II. Химиотерапия 2-й линии:
— Алемтузумаб
— PC (пентостатин, циклофосфан) ± ритуксимаб
— Полихимиотерапия ± ритуксимаб или алемтузумаб
В последние годы при хроническом лимфолейкозе изучается эффективность трансплантации аллогенных гемопоэтических стволовых клеток и биологических методов лечения.
Трансплантация аллогенных гемопоэтических стволовых клеток используется у больных моложе 55 лет при наличии неблагоприятных прогностических факторов (в частности, высокого уровня ZAP-70). Этот метод лечения используется редко, так как большинство пациентов старше 60 лет и имеют большое количество сопутствующих заболеваний.
После трансплантации достоверно увеличивается общая выживаемость, однако это нивелируется высокой смертностью, обусловленной лечением. При внедрении немиелоаблативных режимов кондиционирования количество больных хроническим лимфолейкозом, которым показана трансплантация, может существенно увеличиться, а совершенствование метода позволит уменьшить количество осложнений.
В ряде случаев у больных хроническим лимфолейкозом могут применяться паллиативные методы лечения (лучевая терапия, спленэктомия, лейкоцитаферез).
Лучевая терапия используется при наличии выраженной спленомегалии или конгломерата лимфатических узлов с признаками компрессии окружающих органов.
Необходимость в спленэктомии у больных хроническим лимфолейкозом возникает редко. Показания к спленэктомии:
а) аутоиммунная гемолитическая анемия, резистентная к терапии глюкокортикостероидами и цитостатическими препаратами;
б) выраженная спленомегалия, не поддающаяся консервативным методам лечения, в том числе лучевой терапии.
Лейкоцитаферез может использоваться для профилактики и лечения лейкостаза у больных с гиперлейкоцитозом, при резистентном к терапии хронического лимфолейкоза или при наличии противопоказаний к химиотерапии.
Лечение осложнений хронического лимфолейкоза (инфекционных, аутоиммунных) проводится по общим принципам онкогематологии.
К новым методам лечения, эффективность которых изучается у больных хроническим лимфолейкозом, относятся:
1) антисмысловые олигонуклеотиды (в частности, направленные против BCL-2);
2) генная терапия, направленная на изменение иммунофенотипа хронического лимфолейкоза;
3) комбинированная терапия мабтерой и ингибиторами ZAP-70;
4) моноклональные антитела к детерминантам опухолевых клеток (HLA-DR, CD40 и др.).
Хронический лимфоцитарный лейкоз (ХЛЛ) является одной из разновидностей рака крови. Его также называют хронической лимфоидной лейкемией или лимфомой малых лимфоцитов.
Что такое хронический лимфоцитарный лейкоз?
ХЛЛ развивается из-за аномалий в образовании и развитии одной из разновидностей кровяных телец – лимфоцитов.
Большинство случаев ХЛЛ (около 95%) начинается с повреждения B-лимфоцитов (B-клеток). Основные признаки:
Из-за этого лейкоциты не могут нормально выполнять некоторые свои функции по борьбе с инфекциями;
Постепенно они накапливаются в костном мозге и крови, вытесняя из кровотока здоровые лимфоциты;
Низкий уровень здоровых лимфоцитов может привести к заражению вторичными инфекциями, анемии и кровотечениям;
Поврежденные клетки разносятся кровотоком по всему телу и мешают нормальному функционированию органов;
В редких случаях хроническая форма лейкоза переходит в агрессивную.
Другие разновидности хронических лимфом
Помимо ХЛЛ существуют и другие разновидности лейкозов.
Пролимфоцитарная лейкома (ПЛЛ). Она более агрессивна, чем большинство типов ХЛЛ. Поражает как B-лимфоциты, так и T-лимфоциты. Обычно развивается стремительнее ХЛЛ, но все-таки не так быстро, как острый лимфобластный лейкоз.
Крупнозернистая лимфоцитарная лейкемия (КЛЛ). Имеет тенденцию к медленному росту, однако, в некоторых случаях быстро переходит в агрессивную стадию. Характеризуется увеличенными лимфоцитами с видимыми гранулами, поражает T-лимфоциты или естественные киллеры (NK-клетки).
Волосатоклеточный лейкоз (ВКЛ). Медленно растущая разновидность рака B-клеток, при этом довольно редкая. Название происходит от внешнего вида лимфоцитов – точечных проекций на поверхности клеток, которые делают их волосатыми на вид.
Малая лимфоцитарная лимфома (МЛЛ). Это заболевание тесно связано с хронической формой лимфомы, однако, при МЛЛ раковые клетки обнаруживаются в лимфоузлах и селезенке, а не в костном мозге и крови.
Органы кроветворения и ХЛЛ
Для начала полезно разобраться, как вообще устроено кроветворение в организме и какую роль в этом играет костный мозг.
Стволовыми клетками называют особый тип клеток в организме, которые могут трансформироваться практически в любую иную форму: клетки печени, кожи, мозга или крови. Они формируются в костном мозге. Те стволовые клетки, которые участвуют в кроветворении, называются гемопоэтическими (стволовыми клетками крови).
Кровяные тельца непрерывно стареют, повреждаются и погибают. На них место должны непрерывно поступать новые, причем в достаточном количестве. Так, например, в норме у здорового взрослого человека должно содержаться от 500 до 1500 лимфоцитов на 1 мкл (примерно 25-40% от общего объема крови).
Стволовые клетки продуцируются в основном в мягкой губчатой ткани костей, но некоторое их число также можно встретить в циркулирующей крови.
Гемопоэтические клетки активно трансформируются в лимфоидные и миелоидные стволовые клетки:
-
Лимфоидные вырабатывают лимфобласты, которые в свою очередь преобразуются в несколько типов лейкоцитов, включая лимфоциты и NK-клетки;
Миелоидные, соответственно, продуцируют миелобласты. А те превращаются в другие типы лейкоцитов: гранулоциты, эритроциты и тромбоциты.
У каждого типа клеток крови своя специализация и предназначение.
Лейкоциты активно противостоят инфекциям и внешним раздражителям.
Красные кровяные тельца (эритроциты) отвечают за перенос кислорода из легких к тканям и доставку углекислого газа обратно в легкие для удаления.
Тромбоциты образуют сгустки, чтобы замедлить или прекратить кровотечение.
На ранних стадиях ХЛЛ обычно не беспокоит пациента. Для развития выраженных симптомов могут уйти годы, но как только они появляются – это уже повод говорить о хронической стадии заболевания.
Симптомы ХЛЛ часто путают с гриппом и прочими распространенными заболеваниями. При этом падает уровень содержания всех типов клеток крови. Симптомы низких лейкоцитов в крови:
жар, потливость, боли в различных частях тела;
Также может наблюдаться снижение уровня эритроцитов:
усталость, слабость, недостаток энергии и сонливость.
Симптомы низких тромбоцитов:
красные пятна нёбе или лодыжках;
частое или сильное носовое кровотечение;
синяки по всему телу и плохая свертываемость крови при порезах.
Общие симптомы хронического лимфоцитарного лейкоза:
необъяснимая потеря веса;
боли в костях или суставах;
опухание лимфатических узлов в шее, подмышках, желудке или паху.
Диагностика хронического лимфоцитарного лейкоза
Вышеперечисленные симптомы уже могут навести вашего врача на подозрения, однако, чтобы поставить окончательный диагноз, ему потребуется изучить историю болезни и провести полное медицинское обследование.
Для точной диагностики ХЛЛ потребуется несколько тестов. Некоторые из них могут не понадобиться, но будут нужны, чтобы уточнить диагноз и разработать более эффективную стратегию лечения.
Тест на типы и количество клеток крови, наличие аномальных лимфоцитов или уже сформировавшихся раковых клеток. Врачу здесь необходимо определить тип дефектных клеток, признаки замедления или наоборот прогрессирования рака. Применяется два вида специальных анализов крови: имунофенотипирование и проточная цитометрия. Иногда ХЛЛ можно заподозрить и при помощи общего анализа.
Отбор тканей из костей таза при помощи иглы (аспирация и биопсия костного мозга) и их проверка на наличие раковых клеток.
Клетки крови или костного мозга проверяют на наличие хромосомных аномалий: недостающих частей, дополнительных копий, дублировании хромосом. Также могут быть проверены изменения в белках иммунной системы, которые могут предсказать степень агрессивности ХЛЛ. В целом, выделяют три вида генетических тестов: цитогенетический анализ, флуоресцентную гибридизацию in situ (FISH)и полимеразную цепную реакцию (ПЦР-тест).
Сюда входят рентген грудной клетки, компьютерная и магнитно-резонансная томографии, а также ультразвуковое исследование лимфоузлов.
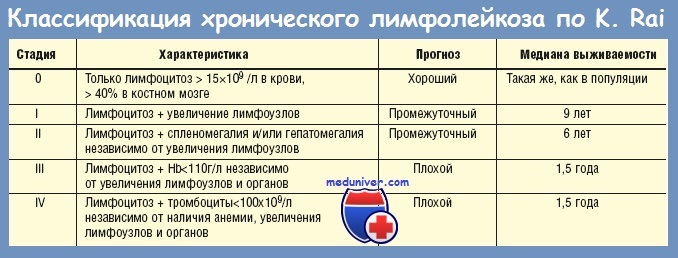
Стадии хронического лимфоцитарного лейкоза по Rai
Чтобы определить, как далеко зашла болезнь, и спланировать лечение, врачи пользуются системой Rai. Она была специально разработана для ХЛЛ:
Стадии заболевания зависят от количества лимфоцитов, эритроцитов и тромбоцитов в костном мозге и кровотоке, а также от того, были ли поражены селезенка, печень и лимфоузлы;
Стадии варьируются от 0 до IV, где 0 – наименее, а IV – наиболее тяжелая.
Ваш этап Rai даст онкологу информацию о вероятности прогрессирования болезни и необходимости лечения. Этап 0 характеризуется низким уровнем риска, этапы I–II – умеренным, этапы III–IV – высоким.
Ваш врач должен тщательно изучить и другие факторы, чтобы спрогнозировать перспективы и подобрать наиболее оптимальную стратегию лечения. В их числе:
Генетические отклонения и мутации в лейкоцитах (к примеру, отсутствие части хромосомы или наличие дополнительной хромосомы);
Наличие мутационного статуса IGHV-гена (наличие тяжелых цепей иммуноглобулина с переменной областью);
Проявляются ли симптомы ХЛЛ;
Возраст, наличие сопутствующих заболеваний, образ жизни;
Количество онкогенных (прелейкемических) клеток;
Скорость деления лейкемических клеток;
Как болезнь реагирует на первичное лечение и как долго длится ответная реакция.
Онкологу потребуется провести дополнительные тесты, анализы крови и костного мозга после анализа лечения.
Ремиссия будет означать, что болезнь реагирует на терапию. Полная ремиссия означает отсутствие каких-либо симптомов и клинических признаков рака. Частичная ремиссия означает уменьшение всех симптомов на 50%;
Рецидив означает, что ХЛЛ возвращается после пребывания в ремиссии более шести месяцев;
Резистентность – заболевание прогрессирует в течение шести месяцев после лечения.
Насколько распространен хронический лимфоцитарный лейкоз?
В США ежегодно диагностируется порядка 20 тысяч случаев ХЛЛ. По статистике это наиболее распространенная разновидность лейкемии среди взрослых – на нее приходится почти 40% случаев.
Причины хронического лейкоза
Медицине не известно, что является причиной ХЛЛ. Известно, что болезни подвержены люди среднего и старшего возраста. Средний возраст пациентов на момент постановки диагноза составляет 72 года. ХЛЛ чаще встречается среди мужчин, чем среди женщин.
В целом, это заболевание более распространено в Северной Америке и Европе, чем в Азии. Однако это зависит не от места проживания, а скорее от генетической предрасположенности отдельных рас. Азиаты, живущие в США, Канаде или европейских странах, подвергаются примерно одинаковому риску ХЛЛ со своими соплеменниками из азиатских стран.
В настоящий момент выявлено всего два фактора риска по ХЛЛ:
случаи ХЛЛ или иных типов лейкозов среди близких родственников.
Нужно иметь в виду, что у многих людей с ХЛЛ вообще не было факторов риска в анамнезе.
Читайте также:

