Критерии ответа опухоли на лечение
а) Терминология:
1. Сокращения:
• Критерии оценки ответа солидных опухолей на лечение (RECIST)
2. Определение:
• Новая версия критериев была опубликована в 2009 г.
• Используются модифицированные критерии RECIST
3. Ключевые принципы:
• Критерии включения пациентов:
о Пациенты с наличием измеряемых проявлений заболевания при первичном исследовании
- Наличие как минимум одного измеряемого очага
о Первичной конечной точкой является оценка объективного ответа опухоли на лечение
• Оценка опухоли при первичном исследовании:
о Обнаружение измеряемых проявлений заболевания
о Выбор целевых и нецелевых очагов
о Измерение целевых очагов
о Опухолевая нагрузка: сумма размеров целевых очагов
• Оценка опухоли при повторном исследовании:
о Измерение целевых очагов
о Оценка нецелевых очагов
о Обнаружение новых очагов
о Расчет ответа опухоли на лечение в данной временной точке
4. Существенные различия между RECIST и RECIST 1.1:
• Внесены изменения в определения следующих понятий:
о Опухолевая нагрузка
о Размер лимфатических узлов
о Прогрессирование заболевания
о Прогрессирование неизмеряемых проявлений заболевания о Подтверждение ответа о Новые очаги




б) Лучевая анатомия:
1. Измеряемые и неизмеряемые проявления заболевания:
• Измеряемые проявления:
о Опухоль с наибольшим диаметром (LD) > 10 мм, измеренным при КТ или МРТ в аксиальной плоскости с интервалом реконструкции 5 мм LD должен превышать толщину среза как минимум в два раза
о Опухоль с наибольшим диаметром (LD) >20 мм, измеренным при рентгенографии органов грудной клетки (если очаг имеет четкий контур и окружен воздушной легочной тканью)
- Предпочтительнее проводить КТ
о Опухоль с наибольшим диаметром (LD) > 10 мм, измеренным клинически (по фотографии) электронным штангенциркулем:
- На фотографиях на кожных покровах следует располагать линейку
- Образования, размер которых не удается с точностью определить с помощью штангенциркуля, следует считать неизмеряемыми
о Размер лимфатических узлов по короткой оси при КТ должен составлять > 15 мм (толщина среза 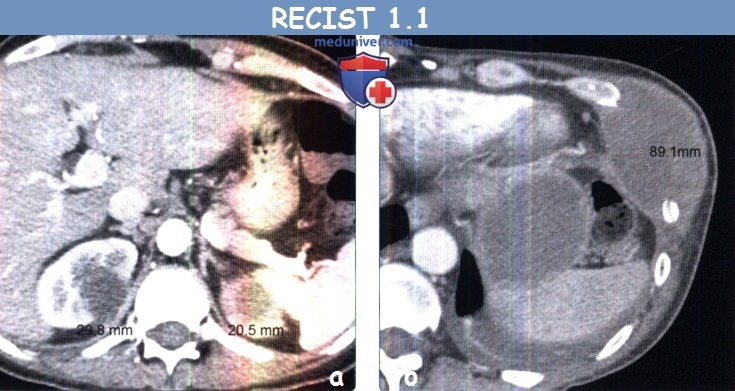
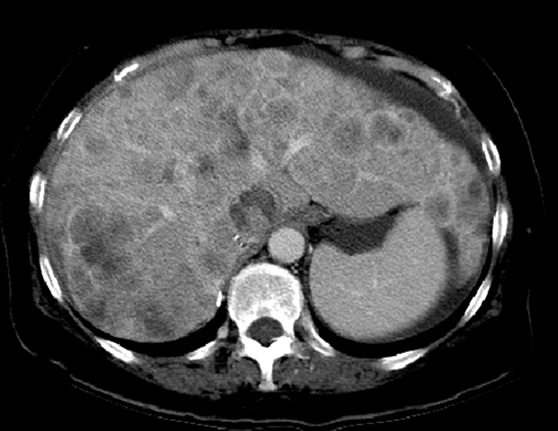
(а) Женщина 27 лет с метастазами EGFR-позитивной аденокарциномы легкого. При КТ с контрастным усилением в почках определяются метастазы. Поскольку ранее они не выявлялись, эта картина соответствует прогрессированию заболевания.
(б) Мужчина 47 лет с метастазами немелкоклеточного рака легкого. При КТ с контрастным усилением в грудной стенке визуализируется метастаз. В соответствии с RECIST 1.1 метастазы в костях считаются целевыми очагами только в том случае, если содержат мягкотканный компонент, отвечающий критериям размера. 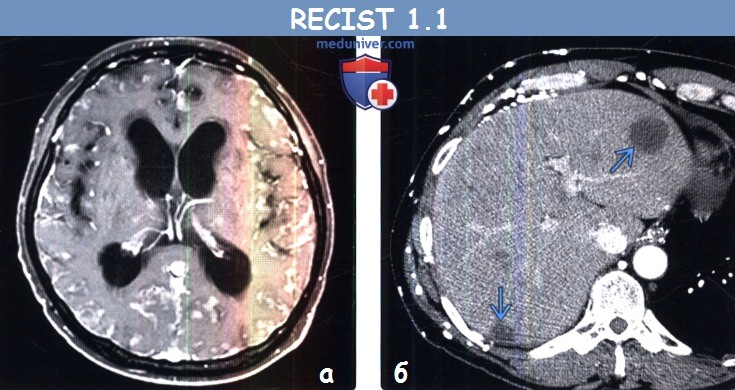
(а) Мужчина 37 года с метастазами аденокарциномы легкого. При МРТ на Т1ВИ с контрастным усилением определяется контрастирование мягкой мозговой оболочки на большом протяжении. Образования, не соответствующие критериям размера целевых очагов, а также такие патологические процессы, как контрастирование мягкой мозговой оболочки, считают неизмеряемыми проявлениями заболевания.
(б) Мужчина 4 7 года с метастазами муцинозной аденокарциномы легкого. При КТ с контрастным усилением в печени визуализируется гиподенсный кистозный метастаз, расцененный как измеряемый очаг. 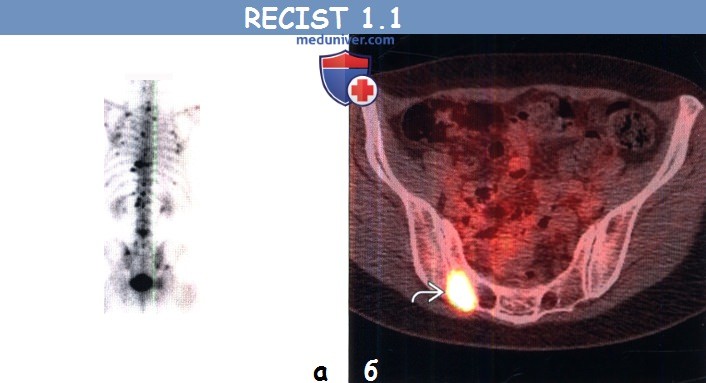
(а) Пациент, страдающий немелкоклеточным раком легкого. При остеосцинтиграфии всего тела в задней проекции определяются множественные очаги повышенного накопления РФП, соответствующие метастазам.
(б) Пациент, страдающий немелкоклеточным раком легкого. При ФДГ-ПЭТ/КТ в правой половине крестца визуализируется очаг с повышенным уровнем поглощения ФДГ. При КТ в данной области патологический участок не выявлен. Остеосцинтиграфия и ПЭТ/КТ могут быть использованы для обнаружения метастазов в костях, но не для их измерения.
в) Оценка ответа:
1. Ключевые принципы:
• Измерение ранее выбранных целевых очагов (даже если их размер перестал быть наибольшим)
• Оценка всех ранее выбранных нецелевых очагов
• Оценка новых очагов
2. Оценка целевых очагов:
• Расчет SLD:
о Измерение LD каждого целевого очага
о Измерение размера целевых лимфатических узлов по короткой оси
о Если размер образования слишком мал для того, чтобы быть измеренным, считают, что его размер составляет 5 мм (величина по умолчанию)
о Если образование исчезло, считают его размер равным 0
о Распадающиеся или сливающиеся очаги:
- Если целевой очаг распадается на множество меньших по размеру фрагментов, то суммируются LD всех фрагментов
- Если целевые очаги сливаются, то используется LD конгломерата
3. Новые очаги:
• Новые очаги должны быть исключительно опухолевой этиологии:
о Сомнительные очаги, возникновение которых обусловлено разницей в методиках исследования или потенциально неопухолевым процессом, не учитывают
о Не обязательно должны быть измеряемыми
• Сомнительные очаги:
о Оценивают повторно при исследовании в следующей временной точке
о Если наличие очага подтверждается при повторном исследовании, то регистрируется прогрессирование заболевания по дате первого выявления такого очага
• Очаги, обнаруженные за пределами зоны первичного исследования, считают новыми
• Наличие новых очагов, выявленных при УЗИ, следует подтвердить с помощью КТ или МРТ
4. Общий ответ:
• Категории:
о Полный ответ (CR)
о Частичный ответ (PR) о Стабилизация заболевания (SD)
о Оценка невозможна (NE) о Прогрессирование заболевания (PD)
6. Ошибочная оценка и случаи, когда оценка невозможна:
• NE: все очаги не могут быть оценены в определенной временной точке:
о Обычно причиной служит потеря данных или низкое качество изображений
о Также данная категория ответа соответствует невозможности оценки некоторой части очагов:
- Исключение: если данные очаги не повлияют на оценку ответа на лечение в определенной временной точке
7. Рецидивирование очагов:
• Влияние рецидивирования очагов зависит от общего ответа:
о Стабилизация заболевания/частичный ответ:
- Образование, подвергшееся обратному развитию, а затем рецидивировавшее, продолжает учитываться
- Категория ответа зависит от состояния других очагов
о Полный ответ
- Рецидивирования образования свидетельствует о прогрессировании заболевания
8. Подтверждение ответа на лечение:
• Частичный ответ/полный ответ:
о Подтверждение необходимо в случае нерандомизированных клинических исследований, в которых эффективность лечения является первичной конечной точкой
о В случае стабилизации заболевания в первой промежуточной точке допускается последующее подтверждение частичного ответа
г) Видео RECIST 1.1 - критерии ответа рака легкого на лечение находится здесь.
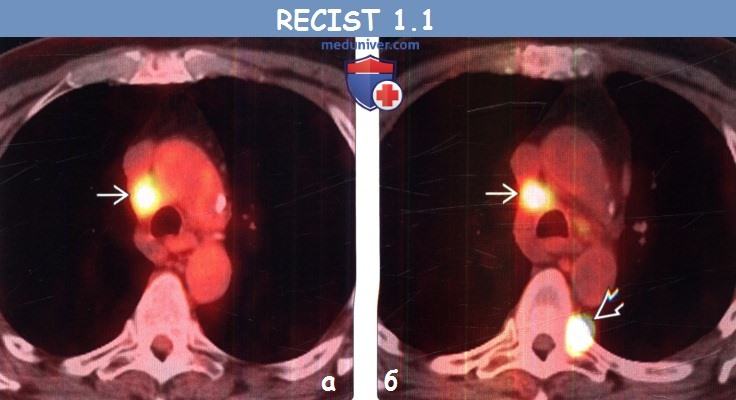
(а) Мужчина 58 лет, немелкоклеточный рак легкого (не показано). При первичной ФДГ-ПЭТ/КТ определяется интенсивный уровень поглощения ФДГ правым паратрахеальным лимфатическим узлом, что соответствует его метастатическому поражению.
(б) У этого же пациента после курса химиотерапии при ФДГ-ПЭТ/КТ уровень поглощения ФДГ правым паратрахеальным лимфатическим узлом остался без изменений, однако в грудном позвонке возник новый интенсивно накапливающий ФДГ метастаз, что соответствует прогрессированию заболевания. 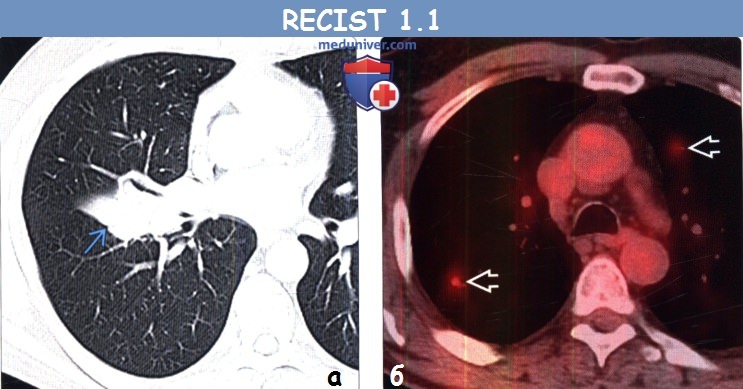
(а) Мужчина 49 лет, немелкоклеточный рак легкого. При первичной КТ с контрастным усилением в нижней доле правого легкого определяется первичная злокачественная опухоль
(б) У этого же пациента после курса химиотерапии при ФДГ-ПЭТ/КТ в легких визуализируются новые интенсивно поглощающие ФДГ узелки, соответствующие метастазам. Поскольку данные метастазы при первичной КТ не выявлялись, а при последующей КТ их наличие было подтверждено, то картина соответствует прогрессированию заболевания. 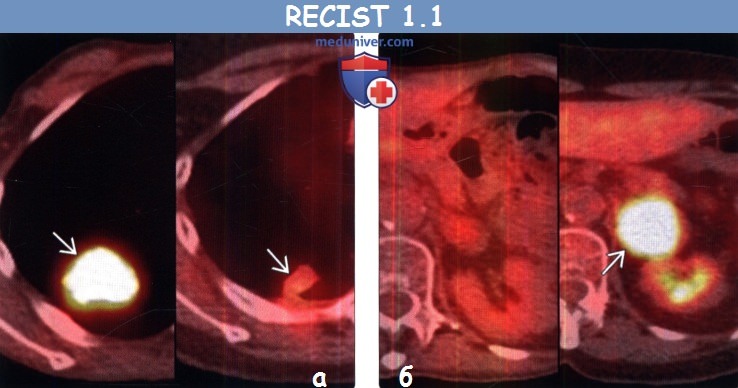
(а) Пациент, страдающий немелкоклеточным раком легкого. На совмещенных изображениях при первичной ФДГ-ПЭТ/КТ (слева) и после курса химиотерапии (справа) определяется выраженное уменьшение размера единственного целевого очага, соответствующего первичной злокачественной опухоли. Интенсивность поглощения ФДГ данным очагом также снизилась.
(б) У этого же пациента на совмещенных изображениях при первичной ФДГ-ПЭТ/КТ (слева) и после курса химиотерапии (справа) визуализируется возникновение интенсивно поглощающего ФДГ метастаза в левом надпочечнике, что соответствует прогрессированию заболевания.
в) Список литературы:
1. Litiere S et al: The components of progression as explanatory variables for overall survival in the Response Evaluation Criteria in Solid Tumours 1.1 database. Eur J Cancer. 50(10)4847-53, 2014
2. Nishino M et al: Revised RECIST guideline version 1,1: What oncologists want to know and what radiologists need to know. AJR Am J Roentgenol. 195(2):281-9, 2010
3. van Persijn van Meerten EL et al: RECIST revised: implications for the radiologist. A review article on the modified RECIST guideline. Eur Radiol. 20(6)4 456-67, 2010
4. Eisenhauer EA et al: New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer, 45(2):228-47, 2009
5. Eisenhauer EA et al: Response assessment in solid tumours (RECIST) and supporting papers (version 14). Eur J. Cancer. 45(2):225-310, 2009
Редактор: Искандер Милевски. Дата публикации: 24.2.2019
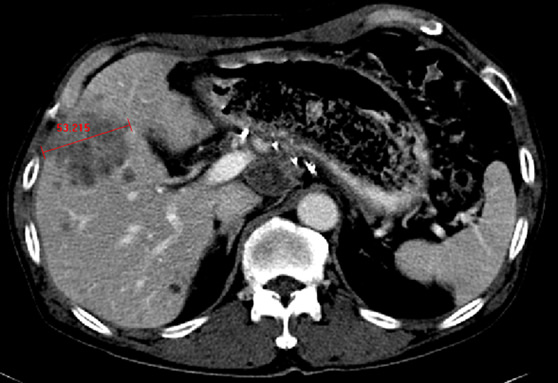
Современными критериями ответа опухоли на терапию являются критерии RECIST 1.1 от 2009 года. Критерии RECIST - это набор критериев, которые используют для оценки ответа опухоли на проводимую терапию. Основу оценки составляет определение размера опухоли с помощью методов лучевой диагностики (рентгенографии, компьютерной томографии, магнитно-резонансной томографии, ультразвукового исследования) и эндоскопических методов.
Опухолевые очаги
В соответствии с критериями RECIST опухолевые очаги подразделяются на два типа:
- измеряемые очаги — очаги, выявляемые и составляющие по наибольшему диаметру:
- ≥10 мм при спиральной КТ при реконструкции срезов толщиной в 5 мм
- ≥20 мм при шаговой КТ с толщиной среза 10 мм
- ≥20 мм при рентгенографии грудной клетки
неизмеряемые очаги — очаги, выявляемые и составляющие по наибольшему диаметру при шаговом КТ величение размеров органов (гепатоспленомегалия), п еритонеальные импланты.
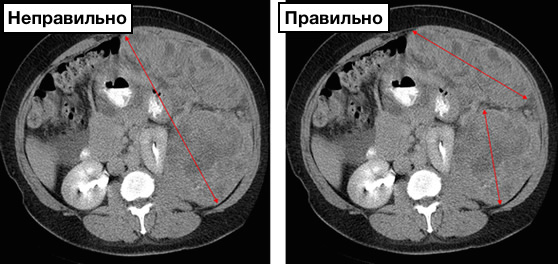
- В первую очередь измеряемые очаги оцениваются количественно.
- Следующим шагом нужно выбрать таргетные очаги, которые в процессе терапии будут использоваться для контроля. Таргетный очаг сохраняется на протяжении всех повторных исследований таргетным, если даже размеры очаги уменьшатся до пределы погрешности метода исследования.
Выбирайте не наибольший очаг в качестве таргетного, а наиболее четкий, оптимальный для измерения.
Таргетные очаги:
- измеряемые очаги, максимально до 5 очагов на орган, в сумме до 10 очагов, очаги, отражающие пораженный орган должны соответствовать критериям таргетного очага
- выбираются исходя их размеров (с наибольшим диаметром) и пригодности для точного повторного измерения
- очаги в подвижных органах (напр. жкт, яичниках) могут быть неподходящими для оценки
- указываются только аксиальные размеры
Не-таргетные очаги:
- могут включать как измеряемые, так и неизмеряемые очаги
- к измеряемым очагам относят все очаги, которые превышают максимально допустимое количество таргетных очагов (до 5 очагов на орган, не более 10 очагов на весь организм), попадая таким образом в группу не-таргетных очагов
- не-таргетные очаги не обязаны быть измеряемыми
- в идеале должны включать все очаги не отнесенные к таргетным очагам
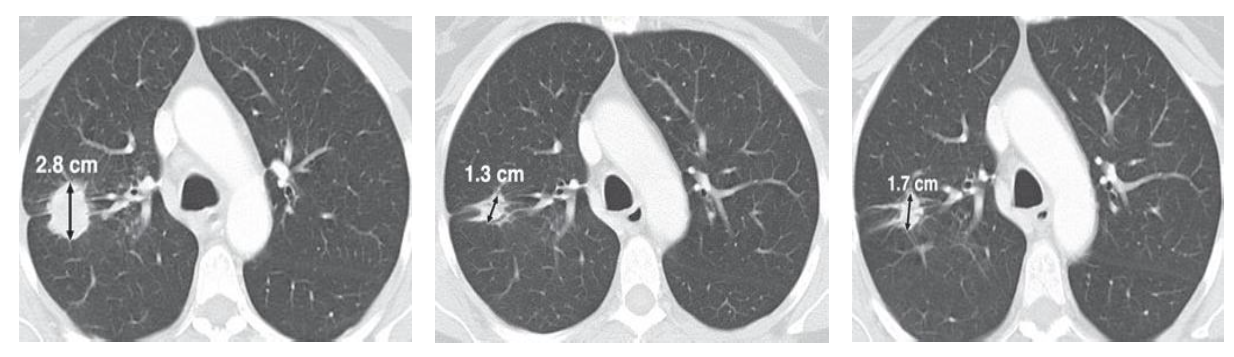
A. Образование наибольшим диаметром 2.8 см (единственный выявленный очаг).
B. КТ после 1 курса химиотерапии, наибольший диаметр образования 1.3 см – уменьшение размеров на 54% - PR.
C. до 1.7 см - увеличение на 30%, однако менее, чем на 5мм - SD по RECIST 1.1

Химиотерапия — медикаментозный способ излечения рака. При разработке лечебной схемы большую важность имеет предсказание ответа опухоли на терапию. Пациенту прописывают капельницы, таблетки, инъекции, содержащие определенные компоненты. Они строго дозированы и индивидуально скомбинированы для борьбы с конкретной патологией:
- раком молочной железы;
- нейробластомой;
- глиомой;
- меланомой;
- раком мочевого пузыря;
- раком толстой кишки, кишечника, желудка;
- раком легкого;
- раком предстательной железы, простаты;
- раком почки;
- раком яичника.
Причины и симптомы опухолей
Точные причины развития онкопатологий изучены недостаточно, однако имеются данные о роли наследственности в этом вопросе.
Онкозаболевания могут проявляться:
- дисфункциями кишечника или мочевого пузыря;
- долго незаживающими язвами;
- необычными кровотечениями, выделениями;
- уплотнениями или образованиями узлов в молочной железе (или других местах и органах);
- диспепсией, затруднениями при глотании;
- изменениями бородавок или родимых пятен;
- изнуряющим кашлем, охриплостью голоса и т. д.
Необходимость определения ответа опухоли на терапию
Важным критерием оценки эффективности химиотерапии, планирования и коррекции лечения, принятия решения об операции или продолжении химиотерапии, а также прогноза течения заболевания является предсказание ответа опухоли на терапию. Проводится оптимизация ныне используемых методов оценки ответа раковых патологий на химиотерапевтическое лечение.
Персонифицированный подход к лечению рака сводится к выявлению ряда биомаркеров (онкомаркеров) в опухоли пациента. Биомаркеры представляют собой определенные белки, гены или ферменты, которые можно идентифицировать лабораторным методом и оценить их роль в онкологическом процессе. Существует взаимосвязь между предварительным определением ответа опухоли на терапию со временем до прогрессирования болезни и общей выживаемостью пациентов.
Эффективность применения противораковых препаратов связана с определением целого ряда биомаркеров, которые позволяют предсказать чувствительность рака к цитостатикам, спрогнозировать эффективность комбинаций различных лекарственных средств и т. д. Таким образом, определение ответа опухоли на терапию — условие подбора максимально эффективного лечения.
Таргетная терапия
Применение химиотерапии в лечении опухолей направлено не на разрушение клеток новообразования, а на подавление их активности и угнетение способности к регенерации. У этого метода есть побочные эффекты. Химиотерапевтические вещества действуют не только на клетки опухоли, но затрагивают и здоровые клетки организма. Пациенты страдают от сопутствующих расстройств, которые усложняют лечение онкологического заболевания.
Это привело к необходимости разработки препаратов, которые воздействуют исключительно на раковые клетки опухоли, и к появлению такого направления, как таргетная терапия. Подбор противоопухолевых (противораковых) препаратов является индивидуальным. Ответ опухоли на таргетную терапию должен быть оптимальным, поэтому предварительно проводится исследование — определение молекулярных опухолевых характеристик.
Мишени таргетных препаратов:
- генные структуры, отвечающие за рост и деление клеток опухоли;
- молекулярные структуры, контролирующие апоптоз;
- рецепторы к гормонам, лежащие на поверхности раковых клеток;
- рецепторы факторов роста, сосудистые структуры, отвечающие за развитие опухолевой сосудистой сети.
5 фторурацил, фторафур
Гистологическое исследование резецированного материала показало полное отсутствие опухолевой паренхимы (лечебный патоморфоз 4 степени) у 8-ми (80%) из 10-ти больных, сохранение 20-50% опухолевой паренхимы (лечебный патоморфоз 2 степени) установлено в 2-х случаях.
Рентгенологическое исследование показало полный ответ опухоли (CR) у одного больного, частичный ответ (PR) — у 2-х больных, стабилизацию опухоли (SD) — у 7-ми больных (табл. 4).
У больного с рентгенологически полным ответом в резецированном пищеводе опухолевого роста не обнаружено, но в 1-м перигастральном л/узле из 5-ти обнаружен лечебный патоморфоз 2 ст. Из 2-х больных с частичным ответом у 1-го установлен лечебный патоморфоз 4 ст. с клетками рассасывания в мыщечном слое, а у второго установлен 2 ст. лечебного патоморфоза плоскоклеточного рака. Из 7-ми больных с рентгенологической стабилизацией опухоли у 6-ти больных патоморфологическое исследование показало полное отсутствие паренхимы опухоли (лечебный патоморфоз 4 ст.) и у одного больного частичный ответ (лучевой патоморфоз 2 ст.).
Рентгенологическое обследование после неоадъювантной терапии предсказало полный гистологический ответ опухоли у 1-го (10%) из 10-ти больных (табл. 4).
Эндоскопическое обследование через 3-4 недели после завершения лечения было выполнено 6-ти больным. Полный ответ (CR) зарегистрирован у 3-х больных, частичный ответ (PR) — у одного больного и стабилизация опухоли (SD) — у 2-х больных (табл. 4).
Из 4-х больных с полным и частичным ответом опухоли, установленным эндоскопически, у всех в резецированном материале полностью отсутствовала опухолевая паренхима (лучевой патоморфоз 4 степени), а из 2-х больных, не ответивших на проведенное лечение (частичный ответ и стабилизация опухоли), у одного больного, которому эндоскопическое исследование было выполнено непосредственно после завершения химио-лучевой терапии, патоморфологически были выявлены изменения характерные для лечебного патоморфоза 4 степени лишь в слизистой оболочке пищевода, у второго больного, которому исследование было выполнено через месяц, гистологически был установлен лечебный патоморфоз 2 степени. Таким образом, эндоскопическое исследование, проведенное через 3-4 недели, предсказало полный гистологический ответ опухоли на проведенное лечение у 3-х (50%) из 6-ти больных.
Лечебный патоморфоз 4 степени установлен у 6-ти из 8-ми больных, которым химиотерапия была проведена производными платины и антогонистами пиримидинов. Из 3-х больных, которым было проведено 2 цикла химиотерапии производными платины и антогонистами пиримидинов, лечебный патоморфоз 4 степени был установлен у 2-х больных, у одного больного — 2 ст. Из 5-ти больных, которым был проведен один цикл химиотерапии лечебный патморфоз установлен у 4-х больных. Лечебный патоморфоз 4 степени установлен у одного больного, которому проведен один цикл химиотерапии производными платины и таксанами и у одного больного, которому проведена химиотерапия антагонистами пиримидинов (5 фторурацил, фторафур). Малое количество больных в исследуемой группе не позволяет предположить какую-либо взаимосвязь лечебного эффекта с дозой используемых препаратов (табл. 4).
В последние 15 лет авторы зарубежных исследований сравнительной эффективности лучевых методов дооперационной оценки ответа опухоли на химиолучевую терапию у больных раком пищевода отмечают, что точность КТ значительно ниже точности эндоскопического УЗИ и ФДГ-ПЭТ, а точность эндоскопического УЗИ аналогична ФДГ-ПЭТ [17, 18, 21, 22].
Swisher S.G. и совт. [22] показали, что точность ФДГ-ПЭТ в предсказании отсутствия ответа (сохранение более 10% жизнеспособных опухолевых клеток) на проведенное лечение превосходит УЗИ-эндоскопию и КТ, точность предсказания которых составила 76, 68 и 62% соответственно.
Westerterp М. и соавт. [18] на основании данных 11 исследований полагают, что максимальная совместная чувствительность и специфичность для КТ, эндоскопического УЗИ и ФДГ-ПЭТ составляет 54, 86 и 85% соответственно, расчетные значения специфичности КТ, эндоскопического УЗИ и ФДГ-ПЭТ (значения, которые соответствуют желаемому уровню чувствительности 90%) — 13, 78 и 78%, соответственно.
В настоящее время ФДГ-ПЭТ/КТ с измерением изменения степени и интенсивности накопления 18 фтордезоксиглюкозы представляется лучшим методом визуализации не только ответа опухоли [18, 23-26], но и раннего реагирования опухоли на химиолучевую терапию у больных раком пищевода [27]. Однако до настоящего времени, нет ни одного масштабного рандомизированного исследования, где были бы установлены стандартные методы оценки ответа опухоли на химиолучевое лечение с учетом гистологического типа опухоли, степени ее распространения, схем химиотерапии и метода облучения.
Заключение
1. Рентгенографический метод исследования является малоинформативным в оценке ответа опухоли, индуцированного неоадъювантной химиолучевой терапией у больных раком грудного отдела пищевода.
2. Информативность эндоскопического исследования, выполненного через 3-4 недели после завершения химиолучевой терапии, в оценке ответа опухоли значительно превышает информативность рентгенографического метода исследования.
3. Представляется целесообразным проведение исследования эффективности ФДГПЭТ/КТ для оценки ответа опухоли, индуцированного неоадъювантной химиолучевое терапией у больных раком грудного отдела пищевода.
Литература
Лавникова Г.А. Некоторые закономерности лучевого патоморфоза опухолей человека и их практическое использование // Вестн. АМН СССР. — 1976. — 6. — С. 13-19.
1 Современные критерии ответа опухоли на терапию *RECIST 1.1 Научный сотрудник ГБУЗ НПЦ медицинской радиологии Гележе Павел Борисович
2 Зачем нужны критерии ответа опухоли на терапию? Важно разделить пациентов по типу ответа Позволит достичь максимальной эффективности лечения Разработка критериев ответа в первую очередь для клинических исследований RECIST 1.0 размер выборки 569 пациентов* RECIST 1.1 размер выборки более 6500 пациентов** *Measuring response in solid tumors: unidimensional vs bidimensional measurement / James K, Eisenhauer E, Christian M, et al. - J Natl Cancer Inst 1999;91(6): **Individual patient data analysis to assess modifications to the RECIST criteria / Bogaerts J, Ford R, Sargent D, et al. - Eur J Cancer 2009;45(2):
3 Зачем создавать много критериев ответа?
4 Первый вариант критериев: World Health Organization, 1979 Оценка суммы поперечных размеров Sum of product diameters (SPD) Отсутствие ограничения минимальных размеров, количества очагов
5 RECIST 1.0 Измерение наибольшего размера очага До 10 образований, не более 5 в одном органе Отсутствие ограничения минимальных размеров, количества очагов New guidelines to evaluate the response to treatment in solid tumors (RECIST Guidelines) Therasse P, Arbuck SG, Eisenhauer EA, et al. J Natl Cancer Inst 2000;92:
6 RECIST 1.1 (2009)
7 RECIST 1.1 (2009) Response Evaluation Criteria In Solid Tumors Не применяется при: Опухолях головного мозга (RANO) GIST (Choi) Гепатоцеллюлярном раке (mrecist) Лимфомах (Cheson, Lugano)
8 Что измеряем при RECIST 1.1 Опухолевые очаги в тканях и органах Не менее 10 мм в диаметре Литические или смешанные очаги в кости (не менее 10 мм) Лимфатические узлы Измерение только по короткой оси (КО) Не менее 15 мм по КО ИЗМЕРЯЕМЫЕ ОЧАГИ
9 Измеряемые образования mts очаг в печени 1,9 см очаг по брюшине 1,6 см
10 Измеряемые образования подвздошный лимфоузел 3,1 см метастаз колоректального рака в легкие 2,5см
11 Что нельзя измерять (nonmeasurable disease) Остеобластические очаги Плевральный, перикардиальный, абдоминальный выпот Перитонеальные импланты Лимфогенный канцероматоз Увеличение размеров органов (гепатоспленомегалия)
12 Сколько очагов измеряем? Не более 2-х в органе Парные органы (легкие, почки) один орган Не более 5 в теле (включая лимфатические узлы) ТАРГЕТНЫЕ (ЦЕЛЕВЫЕ) ОЧАГИ
14 Внутривенное контрастирование и выбор фазы Множественные метастазы нейроэндокринной опухоли в печень Разность в визуализации количества и размеров очагов в артериальную и венозную фазу контрастирования
15 Образования, воспроизводимые в измерениях Reproducible lesions
16 Слияние или распад образований Если отдельные образования сливаются в конгломерат, сравнивайте его наибольший размер с суммой наибольших размеров исходных образований Если происходит распад исходного образования, измеряйте сумму наибольших диаметров его частей
17 Слияние образований Метастазы колоректального рака в печень
18 Оценка динамики заболевания по RECIST 1.1 Частичный ответ (Partial Response) PR Полный ответ (Complete Response) CR Прогрессирование заболевания (Progressive Disease) PD Стабилизация заболевания (Stable Disease) SD Уменьшение суммы диаметров очагов не менее чем на 30% Исчезновение всех очагов. Любой из прежде увеличенных лимфатических узлов должен иметь короткую ось менее 10 мм Увеличение на 20% и более суммы диаметров основных очагов (> 5 мм); появление одного или нескольких новых очагов; безусловная прогрессия нецелевых очагов Все остальное
19 Частичный ответ PR Мужчина, 47 лет, 2 метастаза колоректального рака в печени: 4.6 см (А) и 5.4 см (B), суммарно 10.0 см. C и D. Контрольное КТ после курса химиотерапии, уменьшение размеров очагов: 3.3 см (C) и 2.7 см (D) соответственно, суммарно 6.0 cm уменьшение на 40% [(10 см 6 см) / 10 см 100] частичный ответ PR
20 PR и SD A. Образование наибольшим диаметром 2.8 см (единственный выявленный очаг). B. КТ после 1 курса химиотерапии, наибольший диаметр образования 1.3 см уменьшение размеров на 54% - PR. C. до 1.7 см - увеличение на 30%, однако менее, чем на 5мм - SD по RECIST 1.1
21 Прогрессирование заболевания PD Появление новых очагов!
22 Выбор базового исследования При неизмененном тренде сравнение производить с исходной точкой При изменении тренда производить сравнение с надиром Точка наименьших измерений
23 Резюме Изменения размеров опухоли не всегда отражают динамику заболевания Возможно использование только для солидных опухолей Слабая воспроизводимость измерений Несовпадение измерений до 29,75 % при PD и до 13,75 % при PR* Единственные критерии ответа, испытанные на большой выборке пациентов
Предметы
Эта статья была обновлена
Аннотация
Радиологическая оценка ответа на ингибиторы контрольной точки остается несовершенной. Мы оценили индивидуальное поражение и реакцию между пациентами по оценке ответа (RECIST) 1.1, критериям иммунного ответа (irRC), CHOI и модифицированному CHOI (mCHOI) и коррелировали ответ с общей выживаемостью (OS).
Методы:
Тридцать семь пациентов с 567 измеримыми поражениями, получавшими пембролизумаб в исследовании Keynote 001, были исследованы. Ассоциация ответа с ОС была определена.
Результаты:
Ответ варьировался в зависимости от сайта; поражения легких имели самый высокий уровень полного ответа (69 из 163 (42%) против других сайтов 71 из 404 (18%), P 2 по сравнению с исходным уровнем увеличивало риск смерти на 25, 9% (ЧСС = 1, 259 (95% ДИ = 1, 116–1, 420), P = 0, 0002). Точно так же, каждое увеличение плотности в 20HU увеличивало ЧСС на 15% (ЧСС = 1, 15, (95% ДИ 1, 045–1, 260), P = 0, 004). Ответ, определенный по любым критериям, имел превосходную ОС (CHOI P = 0, 0084; mCHOI P = 0, 0183; irRC P 15% указывает на ответ на лечение.
Схемы ответа могут отличаться между агентами ICI. Антитела против PD-1 и CTLA-4 имеют различные механизмы действия (Das et al, 2015), и отсроченные ответы или псевдопрогрессия, по-видимому, реже встречаются с агентами против PD-1, по крайней мере, при меланоме (Chiou and Burotto, 2015; Wolchok et al, 2015). Неизвестно, различаются ли схемы ответа с ICI между типами солидных опухолей.
Мы стремились изучить различные варианты ответа на пембролизумаб анти-PD-1-антитело у пациентов с меланомой, получавших этот препарат в фазе I исследования. Одной из целей было оценить и сопоставить ответ с использованием RECIST и irRC. Мы также стремились изучить роль CHOI и модифицированного CHOI (mCHOI) в оценке реакции с этим агентом.
материалы и методы
Это ретроспективное исследование было проведено в Онкологическом центре принцессы Маргарет, Торонто, Онтарио, Канада, с использованием протокола, утвержденного Советом по этике институциональных исследований (14–7328), в соответствии с Хельсинкской декларацией. Были идентифицированы пациенты, участвовавшие в исследовании I фазы Keynote 001 пембролизумаба при меланоме, и были проанализированы их клинические характеристики и результаты сканирования. Двумерные измерения диаметра и плотности опухоли были получены на исходном уровне и при последующей серийной оценке КТ, выполненные в определенные моменты времени в соответствии с протоколом исследования. По возможности, сканирование, выполненное до базового сканирования (предварительное базовое сканирование), также рассматривалось. Измеримые поражения были определены как поражения, имеющие mm5 мм по наибольшему диаметру или in15 мм по короткой оси для лимфатических узлов (LNs). Ответ, специфичный для поражения, определялся по изменению произведения длинных перпендикулярных диаметров и классифицировался как полный (CR, полное исчезновение или диаметр по короткой оси 10 мм для LN), частичный (PR, уменьшение 50%), PD (25% увеличение) или стабильный (SD, ни CR, ни PR, ни PD). Реакцию опухоли пациента определяли с использованием критериев irRC (Wolchok et al, 2009), RECIST 1.1 (Eisenhauer et al, 2009), CHOI (Choi et al, 2004, 2007) и mCHOI (Nathan et al, 2010). Все рентгенологические оценки были выполнены, как описано ранее (Choi и др., 2004, 2007; Eisenhauer и др., 2009; Wolchok и др., 2009; Nathan и др., 2010), см. Таблицу 1, а количество оцененных поражений показано в дополнительной таблице. 1
Таблица в натуральную величину
Общий ответ был назначен в соответствии с окончательной компьютерной томографией. Была определена связь каждого радиологического критерия с ОС.
статистический анализ
Категориальные переменные, такие как классификация бремени опухоли, место возникновения, пол, стадия, уровень ЛДГ, статус BRAF и NRAS, были суммированы с подсчетами и процентами. Непрерывные переменные, такие как опухолевая нагрузка от исходного уровня до исходного уровня и последующие меры, были обобщены со средним значением, медианой и / или диапазонами в зависимости от ситуации. χ 2 -тест использовался для сравнения уровня категориальных ковариат, представляющих интерес, с общим ответом (CR против PR / SD / PD). T- тест Стьюдента использовался для сравнения размера поражений на исходном уровне на основании общего ответа (CR против PR / SD / PD). Время до события было определено как интервал от базовой КТ до даты смерти или даты последнего наблюдения для тех, кто был жив в конце исследования. Оценки общей выживаемости были получены с использованием метода предела произведения Каплана-Мейера. Лог-ранговый тест использовался в качестве тестовой статистики для оценки влияния общего отклика на ОС. Модель пропорциональных рисков Кокса также использовалась для оценки влияния увеличения размера опухоли и увеличения плотности от базовой линии на ОС. Все значения P были двусторонними, и для статистического анализа будет рассмотрено, что P 2 (диапазон 15–20 976). Эти множественные поражения были расположены в различных местах, включая внутренние органы, кожу, узлы и мышцы. Наиболее распространенное место возникновения было в легких с 163 из 567 поражений (29%), происходящих в этом месте. Узловая болезнь составила 25% (140) от всех поражений, см. Таблицу 3.
Таблица в натуральную величину
Реакция на поражения в зависимости от места метастазирования и размера поражения
В целом, большинство повреждений оставалось стабильным в двумерном размере в течение всего периода оценки, тогда как 25% (140 из 562) продемонстрировали CR, который был определен как полное исчезновение повреждения или 
Реакция оценивается в отдельных очагах и в зависимости от местоположения. ( A ) Обзор реакции отдельных поражений, большинство поражений оставалось стабильным (34%) с КР, очевидным в 25%. ( B ) Ответ различался в зависимости от локализации метастатического заболевания, при этом поражения легких демонстрировали наибольший ответ.
Изображение в полном размере
Поражения, перенесшие CR, были меньше по размеру (определяемые как POD) на исходном уровне по сравнению с поражениями с PR / SD / PD; среднее значение POD / SD / PD (среднее значение / стандартное отклонение POD CR (568, 8 / 879, 6 мм 2 ) против среднего значения POD / SD / PD (806, 7 / 1166, 7 мм 2 ; P = 0, 015).
Была выявлена связь между клинической пользой и статусом BRAF ( P -1 .
Изменения в размере поражения до начала, в начале и в процессе лечения
В целом наблюдалось увеличение опухолевой нагрузки от предварительного исследования до базового исследования, что оценивалось по изменению POD всех поражений со средним увеличением 1467 мм 2 (диапазон от -621 до 7074). Когда POD был рассчитан на пациента, большинство (84%, 31 из 37) показали увеличение размера опухоли от исходного до исходного уровня. Не было никаких доказательств связи между этим предварительным исходным уровнем и базовым изменением (увеличенным или уменьшенным) и последующим ответом в первом проведенном последующем исследовании (поддается оценке у 37 пациентов, P = 0, 19). Тем не менее, была отмечена значительная связь между этим предварительным исходным уровнем и базовым изменением (увеличенным или уменьшенным) и вторым контрольным оценочным исследованием (оцениваемым у 30 пациентов, P = 0, 03). Из пациентов, у которых заболевание увеличивалось до исходного сканирования, 56% (irRC) и 48% (RECIST) продемонстрировали либо полное, либо PR во втором последующем исследовании, и 16% и 28% испытывали SD по критериям irRC и RECIST соответственно. ( P = 0, 03 и P = 0, 03).
Ответ в соответствии с IRRC
При оценке с использованием IRRC 59% пациентов (22 из 37 пациентов) имели клиническую пользу в первый момент оценки, описанный как CR ( n = 1), PR ( n = 14) или SD ( n = 7). Сорок один процент пациентов (15 из 37) показали неподтвержденные ПД в первом оценочном исследовании (в IRRC требуется подтверждение ПД путем повторной оценки в течение как минимум 4 недель). Из этой группы пациентов семь были подтверждены как PD в последующих исследованиях, два пациента впоследствии продемонстрировали отсроченную пользу от SD по irRC или PR по irRC, а у остальных шести пациентов после этого не было дополнительной визуализации (Рисунок 2). ). Один из семи пациентов с подтвержденным БП при втором обследовании продемонстрировал атипичный отсроченный ответ в последующих оценках с результирующим PR по IRRC.

Паттерны ответа, оцененные с помощью (A) irRC и (B) Критерии оценки ответа при солидных опухолях (RECIST) 1.1. Паттерны ответов отличались более значительными вариациями, наблюдаемыми при первом сканировании, как было оценено RECIST, по сравнению с irRC.
Изображение в полном размере
Ответ в соответствии с критериями RECIST 1.1
При оценке с использованием критериев RECIST у 43% (16 из 37 пациентов) был обнаружен БП при первичном сканировании. Среди этих пациентов с REC REC PD, irRC идентифицировали четырех из них как имеющих стабильное заболевание в первоначальном оценочном исследовании, двое из которых продолжали демонстрировать объективные ответы (irRC) в последующей точке оценки, один имел PR irRC и один SD irRC. Следовательно, этот анализ показывает, что 5% (2 из 37) пролеченных пациентов, которые первоначально были охарактеризованы как БП по критериям RECIST, действительно продемонстрировали некоторую пользу от лечения (Рисунок 2).
Ответ по критериям CHOI и mCHOI
Двадцать четыре (65%) пациента соответствовали критериям плотности и размера CHOI для оценки клинического эффекта (CR, PR или SD) при первом наблюдении. Критерии CHOI и mCHOI показали преимущество в 38% (14 из 37). Изменение размера и плотности опухоли при первой последующей оценке было связано с ОС с увеличением размера опухоли на 1000 мм 2 по сравнению с исходным уровнем, повышая риск смерти на 26% (ЧСС = 1, 26, (95% ДИ = 1, 12–1, 42), P = 0, 0002). Точно так же, каждое увеличение плотности в 20HU увеличивало ЧСС на 15% (ЧСС = 1, 15, (95% ДИ 1, 045–1, 260), P = 0, 004).
Различия в оценке ответов между критериями
Влияние плотности в отличие от изменения размера поражений было изучено путем сравнения, где это возможно, ответа RECIST на CHOI в каждый момент времени. Были различия в клинической пользе по каждому из этих критериев, что позволяет предположить, что плотность имела добавленную стоимость при оценке ответа (Таблица 4; Дополнительная Таблица 2).
Таблица в натуральную величину
При исследовании самых больших наборов данных, исходных данных, вначале и во время второго наблюдения, были выявлены различия между критериями в количестве пациентов, которые, как было определено, получали клиническую пользу от лечения (Таблица 5). Невозможно было определить, какой критерий был оптимальным при оценке ответа во время лечения или в целом. Амплитуда ответа по каждому критерию для всех поддающихся оценке пациентов показана на дополнительной фигуре 1. Рисунок 3 иллюстрирует разницу в оценке по разным критериям в одном очаге при серийном КТ при лечении.
Таблица в натуральную величину

Серийные изображения 62-летней женщины с метастатической меланомой в подкожных тканях, обработанных антителом против PD-1. ( A ) Базовое сканирование показывает подкожный осадок размером 26 × 20 мм с плотностью 57 HU. ( B ) Первое последующее сканирование, выполненное через 13 недель после первой инфузии, показало, что поражение прогрессировало с помощью RECIST и irRC (измерения были 48 × 32 мм), но уменьшилось по плотности (до 38 HU). ( C ) На втором последующем КТ-сканировании измерения были 60 × 31 мм, но плотность снова уменьшилась (до 35 HU). ( D ) При окончательном оценочном сканировании измерения были 67 × 30 мм, но плотность была 25 HU.
Изображение в полном размере
Связь между ответом (по каждому критерию) и ОС
На момент сообщения средний период наблюдения составил 9, 7 месяца (диапазон 3–19). Ответчики (CR / PR / SD против PD), определенные по любому критерию, имели превосходную ОС (путем тестирования по рангу); irRC P 2 ( P
Читайте также:

