Лечение рака печени современные методы
Рак печени — злокачественное новообразование с летальным исходом, занимающее 5 место по распространенности среди мужчин и 8 среди женщин. В большинстве случаев заболевание диагностируют на запущенных стадиях, сопровождающихся циррозом. В развитых странах у приблизительно 30% населения выявляют относительно благоприятную гепатоцеллюлярную карциному.
У таких больных результативно следующее лечение:
- Хирургическая резекция;
- Миниинвазивные методики:
- Химиоэмболизация;
- Радиочастотная (термическая) абляция;
- Микроволновая абляция;
- Радиоэмболизация.
- В ряде случаев показана трансплантация печени. [1]

Гепатоцеллюлярный рак зачастую возникает на фоне цирроза печени
Хирургическая резекция печени
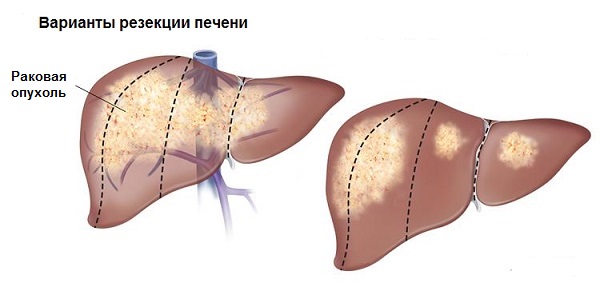
Резекцией печени называется операция по удалению части органа. Она показана в случае необходимости удаления периферического участка печени, его сегментов, долей. Оперативное вмешательство проводится с применением общего наркоза. Выделяют анатомические (типичные) и атипичные (неанатомические) резекции.
Анатомическая резекция подразумевает удаление части печени согласно строению органа. При ней производят перевязку крупных сосудов и протоков в портальных и кавальных вратах органа. Ткань разделяют в пределах малососудистых участков – портальных фиссур. Атипичная резекция — удаление части печени, основанное не на ее анатомии, а на объеме охвата патологическим процессом тканей органа. Во время операции не учитывают особенности строения и направления сосудов, печеночных протоков, не производят предварительную перевязку печеночной ножки. Основным условием оперативного вмешательства является наложение гемостатического (кровоостанавливающего) шва или внутритканевая перевязка печеночных протоков и кровеносных сосудов.
Среди типичных резекций выделяют:
- Правостороннюю или левостороннюю гемигепатэктомию — удаление левой (удаляют 35% ткани органа) или правой (резекция 65% тканей) половины печени;
- Расширенная гемигепатэктомия – гепатэктомия с удалением дополнительных тканей (70% и более);
- Правостороннюю или левостороннюю латеральную лобэктомию – удаление 6,7 сегментов печени справа или 2,3 слева;
- Сегментэктомии (удаление сегмента органа) и би – трисегментэктомии (удаление 2-х и 3-х сегментов соответственно).
Среди атипичных резекций выделяют:
- Краевую;
- Клиновидную;
- Поперечную;
- Сегментарную;
- Долевую.
Трансплантация печени
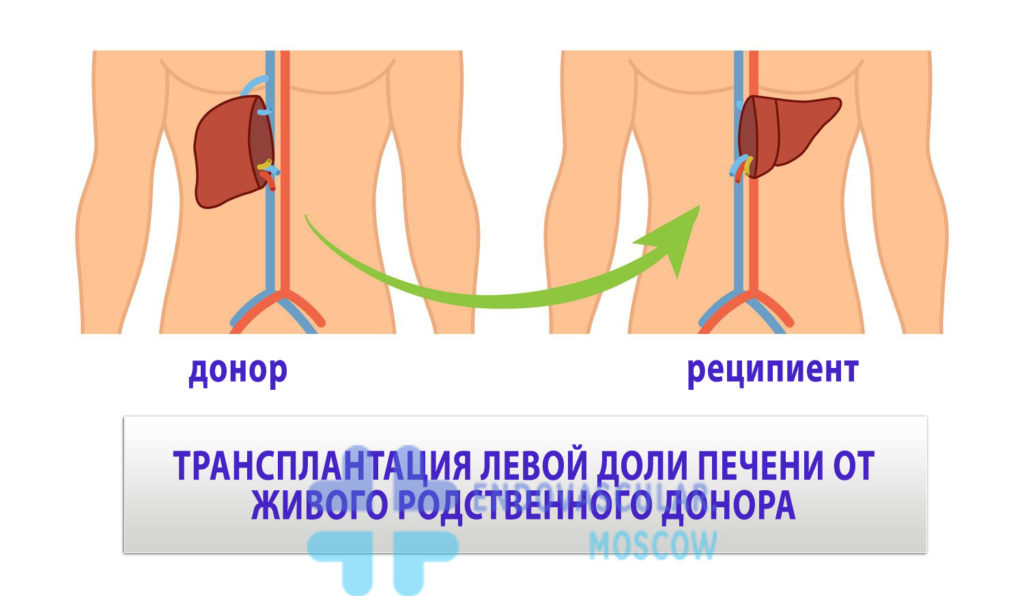
Можно пересадить как печень живого донора, так и мертвого. Связано это с регенераторной способностью печени – с 1 доли может вырасти целый орган. Оптимальной является пересадка органа от родственника (родителя, ребенка, сестры или брата) – т.о. снижается вероятность развития аутоиммунных реакций отторжения организмом трансплантата.
Требования к донорскому органу:
- Совместимость по группе крови и резус-фактору;
- Отсутствие заболеваний и/или повреждений органа;
- Отсутствие заболеваний, передающихся через кровь;
- Удовлетворительное общее состояние донора.
Операция заключается в удалении больного органа с участком полой вены, прекращении кровотока по сосудам, питающим орган, установке шунтов, по которым перекачивается кровь к сердцу из нижней полой вены. После чего пациенту пересаживают целый донорский орган, его долю или ее половину. Далее заново соединяют сосуды и желчные протоки. Средняя длительность операции 7-13 ч. По окончанию процедуры больного переводят минимум на 7 дней в реанимацию. В это время следят за состоянием больного и пересаженного органа, т. к. могут развиться осложнения трансплантации печени:
- отторжение трансплантата
- кровотечение;
- перитонит (воспаление брюшины);
- присоединение инфекции;
- недостаточность пересаженной печени (не функционирует).
Согласно показаниям к трансплантации печени, выдвинутым Калифорнийским университетом Сан-Франциско (критерии Сан-Франциско) 5-летняя послеоперационная выживаемость больных находится в пределах 50%. Критерии:
- наличие одиночного опухолевого узла чем 8 см суммарно.
Миниинвазивные методики лечения
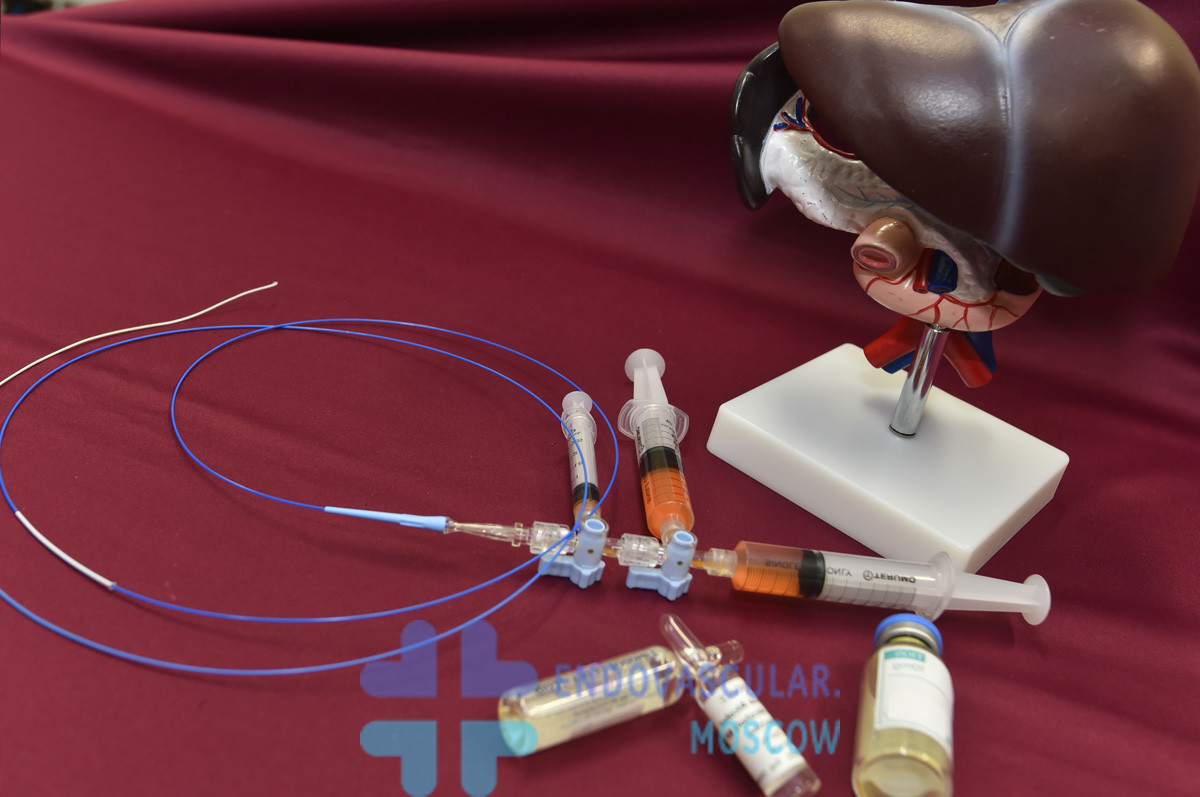
Является комбинированной методикой терапии гепатоцеллюлярного рака. Представляет собой эмболизацию (закупорку питающей опухоль артерии) специальным средством и локальное введение противоопухолевых препаратов в сам сосуд. После чего в артерию вводят эмболизирующее средство, позволяющее лекарству длительно находиться в области введения, непрерывно воздействовать на опухоль. Эмболизирующим материалом могут быть специальный лекарственно насыщаемые микросферы (гепасферы) HepaSphere, DCBead и др.
Эффект химиоэмболизации основан на:
- одномоментном локальном введении значительного количества противоопухолевого препарата в зону опухоли, отсутствие негативного эффекта на организм в целом;
- резком прекращении притока крови к раковым клеткам, из-за чего они лишаются необходимых питательных веществ и кислорода;
- длительном воздействии препарата на опухоль.
Из-за особенностей кровоснабжения химиопрепарат вводят в саму печеночную артерию – он моментально доставляется к опухолевым клеткам и, что важно, практически не достигает и не повреждает здоровых. После прекращения кровотока по печеночной артерии приток крови к новообразованию прекращается, а кровоток в здоровых тканях обеспечивается через воротную (портальную) вену. Химиоэмболизация может быть выполнена бесплатно даже в ведущих государственных центрах Москвы.
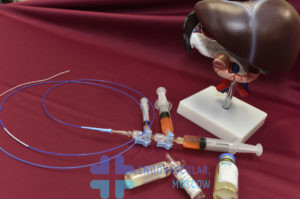
Операция проводится в операционной, оснащенной рентгенологическим оборудованием, позволяющим визуализировать новообразование и питающие его сосуды. Перед вмешательством для защиты почек, больному назначают Аллопуринол, антибиотики (предупреждение инфекций), противорвотные средства и анальгетики. В большинстве ситуаций операцию проводят под местным обезболиванием. Спинальная или общая анестезия применяется по исключительным показаниям.
Перед операцией микросферы для химиоэмболизации наыщаются химиопрепаратом, в основном доксорубицином. Обычно используется насыщение 37,5 мг доксорубицина на 1мл микросфер.
Хирург делает кожный разрез 0,6*0,5 см или прокалывает кожные покровы. Под контролем рентген аппарата в бедренную артерию устанавливают катетер, продвигают его к сосудам печени. Затем вводят контрастное вещество и делают первичный контроль – ангиографию. Оценивается кровоснабжение опухоли печени, возможность селективной катетеризации питающей опухоль артерии.
Печень может иметь различные варианты артериального кровоснабжения (10 вариантов по Michels). Самое частое — отхождение какой-либо печеночной артерии от верхней брыжеечной. Поэтому помимо ангиографии чревного ствола (целиакографии) необходимо выполнение ангиографии верхней брыжеечной артерии.
Когда катетер размещен в сосудистом русле печени, по нему к опухоли подается противоопухолевый препарат и эмболизирующее вещество. Затем делается повторный рентген-контроль. После того, как хирург убедился, что новообразование достаточно обработано препаратами катетер извлекают и останавливают кровотечение. На область раны накладывают давящую повязку. Ушивание тканей не проводится.
Процедура длится не более 1,5-2 ч. По окончанию вмешательства больной наблюдается 8-10 ч, затем он может покинуть лечебное учреждение.
Под абляцией подразумевается методика локального разрушения новообразования без необходимости его удаления. К процедуре прибегают в случае наличия нескольких новообразований незначительных размеров, удалить которые невозможно традиционным хирургическим путем. Метод оптимален при наличии образований до 3 см. При больших опухолях (3-5 см) его сочетают с эмболизацией.
Не во всех случаях абляция позволяет излечить опухоль, но для больных с небольшими образованиями коэффициент 5-летней выживаемости приближается к таковому после традиционного хирургического вмешательства. Также абляция применима у пациентов, которым необходима пересадка печени.
Через кожный разрез или прокол под рентгенологическим или УЗИ контролем в новообразование вводят датчик диаметром в 0,5-0,7 мм. Затем делается контроль местонахождения датчика. При правильной установке на него подают электрический ток высокой частоты, под воздействием которого разрушаются белковые структуры опухолевых клеток. После коагуляции необходимого объема тканей делают повторный контроль и извлекают датчик, выполняют гемостаз (остановку кровотечения). На рану накладывают повязку.
После вмешательства пациент находится под наблюдением в течение 8-12 часов. При удовлетворительном состоянии больного его выписывают домой.
Микроволновая абляция — альтернатива оперативному вмешательству. Особенно в тех случаях, когда провести операцию или трансплантацию невозможно. Методика позволяет эффективно бороться с гепатоцеллюлярной карциномой путем точечного воздействия на новообразование, без нанесения вреда здоровым тканям. С ее помощью можно удалять не только одиночные, но и множественные новообразования за короткое время. Время вмешательства в пределах 30-40 мин.
Метод основан на эмболизации специальными микросферами с высоким содержанием радиоактивного материала Итрия-90, который доставляется к опухоли чрезсосудистым путем. Радиоактивное излучение локально влияет на клетки новообразования, которые из-за аномально активного обмена веществ высокочувствительны к излучению.
Радиоэмболизация показана как для лечения первичных форм рака, так и метастатических – из других органов. При гепатоцеллюлярном раке процедура проводится при безрезультативности химиотерапии или при неоперабельной опухоли. По индивидуальным показаниям метод можно использовать как терапию 1-й линии. Также она применима при неприемлемости химиоэмболизации (напр. при тромбозе портальной вены, крупной опухоли и др.).
Доступ к сосудам печени аналогичен таковому при химиоэмболизации. После достижения питающей опухоль артерии вводят радиоактивные микросферы с Итрием-90, выделяющие β-излучение, проникающее в глубину тканей на 1-1,5 см. Т.о. достигается избирательность воздействия на опухолевые клетки.
Радиоэмболизацию проводят двухэтапно, каждый этап занимает 1-1,5 нед. На 1 этапе проводят детальную ангиографию (рентгенологическое исследование сосудов) чтоб узнать их локализацию. Затем по катетеру вводят специальный датчик для определения оптимальной дозы излучения. 1 этап считается подготовительным, моделирующим. На 2 этапе проводят ангиографию, после чего переходят к введению радиоактивного вещества.
Подготовительный этап занимает до 1,5 ч, сама процедура до 2. В течение 5-7 ч радиоактивное вещество покидает организм. Радиоэмболизация не обладает системными побочными эффектами. Пациентов выписывают из стационара через 10-15 ч, после чего им показано амбулаторное лечение.

Выбор метода лечения обусловлен размерами и локализацией первичной опухоли, наличием метастазов в печени и других органах, состоянием ткани печени и самого пациента. Поэтому терапия подразделяется на две линии: при наличии цирроза печени и при отсутствии цирроза.
Профилактической терапии, способной снизить риск рецидива печёночно-клеточного рака и продлить жизнь, к сожалению, не существует.
- Хирургическое лечение рака печени
- Клинический случай
- Современные методы локального воздействия на рак печени
- Радиочастотная аблация печени (РЧА)
- Криодеструкция опухоли
- Трансартериальная химиоэмболизация (ТАХЭ)
- Трансартериальная радиоэмболизация (ТАРЭ)
- Химиотерапия при раке печени
- Цены в Европейской онкологической клинике на лечение рака печени
Хирургическое лечение рака печени
Даже при современном развитии медицины без хирургического воздействия невозможно вылечить злокачественную опухоль, и рак печени не исключение.
Операцию делают невозможной:
- метастазы в печень;
- метастазы в другие органы и ткани;
- низкие функциональные возможности печени и почек;
- тромбоз воротной вены.
Объём вмешательства зависим от распространения поражения печени. Без сопутствующего цирроза при раннем раке – небольшой опухоли до 5 см - методом выбора считается резекция печени.
При вовлечении в опухоль участков обеих долей печени на стороне максимального поражения выполняется гемигепатэктомия, в доле с меньшим повреждением предпочтительно локальное воздействие: экономная резекция, радиочастотная аблация или криодеструкция.
Большой объём опухоли на фоне цирроза поставит вопрос о трансплантации печени. При ожидании трансплантации возможно локальное воздействие на опухоль, в том числе аблация, эмболизация и парциальная резекция печени.
Клинический случай
В Европейскую онкологическую клинику обратился за помощью пациент 46 лет с диагнозом рак прямой кишки, метастатическое поражение печени. Осложнения: кишечная непроходимость. 27 апреля 2016 года пациенту была проведена паллиативная лапароскопическая передняя резекция прямой кишки, удаление метастаза левой доли печени, резекция 2 сегмента печени с опухолевым узлом. Гистологическое исследование показало низко- и умеренно-дифференцированную аденокарциному прямой кишки.
Учитывая изолированное метастатическое поражение печени, гипоплазированную левую долю печени, решено выполнить ALPPS резекцию. 3 сентября 2016 выполнен первый этап ALPPS — резекции печени in situ. 10 сентября 2016 проведён второй этап операции — расширенная правосторонняя гемигепатэктомия (+SIVа) после ALPPS, атипичная резекция SIVb. Пациент выписан через 5 суток, запланировано проведение химиотерапии. Читайте подробнее об уникальной операции по резекции печени.
Современные методы локального воздействия на рак печени
При единственной опухоли или единичных узлах опухоли не более 3 см, не подлежащих оперативному лечению, выполняют локальную деструкцию: радиочастотную или микроволновую аблацию, криодеструкцию.
Радиочастотная аблация печени (РЧА)
Предпочтительным и наиболее часто используемым методом считается радиочастотная аблация. Этот вариант термической деструкции применяется при:
- раннем гепатоцеллюлярном раке до 3см;
- рецидиве опухоли;
- с паллиативной целью при узле до 5 см;
- единичных опухолевых узлах, числом не более 5.
Противопоказания почти такие же, как и для хирургического вмешательства, но менее жёсткие: отдалённые метастазы, декомпенсированный цирроз печени, не купируемый асцит, энцефалопатия, наличие кардиостимулятора, выраженные нарушение свёртываемости крови и активное желудочное кровотечение, и конечно, прилежание опухоли к другим органам и крупным желчным протокам.
Наилучший результат достигается при небольших опухолях, особенно, при возможности термического воздействия на окружающую ткань, хорошем доступе к узлу во время РЧА. Лечение эффективно, когда удаётся добиться 100% некроза опухоли. Пятилетняя выживаемость пациентов с компенсированным циррозом и ГЦР менее 5 см в диаметре достигает 60%.
Вероятность осложнений есть, но она менее 10%, главное – они не фатальны для больного и устранимы. Нередко РЧА комбинируют с другими методами локального воздействия, в частности, с трансартериальной химиоэмболизацией.
Выполняется также микроволновая аблация - манипуляция аналогична РЧА, но с другой частотой волны. Показания и противопоказания схожи.
Криодеструкция опухоли
Криодеструкция - прямое воздействие жидкого азота, охлаждающего ткани до температуры минус 180°С. Непосредственное охлаждение опухоли с помощью специального устройства вызывает гибель клеток, а в окружении опухоли формируются микрососудистые тромбы, которые усугубляют повреждение за счёт дополнительного нарушения её питания.
Во время манипуляции, которую могут выполнять через кожу или во время операции, к опухоли подводится специальный аппликатор, охлаждаемый до минус 180°С. Криодеструкция позволяет лечить опухоли больших размеров.
О комплексном подходе в лечении рака печени рассказывают врачи Европейской онкологической клиники Бурдюков М.С. и Бобров Б.Ю.

Трансартериальная химиоэмболизация (ТАХЭ)
Химиоэмболизация - ведущий метод локорегиональной терапии ГЦР, применяемый в первой линии паллиативной терапии не подлежащего операции опухолевого процесса без признаков вовлечения сосудов и внепечёночных проявлений заболевания - метастазов.
Наилучший эффект ТАХЭ достигается при невыраженном циррозе и сохранной функцией печени, но при тромбозе воротной вены и выраженном циррозе эмболизация не выполняется.
Микросферы блокируют кровоток в питающих опухоль сосудах, не вовлекая крупных ветвей печёночной артерии, поэтому оказывают максимальный терапевтический эффект при минимизации нежелательных последствий эмболии.
Трансартериальная радиоэмболизация (ТАРЭ)
Почти аналогичная ТАХЭ манипуляция, но на поверхности микросфер располагается радиоактивный изотоп иттрия-90. При ТАРЭ эмболизирующее действие микросфер сочетается с локальным облучением опухоли печени.
Лучевая терапия рака печени в клинической практике, вне научных исследований, почти не применяется
Химиотерапия при раке печени
Современные возможности лекарственной терапии рака печени ограничены, поскольку опухоль устойчива к цитостатикам. Как правило, химиотерапия печени используется при противопоказаниях к локальным методам воздействия, метастазах внепечёночной локализации и при прогрессировании после локального воздействия.
Основная цель лечения - увеличение продолжительности жизни, а достоверно её увеличивает только сорафениб. Иные химиопрепараты и их комбинации демонстрируют эффективность в 20% случаев, но не влияют на длительность жизни больных.
При циррозе печени переносимость химиотерапии ухудшается, что ограничивает возможности активного лечения. При хроническом гепатите В или носительстве вируса к химиотерапии присоединяют противовирусные препараты. Но при хроническом гепатите С нет нужды в противовирусной терапии, зато вероятность гепатотоксичности и развития лекарственного гепатита очень высоки, поэтому проводят их профилактику. В рекомендациях отмечена неэффективность эссенциальных фосфолипидов - широко распространённого в России Эссенциале®.
В научной литературе не доказали, что применение аналогов соматостатина увеличивает продолжительности жизни, но на нём могут регистрировать уменьшение опухоли. Интерферон-2α в стандартных дозах бесполезен, но оказывает небольшой эффект в сочетании с химиотерапией.
При наличии противопоказаний к химиотерапии при раке печени мы проводим симптоматическую терапию, направленная на повышение качества жизни и улучшение самочувствия пациента.

Рак печени – одно из самых опасных онкологических заболеваний. Лечить его зачастую очень сложно. Даже на ранних стадиях, когда опухоль не распространяется за пределы печени, пятилетняя выживаемость составляет всего 31%. Если опухоль проросла в соседние ткани, этот показатель снижается до 11%, а если появились метастазы – до 3%.
В лечении рака печени есть немало проблем. Далеко не всем пациентам может быть выполнена операция. Зачастую недостаточно удалить пораженную часть печени, требуется трансплантация, при этом существует жесткий дефицит донорских органов. Многим больным приходится подолгу ждать. При раке печени практически неэффективна системная химиотерапия. Печеночные клетки – гепатоциты – разрушают химиопрепарат, поэтому нужны большие дозы, которые вызывают тяжелые побочные эффекты.
Тем не менее, не все так плохо. Врачи и ученые находят возможности справляться с проблемами, появляются новые методы лечения. Многие из них доступны в России.

Химиотерапия

В настоящее время существуют технологии, которые помогают доставлять химиопрепараты прямо в опухоль в печени. Главное преимущество таких процедур в том, что лишь небольшое количество препарата поступает в общий кровоток, поэтому побочные эффекты минимальны. Это позволяет применять намного большие дозировки, чем при системной химиотерапии. Проблема разрушения химиопрепарата клетками печени становится неактуальной.
- При внутриартериальной химиотерапии в области паха делают прокол, вводят в бедренную артерию катетер, проводят его в сосуд, питающий опухоль, и вводят химиопрепарат.
- Некоторым пациентам выполняют химиоэмболизацию. В питающий опухоль сосуд помещают катетер, через него вместе с химиопрепаратом вводят эмболизирующий препарат. Последний состоит из особых микроскопических частиц – микросфер, которые перекрывают просвет сосуда. Опухолевые клетки перестают получить кислород, питательные вещества, и погибают. Современные эмболизирующие препараты позволяют проводить процедуру максимально эффективно и безопасно. Нормальная ткань печени не страдает, потому что она получает питание из другого сосуда.
Таргетная терапия
Таргетные препараты блокируют жизненно важные для раковых клеток молекулы. При раке печени эффективны три таргетных препарата:
- Сорафениб (Нексавар) блокирует ферменты-киназы, которые задействованы в процессе образования новых кровеносных сосудов, запрограммированной клеточной смерти. Препарат применяется при неоперабельном раке печени.
- Регорафениб (Стиварга) также ингибирует киназы, тем самым подавляя размножение раковых клеток и рост новых кровеносных сосудов в опухолевой ткани. Его рекомендуется применять в случаях, когда неэффективен сорафениб.
- Кабозантиниб (Кометрик) является ингибитором фермента-тирозинкиназы с-Мет и сосудистого эндотелиального фактора роста 2 (VEGFR2). В исследованиях было показано, что этот препарат подавляет прогрессирование рака печени и снижает риск гибели пациента.
Что нового в хирургическом лечении рака печени?

В настоящее время ученые оценивают возможности адъювантной и неоадъювантной терапии, пытаются понять, могут ли они улучшить результаты хирургического лечения.
Многообещающие результаты были получены во время исследований молекулярно-генетических характеристик опухолевых клеток печени. Возможно, в ближайшем будущем врачи смогут, отправив опухолевую ткань на анализ, определить, у кого из пациентов после операции повышен риск рецидива, и какими способами его можно снизить.
Для того чтобы пациенту могла быть выполнена трансплантация печени, должны быть соблюдены некоторые условия. Нужно, чтобы опухоль имела небольшие размеры (один очаг менее 5 см или 2–3 очага менее 3 см каждый) и не вторгалась в кровеносные сосуды. Показания ограничены, в настоящее время ученые ищут способы их расширить.

Лучевая терапия
Главная проблема лучевой терапии при раке печени в том, что ионизирующее излучение сильно повреждает здоровые печеночные клетки. Ученые ищут способы избежать этого. В настоящее время изучается возможность применения брахитерапии – процедуры, во время которой источник излучения в виде небольшой гранулы внедряют прямо в печень через специальный катетер. Это помогает минимизировать воздействие на окружающие здоровые ткани.
Аблация
Метастазы в печени можно уничтожить с помощью радиочастотной аблации (РЧА) – процедуры, во время которой в узел вводят иглу-электрод и подают на нее ток высокой частоты. Опухолевая ткань сильно нагревается и погибает. Для того чтобы можно было провести РЧА, должны быть соблюдены некоторые условия:
Восстановление оттока желчи
Одно из распространенных осложнений первичного и метастатического рака печени – нарушение проходимости желчных протоков и оттока желчи. Раньше эту проблему решали с помощью дренирования: в желчные протоки устанавливали специальную тонкую гибкую трубку – дренаж. Это помогало улучшить состояние, но постоянно носить дренаж не очень удобно. За ним нужно правильно ухаживать, он раздражает брюшную стенку, то и дело норовит сместиться или выпасть.
Более современное решение – стент. Это такой цилиндрический полый каркас с сетчатой стенкой, обычно изготовленный из металла. Стент устанавливают в желчные протоки эндоскопически, через двенадцатиперстную кишку, или, если это невозможно – прямо через кожу, во время чрескожной чреспеченочной холангиографии. Стент расширяет просвет желчного протока и восстанавливает отток желчи, при этом не причиняет неудобств пациенту.
Где в Москве можно получить самое эффективное лечение при раке печени?
В России есть клиники, которые специализируются на лечении рака, используют современные высокотехнологичные методы лечения. Мы сможем подобрать для вас такую клинику и врача-специалиста, ведь мы сотрудничаем с лучшими онкоцентрами страны:
- Отделение анестезиологии и реанимации
- Метастазы рака
- Химиотерапия
- Хоспис для онкологических больных
- Иммунотерапия в центре платной онкологии Медицина 24/7
- КТ-исследования
- МРТ-исследования
Лечение рака печени за последнее десятилетие изменилось благодаря инновационным технологиям, тем не менее в 2017 году диагноз был установлен 8 796 взрослых россиян, а умерло от злокачественного заболевания 9 959. И подобная ущербная динамика прослеживается не один год, что свидетельствует о не слишком успешной противоопухолевой терапии и невысокой продолжительности жизни пролеченных.
Основное большинство в 58% на момент обнаружения имеет 4 стадию заболевания, ещё 22.5% с 3 стадией карциномы не лишены шансов на жизнь, но только у каждого седьмого при благополучном стечении клинических обстоятельств есть хорошие перспективы на будущее.

Принципы лечения рака печени
Единственный радикальный способ лечения гепатоцеллюлярной карциномы — хирургический, успешность химиотерапии не высока, лучевая терапия не нашла широкого применения в клинической практике из-за невозможности её использования при циррозе, слишком частом у этой категории больных.
Особенность развития карциномы печени — наличие хронического печеночного заболевания у подавляющего большинства пациентов, только у каждого десятого рак возникает в до того момента здоровом органе.
План лечения обязательно учитывает функциональные возможности печени и различается тактика лечения пациентов без цирроза и с различной выраженностью цирроза. Фактически при 2 — 3 баллах цирроза по шкале Child-Pugh можно рассчитывать только на пересадку органа.
Размер печёночного новообразования важен для выбора тактики, но много важнее, с чем останется больной. При исходном циррозе после операции не может остаться менее половины печени, без цирроза достаточно сохранить одну треть органа.
Во всех случаях проводится только анатомическая резекция, то есть удаление части органа с учётом системы локального кровоснабжения, что способствует удалению тромбированных раковыми эмболами сосудов и располагающихся рядом с первичным очагом микроскопических отсевов рака. За год после резекции печеночная ткань восполняет три четверти утраченного объёма.
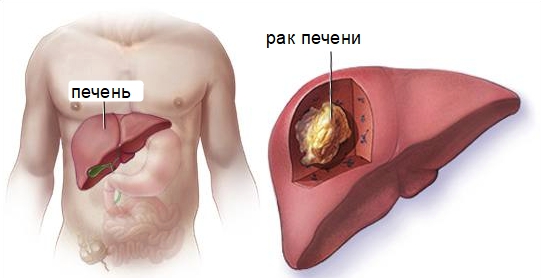
Лечение раннего рака печени
Ранний рак печени констатируется при наличии одного единственного узла не более 5 см и обязательно без вовлечения сосудов, что по стандартной классификации означает 1 стадию процесса. Операция выполняется и при нескольких узлах, но числом не больше трёх и до 3 см в диаметре, также без признаков сосудистой инвазии.
Резекция печени всегда предпочтительна, если технически невозможно удалить часть органа пациенту рекомендуется пересадка донорской печени. Выживаемость в течение года после пересадки высокая — 85-88%.
Методы лечения рака печени
В трансплантации больному отказывают при наличии отдалённых метастазов, а цирроз не помешает операции, потому что это самый радикальный способ терапии всех печеночных заболеваний. Другое дело, что тяжелое состояние вследствие осложнений цирроза — асцит, варикозное расширение вен желудочного тракта, серьезные нарушения свертывания крови мешают ждать оперативное вмешательство.
В период ожидания возможны:
- химиотерапия увеличивающим продолжительность жизни пациентов сорафенибом или комбинацией цитостатиков при прогрессировании процесса на фоне сорафениба;
- введение в питающий опухоль сосуд цитостатика с жировой эмульсией или в форме микросфер — транс-артериальная химиоэмболизация (ТАХЭ);
- разрушение очага высокочастотным электрическим током — метод радиочастотной абляции (РЧА);
- разрушение ракового конгломерата жидким азотом — криодеструкция;
- введение внутрь опухоли этанола (спирта);
- локальное — стереотаксическое облучение.
У пациента может использоваться в разной последовательности несколько инвазивных методов, для каждого метода существует свой список противопоказаний, преимущественно обусловленных циррозом и его осложнениями, количеством и размером опухолевых узлов.
Лечение метастазов рака печени
При противопоказаниях к пересадке, а также при рецидиве рака после резекции, прибегают к локальным методам терапии, перечисленным выше. Наличие метастазов — полное противопоказание к хирургии, но не исключает дополнительные локальные способы лечения, в первую очередь направленные на улучшение состояния пациента и изменения качества его жизни в лучшую сторону.
Читайте также:





