Лечение плоскоклеточного рака гортани химиотерапией
- Клинические признаки
- Диагностика рака на III стадии
- Лечение рака на III стадии
- Прогноз
Клинические признаки
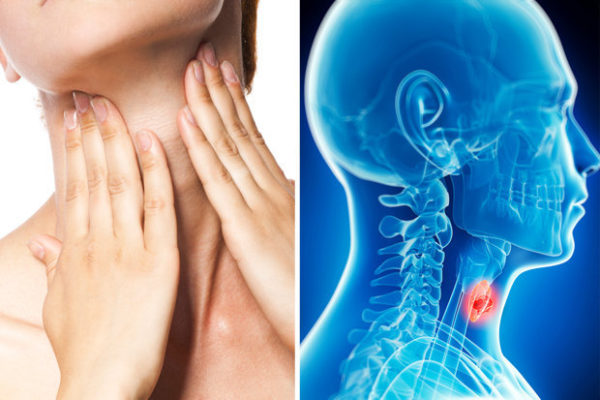
Рак гортани III стадии характеризуется распространенностью опухоли с поражением 1-3 ее анатомических отделов, без выхода за пределы органа, а также с/без поражением одного л/узла шеи (с его увеличением не более 3см). Исходя из вышеизложенного, основным признаком рака гортани третьей стадии является паралич одной или обеих голосовых складок, что может сопровождаться осиплостью или потерей голоса , а при двухстороннем поражении голосовые складки могут полностью перекрывать просвет гортани, не позволяя пациенту адекватно дышать ( вплоть до асфиксии, из-за чего еще до начала лечения может выполняться трахеостомия).
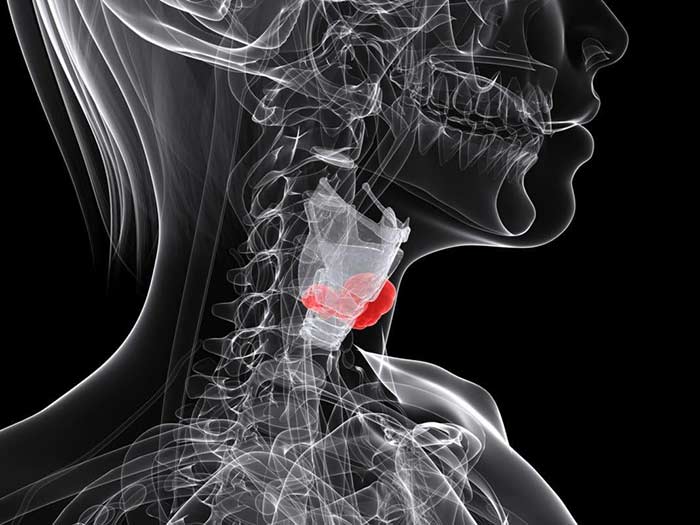
Дополнительными специфическими симптомами, на которые пациент может обратить внимание врача, могут быть:
- ощущение комка в горле при глотании,
- поперхивание, кашель ( в мокроте могут определяться прожилки крови)
- боль в горле в покое и при глотании
- неприятный (гнилостный) запах изо рта
Общими симптомами для многих онкологических заболеваний и , в частности, для рака гортани являются:
- повышенная до субфебрильных и фебрильных (при присоединении бактериальной инфекции) значений температура тела
- постоянное недомогание;
- анемия
- снижение массы тела
- быстрая утомляемость
- апатия, сонливость
Диагностика рака на III стадии
Для проведения диагностики рака на третьей стадии врач тщательно собирает анамнез болезни со слов больного, ориентируясь в первую очередь на его жалобы.
Далее, исходя из данных анамнеза и физикального осмотра (внешний осмотр и пальпация), назначается план обследования. Основными пунктами этого плана являются следующие методы обследования:
- Непрямая и Прямая ларингоскопия (фиброларингоскопия). Последняя позволяет произвести осмотр всех отделов гортани с максимальной четкостью. Введение инструмента в гортань не причиняет какого-либо вреда больному, позволяя выполнить высококачественную фото и видеосьемку.
- Во время фиброларингоскопии выполняется биопсия опухоли и полученные образцы тканей отправляются на гистологическое (включая иммуногистохимическое) и цитологическое исследования для постановки морфологического диагноза (чтобы понять какого строения опухоль, степень ее дифференцировки)
- УЗИ шеи и органов брюшной полости ( для исключения или определения метастазов, их локализации и размеров)
- Рентгенография органов грудной клетки ( для исключения метастазов в легких)
Современная медицина дает возможность не только диагностировать заболевание, но и выявить его особенности.
Если полученных данных врачу недостаточно для постановки диагноза или определения операбельности, то прибегают к назначению уточняющих или дополнительных методов диагностики:
- компьютерная томография (КТ) шеи, органов грудной клетки
- магнитно-резонансная томография (МРТ) шеи, органов грудной клетки, органов брюшной полости)
- Радиоизотопное исследование костей скелета
- определение связи опухоли с наличием HPV (ВПЧ) - инфекции (ВПЧ - Вирус Папилломы Человека)
- молекулярно-генетическая диагностика опухолевой ткани ( при планировании таргетной или иммунной терапии)
Вышеперечисленные диагностические методы необходимы для правильной постановки диагноза и назначения соответствующего лечения.
Лечение рака на III стадии
Среди всех больных раком гортани, обращающихся за помощью в медицинские учреждения, пациенты с III стадией составляют самую многочисленную и разнообразную по распространенности группу. В связи с чем эти пациенты являются самыми сложными в диагностике и выборе тактики лечения. Именно поэтому для борьбы с раком на третьей стадии чаще всего применяется комплексная терапия (сочетание хирургического, лучевого и лекарственного лечения). Только своевременное начало и правильное сочетание всех вышеуказанных видов лечения, как правило, позволяет добиться максимального эффекта, т.е. излечения от данного заболевания.
Наиболее радикальным видом лечения рака гортани продолжает оставаться хирургическое (ларингэктомия/резекция гортани + шейная лимфодиссекция). Но больше всего данное положение относится к складочной локализации опухолевого процесса и при четких границах первичной опухоли. Далее, при условии радикально выполненной операции, эффект может быть закреплен лучевой терапией. Существующие в настоящее время голосовые протезы, устанавливаемые одномоментно с удалением гортани, позволяют в максимально короткие сроки (от 2-х недель спустя от дня операции) вернуться пациенту к достойному качеству жизни без потери голоса.
При инфильтративных опухолях и распространении на надскладочный отдел наиболее эффективным признано начало лечения с химиотерапии (неоадьювантная) или сочетанного химиолучевого лечения. Стандартной схемой первой линии является TPF (таксаны, препараты платины, 5-фторурацил). Проведение одного курса занимает 4-5 дней в условиях стационара. Цикл 21 день (это означает , что от первого дня первого курса химиотерапии до первого дня второго курса должно пройти 3 недели). После 2-3 курсов назначается контрольное обследование, оценивается эффект и консилиумом определяется дальнейшая тактика. При сочетанном химиолучевом лечении во время лучевой терапии еженедельно вводятся препараты платины. Схема полихимиотерапии, дозировки препаратов и режимы введения определяются химиотерапевтом индивидуально для каждого больного, исходя из его общего состояния, показателей обследования, а также из вида и распространенности опухоли.
В ряде случаев, при условии высокой чувствительности опухоли (это выясняется в процессе лечения), излечение может наступить и без выполнения операции.
Лучевая терапия , как и химиотерапия, в моноварианте не применяется при раке гортани III стадии. В сочетании с химиотерапией, при условии высокой чувствительности опухоли, применяется в виде радикального курса (с доведением суммарной очаговой дозы до 65-70 Гр). Лечение проводится в режиме 5 дней в неделю по РОД 2Гр/день, соответственно длится около семи рабочих недель. Режим послеоперационной лучевой терапии радиолог определяет индивидуально, исходя из факторов прогноза (определяются по данным гистологического исследования операционного материала).
Питание больного раком гортани должно препятствовать усугублению изначальных симптомов заболевания и побочных эффектов лечения, а также истощению организма. Пищу необходимо хорошо термически и механически обрабатывать, дабы она не травмировала глотку и быстро усваивалась. Температура продуктов перед употреблением должна быть близка к комнатной. Употребляемые продукты тщательно измельчаются и принимаются небольшими порциями 5-6 раз в сутки. Обьем потребляемой воды не менее 2-х литров.
- слизистые протертые супы, сваренные на нежирном мясном бульоне;
- полувязкие крупяные каши, сваренные на воде пополам с молоком;
- отварные блюда из рыбы, измельченные с помощью блендера;
- овощные пюре из картофеля, моркови, тыквы, свеклы и капусты;
- фруктовые, овощные свежевыжатые соки ( исключить кислые)
- кисломолочные продукты, включая йогурты, кефир и ряженку.
Обязательно следует учесть, что пища не должна быть жареной, острой, содержать специи и приправы. Также следует отказаться от кофе, крепкого чая и алкогольных напитков.
Прогноз
Если диагноз был поставлен правильно, а лечение начато своевременно, то пятилетняя выживаемость пациентов, у которых диагностирован рак гортани на третьей стадии, составляет около 50-80%. Пациенту нужно помнить , что это зависит не только от множества вышеперечисленных факторов, включая опыт и уровень профессионализма врача, технического и медикаментозного обеспечения клиники, но и от собственного желания пациента вылечиться. Тщательное следование рекомендациям врача до, во время и после лечения не менее важны в достижении позитивного результата в борьбе с заболеванием.
Плоскоклеточный рак гортани – это онкозаболевание чаще обнаруживается у жителей больших городов с неблагополучной экологией. Развиваясь из клеток и поражая эпителиальный слой, новообразование выявляется в разных отделах горла. Первые признаки недуга: одышка, осиплость голоса, кашель. Их больные часто связывают с респираторными заболеваниями и не придают большого значения, надеясь на стандартное лечение респираторных инфекций. Но при раке горла желаемого облегчения не наступает, а первые симптомы сменяются стенозом гортани и острой болью.
Провоцирующие факторы
Оснований для возникновения плоскоклеточного рака горла множество. Стоит отметить вовремя не обнаруженное и не пролеченное предраковое состояние. К подобным заболеваниям онкологами отнесены:
- Лейкоплакия – при состоянии отмечается орогевающий либо неорогевающий процесс клеток эпителия в виде белых бляшек с налётом сероватого цвета. Больной длительное время не замечает аномалию, но возникает ощущение присутствия в горле инородного предмета. Ороговевшие клетки не выходят за грани слизистой оболочки, диаметр не больше 0,6 мм.
- Пахидермия – эпителиальный слой глотки покрывается специфическими образованиями. Происходит из-за запущенного воспалительного процесса, без терапии. Такие наросты располагаются поодиночке и группами. Помимо охриплости голоса, особых симптомов не отмечается.
- Папилломатоз – при патологии в гортани образуются сосочкообразные наросты разной степени с ороговением. Симптомы аномалии зависят от расположения: если в районе связок, изменяется тембр голоса. При локализации в надскладочной области – возникает чувство чужеродного предмета в горле, при обнаружении папиллом под голосовыми связками появляется першение, кашель, трудное дыхание.
При диагностировании указанных патологий требуется срочно приступать к терапии, они достаточно часто переходят в злокачественные формы.
Помимо указанных недугов, выделен ряд заболеваний, увеличивающих риск их перехода в плоскоклеточный рак горла. Они нечасто переходят в стадию онкологии, но без адекватной терапии грозные последствия не исключены. К этим аномалиям онкологи относят:
- дисплазию слизистого слоя горла;
- рубцы после долговременного лечения ряда инфекций;
- контактные гранулёмы;
- фибромы контактного происхождения.
Помимо провоцирующих патологий описаны факторы, способные спровоцировать злокачественный процесс. Сюда относят табакокурение, жевательный табак, злоупотребление алкоголем и пр. Также онкология гортани нередко диагностируется у работников вредных производств: лакокрасочные организации, цементные заводы и т.д.; у жителей многонаселённых, загазованных населённых пунктов.
Типы раковых состояний горла
Онкологический процесс, такой как плоскоклеточный рак гортани, делят на два вида:
- ороговевающий – развивается медленно, практически не метастазирует;
- неороговевающий – этот вид образуется из неороговевших клеток слизистой глотки, часто даёт метастазы.
Иногда врачи диагностируют смешанные виды заболевания.
В основном онкозаболевание поражает верхние участки органа: желудочек горла, надгортанник, стремительно распространяется на располагающуюся поблизости здоровую ткань. Порой опухоль разрастается настолько, что почти перекрывает просвет глотки, вызывая трудности с речью и дыханием.
Если заболевание локализуется в области голосовых связок, становится сильно заметно изменение голоса. Но самую большую опасность представляет новообразование, поражающее нижний отдел гортани: её практически невозможно обнаружить вовремя, она стремительно разрастается.
Плоскоклеточному раку гортаноглотки присущи указанные этапы развития:
- 1 степень – заболевание практически не проявляется, раковые клетки поражают определённый участок слизистой горла и не дают метастазов.
- 2 этап – новообразование поражает отдельные участки органа, не выходя за пределы.
- 3 стадия – опухоль выходит за пределы слизистого слоя, повреждая близлежащие ткани и уменьшая подвижность гортани.
- 4 этап – карцинома метастазирует, поражая соседние органы и лимфосистему.
Продуктивная терапия прямо пропорционально зависит от стадии развития опухоли. Первая и вторая степень гораздо лучше поддаётся традиционным методам лечения, но при запущенном состоянии процесс усложняется.
Дифференциация
Этапы, которым характерен конкретный дифференцированный тип:
- GX – не представляется возможным выявить степень дифференциации;
- G1 – раковые клетки схожи со здоровыми (высокодифференцированны);
- G2 – умеренно выраженная схожесть поражённых и здоровых тканей;
- G3 – частицы опухоли отличаются от нормальных (низкодифференциированны).
Признаки развития болезни
Симптоматика онкологии гортани разнится в зависимости от того, где локализовано новообразование, от стадии развития недуга. Больного может ничего не тревожить либо человек думает, что простудился. Это усложняет диагностику: часть пациентов попадает к онкологу уже на 3-4 стадии заболевания, когда рак уже запущен. Стоит запомнить, что не проходящие больше двух недель тревожные симптомы – повод для обращения к врачу. Лучше перестраховаться, чем упустить время.
Главным признаком плоскоклеточного рака горла медики считают изменение тембра голоса – становится осиплым либо охриплым, что усугубляется по мере развития болезни.
- Влияние веществ, увеличивающих риск прогрессирования рака (канцерогенов) – дым сигарет, токсичные газообразования, некоторые пищевые продукты.
- Механическое поражение – хирургическое вмешательство, травматизм шейного отдела, употребление крепкого спиртного, горячих напитков.
- Наследственная расположенность – если в роду у человека есть родственники, перенесшие рак гортани, рекомендуется каждые полгода проходить профобследование, поскольку такие люди больше подвержены риску развития аномалии.
- Вирусы – ряд вирусов папилломы человека могут спровоцировать патологию. Так, рак горла у женщины может развиться вследствие орального секса с мужчиной, больным ВПЧ.
- Возраст пациента – по мере взросления человека клетки делятся значительно медленнее. Чем старше больной, тем дольше прогрессирует заболевание. С возрастом увеличивается риск проявления онкологии горла.
- Дефицит витамина А – содержание его велико в растительных жирах и других пищевых продуктах.
Мужчины больше подвержены рискам развития новообразований в горле, стоит внимательнее следить за состоянием здоровья. Едва замечен первый симптом, полагается сразу обращаться к онкологу:
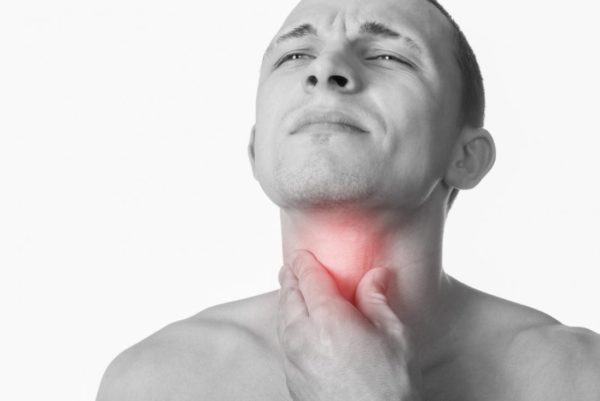
- изменение звучности голоса, охриплость;
- дискомфорт во время глотания;
- ощущение кома в глотке либо наличия инородного тела;
- желание проглотить слюну, не приносящее облегчения;
- периодическая слабая боль в горле;
- боли в гортани, похожие на проявления ОРВИ, не поддающиеся традиционным методам лечения;
- припухлость на внешних покровах шеи;
- в некоторых случаях возможно увеличение шейных, околоушных и подчелюстных лимфоузлов;
- зубная боль со стороны предполагаемого расположения злокачественного процесса;
- значительная болезненность горла, усиливающаяся при глотании и часто отдающая в ухо;
- стеноз гортани (в запущенных случаях);
- беспричинная слабость и утомляемость.
Долговременное присутствие подобных проявлений не обязательно говорит о развитии ракового процесса, но проконсультироваться с отоларингологом необходимо. В норме таких нарушений у здорового человека быть не должно.
Имеют место и признаки отравления организма – тошнота, систематическое головокружение, мигрени, нарушения сна.
По статистическим данным, в 80-95% пациентов, у которых диагностирована конкретная форма рака гортани, входят мужчины возрастом 40-60 лет. Женщины реже подвергаются заболеванию, что неудивительно, ведь среди мужчин в разы больше распространено пристрастие к курению табачных изделий.
Диагностика онкозаболевания глотки
Выявление рака горла на начальных стадиях развития – первостепенная задача медиков.
Комплекс мер, определяющих наличие новообразования, в обязательном порядке включает полный сбор анамнеза и информацию о болезнях ротоглотки у ближайших родных. Помимо этого, врач проводит антропометрический осмотр пациента, пальпацию и осматривает орган.
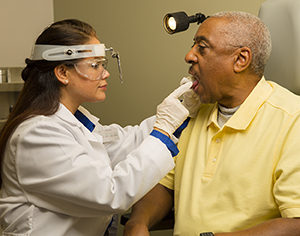
Проводятся следующие методики диагностики:
- Фиброларингоскопия – тщательное изучение надгортанника и подголосового отдела.
- Эндоскопия в комплексе с биопсией – забором биоматериала для изучения на предмет наличия раковых тканей.
- Интраоперационная диагностика – исследование клеток на гистологическом уровне, подтверждающее или опровергающее диагноз рака, в случаях, когда биопсия оказалась неэффективной.
- Ультразвуковое исследование – применяется для визуализации тканей опухоли, а также наличия метастазов. Наряду с УЗИ применяются КТ и МРТ.
Самым дешёвым, но наиболее информативным способом выявления опухоли в ротоглотке считается рентгенография.
Терапия
Главная цель лечения – ликвидация раковых новообразований и нормализация функционирования органов горла. Прогноз зависит от локализации рака и стадии развития.
Традиционные методы борьбы с опухолями глотки включают в себя:
- Лучетерапия – довольно эффективный способ лечения рака гортани, но преимущественно применяется после их оперативного удаления, во избежание возможных осложнений. Особенно действенным оказывается облучение на начальных стадиях заболевания, в комплексе с оксигенацией. Сохраняя непоражённые клеточки, эти методики убивают раковые.
- Химиотерапия – даёт положительные сдвиги, если опухоль локализуется в верхней части горла. Если поражены нижние отделы органа, терапия не даст результата.
- Хирургическое вмешательство – кардинальный способ лечения онкологии. Суть заключается в резекции области глотки вместе с новообразованием. Если операция проведена на начальной стадии заболевания, функции гортаноглотки сохраняются.
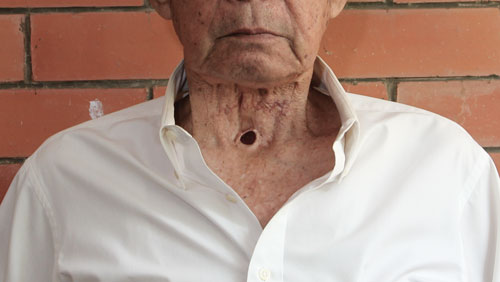
После проведения операции пациенту устанавливается эндопротез, предотвращающий развитие стеноза. При раке 3 стадии и выше удаляется вся опухоль вместе с соседними тканями. Вследствие вмешательства больной может лишиться способности разговаривать, ему устанавливаются протезы голосовых связок.
Питание
Для исключения рецидива и устранения последствий химио и лучетерапии пациенту советуется употреблять в пищу:
- лук и чеснок;
- соя и соевые продукты;
- миндаль;
- бурые водоросли;
- яйца и рыба;
- цитрусовые и ягоды;
- томаты;
- масло оливы;
- овощи семейства крестоцветных (капуста, брокколи и пр.);
- китайские грибы;
- куркума;
- зелёный, чёрный чай.
Прогнозы медиков
Продолжительность жизни после лечения плоскоклеточного рака гортани предугадать сложно. Своевременная диагностика и лечение болезни на ранней стадии увеличивают положительный прогноз до 90%. В запущенных случаях адекватное лечение 3 этапа онкологического процесса прогнозирует жизнь до 3 лет и больше. 4 степень лечится труднее остальных, поскольку раком поражено уже большинство органов человека. Среди частых причин смерти пациентов – воспаление лёгких, кровоизлияние и удушье.
Злокачественные опухоли головы и шеи в России составляют около 20% всех злокачественных новообразований.
В основном эти опухоли представляют собой плоскоклеточный рак (ПКР) (до 90%), возникающий в слизистой оболочке верхних отделов дыхательной и пищеварительной систем: полости носа и ее придаточных пазух, полости рта, носо-, рото- и гортаноглотки, гортани.
Некоторую долю составляют эпителиальные злокачественные опухоли, возникающие в больших и малых слюнных железах, а также в щитовидной железе.
Традиционно при изучении эффективности противоопухолевых препаратов лечение опухолей головы и шеи различных локализаций рассматривается как единая проблема. Главным образом, это ПКР разных отделов верхних дыхательных и пищеварительных путей, таких как полость рта, глотка, гортань и слизистая оболочка придаточных пазух. Факторами риска развития этих заболеваний являются табакокурение, употребление крепких спиртных напитков.
В последние годы появились работы о вирусе папилломы человека как факторе риска развития плоскоклеточного рака головы и шеи, особенно интересен факт лучшего прогноза заболевания и высокой чувствительности опухоли к химиолучевому лечению у пациентов с определяемым папилломавирусом.
У ПКР головы и шеи есть общие особенности: увеличение частоты рака с увеличением возраста, трудность определения первоначальной локализации опухоли в связи с близостью границ различных отделов и органов, включающих полость рта, ротоглотку, полость носа, гортань и гортаноглотку. Общность проявляется также и в направлении метастазирования, преимущественно в регионарные лимфоузлы шеи.
Отдаленные метастазы достаточно редки и обнаруживаются, как правило, в легких, лимфоузлах средостения, реже — в печени и костях скелета. Костные поражения вторичного характера при плоскоклеточном раке головы и шеи происходят преимущественно путем местного распространения на соседние структуры. От локализации опухоли зависит симптоматика, тактика обследования, клиническое течение заболевания, характер метастазирования, прогноз заболевания, что в конечном счете определяет план оптимального лечения.
Стадирование рака головы и шеи
Разработана классификация по системе TNM для основных локализаций опухоли в области головы и шеи: губы и полости рта, ротоглотки, носоглотки, гортаноглотки, гортани, полости носа и ее придаточных пазух, слюнных желез, щитовидной железы.
Помимо системы TNM для оценки степени распространенности опухолевого процесса и оценки прогноза заболевания обязательно использование классификации рака по стадиям. В табл. 9.3 отражена классификация ПКР по стадиям и группировка по системе TNM для основных локализаций в области головы и шеи.
Таблица 9.3. Группировка плоскоклеточного рака головы и шеи по стадиям

Цель химиотерапии
Химиотерапия (XT) применялась ранее у больных раком головы и шеи в основном с паллиативной целью при неоперабельных распространенных опухолевых процессах, чаще рецидивного характера, с наличием отдаленных метастазов. В последние годы она используется в качестве равноправного компонента сочетанного воздействия вместе с хирургическим и лучевым методами лечения.
Лечение плоскоклеточного рака головы и шеи проблематично в основном из-за того, что на всех этапах развития болезни требуется тщательный мультидисциплинарный подход для выбора существующих опций лечения больных.
На рис. 9.1 показан мультидисциплинарный подход к лечению ПКР головы и шеи. В верхней части рисунка — возможные стадии развития опухолевого процесса; в средней части — возможные варианты применяемого консервативного лечения; в нижней части — хирургический метод лечения, использование которого возможно на любом этапе развития болезни как с лечебной, так и паллиативной целью.

Рис. 9.1. Схема мультидисциплинарного подхода к лечению плоскоклеточного рака головы и шеи
Таким образом, на сегодняшний день XT при плоскоклеточном раке головы и шеи применяется в следующих клинических ситуациях. При лечении первичных местнораспространенных опухолевых процессов в виде нескольких курсов индукционной (неоадъювантной) полихимиотерапии (ПХТ) перед хирургическим лечением или облучением. Индукционная химиотерапия позволяет отобрать пациентов с опухолями, чувствительными к дальнейшему лучевому лечению, и выполнить хирургическое вмешательство на ранних этапах в случае неудовлетворительного ответа на XT.
Индукционная XT не увеличивает количество осложнений от последующего хирургического вмешательства, снижает риск развития отдаленных метастазов и дает возможность сохранения органов, но не улучшает выживаемость. Основная критика использования индукционной химиотерапии заключается в том, что она применяется только для отбора пациентов и в дозах, недостаточных, чтобы оказать реальное влияние на их выживаемость.
В последние годы вошло в широкую клиническую практику применение конкурентного (сочетанного или одномоментного) химиолуиевого лечения, когда на фоне лучевой терапии больному вводят химиопрепараты, что обеспечивает повышение выживаемости, улучшение локорегионарного контроля и увеличение доли сохранения органов, что особенно важно при лечении рака таких локализаций, как гортань и гортаноглотка.
Логичным продолжением применения XT при местнораспространенных первичных опухолях стало появление схем так называемого последовательного, или секвентального, химиолучевого лечения. При данном виде лечения на первом этапе проводится несколько курсов индукционной ПХТ с последующим конкурентным химиолучевым лечением. Основными комбинациями, используемыми при индукционной полихимиотерапии, на сегодняшний день признаны цисплатин с 5-ФУ, доцетаксел с цисплатином и 5-ФУ. Последняя схема представляется как наиболее эффективная, но и наиболее токсичная.
При развитии рецидива опухоли и невозможности выполнения радикального хирургического вмешательства пациентам обычно предлагается XT как лечение первой линии. С точки зрения ограниченных возможностей лечения эта категория пациентов с ПКР головы и шеи давно нуждалась в более современных химиотерапевтических средствах, но за последние десятилетия не появилось комбинаций химиопрепаратов, улучшавших показатели выживаемости этой группы больных.
Стандартом лечения этих больных была комбинация цисплатина и 5-ФУ, но при этом применение комбинации этих препаратов лишь увеличивало количество ответов опухоли на химиотерапию, не изменяя показатели выживаемости пациентов. По последним данным, единственной комбинацией химиопрепаратов, дающей не только увеличение количества полных и частичных ремиссий, но и увеличивающей продолжительность жизни больных с рецидивами и отдаленными метастазами плоскоклеточного рака головы и шеи, считается схема с использованием цетуксимаба, цисплатина и 5-ФУ.
Отбор пациентов для проведения химиолучевого лечения
Для принятия решения о проведении химиолучевого лечения удобно пользоваться следующим разделением пациентов с первичными опухолевыми процессами области головы и шеи, когда речь идет о ПКР.

В настоящее время принято считать, что пациенты с ранними стадиями болезни успешно лечатся с применением лучевой терапии в самостоятельном варианте, ау пациентов с умеренными и распространенными стадиями могут применяться химиолучевые методы лечения.
Химиотерапия
Химиотерапия рака некоторых локализаций в области головы и шеи
При I и II стадиях рака гортани, как правило, проводится лучевая терапия или хирургическое лечение, при этом предпочтение отдается облучению. Стандартом лечения рака гортани III стадии является комплексный подход, включающий химиолучевое лечение, либо в виде нескольких курсов индукционной ПХТ с последующей лучевой терапией, либо в виде конкурентного химиолучевого лечения с операцией в случае неэффективности лучевой терапии.
Клиническими исследованиями доказано повышение эффективности лучевой терапии при проведении одновременной с ней химиотерапией или индукционной XT. Такой подход позволяетувеличить количество больных раком гортани III стадии, которым удается сохранить гортань, и этим улучшить качество их жизни.
При раке гортани IV стадии стандартом лечения является ларингэктомия с последующим облучением. Однако в настоящее время проводятся исследования по изучению возможности проведения на первом этапе неоадъювантной или одновременной с облучением XT.
При распространении регионарных метастазов до стадии N2 и N3 и полной регрессии первичной опухоли рекомендуется обязательное выполнение шейной лимфодиссекции на завершающем этапе лечения.
В начальных стадиях плоскоклеточного рака ротоглотки (I и II стадий) проводится лучевое лечение. Также возможно использование хирургического метода лечения. В этих случаях выбор метода лечения обусловлен в основном локализацией опухоли и предполагаемой степенью возможных функциональных послеоперационных нарушений.
При III и IV стадиях рака ротоглотки стандартом лечения является химиолучевой метод. Использование противоопухолевых препаратов в виде 1-2 курсов индукционной XT целесообразно при распространенных опухолевых процессах в расчете на уменьшение объема опухоли к моменту облучения.
При неоперабельных опухолях целесообразно проводить химиотерапию одновременно с облучением. По данным клинических исследований, в таких ситуациях XT позволяет улучшить местный контроль опухоли, а также улучшить безрецидивную и общую выживаемость по сравнению с одной лучевой терапией.
Кроме ПКР носоглотки сюда относятся также переходноклеточный рак и лимфоэпителиома (опухоль Шминке). При раке носоглотки XT, как правило, является компонентом химиолучевого лечения. Противоопухолевые препараты вводятся в виде 1-2 курсов до начала облучения.
Такая индукционная химиотерапия позволяет в значительной степени уменьшить объем опухоли носоглотки и, если имеются, регионарных метастазов. В случае высоко- и умеренно дифференцированного рака чаще используется комбинация цисплатина и 5-ФУ, но возможны и другие сочетания противоопухолевых препаратов. При недифференцированном раке так называемого носоглоточного типа, связанного с вирусом Эпштейна-Барр, высокоэффективна схема АЦОП + цисплатин.
При раке полости рта I стадии проводится операция или облучение. Стандартом лечения рака II стадии кроме операции или облучения может быть комбинация этих методов. При этих стадиях XT, как правило, не проводится.
Поскольку результаты хирургического, лучевого или комбинированного методов лечения распространенного рака полости рта, соответствующего III и IV стадиям, до настоящего времени остаются неудовлетворительными, многими исследователями проводятся клинические испытания, направленные на изучение роли дополнительной индукционной XT.
Показано, что неоадъювантная химиотерапия приводит к уменьшению размера опухоли и, тем самым, способствует большей радикальности операции или облучения. Относительно улучшения показателей безрецидивной и общей выживаемости при методах лечения, включающих XT, выводы пока неоднозначны, требуется продолжение проспективных рандомизированных исследований. Тем не менее XT стала составной частью комплексного лечения рака полости рта.
Рак слюнных желез в большинстве случаев имеет железистую природу. Основные методы лечения — операция и облучение, чаще в виде комбинации этих методов. Роль химиотерапии при раке слюнных желез изучается в серии клинических исследований.
Есть данные о том, что некоторые гистологические варианты рака слюнных желез могут быть чувствительны к XT. При неоперабельных формах рака исследуется эффективность химиолучевого воздействия с использованием схем, включающих цисплатин, циклофосфамид, 5-ФУ и доксорубицин.
Принципы лечения рака щитовидной железы определяются морфологическим вариантом опухоли и ее стадией. Для дифференцированного рака (папиллярная, фолликулярная и папиллярно-фолликулярная аденокарцинома) основным методом при I, II и III стадиях служит хирургическое лечение.
Возможно использование радиоактивного йода (131I) в расчете на снижение риска рецидива и метастазов. При IV стадии выполняется тиреоидэктомия, в дальнейшем, при наличии отдаленных метастазов, в зависимости от их способности накапливать изотоп применяется либо 131I, либо наружное облучение и гормонотерапия Т4. Известны попытки химиотерапии с использованием доксорубицинсодержащих комбинаций.
При недифференцированном раке щитовидной железы применение гормонотерапии бесперспективно. При медуллярных формах рака лечение начинают с операции, при III стадии — в сочетании с облучением. При наличии отдаленных метастазов медуллярного рака применяют XT с использованием доксорубицинсодержащих комбинаций. В последние годы при этой форме рака успешно применяется ИФН-а (роферон) и октреотид.
При анапластическом раке щитовидной железы в случае возможности используется хирургическое лечение и наружное облучение. Применяется XT. Наибольшая эффективность (около 30%) при раке щитовидной железы отмечается у доксорубицина и эпирубицина. Противоопухолевой активностью при этой форме рака обладает также цисплатин, блеомицин. Показано, что комбинация доксорубицина с цисплатином имеет преимущество перед применением одного доксорубицина.
В стадии клинических исследований находится изучение сочетанного химиолучевого лечения при анапластическом раке. При полном клиническом эффекте становится возможным выполнить операцию, что может улучшить выживаемость больных анапластическим раком.
Режимы химиотерапии
Ниже приведены схемы наиболее часто используемых режимов ПХТ при ПКР любой локализации в области головы и шеи. Они могут применяться в качестве индукционной XT с последующим хирургическим вмешательством или лучевой терапией, а также при рецидивных или метастатических опухолях.
1. Цисплатин — 100 мг/м2 в/в в 1-й день. 5-ФУ — 1000 мг/м2/сут в/в 96-часовая непрерывная инфузия в 1-4-й день. Повторение цикла каждые 21 (28) день.
2. Цисплатин — 100 мг/м2 в/в в 1-й день. 5-ФУ — 750 мг/м2/сутки в/в 120-часовая непрерывная инфузия в 1-5-й день. Повторение цикла каждые 21 день.
3. Карбоплатин — AUC 6 в/в 1-й день. 5-ФУ — 1000 мг/м2/сутки в/в 96-часовая непрерывная инфузия в 1-4-й день. Повторение цикла каждые 21 день.
4. Цисплатин — 75 мг/м2/сутки в/в в 1-й день. Капецитабин — 1000 мг/м2 внутрь 2 раза в сутки в 1-14-й день. Повторение цикла каждые на 21 день.
5. Паклитаксел — 175 мг/м2 в/в в 1-й день. Цисплатин — 75 мг/м2 в/в во 2-й день. Повторение цикла каждые 21 день.
6. Паклитаксел — 175 мг/м2 в/в в 1-й день. Карбоплатин — AUC 6 в/в в 1-й день. Повторение цикла каждые на 21 день.
7. Доцетаксел — 75 мг/м2 в/в в 1-й день. Цисплатин — 75 мг/м2 в/в в 1-й день. Повторение курса 21 день.
8. Доцетаксел — 75 мг/м2 в/в в 1-й день. Цисплатин — 75-100 мг/м2 в/в в 1-й день. 5-ФУ — 1000 мг/м2/сутки в/в 96-часовая непрерывная инфузия в 1-4-й день. Повторение цикла каждые 21 день.
9. Паклитаксел — 175 мг/м2 в/в в 1-й день. Цисплатин — 100 мг/м2 в/в во 2-й день. 5-ФУ — 500 мг/м2/сут непрерывная инфузия 120-часовая в 1-5-й день. Повторение цикла каждые 21 день.
10. Цетуксимаб — 400 мг/м2 в/в 2-часовая инфузия в 1-й день 1-го курса, затем 250 мг/м2 в/в 1-часовая инфузия в 8-й и 15-й дни и в 1-й день последующих курсов. Цисплатин — 75-100 мг/м2 в/в в 1-й день. 5-ФУ — 1000 мг/м2/сут в/в 96-часовая непрерывная инфузия в 1-4-й день. Повторение цикла каждые 21 день.
При проведении конкурентного одновременного химиолучевого лечения рекомендованы следующие курсы химиотерапии:
1. Цисплатин — 100 мг/м2 в/в в 1, 22 и 43-й дни лучевой терапии. Лучевая терапия в суммарной очаговой дозе (СОД) 66-70 Гр, разовой очаговой дозе (РОД) 2 Гр.
2. Цисплатин — 20 мг/м2 в/в еженедельно при проведении лучевой терапии. Лучевая терапия в СОД 66-70 Гр, РОД 2 Гр.
3. Карбоплатин — AUC 1,5 в/в еженедельно при проведении лучевой терапии. Лучевая терапия в СОД 66-70 Гр, РОД 2 Гр.
4. Цетуксимаб — 400 мг/м2 в/в 2-часовая инфузия за неделю до начала лучевой терапии, затем 250 мг/м2 в/в 1-часовая инфузия еженедельно при проведении лучевой терапии.
Лучевая терапия в СОД 66-70 Гр, РОД 2 Гр.
При проведении монохимиотерапии рекомендовано применение следующих схем:
1. Доцетаксел — 75 мг/м2 в/в в 1-й день. Повторение цикла через 21 день.
2. Паклитаксел — 175 мг/м2 в/в в 1-й день. Повторение цикла через 21 день.
3. Метотрексат — 40 мг/м2 в/в или в/м. Повторение цикла каждую неделю.
4. Винорелбин — 30 мг/м2 в/в. Повторение цикла каждую неделю.
5. Цетуксимаб — 400 мг/м2 в/в 2-часовая инфузия в 1-й день, затем 250 мг/м2 в/в 1-часовая инфузия еженедельно.
При эстезионейробластоме полости носа и недифференцированном раке носоглотки используется схема АЦОП с цисплатином в сочетании с лучевой терапией:
Доксорубицин — 40 мг/м2 в/в в 1-й день.
Циклофосфамид — 600 мг/м2 в/в в 1-й день.
Винкристин — 2 мг/м2 в/в в 1-й день.
Цисплатин — 100 мг/м2 в/в в 4-й день.
Преднизолон — 1 мг/кг внутрь в 1-5-й день.
Повторение цикла каждые 21 день.
При раке головы и шеи железистого происхождения (рак больших и малых слюнных желез, неоперабельный рак щитовидной железы) возможно применение следующих режимов медикаментозного противоопухолевого лечения:
1. Доксорубицин — 60 мг/м2 в/в в 1-й день. Цисплатин — 40 мг/м2 в/в в 1-й день. Повторение цикла каждые 21 день.
2. Дакарбазин — 200 мг/м2 в/в в 1-3-й день. Эпирубицин — 25 мг/м2 в/в в 1-3-й день. 5-ФУ — 250 мг/м2 в/в в 1-3-й день. Повторение цикла каждые 21 день.
3. Доксорубицин — 60 мг/м2 в/в в 1-й день. Блеомицин — 15 мг в/в в 1-5-й день. Винкристин — 1,4 мг/м2 в/в в 1-й и 8-й дни. Повторение цикла каждые 21 день.
4. Винкристин — 1,4 мг/м2 в/в в 1-й день. Доксорубицин — 60 мг/м2 в/в в 1-й день. Циклофосфамид — 1000 мг/м2 в/в в 1-й день. Повторение цикла каждые 21 день.
Читайте также:

