Лечение метастазов колоректального рака в легкие

Informo, ergo sum!
ПАЦИЕНТЫ МЕТАСТАТИЧЕСКИМ КОЛОРЕКТАЛЬНЫМ РАКОМ
БОЛЕЕ 30% ИЗ НИХ ПЕРЕЖИВАЮТ 5-ЛЕТНИЙ СРОК
ПОСЛЕ СОВРЕМЕННОГО КОМБИНИРОВАННОГО ЛЕЧЕНИЯ
(Конспект материалов заседания)

Интернет: www. ronc.ru //www.oncology.ru //www.elibrary.ru //www.oncodome.narod.ru
№ 3 (596)
ИНФОРМАЦИОННЫЙ БЮЛЛЕТЕНЬ МОСКОВСКОГО ОНКОЛОГИЧЕСКОГО ОБЩЕСТВА. ИЗДАЕТСЯ С 1994 г.
ОБЩЕСТВО ОСНОВАНО В 1954 г.
ЗАСЕДАНИЕ № 000
СОСТОИТСЯ В ЧЕТВЕРГ, 28 МАРТА 2013 г., в 17.00
В КОНФЕРЕНЦ-ЗАЛЕ КЛИНИКИ РОССИЙСКОГО О НКОЛОГИЧЕСКОГО НАУЧНОГО ЦЕНТРА им. Н. Н.БЛОХИНА
ПОВЕСТКА ДНЯ:
ЛЕЧЕБНАЯ СТРАТЕГИЯ
ПРИ МЕТАСТАТИЧЕСКОМ КОЛОРЕКТАЛЬНОМ РАКЕ
Президиум:
академик РАН, проф. М.Р. Личиницер, проф. Ю.И. Патютко, д. м.н. Д. Л.Cтрояковский, проф.
Доклад: СТРАТЕГИЯ ЛЕЧЕНИЯ ПРИ МЕТАСТАТИЧЕСКОМ КОЛОРЕКТАЛЬНОМ РАКЕ
Доклад: РОЛЬ КОМБИНИРОВАННОГО ЛЕЧЕНИЯ
БОЛЬНЫХ МЕТАСТАТИЧЕСКИМ КОЛОРЕКТАЛЬНЫМ РАКОМ
Cтрояковский Д. Л.,
(Московская онкологическая больница № 62)
Дискуссия, прения:
• ЛЕЧЕНИЕ БОЛЬНЫХ КОЛОРЕКТАЛЬНЫМ РАКОМ С МЕТАСТАЗАМИ В ПЕЧЕНЬ. – , , (РОНЦ им. )
• ЛЕЧЕНИЕ БОЛЬНЫХ КОЛОРЕКТАЛЬНЫМ РАКОМ С МЕТАСТАЗАМИ В ЛЕГКИЕ. – , (РОНЦ им. )
• ЛЕЧЕНИЕ БОЛЬНЫХ МЕТАСТАТИЧЕСКИМ КОЛОРЕКТАЛЬНЫМ РАКОМ – , с соавт. (РОНЦ им. )
СОСТОЯНИЕ и ПЕРСПЕКТИВЫ
ЛЕЧЕНИЯ БОЛЬНЫХ МЕТАСТАТИЧЕСКИМ КОЛОРЕКТАЛЬНЫМ РАКОМ
Колоректальный рак – третья по частоте злокачественная опухоль (после рака легкого и желудка). В России ежегодно выявляется порядка 50.000 пациентов. Отдаленные метастазы, прежде всего – в печени, выявляются при выборе метода лечения у каждого третьего, а при наблюдении после условно радикальных операций – у каждого второго больного. В 25% случаев поражения печени длительно остаются единственным проявлением заболевания, что обосновывает показания к хирургическим вмешательствам.
В плане комбинированного лечения больных метастатическим КРР резекция печени является оптимальным объемом хирургического вмешательства. По статистике 10-25% больных метастатическим колоректальным раком могут быть оперированы при лостаточно низких показателях частоты осложнений и летальности. Химиотерапия, по данным современных рандомизированных исследований – G.Portier, et al. (2006); B.Nordlinger, et al.(2008) – улучшает отдаленные результаты лечения.
(Продолжение – см. с. 2.)
СОСТОЯНИЕ, ПЕРСПЕКТИВЫ ЛЕЧЕНИЯ БОЛЬНЫХ МЕТАСТАТИЧЕСКИМ КОЛОРЕКТАЛЬНЫМ РАКОМ
Хирургическое удаление радикально (R0) резектабельных метастазов колоректального рака в печень потенциально может привести к излечению больного. По данным литературы показатели 5-летней выживаемости соответствуют 20–45%. Пятилетняя общая и безрецидивная выживаемость составила после резекции печени 41,1-26,7%, но повышалась до 51,1-33,5% в группе больных после резекций с адъювантной химиотерапией. Получено достоверное увеличение показателей безрецидивной выживаемости при комбинированном лечении.
•Патютко лечение злокачественных опухолей печени. практическая медицина. Москва 2005.
•Laweus D., I. Taylor. Chemotherapy for colorectal cancer – an overview of current managements for surgeons. EJSO, 2005.
•Guillaume Portier, Dominique Elias et al. Multicenter Randomized Trial of Adjuvant Fluorouracil and Folinic Acid Compared
With Surgery Alone After Resection of Colorectal Liver Metastases. FFCD ACHBTH AURC 9002 Trial. J Clin Oncol, 2006.
•Nordlinger, B. Perioperative chemotherapy with FOLFOX4 and surgery versus surgery alone for resectable liver metastases from
colorectal cancer (EORTC Intergroup trial 40983): a randomised controlled trial / B. Nordlinger, H. Sorbye, B. Glimelius et al. //
Lancet. – 2008. - Vol.371, N 9617. – P. .
•ESMO Consensus Guidelines for management of patients with colon and rectal cancer. A personalized approach to clinical decision making.
По материалам Н. ВДобровой, , .
ТРУДЫ 
МОСКОВСКОГО ОНКОЛОГИЧЕСКОГО ОБЩЕСТВА
PROCEEDINGS OF THE MOSCOW CANCER SOCIETY (№ #596; March 28, 2013)
THE TREATMENT STRATEGY FOR METASTATIC COLORECTAL CARCINOMA
Report-1 TREATMENT’S STRATEGY FOR METASTATIC COLORECTAL CANCER. THE DATA FROM CURRENT CLINICAL PRACTICE AND RESEARCH MATERIALS OF INTERNATIONAL Dr. N. Dobrova, et al. (The N. N.Blokhin Russian Cancer Research Center).
Report-2 COMBINED TREATMENT FOR PATIENTS WITH METASTATIC COLORECTAL Prof. D. Strojakovsky et al. (Moscow City Cancer Hospital N#62)
Discussion CURRENT PROBLEMS OF TREATMENT STRATEGY FOR METASTATIC COLORECTAL CARCINOMA. •Surgery for hepatic metastases of colorectal Dr. N. Podlujny, et al. • Surgery for pulmonary metastases of colorectal Dr. A. Allaxverdiev, et al. • Тhe results of surgical and combined treatment in patients with metastatic colorectal Dr. V. Aliev, et al. (The materials for discussion are presented by the stuff of the N. N.Blokhin Russian Cancer Research Center).
Доклад: СТРАТЕГИЯ ЛЕЧЕНИЯ ПРИ МЕТАСТАТИЧЕСКОМ КОЛОРЕКТАЛЬНОМ РАКЕ
При колоректальном раке (КРР) метастазы выявляются у 20-25% больных при установлении диагноза и еще у 20-25% – после удаления первичной опухоли. Современная таргетная и химиотерапия метастатического КРР в сочетании с удалением первичной опухоли, резекцией печени и легких (как наиболее частых локализаций метастазов) позволяют добиться длительной выживаемости и улучшения качества жизни, достигнуть клинического излечения.
В научных исследованиях продолжают изучаться вопросы выбора противоопухолевой терапии, сочетания таргетных и химиопрепаратов, продолжительности и индивидуализации лечения. Сложившиеся представления формулируются следующим образом:
Принципы лечения при наличии первичной опухоли и потенциально резектабельных метастазов. Лечебная стратегия должна предусматривать возможность достижения радикализма (выполнения R0 хирургического вмешательства). Стандартом является назначение пред-и послеоперационной химиотерапии (в режиме FOLFOX; продолжительностью 3 мес до и 3 – после операции) Возможно первым этапом удаление первичной опухоли и метастазов, затем послеоперационная адъювантная терапия в режиме FOLFOX в течение 6 месяцев.
Химиотерапия при резектабельных метастазах в печень. Современным стандартом является периоперационная химиотерапия в течение 3 мес до операции и 3 – после. Такой подход доказан в исследовании EORTC 40983 для режима FOLFOX в группе больных единичными (до 4) метастазами в печень и нелеченными оксалиплатином. У больных, не ответивших в пределах предшествующих 12 месяцев на адъювантную терапию на основе оксалиплатина, необходимо использовать другой режим (например, FOLFIRI) или сразу выполнить операцию. Больным с благоприятным прогнозом, например, при солитарном (
Легкие - третья по частоте после печени и брюшинной полости (канцероматоз брюшины) излюбленная локализация метастатической диссеминации опухолей ЖКТ, включая колоректальный рак. Как правило, метастазы в легких свидетельствуют об инкурабельном распространении опухолевого процесса. В связи с этим принципиальным методом лечения является системная химиотерапия, которая имеет прямые показания, если переносима.
Плохие прогностические факторы:
• Множественные метастазы (> 4).
• Билатеральные метастазы в легких.
• Небольшой срок между выявлением первичной опухоли и метастазов или синхронное развитие.
• Неудовлетворительная функция легких.
Хирургическое вмешательство может быть эффективно у тщательно отобранных больных, подходящих для операции, с ограниченным числом метастазов, относительно медленной прогрессией и без признаков экстрапульмонарных метастазов.
Длительная потенциальная выживаемость у таких больных после резекции в среднем составляет 38% (30-70%) по сравнению с пятилетней выживаемостью менее 1% у всей группы больных с метастазами в легких.
Резекция легкого обычно не показана во время абдоминальной резекции, более оправдан двухэтапный подход: резекция легкого после курса химиотерапии продолжительностью 12-16 недель. Преимущества: оценка чувствительности опухоли к химиотерапии, уменьшение размеров и лучшая резектабельность, исключение больных с быстрой легочной и внелегочной прогрессией заболевания, не имеющих преимуществ при операции.
а) Эпидемиология. Возникают у 10-15% больных колоректальным раком (КРР) => метахронные метастазы после резекции первичной опухоли.
б) Симптомы. Наиболее часто бессимптомное течение => выявление во время первичного обследования или наблюдения.
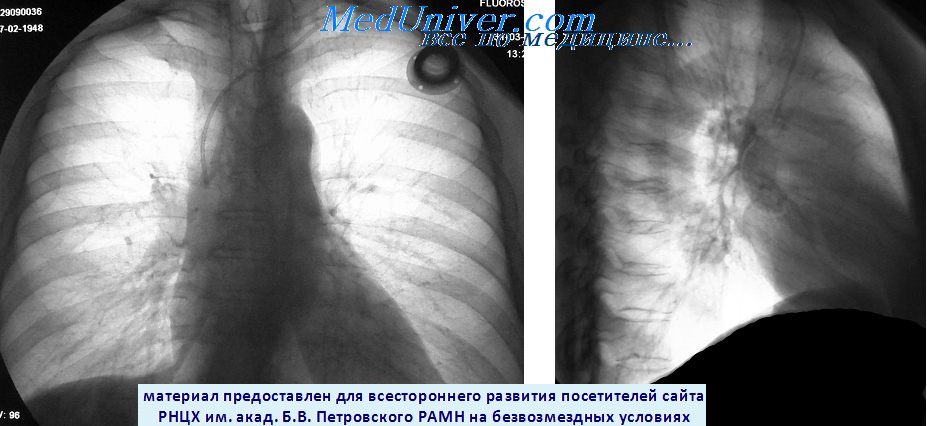
Рентгенограмма метастаза рака в нижнею долю правого легкого
в) Дифференциальный диагноз:
• Первичный рак легкого.
• Доброкачественные образования в легких.
г) Патоморфология. Гистологический тип метастатических очагов должен соответствовать строению первичной опухоли.
д) Обследование при метастазе рака кишки в легкое
Необходимый минимальный стандарт:
- Анамнез заболевания, общее состояние больного, сопутствующие заболевания (в частности сердечно-легочные, курение и другие факторы риска для рака легких), операбельность.
- Клиническое обследование:
• Исследование брюшной полости и таза - выявление местного рецидива, желтухи, асцита и т.д.
• Оценка сердечно-легочной функции и функции дыхания: операбельность, сниженная функция легких, эмфизема, ХОБЛ, нагрузка на правое предсердие и т.д.
- Анализы крови: газы артериальной крови, анемия, функция печени (альбумин, АЧТВ, ПТИ), функция почек, онкомаркер (РЭА).
- КТ органов грудной клетки/брюшной полости/малого таза и/или ПЭТ-КТ: выявление экстрапульмонарных метастазов.
Дополнительные исследования (необязательные):
• Бронхоскопия: если изменения похожи на первичный рак легких.
• Биопсия (например, под контролем КТ): подтверждение.
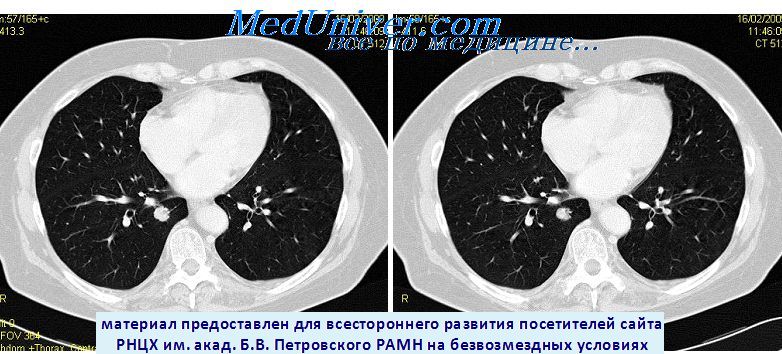
КТ метастаза рака в нижнею долю правого легкого
е) Классификация метастазов рака в легкие:
• Резектабельные метастазы в легких.
• Нерезектабельные метастазы (в связи с количеством, распределением, близостью к жизненно важным структурам).
ж) Лечение без операции метастазов рака в легкие:
• Нерезектабельные метастазы в легких (диссеминированные метастазы, экстрапульмонарные метастазы).
• Иноперабельные больные с сопутствующими заболеваниями и плохим общим состоянием.
з) Операция при метастазе рака кишки в легкие
Показания - резектабельные метастазы.
Хирургический подход - метастазэктомия (редко более расширенная резекция):
• Видеоассистированное торакоскопическое оперативное вмешательство: сравнительно быстрое выздоровление, но относительно высокая частота пропущенных метастазов.
• Открытое оперативное вмешательство: большее число осложнений, сравнительно низкий уровень пропущенных метастазов (возможность пальпации легкого).

Сублобарная резекция нижней доли правого легкого при метастазе аденокарциномы прямой кишки
и) Результаты:
• Пятилетняя выживаемость после резекции метастазов в легких: 30-70% (внимание: строго отобранные пациенты).
• Осложнения: кровотечение, раневая инфекция, подсасывание воздуха, дыхательная недостаточность.
к) Наблюдение и дальнейшее лечение при метастазе рака в печень. Продолжение адъювантной/паллиативной химиотерапии показано:
• Всем больным после метастазэктомии.
• Пациентам, неподходящим для резекции, до тех пор, пока польза превышает тяжесть побочных эффектов.
Международное медицинское сообщество в марте традиционно стремится привлечь внимание к росту заболеваемости раком ободочной и прямой кишки и повысить осведомленность людей о проблеме. Это важно потому, что вовремя выявленный колоректальный рак излечим. При постановке диагноза на ранней стадии 9 из 10 пациентов могут быть спасены.

- Алексей Викторович, кто и почему заболевает колоректальным раком?
- Этимология данного вида рака, как и многих других онкозаболеваний, до сих пор неясна. Есть предрасполагающие факторы, или факторы риска. Это прежде всего наличие в анамнезе пациента доброкачественного образования толстой кишки (есть такое понятие, как трансформация или перерождение доброкачественного образования в злокачественное). В зоне риска также пациенты с язвенным колитом и болезнью Крона. Чаще других подвержены заболеванию и те, у кого в анамнезе у родственников есть подобные новообразования. Существует фактор генетической предрасположенности, виды наследственного колоректального рака - это семейный аденоматоз толстой кишки и синдром Линча. Эти заболевания передаются по наследству от родителей детям, и пациенты составляют особую группу, поскольку заболевание развивается у них еще в подростковом и даже детском возрасте. В меньшей мере, но тоже играют роль экологические факторы, факторы питания. По данным мультицентрового исследования, проведенного в США, доказано, что курение - один из предрасполагающих факторов к развитию не только рака легких и желудка, но и кишечника.
Основную группу наших пациентов составляют граждане от 60 лет и старше, еще недавно на них приходилось до 95% случаев заболеваний. Но сейчас колоректальный рак стал молодеть, это тренд последнего десятилетия, появляются пациенты от 40 до 50 лет, их где-то 10%.
- Как проявляется заболевание и как ставится диагноз?
- Ранних клинических проявлений колоректальный рак практически не имеет, чем он и коварен, чем и обусловлена его поздняя диагностика. Начальные проявления заболевания дают о себя знать чаще всего болью в животе, появлением крови в кале, отмечается чередование поносов и запоров. На поздних стадиях появляются анемия, потеря массы тела. Онконастороженность у наших пациентов немного притуплена, из-за чего болезнь часто выявляется на 3-й и 4-й стадиях, когда уже проявляются первые симптомы. Поздние симптомы – это кишечная непроходимость, сопровождающаяся отсутствием самостоятельного стула, выраженным дефицитом веса, кахексией.
В диагностике колоректального рака золотым стандартом признана колоноскопия - эндоскопическое исследование толстой кишки и терминального отдела подвздошной кишки при помощи специального гибкого эндоскопа. Только она дает возможность при малейших подозрениях взять у пациента биопсию для верификации выявленных образований. А вспомогательными методами могут быть компьютерная и магнитнорезонансная томография, ирригоскопия и ультразвуковое исследование. В качестве скрининга может использоваться исследование кала на скрытую кровь. Есть еще онкомаркеры - раково-эмбриональный антиген (РЭА) и СА19.9. Но они не всегда коррелируют с наличием опухоли, то есть могут давать как ложноотрицательные, так и ложноположительные результаты. Поэтому онкомаркеры обычно используются для диагностики возможного рецидива у пациентов, которым уже был установлен диагноз и проведено комплексное лечение.
- Каковы показатели смертности и выживаемости от колоректального рака?
- Если лечение включено на ранней стадии, то полное излечение достигается в 97-99% случаев, если больной обращается на 2-й стадии, то в 90-95%. На 3-й стадии результат будет значительно хуже: в зависимости от вида опухоли и ее гистологического строения – около 60-70%, и уже высока частота рецидивов заболевания. При 4-й стадии прогноз еще хуже, выживаемость невысокая и зависит от количества метастазов, характера течения заболевания, характера опухоли.
В нашей стране годичная летальность от колоректального рака все еще высока - в некоторых субъектах достигает 60-65%. И смертность от заболевания высока. Если в год у нас регистрируется около 60 тыс. случаев, то и смертность составляет где-то 50-60 тыс. случаев. Но это не годичная летальность. Половину составляют люди, которым поставили диагноз меньше года назад, а вторая половина - это те, у кого рецидивы возникли на поздних стадиях, они прожили больше года, но все равно пополнили этот список.
- Как лечат этих больных? Какие новые методики применяются?
- Лечение колоректального рака прежде всего хирургическое. Хирургический этап лечения может выполняться врачами-онкологами или колопроктологами. Есть комплексное лечение, включающее предоперационную лучевую терапию, которая особенно актуальна при лечении рака прямой кишки. Есть и комплексная дооперационная и послеоперационная химиотерапия. Дооперационная используется для уменьшения объемов самой опухоли или метастазов. Чаще всего опухоль метастазирует в печень и легкие, и химиотерапия позволяет уменьшить размеры поражения этих органов и открывает возможность радикального удаления метастазов. Что касается послеоперационной комплексной химиотерапии, ее используют при метастатическом колоректальном раке у пациентов с 3-й и 4-й стадиями или когда есть риск развития метастазов. В последние годы активно применяется персонифицированный индивидуальный подход, исследуется эпителиально-мезенхиальный переход, иммуногистохимическое типирование опухоли, по которому с применением четких прогнозирующих критериев определяется, будет опухоль метастазировать или нет. При средних и высоких рисках метастазирования проводится послеоперационная химиотерапия. Если же риск низкий, ее не применяют, поскольку химиотерапия сама по себе токсична, не говоря уже о том, что стоит недешево.
В последние годы в практику широко внедряются лапароскопические технологии. Вместе с лапароскопией стали применяться люминесцентные методы. Это специальное свечение в узком спектре света, при котором видна зона анастомоза, а также метастазы, которые могут быть не обнаружены на глаз и пропущены хирургом. Очень важно их увидеть, потому что увеличивается радикализм операции и снижается риск возможного рецидива. Среди эндоскопических технологий – трансанальная эндомикрохирургия и радикальное удаление опухоли через гибкий эндоскоп, которое можно делать, не совершая разрезы, а внутрипросветно. Но такая технология чаще применяется для колоректального рака на первой стадии.
- Как финансируется лечение и какова его стоимость?
- Общая стоимость лечения колоректального рака на 1-2 стадиях колеблется от 80 до 200 тысяч рублей. Лечение на 3-й стадии дороже - 300-500 тысяч, а на 4-й сумма достигает уже от 500 тысяч до 1,5 миллиона рублей. Названные цифры – это то, во сколько обходится государству лечение каждого пациента. Практически 100% больных получают необходимое лечение в рамках Программы государственных гарантий бесплатного оказания гражданам медицинской помощи. Часть средств получаем по программам ВМП из ОМС, часть идет по программе дополнительного лекарственного обеспечения, которое закупается за бюджетные средства.
- Дайте, пожалуйста, рекомендации: что должно насторожить врача первичного звена при осмотре пациента с колоректальным раком? И каким должно быть взаимодействие врачей разных специальностей в борьбе против этого заболевания?
- На самом деле на данный момент уже выстроена система организации такой помощи, включающая врачей-онкологов, колопроктологов, радиологов, эндоскопистов, химиотерапевтов, ну и в меньшей степени врачей общей практики и некоторых других специальностей.
Мультидисциплинарный подход – ключевой момент в успешности диагностики и лечения рака толстой кишки. По хирургии колоректального рака мы проводили пять лет назад исследование и выяснили, что органосохраняющие операции при раке прямой кишки в основном делают как раз специалисты-колопроктологи, а не онкологи. Последние делают в основном радикальную операцию с удалением сфинктерного аппарата без дальнейшей возможности реконструктивно-восстановительных операций. Поэтому такое взаимодействие очень важно.

Метастатическое поражение легких является одним из самых частых клинических проявлений злокачественных новообразований. Наличие метастазов в легких свидетельствует о IV стадии онкопатологии.
Метастазирование в легкие заключается в том, что раковые клетки из первичной опухоли, которая находится в другом органе, с током крови (гематогенно) или лимфы (лимфогенно) распространяются в легочную ткань, оседают там и начинают активно делиться, что провидит к образованию и росту метастаза и, соответственно, ухудшению состояния больного.
Метастазы в легких могут обнаруживаться при любой злокачественной опухоли, но наиболее частыми причинами могут быть:
- Опухоли желудочно-кишечного тракта (рак пищевода, желудка, колоректальный рак);
- Рак молочной железы;
- Опухоли женской репродуктивной системы (рак яичников, рак тела матки)
- Рак почки и мочевого пузыря;
- Меланома.
Виды метастазов в легких

Метастазы в легкие могут быть:
- по распространенности: одно- и двусторонние;
- по количеству: единичные (до трех) и множественные. Множественные метастазы в легкие по мере своего роста могут сливаться между собой, формируя сливные очаги, приводить к таким осложнениям, как распад, инфицирование, кровотечение. Часто при метастазах в легкие у пациентов диагностируется опухолевый плеврит, что также приводит к резкому ухудшению самочувствия, качества жизни и прогноза.
Метастазы в легких: симптомы
Симптомы метастатического поражения легких вариабельны в зависимости от количества очагов, их расположения, связи с бронхами, сосудами, наличия плеврита.
Специфические симптомы метастатического поражения легких:
- Кашель* (самый частый симптом), кровохарканье;
- Одышка;
- Боль в груди;
- Слабость, повышенная утомляемость;
- Прогрессирующая потеря веса;
- Повышение температуры тела;
- Снижение или отсутствие аппетита.
*Кашель при метастазах в легких вначале своего развития может быть сухим и редким, по мере роста метастазов и сужения просвета бронха кашель становится надсадным мучительным, беспокоит часто по ночам. Впоследствии он становится влажным с трудно отделяемой слизисто-гнойной мокротой, в которой могут присутствовать прожилки крови. В дальнейшем мокрота становиться гнойной, возможно с резким неприятным запахом. При далеко запущенном опухолевом поражении легких (при прорастании метастазами кровеносных сосудов) больного беспокоит кровохарканье с эпизодами кровотечения, что требует немедленной медицинской помощи.
Диагностика метастазов в легкие

Для обнаружения и уточнения характера метастатического поражения легких при любой онкопатологии используют:
- Рентгенологическое исследование легких в двух проекциях;
- Компьютерную томографию (КТ) – одно из самых информативных методов послойного исследования любой области организма с получением трехмерного изображения исследуемого органа. По этому изображению можно определить размеры органа, его структуру и все патологические изменения, включая метастазы в легких;
- Магнитно-резонансную томографию (МРТ) – по показаниям;
- Позитронно-эмиссионную томографию (ПЭТ) и ПЭТ, совмещенная с КТ (ПЭТ-КТ)– по показаниям;
- Бронхоскопия с возможной биопсией опухоли для морфологической верификации диагноза. Метод непосредственного осмотра и оценки состояния слизистых трахеобронхиального дерева: трахеи и бронхов при помощи специального прибора – бронхоскопа (существует несколько видов инструментов);
- Биопсия опухоли (например, под контролем КТ) для цитологической, гистологической верификации диагноза, молекулярно-генетического анализа биоматериала (по показаниям);
- Плевральная пункция при сопутствующем плеврите с цитологическим исследованием плевральной жидкости. Плевральная пункция — пункция или прокол плевральной полости, которая находится между париетальным и висцеральным листками плевры, с помощью полой иглы или троакара. Манипуляция проводится под местным обезболиванием с целью получения диагностического материала, а также с лечебной целью, при этом после эвакуации жидкости из плевральной полости больной чувствует облегчение симптомов, уменьшение одышки, тяжести и боли в грудной клетке;
- Цитологическое исследование мокроты;
- КТ-ангиография – по показаниям. Этот метод исследования сочетает в себе две методики: КТ и ангиографию. Применяется для визуализации сосудистого русла в исследуемом участке, определении патологии сосудистого русла (тромбоз, атеросклероз сосудов, кровоизлияния, стеноз и т.д.). КТ-ангиография помогает визуализировать степень прорастания опухолью крупных сосудов, оценить риск кровотечения при хирургических манипуляциях.
- Торакоскопия – по показаниям. Торакоскопия используется для диагностической цели в таких клинических ситуациях, когда невозможно другими методами получить материал для морфологического исследования. Кроме того, торакоскопия активно используется с лечебной целью, чтобы удалить метастазы в легком.
Рентгенологическими признаками злокачественности опухоли в легком являются нечеткость, лучистость контуров, инфильтративный рост опухоли, дорожка к корню. Рентгенологическое исследование выявляет образования не менее 5 мм в диаметре.
В ряде случаев метастазы расположены в средостении, в связи с чем таким больным целесообразным является назначение КТ, МРТ и ПЭТ-КТ грудной клетки. На КТ наиболее четко видны метастазы в легких, с помощью этого метода можно получить достоверную информацию об их размерах, локализации, прорастании в окружающую ткань. На КТ снимке можно четко визуализировать корни легкого и уточнить распространенность процесса, определить размер, вид и количество даже самых мелких узелков, слияние между собой метастазов, можно визуализировать полости распада. Лимфогенное метастазирование характеризуется появлением дорожки к корню легкого, цепочки лимфоузлов.
Лечение метастазов в легких

Лечение метастазов в легких осуществляется в комплексе с лечением первичной опухоли.
Методы лечения метастазов в легких различны и назначаются в зависимости от вида основного заболевания, его стадии, степени местного распространения первичной опухоли и метастазов в легких, общего состояния больного, его сопутствующей патологии и степени ее коррекции, а также в зависимости от вида и эффективности ранее проведенного противоопухолевого лечения, длительности безрецидивного периода и других факторов.
- Хирургическое лечение предусматривает удаление как первичного очага, так и удаление метастазов в легких.
- Лекарственное противоопухолевое лечение основано на системном воздействии лекарственных препаратов на раковые клетки в первичном очаге, циркулирующие в сосудах опухолевые клетки, а также регионарные и отдаленные метастазы, включая метастазы в легких. К этому методу относят химиотерапию, таргетную терапию, гормонотерапию.
- Лучевая терапия - особенно актуальна при радиочувствительных опухолях. Может быть использована дистанционная лучевая терапия и стереотаксическая лучевая терапия в зависимости от клинической ситуации.
Сочетание двух методов лечения называется комбинированной терапией, всех трех методов – комплексным.
Прогноз и срок жизни пациента
Прогноз жизни при наличии метастазов в легких, часто бывает неблагоприятный, срок жизни таких пациентов значительно варьирует и зависит от многих факторов. В первую очередь, это характер основного заболевания и эффективность его лечения, а также наличие различных осложнений и сопутствующей патологии, которые могут усугубить качество жизни и прогноз. Важную роль играет количество и размеры метастазов в легких. Целью терапии таких больных является продление жизни при сохранении ее качества. Поэтому необходимо уделять внимание именно комплексному подходу в лечении и сроку его реализации.
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Cited By
Основываясь на данных мировой медицинской литературы и результатах отечественных исследователей, можно сделать вывод, что достоверно влияют на прогноз выживаемости больных колоректальным раком с метастатическим поражением легких радикальность выполненной операции, количество метастазов и величина DFI (интервал с момента излечения первичной опухоли до появления легочных метастазов). Поражение внутригрудных лимфатических узлов в сочетании с легочными метастазами, повышение уровня РЭА >10 нг/мл считаются крайне неблагоприятными прогностическими фактороми. В изученных нами статьях размер первичной опухоли, одностороннее или двустороннее распределение легочных метастазов не являлись прогностическими факторами выживаемости, однако некоторые авторы считают двустороннее поражение и распространение первичной опухоли T3–4 прогностически неблагоприятными признаками. Ключевыми факторами для проведения хирургического лечения легочных метастазов являются функциональная переносимость операции, выполнение радикального объема вмешательства, отсутствие других проявлений заболевания.
1. Weinlechner J. Tumoren an der brustwand und deren behnadlung resection der rippeneroffnung der brusthohle und partielle entfernung der lunge. Wien Med Wochenschr 1882; 32: 589–591.
2. Berney C.R., Yang J.L., Fisher R.J., Russell P.J., Crowe P.J. Over expression of nm23 protein assessed by color video image analysis in metastatic colorectal cancer: correlation with reduced patient survival. World J Surg. 1998 May; 22 (5): 484–90.
3. Shiono S., Ishii G., Nagai K., Murata Y., Tsuta K., Nitadori J., Kodama T., Ochiai A. Immunohistochemical prognostic factors in resected colorectal lung metastases using tissue microarray analysis. Eur J Surg Oncol. 2006 Apr; 32 (3): 308–9.
4. Тюрин И.Е. Компьютерная томография органов грудной полости. СПб., 2003. 371.
5. Choi Y.J., Park S.H., Lee S.S., Choi E.K., Yu C.S., Kim H.C., Kim J.C. CT Colonography for Follow Up After Surgery for Colorectal Cancer. Am J Roentgenol. 2007; 189: 283–289. doi: 10.2214/AJR.07.2305.
6. Parsons A.M., Detterbeck F.C., Parker L.A. Accuracy of helical CT in the detection of pulmonary metastases: is intraoperative palpa tion still necessary? 2004. Ann Thorac Surg. 2004 Dec; 78 (6): 1910–6; discussion 1916–8.
7. Volterrani L., Vegni V., Pieraccini M., Rotili G., Gotti G., Disanto A., Tucci E. Small solitary pulmonary nodule & HRCT: a preliminaty report. Eur Radiol. 1995; 5 (4): 443–447.
8. Blalock A. Recent advances in surgery. N Engl J Med 1944; 231: 261–267.
9. Collins J. CT signs and patterns of lung disease. Radiol Clin North Am. 2001 Nov; 39 (6): 1115–35.
10. Kreel L. Computed tomography of the thorax. Radiol Clin North Am. 1978; 16 (3): 575–584.
11. Kim H.J., Park S.H., Pickhardt P.J., Yoon S.N., Lee S.S., Yee J., Kim D.H., Kim A.Y., Kim J.C., Yu C.S., Ha H.K. CT colonography for combined colonic and extracolonic surveillance after curative resection of colorectal cancer. Radiology. 2010 Dec; 257 (3): 697–704. doi: 10.1148/ radiol.10100385.
12. Гланц С. Медико биологическая статистика. М., 1999. 459.
13. Портной Л.М., Тюрин И.Е., Юрьев А.С. Лучевая диагностика в Российской Федерации: современное состояние и перспективы развития. М., 2002. 25.
14. Афанасьев С.Г., Добродеев А.Ю. Циторедуктивные операции (Нужно ли удалять первичную опухоль? Где предел разумной циторедукции?). Практическая онкология. 2014; 15 (2): 93–100.
15. Brink J.A. Technical aspects of helical (spiral) СТ. Radiol Clin North Am. 1995 Sep; 33 (5): 825–41.
16. Divisi D., Di Tommaso S., Di Leonardo G., Brianzoni E., De Vico A., Crisci R. 18 fluorine fluorodeoxyglucose positron emission tomography with computerized tomography versus computerized tomography alone for the management of solitary lung nodules with diameters inferior to 1.5 cm. Thorac Cardiovasc Surg. 2010 Oct; 58 (7): 422–6. doi: 10.1055/s 0030 1249945.
17. Buscombe J., Hill J., Parbhoo S. Scintimammography, a guide to good practice. Gibbs Associates Limited. 1998.
18. Kang M.C., Kang C.H., Lee H.J., Goo J.M., Kim Y.T., Kim J.H. Accuracy of 16 channel multi detector row chest computed tomography with thin sections in the detection of metastatic pulmonary nodules. Eur J Cardiothorac Surg. 2008 Mar; 33 (3): 473–9. doi: 10.1016/j. ejcts.2007.12.011.
19. Ахмедов Б.Б., Давыдов М.М., Аллахвердиев А.К., Полоцкий Б.Е. Определение показаний и объема хирургического лечения больных с метастазами колоректального рака в легкие. Онкологическая колопроктология. 2016; 6 (3): 34–42. doi:10.17650/2220 3478 2016 6 3 34 42
20. Duque J.L., Ramos G., Castrodeza J., Cerezal J., Castanedo M., Yuste G., Heras F. Early complications in surgical treatment of lung cancer: a prospective, multicenter study. Ann. Thorac. Surg. 1997; 63 (4): 944.
21. Kozower B.D., Sheng S., O’Brien S.M., Liptay M.J., Lau C.L., Jones D.R., Shahian D.M., Wright C.D. STS database risk models: pre dictors of mortality and major morbidity for lung cancer resection. Ann Thorac Surg. 2010 Sep; 90 (3): 875–81; discussion 881–3. doi: 10.1016/j. athoracsur.2010.03.115.
22. Thomford N.R., Woolner L.B., Clagett T. The surgical treatment of metastatic tumors in the lungs. J Thorac Cardiovasc Surg. 1965 Mar; 49: 357–63.
23. Kanemitsu Y., Hirai T., Yasui K. Preoperative probability model for predicting overall survival after resection of pulmonary metastases from colorectal cancer. Br J Surg. 2004 Jan; 91 (1): 112–20.
24. Расулов А.О., Давыдов М.М., Алиев В.А., Гордеев С.С., Аллахвердиев А.К., Ахмедов Б.Б., Налбандян А.В. Колоректальный рак с синхронными метастазами в легких: клинические характеристики, лечение, прогноз. Онкологическая колопроктология. 2016; 5 (1): 8–13.
25. Вашакмадзе Л.А., Трахтенберг А.Х., Хомяков В.М., Сидоров С.В., Пикин О.В. Результаты циторедуктивных операций при колоректальном раке с отдаленными метастазами. Российский онкологический журнал. 2007; 5: 4–8.
26. Pfannschmidt J., Dienemann H., Hoffmann H. Surgical resection of pulmonary metastases from colorectal cancer: a systematic review of published series. Ann Thorac Surg 2007; 84 (1): 324–338.
27. Inoue M., Ohta M., Iuchi K., Matsumura A., Ideguchi K., Ya-sumitsu T., Nakagawa K., Fukuhara K., Maeda H., Takeda S., Minami M., Ohno Y., Matsuda H.; Thoracic Surgery Study Group of Osaka University. Benefits of surgery for patients with pulmonary metastases from colorectal carcinoma. Ann Thorac Surg. 2004 Jul; 78 (1): 238–44.
28. Okumura S., Tsuboi M., Nakayama H., Asamura H., Tsuchiya R., Naruke T. Pulmonary resection for metastatic colorectal cancer: experi ences with 159 patients. J Thorac Cardiovasc Surg. 1996 Oct; 112 (4): 867–74.
29. Pfannschmidt J., Muley T., Hoffmann H., Dienemann H. Prognos tic factors and survival after complete resection of pulmonarymetastases fromcolorectal carcinoma: experiences in 167 patients. J Thorac Cardiovasc Surg. 2003; 126 (3): 732–739.
30. Welter S., Jacobs J., Krbek T., Krebs B., Stamatis G. Longterm survival after repeated resection of pulmonary metastases from colorectal cancer. Ann Thorac Surg. 2007; 84 (1): 203–210.
31. Veronesi G., Petrella F., Leo F., Solli P., Maissoneuve P., Galetta D., Gasparri R., Pelosi G., De Pas T., Spaggiari L. Prognostic role of lymph node involvement in lung metastasectomy. J Thorac Cardiovasc Surg. 2007 Apr; 133 (4): 967–72.
32. Pfannschmidt J., Klode J., Muley T., Dienemann H., Hoffmann H. Nodal involvement at the time of pulmonary metastasectomy: experiences in 245 patients. Ann Thorac Surg. 2006; 81 (2): 448–454.
33. Higashiyama M., Kodama K., Higaki N., Takami K., Murata K., Kameyama M., Yokouchi H. Surgery for pulmonary metastases from colorectal cancer. Jap J Thor Cardiovasc Surg. 2003; 51 (7): 289–296.
34. Horner M., Ries L., Krapcho M. SEER Cancer Stat Fact Sheets. SEER Cancer Statistics Review, 1976–2006. Atlanta, GA: Centers for Disease Control and Prevention, Division of Cancer Prevention and Control. 2009.
35. Pastorino U., Buyse M., Friedel G., Ginsberg R.J., Girard P., Goldstraw P., Johnston M., McCormack P., Pass H., Putnam J.B.Jr.; International Registry of Lung Metastases. Long term results of lung metastasectomy: prognostic analyses based on 5206 cases. J Thorac Car diovasc Surg. 1997 Jan; 113 (1): 37–49.
36. Pfannschmidt J., Bade S., Hoheisel J., Muley T., Dienemann H., Herpel E. Identification of immunohistochemical prognostic markers for survival after resection of pulmonary metastases from colorectal carcinoma. Thorac Cardiovasc Surg. 2009 Oct; 57 (7): 403–8. doi: 10.1055/s 0029 1185820.
37. DeMatteo R.M., Minnard E.A., Kemeney N. Surgical resection of both hepatic and pulmonary metastases in patients with colorectal cancer. Proceedings of ASCO. 1999; abstract 958.
38. Onaitis M.W., Petersen R.P., Haney J.C., Saltz L., Park B., Flores R., Rizk N., Bains M.S, Dycoco J., D’Amico T.A., Harpole D.H., Kemeny N., Rusch V.W., Downey R. Ann Thorac Surg. 2009 Jun; 87 (6): 1684–8. doi: 10.1016/j.athoracsur.2009.03.034.
39. Iizasa T., Suzuki M., Yoshida S., Motohashi S., Yasufuku K., Iyoda A., Shibuya K., Hiroshima K., Nakatani Y., Fujisawa T. Prediction of prognosis and surgical indications for pulmonary metastasectomy from colorectal cancer. Ann Thorac Surg. 2006 Jul; 82 (1): 254–60.
40. Vogelsang H., Hierholzer C., Berger U., Siewert J.R., Präuer H. Factors influencing survival after resection of pulmonary metastases from colorectal cancer. Br J Surg. 2004 Aug; 91 (8): 1066–71.
41. Melloni G., Carretta A., Ciriaco P., Arrigoni G., Fieschi S., Rizzo N., Bonacina E., Augello G., Belloni P.A., Zannini P. Inflammatory pseudotu mor of the lung in adults. Ann Thorac Surg. 2005 Feb; 79 (2): 426–32.
42. Mitry E., Guiu B., Cosconea S., Jooste V., Faivre J., Bouvier A.M. Epidemiology, management and prognosis of colorectal cancer with lung metastases: a 30 year population based study. Gut. 2010 Oct; 59 (10): 1383–8. doi: 10.1136/gut.2010.211557.
43. Neeff H., Hörth W., Makowiec F., Fischer E., Imdahl A., Hopt U.T., Passlick B. J Gastrointest Surg. 2009 Oct; 13 (10): 1813–20. doi: 10.1007/ s11605 009 0960 1.
44. Barbareschi M., Murer B., Colby T.V., Chilosi M., Macri E., Loda M., Doglioni C. CDX 2 homeobox gene expression is a reliable marker of colorectal adenocarcinoma metastases to the lungs. Am J Surg Pathol. 2003 Feb; 27 (2): 141–9.
45. Headrick J.R., Miller D.L., Nagorney D.M., Allen M.S., Deschamps C., Trastek V.F., Pairolero P.C. Surgical treatment of hepatic and pulmonary metastases from colon cancer. Ann Thor Surg. 2001; 71 (3): 975–980.
46. Shah S.A., Haddad R., Al-Sukhni W., Kim R.D., Greig P.D., Grant D.R., Taylor B.R., Langer B., Gallinger S., Wei A.C. Surgical resection of hepatic and pulmonary metastases from colorectal carcinoma. J Am Coll Surg. 2006 Mar; 202 (3): 468–75.
47. Kobayashi K., Kawamura M., Ishihara T. Surgical treatment for both pulmonary and hepatic metastases from colorectal cancer. J Thorac Cardiovasc Surg. 1999 Dec; 118 (6): 1090–6.
48. Miller G., Biernacki P., Kemeny N.E., Gonen M., Downey R., Jarnagin W.R., D’Angelica M., Fong Y., Blumgart L.H., DeMatteo R.P. Outcomes after resection of synchronous or metachronous hepatic and pulmonary colorectal metastases. J Am Coll Surg. 2007 Aug; 205 (2): 231–8.
49. Yano T., Fukuyama Y., Yokoyama H., Tanaka Y., Miyagi J., Kuninaka S., Asoh H., Ichinose Y. Failure in resection of multiple pulmonary metastases from colorectal cancer. J Am Coll Surg. 1997 Aug; 185 (2): 120–2.
50. Deschoolmeeter V., Baay M., Specenier P., Lardon F., Jan B., Vermorken J. A review of the most promising biomarkers in colorectal cancer: one step closer to targeted therapy. Oncologist. 2010; 15 (7): 699–731. doi: 10.1634/theoncologist.2010 0025.
51. Padilla-Valverde D. Departamento de especialidades Médico quirúrgicas [Doctoral Tesis]. Universidad de Córdoba, 2001.
52. Demmy T.L., Dunn K.B. Surgical and nonsurgical therapy for lung metastasis: indications and outcomes. Surg Oncol Clin N Am. 2007 Jul; 16 (3): 579–605.
53. Rena O., Casadio C., Viano F., Cristofori R., Ruffini E., Filosso P.L., Maggi G. Pulmonary resection for metastases from colorectal cancer: fac tors influencing prognosis. Twenty year experience. Eur J Cardiothorac Surg. 2002 May; 21 (5): 906–12.
54. Renehan A.G., Egger M., Saunders M.P., O’Dwyer S.T. Impact on survival of intensive follow up after curative resection for colorectal cancer: systematic review and meta analysis of randomised trials. BMJ. 2002 Apr 6; 324 (7341): 813.
55. Rex D.K., Kahi C.J., Levin B., Smith R.A., Bond J.H., Brooks D., Burt R.W., Byers T., Fletcher R.H., Hyman N., Johnson D., Kirk L., Lieber-man D.A., Levin T.R., O’Brien M.J., Simmang C., Thorson A.G., Winawer S.J. Guidelines for colonoscopy surveillance after cancer resection: a consensus update by the American Cancer Society and US Multi Society Task Force on Colorectal Cancer. CA Cancer J Clin. 2006 May Jun; 56 (3): 160–7; quiz 185 6.
56. Tamura M., Oda M., Tsunezuka Y., Matsumoto I., Kawakami K., Wanatabe G. Vascular endothelial growth factor expression in metastatic pulmonary tumor from colorectal carcinoma: utility as a prognostic factor. J Thorac Cardiovasc Surg. 2004 Oct; 128 (4): 517–22.
57. Loehe F., Kobinger S., Hatz R.A., Helmberger T., Loehrs U., Fuerst H. Value of systematic mediastinal lymph node dissection during pulmo nary metastasectomy. Ann Thorac Surg. 2001 Jul; 72 (1): 225–9.
58. Milleron B., Capron F., Calais G., Mangiapan G., Rosencher L., Wdowick A. Pneumologie. Encycl. Méd. Chir. 1996; 6 002 G 70.
59. Mongil Poce R., Pagés Navarrete C., Ruiz Navarrete J.A., Roca Fernández J., Arrabal Sánchez R., Benítez Doménech A., Fernández de Rota Avecilla A., Fernández Bermúdez J.L. Survival analysis of resection of lung metastases from colorectal cancer. Arch Bronconeumol. 2009 May; 45 (5): 235–9. doi: 10.1016/j.arbres.2008.11.008.
60. Greelish J.P., Friedberg J.S. Secondary pulmonary malignancy. Surg Clin North Am 2000; 80 (2): 633–657.
61. Ахмедов Б.Б., Аллахвердиев А.К., Давыдов М.М., Полоцкий Б.Е. Опыт хирургического лечения легочных метастазов колоректального рака. Российский биотерапевтический журнал. 2006; 15 (1): 7–8.
62. Ninomiya N., Nakayima J., Tanaka M., Takenchi E., Murakawa T., Fukami T. Effects of lung metastasectomy on respiratory function. Jpn J Thorac Cardiovasc Surg. 2001 Jan; 49 (1): 17–20.
63. Landreneau R.J., Mack M.J., Keenan R.J., Hazelrigg S.R., Dow-ling R.D., Ferson P.F. Strategic planning for video assisted thoracic surgery. Ann Thorac Surg. 1993 Sep; 56 (3): 615–9.
64. Nakajima J., Murakawa T., Fukami T., Takamoto S. Is thoraco scopic surgery justified to treat pulmonary metastasis from colorectal cancer? Interact Cardiovasc Thorac Surg. 2008 Apr; 7 (2): 212–6; discus sion 216–7.
65. Cerfolio R.J., McCarty T., Bryant A.S. Non imaged pulmonary nodules discovered during thoracotomy for metastasectomy by lung palpa tion. Eur J Cardiothorac Surg. 2009 May; 35 (5): 786–91; discussion 791. doi: 10.1016/j.ejcts.2009.01.012.
66. Roth J.A., Pass H.I., Wesley M.N., White D., Putnam J.B., Seipp C. Comparison of median sternotomy and thoracotomy for resection of pul monary metastases in patients with adult soft tissue sarcomas. Ann Thorac Surg. 1986 Aug; 42 (2): 134–8.
67. Rama N., Monteiro A., Bernardo J.E., Eugenio L., Natunes M. Lung metastases from colorectal cancer: surgical resection and prognostic factors. Eur J Cardiothorac Surg. 2009 Mar; 35 (3): 444–9. doi: 10.1016/j. ejcts.2008.10.047
68. Kim A.W., Faber L.P., Warren W.H., Saclarides T.J., Carhill A.A., Basu S., Choh M.S., Liptay M.J. Repeat pulmonary resection for metachro nous colorectal carcinoma is beneficial. Surgery. 2008 Oct; 144 (4): 712–7; discussion 717–8. doi: 10.1016/j.surg.2008.07.007.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Читайте также:

