Высший оксид с хлором
Оксидами или окислами называют соединения различных элементов с кислородом. Почти все элементы образуют такие соединения. Хлор, как и другие галогены, характеризуется в таких соединениях положительной степенью окисления. Все оксиды хлора являются чрезвычайно неустойчивыми веществами, что характерно для окислов всех галогенов. Известно четыре вещества, в молекулах которых содержатся хлор и кислород.
- Газообразное соединение от желтого до красноватого цвета с характерным запахом (напоминает запах газа Cl2) — оксид хлора (I). Формула химическая Cl2O. Температура плавления минус 116 °C, температура кипения плюс 2 °C. При нормальных условиях его плотность равняется 3,22 кг/м³.
- Желтый или желто-оранжевый газ с характерным запахом — оксид хлора (IV). Формула химическая ClO2. Температура плавления минус 59 °C, температура кипения плюс 11 °C.
- Красно-коричневая жидкость — оксид хлора (VI). Формула химическая Cl2O6. Температура плавления плюс 3,5 °C, температура кипения плюс 203 °C.
- Бесцветная маслянистая жидкость — оксид хлора (VII). Формула химическая Cl2O7. Температура плавления минус 91,5 °C, температура кипения плюс 80 °C.
Оксид хлора со степенью окисления +1 является ангидридом слабой одноосновной хлорноватистой кислоты (HClO). Получают его по методу Пелуза взаимодействием оксида ртути с газообразным хлором по одному из уравнений реакций: 2Cl2 + 2HgO → Cl2O + Hg2OCl2 или 2Cl2 + HgO → Cl2O + HgCl2. Условия протекания этих реакций разные. Оксид хлора (I) конденсируют при температуре минус 60 оС, потому что при более высокой температуре он разлагается, взрываясь, и в концентрированном виде является взрывоопасным. Водный раствор Cl2O получают при хлорировании в воде карбонатов щелочноземельных или щелочных металлов. Оксид хорошо растворяется в воде, при этом образуется хлорноватистая кислота: Cl2O + H2O ↔ 2HClO. Кроме того, он также растворяется в углероде четыреххлористом.
Оксид хлора со степенью окисления +4 иначе называется диоксид. Это вещество растворяется в воде, серной и уксусной кислотах, ацетонитриле, углероде четыреххлористом, а также в других органических растворителях, с увеличением полярности которых растворимость его возрастает. В лабораторных условиях его получают взаимодействием хлората калия со щавелевой кислотой: 2KClO3 + H2C2O4 → K2CO3 + 2ClO2 + CO2 + H2O. Так как оксид хлора (IV) является взрывоопасным веществом, то его в растворе хранить нельзя. Для этих целей используется силикагель, на поверхности которого в адсорбированном виде ClO2 может храниться долго, одновременно удается избавиться от загрязняющих его примесей хлора, так как он силикагелем не поглощается. В промышленных условиях ClO2 получают восстановлением диоксидом серы, в присутствии серной кислоты, хлората натрия: 2NaClO3 + SO2 + H2SO4 → 2NaHSO4 + 2ClO2. Применяется в качестве отбеливателя, например, бумаги или целлюлозы и прочее, а также для стерилизации и дезинфекции различных материалов.
Оксид хлора со степенью окисления +6, при плавлении распадается по уравнению реакции: Cl2O6 → 2ClO3. Получают оксид хлора (VI) окисляя озоном диоксид: 2O3 + 2ClO2 → 2O2 + Cl2O6. Этот окисел способен взаимодействовать растворами щелочей и с водой. При этом протекают реакции диспропорционирования. Например, при взаимодействии с гидроокисью калия: 2KOH + Cl2O6 → KClO3 + KClO4 + H2O, в результате получаются хлорат и перхлорат калия.
Высший оксид хлора называют еще хлорный ангидрид или дихлорогептаоксид является сильным окислителем. Он способен от удара или при нагревании взрываться. Однако это вещество более устойчиво, чем окислы со степенью окисления +1 и +4. Распад его до хлора и кислорода ускоряется из-за присутствия низших окислов и с повышением температуры от 60 до 70 оС. Оксид хлора (VII) способен медленно растворяться в холодной воде, в результате реакции образуется хлорная кислота: H2O + Cl2O7 → 2HClO4. Получают дихлорогептаоксид, осторожно нагревая хлорную кислоту с фосфорным ангидридом: P4O10 + 2HClO4 → Cl2O7 + H2P4O11. Также Cl2O7 можно получить, используя вместо фосфорного ангидрида олеум.
Раздел неорганической химии, который изучает оксиды галогенов, включая оксиды хлора, в последние годы стал развиваться активно, так как эти соединения являются энергоемкими. Они способны в камерах сгорания реактивных двигателей отдавать энергию мгновенно, а в химических источниках тока скорость ее отдачи может регулироваться. Другая причина интереса — это возможность синтеза новых групп неорганических соединений, например, оксид хлора (VII) является родоначальником перхлоратов.
ХЛОРА ОКСИДЫ
Все Х. о. имеют резкий запах, термически и фотохимически нестабильны, склонны к взрывному распаду, имеют положит. 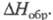
Монооксид [оксид С1(I), дихлороксид, гемиоксид] Cl2O — желто-оранжевый газ со слабым зеленоватым оттенком, в жидком состоянии — красно-коричневый; длина связи С1 — О 0,1700 нм, угол OClO 111°, μ 2,60∙10 −30 Кл∙м (табл.); уравнение температурной зависимости давления пара lgp (мм рт. ст.) = 7,87 — 1373/Т (173–288 К); раств. в воде с образованием HClO, растворимость (г в 100 г H2O при 0 °C): 33,6 (2,66 кПа), 52,4 (6,65 кПа). При 60–100 °C термич. распад Cl2O завершается за 12–24 ч, выше 110 °C через неск. мин происходит взрыв, освещение ускоряет распад и повышает вероятность взрыва. С хлоридами образует оксихлориды, напр., с TlCl4, TaCl5 и AsCl3 дает соотв. Т1OCl2, TaOCl3 и AsO2Cl. С NO2 образует смесь NO2C1 и NO3C1, с N2O5 — чистый NO3C1. Фторированием Cl2O с помощью AgF2 можно получить C1OF3, а реакцией с AsF5 или SbF5 — соли хлорила ClO + 2MF − 6. Аналогично реагируют с MF5 (где М — As и Sb) ClO2 и Cl2O6. С насыщ. орг. соединениями Cl2O ведет себя как хлорирующий агент, подобный хлору. Получают Cl2O пропусканием Cl2, разбавленного N2, над HgO или реакцией Cl2 с влажным Na2CO3.
СВОЙСТВА ОКСИДОВ ХЛОРА
таблица в процессе добавления
* Расчетная. ** 2,38 г/см 3 при −160 °C.
Диоксид ClO2 — желтый газ, в жидком состоянии — ярко-красный, в твердом — красновато-желтый; длина связи С — О 0,1475 нм, угол OClO 117 °C; уравнение температурной зависимости давления пара lgp (мм рт. ст.) = 7,7427 -- 1275,1/T (226–312 К); растворимость в воде 26,1 г/л (25 °C, 20,68 кПа), раств. в CCl4, HClO4, CH3COOH. В индивидуальном состоянии взрывоопасен, при 30–50 °C распад идет с измеримой скоростью, выше 50 С после периода индукции взрывается. В щелочной среде ClO2 диспропорционирует на 
и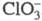
, в присутствии H2O2 образуется 
и выделяется O2. Восстанавливается иодидами, арсенидами, PbO, H2SO3, аминами до хлорит-иона. СNO2 и N2O5 образует NO3C1, с NOC1 -NO2C1. Фторируется посредством AgF2, BrF3 или разб. F2 до C1O2F. Получают ClO2 действием восстановителей (SO2, NO2, метанол, орг. пероксиды) на подкисленный раствор хлората щелочного металла, при нагр. смеси хлората с влажной щавелевой кислотой, действием Cl2 на хлориты. В отличие от остальных Х. о. ClO2 — продукт пром. производства, его используют вместо Cl2 как экологически более безопасный продукт для отбеливания древесной пульпы, целлюлозы, синтетич. волокон, для подготовки питьевой и технол. воды, обеззараживания сточных вод. Раздражает слизистые оболочки, вызывает кашель, рвоту и др.; ПДК в воздухе рабочей зоны 0,1 мг/м 3 , ЛД50 140 мг/кг (крысы, внутрижелудочно).
Перхлорат хлора (цихлоротетраоксид) Cl2O4, или ClOClO3 — светло-желтая жидкость, в кристаллич. состоянии почти бесцветен ( см. перхлораты).
Триоксид (дихлорогексаоксид) Cl2O6 — ярко-красная жидкость, в твердом состоянии — оранжевый, при охлаждении окраска ослабевает. В газе и жидкости молекулы имеют строение O2Cl — О — ClO3, в кристаллах - 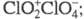
кристаллы моноклинной сингонии (пространств. группа
, z = 4); давление пара 39,9 Па (0 °C), 133 Па (19 °C). Медленно разлагается уже при 0–10 °C на ClO2 и O2, выше 20 °C в продуктах распада появляется Cl2; с водой реагирует со вспышкой, продукты гидролиза — HClO3 и HClO4. С хлоридами, бромидами, нитратами образует перхлораты, напр. с NOC1 дает NOC1O4, с N2O5 — NO2C1O4, с AlCl3 -ClO2[А1(ClO4)4], с FeCl3 — ClO2[Fe2(ClO4)7]. При нагр. в вакууме такие комплексы отщепляют Cl2O6 и превращаются в несольватированные перхлораты А1(ClO4)3, Fe(ClO4)3. Получают Cl2O6 реакцией озона с ClO2 или действием F2 на хлораты металлов. Применяют для синтеза безводных перхлоратов в лаб. условиях.
Оксид Cl(VII) (хлорный ангидрид, дихлорогептаоксид) Cl2O7 — бесцв. подвижная жидкость, чувствителен к удару и трению. Молекула имеет строение O3С1 — О — ClO3, длина связи С1 — О 0,1709 нм, в группах ClO3 — 0,1405 нм, угол ClOС1 118,6°, OClO 115,2°, μ 2,40∙10 −30 Кл∙м; кристаллы моноклинные (пространств. группа C2/с); уравнение температурной зависимости давления пара lgp( мм рт. ст.) = 7,796-1770/Т. Неограниченно раств. в CCl4, хорошо раств. в HClO4, POCl3 и т. п. С водой не смешивается, на границе раздела фаз реагирует с образованием HClO4, реакция сильно экзотермична 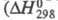
реакции −211 кДж/моль); разогревание слоя Cl2O7 может привести к взрыву. Распад Cl2O7 в газе на хлор и кислород идет с измеримой скоростью при 100–120 °C, но при давлении Cl2O7 выше 13,3 кПа приобретает взрывной характер. Жидкий Cl2O7 устойчив до 60–70 °C, примесь низших Х. о. ускоряет его распад. Для жидкого Cl2O7 характерны реакции с образованием ковалентных соед. с группой — ClO3. С NH3 в CCl4 образует NH4HNC1O3 и NH4C1O4, с алкиламинами — соотв. RHNC1O3 и R2NC1O3, с SbF5 — SbOF3 и FC1O3, с N2O5 в CCl4 NO2C1O4. Используя Cl2O7, можно синтезировать орг. перхлораты из спиртов. Получают Cl2O7 действием P2O5 или олеума на хлорную кислоту или электролизом раствора HClO4 на Pt-электродах ниже 0 °C (Cl2O7 накапливается в анодном пространстве). Чистый Cl2O7 можно получить также при нагр. в вакууме некоторых перхлоратов, напр. Nb(ClO4)5, MoO2(ClO4)2.
Известен ряд хлоркислородных свободных радикалов, полученных в разл. низкотемпературных матрицах и исследованных преим. методом ЭПР,- ClO3, ClOO, ClClO, а также малостабильный сесквиоксид Cl2O3, распадающийся при −50 — 0 °C и имеющий, вероятно, структуру хлората хлора ClOClO2. Термически устойчивый радикал ClO (длина связи С1 — О 0,1569 нм, 
4,133 Кл∙м, 
101,6 кДж/ моль) — промежут. продукт окисления углеводородов хлорной кислотой и Х. о., распада всех Х. о. и др. хлоркислородных соед., а также реакции озона с атомарным хлором в стратосфере.
Лит.: Никитин И. В., Химия кислородных соединений галогенов, М., 1986.
Кислородные соединения хлора
| Свойство | Cl2O | ClO2 | Cl2O6 | Cl2O7 |
| Степень окисления | +1 | +4 | +6 | +7 |
| Температура плавления, ºС | –120,6 | –59 | 3,5 | –91,5 |
| Температура кипения, ºС | ||||
| Внешний вид | Темно-желтый газ | Желто-зеленый газ | Красная жидкость | Бесцв. жидкость |
Оксид хлора (I) Cl2O – темно-желтый газ с резким запахом. Ядовит. Молекула Cl2O имеет угловую форму (валентный угол 111º), длина связи O – Cl 170 пм. Получают оксид хлора (I) взаимодействием газообразного хлора с оксидом ртути (II) или оксидом висмута (III):
Оксид хлора (I) неустойчивое соединение, при небольшом нагревании, при соприкосновении с органическими веществами разлагается со взрывом на Cl2 и О2. Cl2O хорошо растворим в воде (при температуре 0 ºС в одном объеме воды растворяется 200 объемов Cl2O). При растворении в воде образуется хлорноватистая кислота HClO:
ClO2 – желто-зеленый газ с резким запахом. Ядовит. Молекула ClO2 имеет угловую форму (валентный угол OClO 117º), длина связи O – Cl 149 пм. Молекула содержит нечетное число электронов и поэтому парамагнитна.
Оксид хлора (IV) ClO2 – единственный оксид галогенов, который получают в промышленности путем пропускания оксида серы (IV) через подкисленный раствор хлората натрия NaClO3:
Прим. Образующийся газ в реакторе разбавляют азотом, чтобы избежать взрыва. Используется как отбеливающее средство и для обеззараживания воды.
В лабораторных условиях оксид хлора (IV) ClO2 получают взаимодействием хлората калия с щавелевой кислотой в присутствии концентрированной серной кислоты:
Оксид хлора (IV) – сильный окислитель. Взаимодействует с водой (медленно), со щелочью (быстро), при этом протекают реакции диспропорционирования:
Оксид хлора (IV) ClO2 взрывоопасен, взрывается от механического воздействия, при нагревании до 100 ºС, при введении в систему восстановителя.
Оксид хлора (VI) Cl2O6 (ClO3) – вязкая красная жидкость. При обычных условиях Cl2O6 постепенно разлагается на ClO2 и О2. В газовой фазе происходит распад:
Получают окислением ClO2 озоном:
Оксид хлора (VI) – сильный окислитель. Взаимодействует с водой, со щелочью, при этом протекают реакции диспропорционирования:
Оксид хлора (VI) взрывается при соприкосновении с органическими веществами.
Оксид хлора (VII) Cl2О7 – маслянистая бесцветная жидкость. Очень взрывоопасен. Получают путем взаимодействия оксида фосфора (V) с концентрированной хлорной кислотой:
При растворении Cl2О7 в воде образуется хлорная кислота HClO4 (ангидрид хлорной кислоты):
| | | следующая лекция ==> | |
| Сравнительная характеристика галогенводородов | | | Соединения хлора с положительной степенью окисления |
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Содержание статьи
- Как получить оксиды хлора
- Как получить хлорид меди
- Как получить хлорид магния
Хлор образует с кислородом целый ряд оксидов, общее число которых составляет целых пять видов. Все их можно описать общей формулой ClxOy. В них валентность хлора меняется от 1 до 7.
Валентность разных оксидов хлора различна: Cl2O - 1, Cl2O3 - 3, ClO2 - 4, Cl2O6 - 6, Cl2O7 - 7.
Оксид хлора(I) применяют для производства гипохлоритов, которые являются сильными отбеливающими и обеззараживающими агентами.
Оксид хлора(II) активно применяют для отбеливания муки, целлюлозы, бумаги и других вещей, а также для стерилизации и дезинфекции.
Оксид хлора(VI) и оксид хлора(VII) применяют для синтеза органических соединений.
Получение Cl2O
Данный оксид на крупнотоннажных производствах получают двумя способами.
1. По методу Пелуза. Проводят реакцию между газообразным хлором и оксидом ртути. В зависимости от условий может образоваться иное соединение ртути, однако целевой продукт остается. После этого газообразный оксид хлора сжижают при температуре -60 градусов Цельсия.
Уравнения реакции, описывающие метод Пелуза:
2HgO + Cl2 = Hg2OCl2 + Cl2O
HgO + 2Cl2 = HgCl2 + Cl2O
2. Взаимодействие хлора с водным раствором карбоната натрия по реакции:
2Cl2 + 2Na2CO3 + H2O = 2NaHCO3 + Cl2O + 2NaCl
Карбонат натрия может быть заменен другими карбонатами щелочных или щелочноземельных металлов.
Получение ClO2
Единственный промышленный метод получения диоксида хлора основан на взаимодействии хлората натрия и диоксида серы в кислой среде. Результатом такого взаимодействия становится реакция:
2NaClO3 + SO2 + H2SO4 = 2NaHSO4 + ClO2
Получение Cl2O6
В промышленности Cl2O6 получают взаимодействием диоксида хлора с озоном:
2ClO2 + 2O3 = 2O2 + Cl2O6
Получение Cl2O7
1. Осторожное нагревание хлорной кислоты с фосфорным ангидридом приводит к отделению маслянистой жидкости, которая является оксидом хлора (VII). Весь процесс описывается реакцией:
2HClO4 + P4O10 = H2P4O11 + Cl2O7
2. Второй способ получения данного оксида связан с электричеством. Если проводить электролиз раствора хлорной кислоты, то в анодном пространстве можно обнаружить Cl2O7.
3. Нагревание в вакууме перхлоратов переходных металлов приводит к образованию оксида хлора (VII). Наиболее часто нагревают перхлорат ниобия либо молибдена.
Физические свойства оксидов
Cl2O: при стандартных условиях буровато-желтый газ с запахом хлора, а при температуре ниже +2 градусов Цельсия золотисто-красная жидкость. Взрывоопасен в больших концентрациях.
ClO2: при стандартных условиях – газ с характерным запахом красно-желтого цвета, при температуре ниже +10 градусов Цельсия – красно-коричневая жидкость. Взрывается на свету, в присутствии восстановителей и при нагревании.
Cl2O6: неустойчивый газ, который начинает разлагаться при температуре от 0 до +10 градусов Цельсия с образованием диоксида хлора, при 20 градусах Цельсия образуется хлор. Ввиду образования диоксида хлора – взрывоопасен.
Cl2O7: бесцветная маслянистая жидкость, которая при нагревании выше 120 градусов Цельсия взрывается. Может детонировать от удара.
ХЛОРА ОКСИДЫ. Все хлора оксиды имеют резкий запах, термически и фотохимически нестабильны, склонны к взрывному распаду, имеют положит. 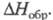
Монооксид [оксид С1(I), дихлороксид, гемиоксид] С12О - желто-оранжевый газ со слабым зеленоватым оттенком, в жидком состоянии - красно-коричневый; длина связи С1 — О 0,1700 нм, угол ОСlO 111°,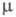
2,60 x 10 -30 Кл x м (табл.); ур-ние температурной зависимости давления пара lgp (мм рт. ст.) = 7,87 - 1373/Т (173-288 К); раств. в воде с образованием НСЮ, р-римость (г в 100 г Н2О при 0 °С): 33,6 (2,66 кПа), 52,4 (6,65 кПа). При 60-100 °С термич. распад С12О завершается за 12-24 ч, выше 110 °С через неск. мин происходит взрыв, освещение ускоряет распад и повышает вероятность взрыва. С хлоридами образует оксихлориды, напр., с Т1С14, ТаС15 и AsCl3 дает соотв. Т1ОС12, ТаОС13 и AsO2Cl. С NO2 образует смесь NO2C1 и NO3C1, с N2O5 -чистый NO3C1. Фторированием С12О с помощью AgF2 можно получить C1OF3, а р-цией с AsF5 или SbF5 - соли хлорила ClO + 2MF - 6. Аналогично реагируют с MF5 (где М - As и Sb) С1О2 и С12О6. С насыщ. орг. соединениями С12О ведет себя как хлорирующий агент, подобный хлору. Получают Сl2О пропусканием С12, разбавленного N2, над HgO или р-цией С12 с влажным Na2CO3.
*Расчетная. **2,38 г/см 3 при -160 °С.
Диоксид С1О2 - желтый газ, в жидком состоянии -ярко-красный, в твердом - красновато-желтый; длина связи С — О 0,1475 нм, угол ОСlO 117 °С; ур-ние температурной зависимости давления пара lgp (мм рт. ст.) = 7,7427 -- 1275,1/T (226-312 К); р-римость в воде 26,1 г/л (25 °С, 20,68 кПа), раств. в ССl4, НС1О4, СН3СООН. В индивидуальном состоянии взрывоопасен, при 30-50 °С распад идет с измеримой скоростью, выше 50 С после периода индукции взрывается. В щелочной среде С1О2 диспропорционирует на 
и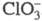
, в присут. Н2О2 образуется 
и выделяется О2. Восстанавливается иодидами, арсенидами, PbO, H2SO3, аминами до хлорит-иона. СNO2 и N2O5 образует NO3C1, с NOC1 -NO2C1. Фторируется посредством AgF2, BrF3 или разб. F2 до C1O2F. Получают СlO2 действием восстановителей (SO2, NO2, метанол, орг. пероксиды) на подкисленный р-р хлората щелочного металла, при нагр. смеси хлората с влажной щавелевой к-той, действием С12 на хлориты. В отличие от остальных хлора оксидов С1О2 - продукт пром. произ-ва, его используют вместо С12 как экологически более безопасный продукт для отбеливания древесной пульпы, целлюлозы, синтетич. волокон, для подготовки питьевой и технол. воды, обеззараживания сточных вод. Раздражает слизистые оболочки, вызывает кашель, рвоту и др.; ПДК в воздухе рабочей зоны 0,1 мг/м 3 , ЛД50 140 мг/кг (крысы, внутрижелудочно).
Перхлорат хлора (цихлоротетраоксид) С12О4, или СlOС1О3 - светло-желтая жидкость, в кристаллич. состоянии почти бесцветен (см. Перхлораты).
Триоксид (дихлорогексаоксид) С12О6 - ярко-красная жидкость, в твердом состоянии - оранжевый, при охлаждении окраска ослабевает. В газе и жидкости молекулы имеют строение О2С1 — О — С1О3, в кристаллах - 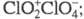
кристаллы моноклинной сингонии (пространств. группа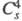
, z = 4); давление пара 39,9 Па (0 °С), 133 Па (19 °С). Медленно разлагается уже при 0-10 °С на С1О2 и О2, выше 20 °С в продуктах распада появляется С12; с водой реагирует со вспышкой, продукты гидролиза - НС1О3 и НС1О4. С хлоридами, бромидами, нитратами образует перхлораты, напр. с NOC1 дает NOC1O4, с N2O5 - NO2C1O4, с А1С13 -СlO2[А1(С1О4)4], с FeCl3 - ClO2[Fe2(ClO4)7]. При нагр. в вакууме такие комплексы отщепляют С12О6 и превращаются в несольватированные перхлораты А1(С1О4)3, Fe(ClO4)3. Получают С12О6 р-цией озона с С1О2 или действием F2 на хлораты металлов. Применяют для синтеза безводных перхлоратов в лаб. условиях.
Оксид Cl(VII) (хлорный ангидрид, дихлорогептаоксид) С12О7 - бесцв. подвижная жидкость, чувствителен к удару и трению. Молекула имеет строение О3С1 — О — ClO3, длина связи С1 — О 0,1709 нм, в группах С1О3 - 0,1405 нм, угол СlOС1 118,6°, ОСlO 115,2°, 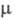
2,40 x 10 -30 Кл x м; кристаллы моноклинные (пространств. группа С2/с); ур-ние температурной зависимости давления пара lgp(мм рт. ст.) = 7,796-1770/Т. Неограниченно раств. в СCl4, хорошо раств. в НС1О4, РОС13 и т. п. С водой не смешивается, на границе раздела фаз реагирует с образованием НСlO4, р-ция сильно экзотермична 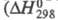
р-ции -211 кДж/моль); разогревание слоя С12О7 может привести к взрыву. Распад С12О7 в газе на хлор и кислород идет с измеримой скоростью при 100-120 °С, но при давлении С12О7 выше 13,3 кПа приобретает взрывной характер. Жидкий С12О7 устойчив до 60-70 °С, примесь низших хлора оксидов ускоряет его распад. Для жидкого С12О7 характерны р-ции с образованием ковалентных соед. с группой — С1О3. С NH3 в ССl4 образует NH4HNC1O3 и NH4C1O4, с алкиламинами -соотв. RHNC1O3 и R2NC1O3, с SbF5 - SbOF3 и FC1O3, с N2O5 в ССl4 NO2C1O4. Используя С12О7, можно синтезировать орг. перхлораты из спиртов. Получают С12О7 действием Р2О5 или олеума на хлорную к-ту или электролизом р-ра НС1О4 на Pt-электродах ниже 0 °С (С12О7 накапливается в анодном пространстве). Чистый С12О7 можно получить также при нагр. в вакууме нек-рых перхлоратов, напр. Nb(ClO4)5, МоО2(СlO4)2.
Известен ряд хлоркислородных свободных радикалов, полученных в разл. низкотемпературных матрицах и исследованных преим. методом ЭПР,- СlО3, СlОО, СlСlО, а также малостабильный сесквиоксид Сl2О3, распадающийся при -50 - 0 °С и имеющий, вероятно, структуру хлората хлора СlOСlO2. Термически устойчивый радикал СlO (длина связи С1 — О 0,1569 нм, 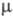
4,133 Кл x м, 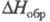
101,6 кДж/ моль) -промежут. продукт окисления углеводородов хлорной к-той и хлора оксидами, распада всех хлора оксидов и др. хлоркислородных соед., а также р-ции озона с атомарным хлором в стратосфере.
Лит.: Никитин И. В., Химия кислородных соединений галогенов, М., 1986.
Непосредственно с кислородом галогены не соединяются. Кислородосодержащие соединения получаются косвенным путем. В основе получения кислородных соединений галогенов лежат реакции с водой и щелочами. Из кислородсодержащих соединений галогенов наиболее устойчивы соли кислородных кислот, наименее— оксиды и кислоты. Во всех кислородсодержащих соединениях галогены, кроме фтора, проявляют положительную степень окисления, достигающую семи.
Фториды кислорода - соединения, содержащие связь О—F, например дифторид OF2, монофторид (диоксофторид) O2F2, нитрат фтора FNO3, перхлорат фтора FClO4. Фтор с кислородом образует в тлеющем разряде смесь стабильных радикалов F—O—O и атомов фтора; при конденсации этой смеси при —96°С образуются высшие фториды кислорода — O2F2, O3F2 и др., стабильные лишь при низких температурах.
Все фториды кислорода обладают сильной окислительной способностью.
Оксиды хлора — неорганические химические соединения хлора и кислорода, общей формулой: ClхOу.
Оксид хлора (I), гемоксид хлора, ангидрид хлорноватистой кислоты — соединение хлора в степени окисления+1 с кислородом, жёлто-коричневый газ.
Получают взаимодействием газообразного хлора с оксидом ртути (метод Пелуза). Реакция в зависимости от условий может протекать двумя различными путями, но во всех случаях с образованием искомого оксида хлора:
Образующийся Cl2O конденсируют при температуре −60 °C. При более высокой температуре соединение разлагается со взрывом.
Другой крупнотоннажный способ - реакция газообразного хлора с влажным Na2CO3 в башенных или во вращающихся трубчатых реакторах:
Также водный раствор может быть получен хлорированием карбонатов щелочных или щёлочноземельных металлов в воде.
В нормальных условиях представляет собой буровато-жёлтый газ с характерным запахом, напоминающим запах хлора. При температурах ниже 2 °C — жидкость золотисто-красного цвета. Ядовит: поражает дыхательные пути. Самопроизвольно медленно разлагается:
При больших концентрациях взрывоопасен. Плотность при нормальных условиях 3,22 кг/м³. Растворяется в четырёххлористом углероде. Хорошо растворим в воде с образованием слабой хлорноватистой кислоты:
Диоксид хлора — неорганическое химическое соединение хлора и кислорода, формула: ClO2.
В лаборатории диоксид хлора получают по реакции хлората калия с щавелевой кислотой:
Из-за взрывоопасности диоксид хлора невозможно хранить в виде жидкости. Однако адсорбирование на поверхности силикагеля позволяет хранить диоксид хлора при пониженной температуре достаточно долго, а также избавиться от примесей хлора, силикагелем не поглощающегося.
Промышленный метод получения ClO2 основан на реакции восстановления хлората натрия диоксидом серы:
Кислотный оксид. При растворении в воде образуются хлористая и хлорноватая кислоты (реакция диспропорционирования). Разбавленные растворы устойчивы в темноте, на свету медленно разлагаются:
Образующаяся хлористая кислота очень неустойчива и разлагается:
ClO2 реагирует со многими органическими соединениями и выступает окислителем средней силы. Большинство реакций с участием ClO2 протекают по механизму одноэлектронного окисления с образованием органических катион-радикалов и хлорит-иона на первой стадии реакции, но возможно протекание и других реакций, в частности, реакции отрыва атома водорода.
Оксид хлора(VI) получают окислением диоксида хлора озоном:
Оксид хлора(VI) является нестойким веществом и начинает разлагаться уже при температурах 0-10 °C
При температурах выше 20 °C в продуктах распада появляется хлор.
С водой реагирует бурно — со вспышкой, при этом продуктами реакции являются хлорноватая и хлорная кислоты:
Взаимодействует с водой и щелочами в растворе, при этом проходит реакция диспропорционирования:
Проявляет сильные окислительные свойства:
Окси́д хло́ра(VII) (дихлорогептаоксид) Cl2O7, (хлорный ангидрид) — кислотный оксид. Высший оксид хлора, в котором он проявляет степень окисления +7.
Молекула Cl2O7 имеет строение О3Cl—О—ClO3 (dCl—О = 0,1709 нм, в группах ClО3 — 0,1405 нм, угол ClOCl = 118,6°, ОClO 115,2°) c пространственной симметрией C2, молекула полярна (μ = 2,40·10 −30 Кл·м).
Хлорный ангидрид представляет собой бесцветную маслянистую жидкость. Cl2O7 взрывается при нагревании выше 120 °C и от удара, однако он более устойчив, чем оксид и диоксид хлора. Жидкий Cl2О7 устойчив до 60—70 °C, но примесь низших оксидов хлора существенно ускоряет его распад:
Медленно растворяется в холодной воде, образуя хлорную кислоту:
Хлорный ангидрид является сильным окислителем.
Получают Cl2О7 при осторожном нагревании хлорной кислоты с фосфорным ангидридом или олеумом:
Оксид хлора(VII) получают также электролизом раствора НClО4 на платиновых электродах ниже 0 °C (Cl2O7накапливается в анодном пространстве). Чистый Cl2O7 можно синтезировать также при нагревании в вакууме некоторых перхлоратов, например, Nb(ClO4)5 или МоО2(ClO4)2.
Оксид брома(I) — неорганическое соединение брома и кислорода с формулой Br2O, неустойчивые тёмно-коричневые кристаллы при температуре ниже -18°С.
· Действие брома на оксид ртути:
· Разложение в вакууме диоксида брома:
Физические и химические свойства:
· Оксид брома(I) образует неустойчивые тёмно-коричневые кристаллы при температуре ниже -18°С, которые плавятся с разложением.
· Является сильным окислителем:
· Реагирует с щелочами:
Диоксид брома (оксид брома(IV)) — неорганическое соединение брома и кислорода с формулой BrO2, неустойчивые светло-жёлтое твёрдое вещество, существующее при температурах ниже −40°С.
Получают действием озона на бром при низкой температуре:
Физические свойства.
Диоксид брома образует неустойчивые светло-жёлтое твёрдое вещество, существующее при температурах ниже −40°С.
Молекула имеет строение BrOBrO3.
Термически неустойчиво при температуре выше −40°С.
Химические свойства.
· Разлагается при осторожном нагревании в вакууме с образованием оксида брома(I):
· Реагирует с щелочами:
Оксид йода(V), йодноватый ангидрид - белое твердое вещество, единственный термодинамически устойчивый из оксидов галогенов. Твердый оксид I2O5. Может быть получен при осторожном нагревании НIO3 до 200°С, порошок. При нагревании выше 300°С распадается на иод и кислород, проявляет окислительные свойства, в частности используется для поглощения CO в анализе:
49. Кислородсодержащие кислоты хлора – хлорноватистая, хлористая, хлорноватая, хлорная и их соли – получение, свойства.
Хлор образует четыре кислородсодержащие кислоты: хлорнотистую, хлористую, хлорноватую и хлорную.
Хлорноватистая кислота НСlO образуется при взаимодействии хлора с водой, а также ее солей с сильными минеральными кислотами. Она относится к слабым кислотам, очень неустойчива. Состав продуктов реакции ее разложения зависит от условий. При сильном освещении хлорноватистой кислоты, наличии в растворе восстановителя, а также длительном стоянии она разлагается с выделением атомарного кислорода:
НСlO = HСl + O
В присутствии водоотнимающих веществ образуется оксид хлора (I):
2 НСlO = 2 Н2О + Сl2O
Cl2О можно считать ангидридом хлорноватистой кислоты. При нагревании хлорноватистая кислота разлагается с образованием двух кислот — соляной и хлорноватой:
3 НСlO = 2 НСl + НСlO3
Поэтому при взаимодействии хлора с горячим раствором щелочи образуется соли не соляной и хлорноватистой, а соляной и хлорноватой кислот:
6 NаОН + 3 Сl2 = 5 NаСl + NаСlО3 + 3 Н2О
Соли хлорноватистой кислоты — г и п о х л о р и т ы — очень сильные окислители. Они образуются при взаимодействии хлора со щелочами на холоду. Одновременно образуются соли соляной кислоты. Из таких смесей наибольшее распространение получили хлорная известь и жавелевая вода.
Хлорная, или белильная, известь СаОСl2, или СаСl(СlO), образуется при взаимодействии хлора с порошкообразным гидроксидом кальция — пушенкой:
Са(ОН)2 + Сl2 = Cl-O-Ca-Cl + H2O
2 Са(ОН)2 + 2 Сl2 = СаСl2 + Са(ОСl)2 + 2 Н2О
Качество хлорной извести определяется содержанием в ней гипохлорита. Она обладает очень сильными окислительными свойствами и может окислять даже соли марганца до перманганат:
5СаОСl2 +2Mn(NО3)2 +3Са(ОН) =Са(МпO4)2+5СаСl2+2Са(NО3)2+ 3H2O
Под действием углекислого газа, содержащегося в воздухе, она разлагается с выделением хлора:
СаОСl2 + СО2 = СаСО3 + Сl2
СаСl2 + Са(ОСl)2 + 2 СО2 = 2 СаСО3 + 2 Сl2
Хлорная известь применяется как отбеливающее и дезинфицирующее вещество.
Хлористая кислота НСlO2 образуется при действии концентрированной серной кислоты на хлориты щелочных металлов, которые получаются как промежуточные продукты при электролизе растворов хлоридов щелочных металлов в отсутствие диафрагмы между катодным и анодным пространствами. Это слабая, неустойчивая кислота, очень сильный окислитель в кислой среде. При взаимодействии ее с соляной кислотой выделяется хлор:
НСlO2 + 3 НС1 = Сl2 + 2 Н2О
Хлориты натрия используются для получения диоксида хлора, при обеззараживании воды, а также какотбеливаюший агент.
Хлорноватая кислота НСlO3 образуется при действии на ее соли — хлораты — серной кислоты. Это очень неустойчивая кислота, очень сильный окислитель. Может существовать только в разбавленных растворах. При упаривании раствора НСlO3 при низкой температуре в вакууме можно получить вязкий раствор, содержащий около 40 % хлорной кислоты. При более высоком содержании кислоты раствор разлагается со взрывом. Разложение со взрывом происходит и при меньшей концентрации в присутствии восстановителей. В разбавленных растворах хлорная кислота проявляет окислительные свойства, причем реакции протекают вполне спокойно:
НСlO3 + 6 НВr = НСl + 3 Вr2 + 3 Н2О
Соли хлорноватой кислоты — хлораты — образуются при электролизе растворов хлоридов в отсутствие диафрагмы между катодным и анодным пространствами, а также при растворении хлора в горячем растворе щелочей, как показано выше. Образующийся при электролизе хлорат калия (бертолетова соль) слабо растворяется в воде и в виде белого осадка легко отделяется от других солей. Как и кислота, хлораты — довольно сильные окислители:
КСlO3 + 6 НСl = КСl + 3 Сl2 + 3 Н2О
Хлораты применяются для производства взрывчатых веществ, а также получения кислорода в лабораторных условиях и солей хлорной кислоты — п е р х л о р а т о в. При нагревании бертолетовой соли в присутствии диоксида марганца МпО2, играющего роль катализатора, выделяется кислород. Если же нагревать хлорат калия без катализатора, то он разлагается с образованием калиевых солей хлороводородной и хлорной кислот:
2 КСlО3 = 2 КСl + 3 O2
4 КСlO3 = КСl + 3 КСlO4
При обработке перхлоратов концентрированной серной кислотой можно получить хлорную кислоту:
КСlO4 + Н2SO4 = КНSO4 + НСlO4
Это самая сильная кислота. Она наиболее устойчива из всех кислород содержащих кислот хлора, однако безводная кислота при нагревании, встряхивании или контакте с восстановителями может разлагаться со взрывом. Разбавленные растворы хлорной кислоты вполне устойчивы и безопасны в работе. Хлораты калия, рубидия, цезия, аммония и большинства органических оснований плохо растворяются в воде.
В промышленности перхлорат калия получают электролитическим окислением бертолетовой соли:
2 Н+ + 2 е- = Н2 (на катоде)
СlО3- - 2 е- + Н2О = СlO4- + 2 Н+ (на аноде)
50. Бромноватистая, йодноватая, метапериодная, ортопериодная кислоты и соли – их свойства и применения. Применение галогенов и их соединений.
Бромноватистая кислота — сложное неорганическое соединение брома, водорода и кислорода с химической формулой HBrO. Представляет собой слабую кислоту; образует соли — гипобромиты. Получается при реакции брома с водой под действием света:
Неустойчивая кислота. Известна только в водном растворе с концентрацией не выше 30 %. При стоянии разлагается:
Сильный окислитель (E = 1,59 В).
Иодноватая кислота HIO3 — бесцветное кристаллическое вещество, со стеклянным блеском и горьковато-кислым вкусом, устойчивое при обычной температуре. Легко образуется в кристаллическом состоянии в виде двух различных, не переходящих друг в друга форм ромбической сингонии.
Иодноватая кислота хорошо растворима в воде, в концентрированных растворах проявляется её склонность к полимеризации и устанавливается равновесие:
При медленном нагревании она частично плавится при 110 о С, частично образует ангидроиодноватую кислоту HI3O8.
При нагревании HIO3 до 230 °C образуется порошок иодноватого ангидрида, обладающего сильными окислительными свойствами, – I2O5, который растворяется в воде, вновь образуя иодноватую кислоту:
Иодноватая кислота — сильная одноосновная кислота, обладает окислительными свойствами: E 0 (HIO3/I2) = 1,19 В.
Соли иодноватой кислоты называют иодатами. Иодаты разлагаются только выше 400 °C. Они обладают сильными окислительными свойствами. При взаимодействии с иодидами в кислой среде иодаты выделяют элементный иод.
Получают в водных растворах при окислении иода хлором, пероксидом водорода либо дымящей азотной кислотой:
Природное соединение фтора - криолит Na3AlF6 - применяется при получении алюминия. Соединения фтора используются в качестве добавок в зубные пасты для предотвращения заболеваний кариесом.
Хлор широко используется для получения соляной кислоты, в органическом синтезе при производстве пластмасс и синтетических волокон, каучуков, красителей, растворителей и др. Многие хлорсодержащие соединения используют для борьбы с вредителями в сельском хозяйстве. Хлор и его соединения применяются для отбеливания льняных и хлопчатобумажных тканей, бумаги, обеззараживания питьевой воды. Правда, применение хлора для обеззараживания воды далеко не безопасно, для этих целей лучше использовать озон.
Простые вещества и соединения брома и иода используются в фармацевтической и химической промышленности.
Читайте также:

