Вапоризация опухоли мочевого пузыря
ОПЕРАТИВНАЯ И КОНСЕРВАТИВНАЯ ПОМОЩЬ НА БЕРЕЗОВОЙ
В нашей клинике в Омске на Березовой на протяжении многих лет успешно применяется высокотехнологичный метод лечения этого варианта хронического цистита у уролога в Омске - плазмо-кинетическая вапоризация.
Биполярная плазмокинетическая вапоризация лейкоплакии мочевого пузыря
Лечение хронического цистита в Омске.
У 50-78% пациенток, которые поступают в нашу клинику по поводу хронического цистита, выявляют лейкоплакию мочевого пузыря, которая гистологически представляет собой ороговение многослойного плоского эпителия. В нашей клинике на протяжении многих лет успешно применяется высокотехнологичный метод лечения этого варианта хронического цистита у уролога в Омске - плазмо-кинетическая вапоризация.
Мы можем предложить Вам квалифицированную доступную помощь на принципах доказательной медицины с использованием современного оборудования экспертного класса специалистом высшей категории с хорошими отзывами. Запишитесь в клинику на Березовой, 1 по телефону +7(909)5377482.
Введение
Лейкоплакия мочевого пузыря является историческим термином, который был предложен в 1877 году немецким исследователем Швиммером для описания белой бляшки, расположенный на поверхности слизистой оболочки. Выделяют три вида лейкоплакии мочевого пузыря:
1. Плоскоклеточную метаплазияю без ороговения.
2. Плоскоклеточную метаплазияю с ороговением.
3. Плоскоклеточную метаплазию с папилломатозом.
Ороговевший эпителий перестает защищать стенки мочевого пузыря от воздействия компонентов мочи и прогрессирования воспалительных процессов. Высока распространенность лейкоплакии у женщин, по данным Е.С.Шпиленя в развитых странах более 40% женщин переносят острый цистит хотя бы раз в жизни, примерно у трети из них развивается хронический цистит.
Причины и клинические проявления лейкоплакии мочевого пузыря
В основе заболевания лежат две основные группы факторов: экзогенные (инфекционные, травматические) и эндогенные (нарушение гормонального статуса). Наиболее частым фактором лейкоплакии является наличие бактериальной инфекции мочевых путей (в первую очередь, внутриклеточные микроорганизмы - уреаплазма, микоплазма, хламидии). С 2010 года всё чаще звучит мнение о вирусной природе этого заболевания (вирус папилломы человека - ВПЧ). ВПЧ начинает прогрессировать в момент ослабления иммунитета, способствуя перерождению многослойного плоского эпителия. Гормональные нарушения в организме женщины в системе гипоталамус-гипофиз-яичники-матка в сторону повышения уровня эстрогенов также могут приводить к развитию заболевания.
Клинически лейкоплакия проявляется стойкой дизурией, приводящей к социальной дезадаптации.Снижение качества жизни делает эту проблему острейшей не только для урологии, но и для всей медицины в целом.
Лечение
Лечение лейкоплакии мочевого пузыря включает в себя консервативные методы лечения, а также вапоризацию зоны лейкоплакии (электрохирургические методы лечения).
Консервативные методы: курсы антибактериальной терапии с учетом чувствительности микрофлоры, противовоспалительной терапии, симптоматической и общеукрепляющей терапии. Внутрипузырные инстилляции аналогами гепарина, гликозаминогликанов (гиалороновой кислоты, хондроитин сульфата, пентозанполисульфата).
Электрохирургические методы лечения лейкоплакии: трансуретральная резекция (ТУР). Под визуальным контролем срезается измененная слизистая, а затем производится коагуляция измененной поверхности; электровапоризация.
Недостатком этих методов, которые применяются повсеместно, является травматичность. Дело в том, что при электрорезекции и электрокоагуляции используется очень высокое напряжение (соответственно, 3.5 и 7 тысяч В), температура в точке соприкосновения достигает 400 `C, глубина повреждения составляет 5 мм, при толщине нормального уротелия всего 200 мкм. В результате, срок регенерации составляет шесть и более месяцев, у многих пациентов она протекает со стойкой дизурией и развитием соединительной ткани и грубой рубцовой девормации.
В настоящее время в развитых странах широкое применение находит более безопасный более эффективный метод лечения лейкоплакии мочевого пузыря - плазмокинетическая вапоризация.
Данные клинической эффективности этого метода подтверждены в 2010 году на Всемирном конгрессе по эндоурологии и в том же году были опубликованы в BJU International Journal.
Плазменный пучок поддерживается при низком напряжении - всего 100-300 В. Это ведет к значительному снижению общего термального эффекта: менее 70 градусов против 300-400 `C при обычной трансуретральной резекции, причем глубина проникновения ПКВ составляет всего 50-100 мкм, в отличие от массивного разрушения тканей при классической методике ТУР, применяемой в большинстве клиник. Время самой операции составляет не более 10 минут.
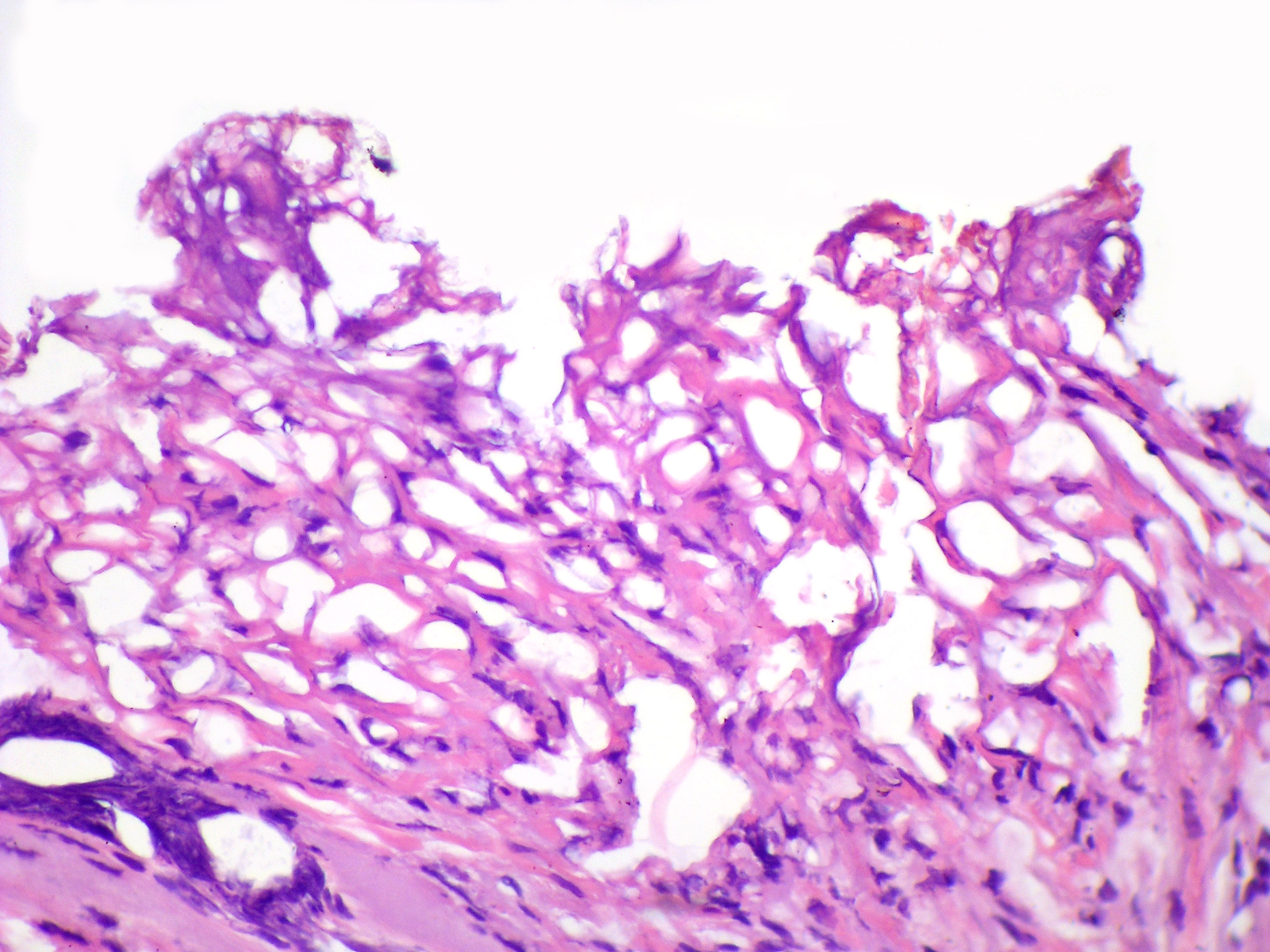
Гистологическое исследование ткани при монополярной коагуляции.
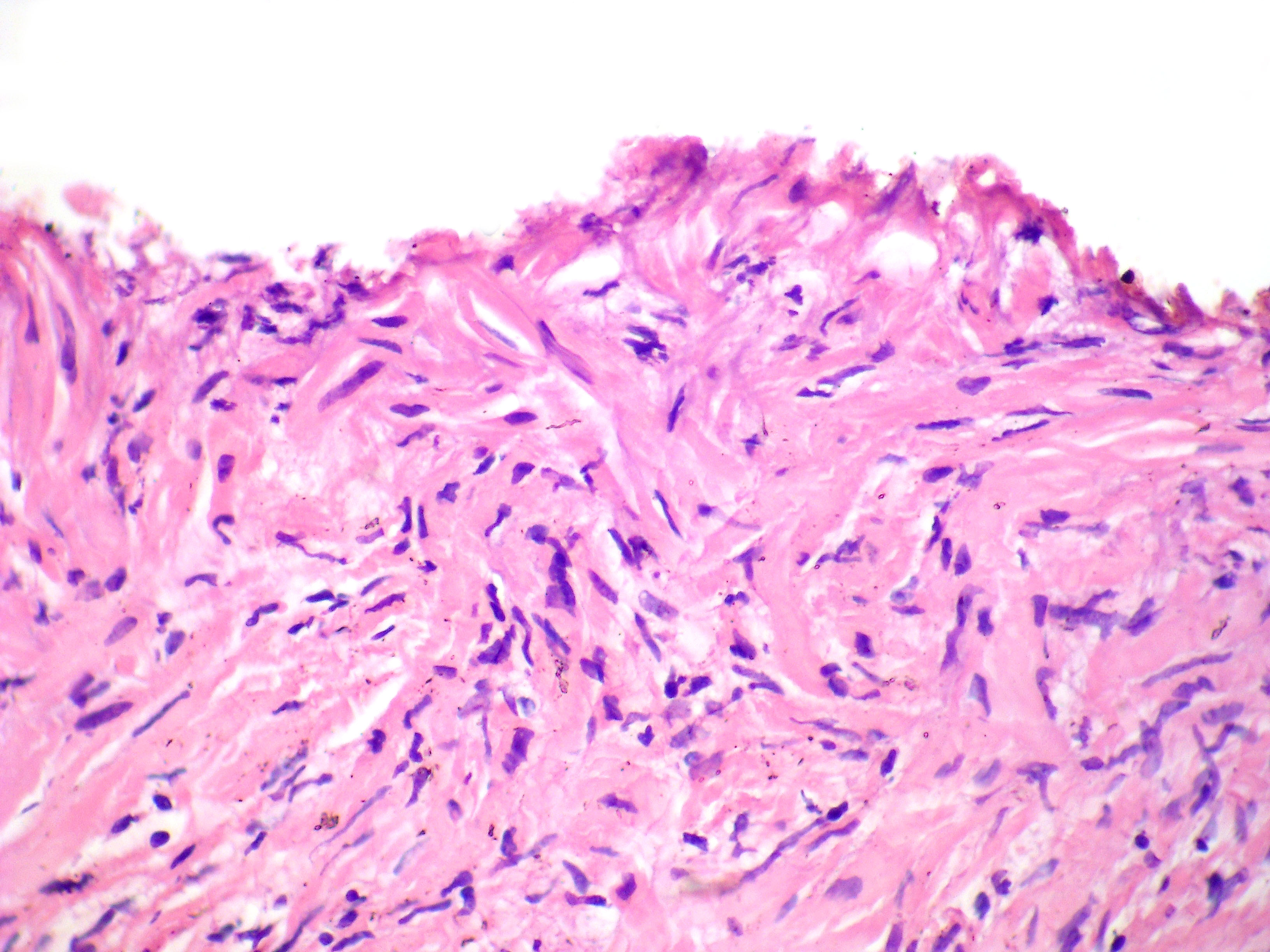
Гистологическое исследование ткани при биполярной коагуляции.
Таким образом, использование плазменной энергии позволяет быстро и точно удалить ткань, в то же время уплотняясмежные структуры и останавливая кровотечение. Тепловая энергия распространяется минимально, отсутствует повреждение глубоких тканей, что способствует быстрой регенерации, уменьшает операционное время.
К осложнениям относят незначительную примесь крови в моче и незначительные боли при мочеиспускании. После оперативного лечения необходимо избегать приема алкоголя и острых приправ к пище.
Плазмокинетическая вапоризация для лечения лейкоплакии мочевого пузыря (лечение хронического цистита в Омске) в сочетании с курсом комплексной послеоперационной терапии является малоинвазивным, безопасным и высокоэффективным способом лечения.
Андрей Олегович Хлебов, г.Омск
уролог высшей категории
телефон 89095377482
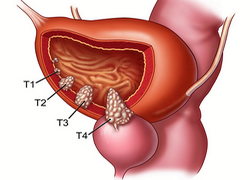
Опухоль мочевого пузыря – новообразование, которое возникает в полости или на стенке органа. Болезнь может протекать как с яркими симптомами, так и без особых признаков, что часто приводит к поздней диагностике. По основной классификации опухоли бывают доброкачественными и злокачественными. Именно тип образования, его размеры и место определяют схему лечения опухоли мочевого пузыря и прогноз выздоровления.
Причины появления опухоли
Механизм развития опухолей заключается в активном делении клеток. Такие процессы могут быть запущены разными факторами, которые провоцируют мутацию генетического клеточного материала. В случае с мочевым пузырем особенно опасны курение, неблагоприятная экология и работа, связанная с химическими веществами. Эти факторы могут вызывать разные виды опухолей мочевого пузыря:
- Доброкачественные: полипы, папилломы, миомы, гемангиомы, фибромы.
- Злокачественные: солидный, переходноклеточный, папиллярный и плоскоклеточный рак, аденокарцинома, а также поверхностный (неинвазивный) и инвазивный рак.
Доброкачественные опухоли часто диагностируются у рабочих, занятых в лакокрасочной, бумажной, химической и резиновой промышленности. Провоцировать заболевание может застой мочи. Чем выше ее концентрация и чем дольше она задерживается в пузыре, тем более сильным оказывается опухолегенное действие веществ в ее составе. У мужчин причинами опухолей выступают заболевания мочеполового тракта:
- аденома простаты;
- простатит;
- камни в органах мочевыделительной системы;
- стриктуры и дивертикулы мочеиспускательного канала.
Ввиду особенностей анатомического строения мужчины больше подвержены риску возникновения новообразований. Злокачественные опухоли мочевого пузыря могут развиваться по тем же причинам:
- из-за работы на вредном производстве;
- паразитарных инфекций;
- длительной задержки мочи;
- инфекций и воспаления урогенитального тракта.
Симптомы опухолевых заболеваний
Рассматривая симптомы опухоли мочевого пузыря, стоит отметить, что на раннем этапе она никак себя не проявляет. Признаки возникают, когда новообразование достигает таких размеров, при которых оно может раздражать стенки органа. В такой ситуации у человека могут быть следующие жалобы:
- изменение цвета мочи;
- спазмы и боль внизу живота;
- ощущение не полностью опорожненного мочевого пузыря;
- выделение мочи небольшими порциями;
- частые позывы к мочеиспусканию;
- нарушение менструального цикла и выделения из половых путей (у женщин);
- отечность в ногах, области промежности;
- нарушения работы органов пищеварения.
Методы диагностики опухоли мочевого пузыря
Поскольку опухоль может носить доброкачественный или злокачественный характер, особое значение приобретает дифференциальная диагностика. Она направлена на то, чтобы определить тип новообразования, поскольку от этого зависит схема лечения. Исходя из этого, в инструментальную и лабораторную диагностику опухоли мочевого пузыря включают:
- Ультразвуковое исследование (УЗИ) органов малого таза.
- Магнитно-резонансную или компьютерную томографию (МРТ или КТ) малого таза.
- Цистоскопию с биопсией новообразования для определения его типа.
- Экскреторную урографию и цистографию.
- Цитологическое тестирование мочи.
Рак мочевого пузыря
Сегодня рак мочевого пузыря занимает 7-е место по распространенности у мужчин и 11-е – у лиц обоих полов.
В группе риска – курильщики, рабочие промышленных предприятий, выпускающие и использующие краски, красители, металл и нефтепродукты. Но, именно курение табака является причиной почти 50% всех случаев рака. При большом количестве выкуриваемых сигарет риск развития заболевания может увеличиваться в 6–10 раз, по сравнению с некурящими. Риск возникновения рака мочевого пузыря выше также и у лиц страдающих хроническим циститом, шистосоматозом.
СИМПТОМЫ РАКА МОЧЕВОГО ПУЗЫРЯ

Одним из первых признаков рака мочевого пузыря является появление крови в моче. Среди других распространенных симптомов – учащенное и болезненное мочеиспускание, боль над лоном, в промежности, в области крестца. Присущи и неспецифические симптомы, такие как слабость, быстрая утомляемость, резкая потеря массы тела, анорексия. Возникновение всех этих симптомов требует проведения очень тщательной диагностики.
Даже небольшая опухоль мочевого пузыря может очень быстро прогрессировать. Если не проводить соответствующее лечение дальнейший рост опухоли приведет к нарушениям мочеиспускания, прорастанию опухоли в соседние органы – прямую кишку, предстательную железу, матку, влагалище, брюшную стенку и может дать метастазы в лимфатические узлы, кости, легкие, печень, кишечник.
ДЛЯ ДИА ГНОСТИКИ РАКА МОЧЕВОГО ПУЗЫРЯ В НАШЕЙ КЛИНИКЕ ПРИМЕНЯЮТ :

В ОНКОУРОЛОГИЧЕСКОМ ОТДЕЛЕНИИ КЛИНИКИ УРОЛОГИИ СЕЧЕНОВСКОГО УНИВЕРСИТЕТА ВЫП ОЛНЯЮТСЯ ВСЕ ВИДЫ ХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ ПРИ РАКЕ МОЧЕВОГО ПУЗЫРЯ:
- Трансуретральная резекция мочевого пузыря (ТУР) ;
- Еn-bloc резекция (удаление опухоли единым блоком) монополярной или биполярной петлей, тулиевым или гольмиевым лазером ;
- Прижигание ( фульгурация ) или лазерная вапоризация небольших папилл ярных рецидивных образований;
- Радикальная цистэктомия (полное удаление мочевого пузыря) : л апароскопическая и робот- ассистированная лапароскопическая цистэктомия ;
- Реконструктивно-пластические операции : создание из различных отделов ЖКТ искусственного мочевого пузыря, соединенного с мочеиспускательным каналом, что позволяет пациенту самостояте льно мочиться (операцияШтудера) или формир ование наружных мочевых свищей с постоянным выделением мочи (операцияБриккера)
ЛЕЧЕНИЕ НЕИНВАЗИВНОГО РАКА МОЧЕВОГО ПУЗЫРЯ

Н еинвазивным считается рак мочевого пузыря , ограниченный слизистой и/или подслизистой оболочкой и не прорастающий в мышечн ый слой стенки мочевого пузыря. Одним из основных видов хирургического лечения неинвазивного рака мочевого пузыря до недавнего времени явля лся ТУР ( трансуретральная резекция мочевого пузыря). Суть операции заключается в удалении существующей опухоли с профилактикой рецидива заболевания и предотвращением развития инфильтративной опухоли. Однако, последнее время получило распространение и уже очень хорошо зарекомендовала себя методика удаления опухоли мочевого пузыря с помощью лазера — En — bloc . Операция проводится без проколов и разрезов, а пациент может быть выписан из стационара уже через 2 дня.
Непосредственно после операции проводится внутрипузырная химиотерапия для разрушения циркулирующих в мочевой пузыре опухолевых клеток после ТУР и снижения риска рецидивов и прогрессирования рака. Также, уже амбулаторно, пациенты проходят д ополнительн ую адъюван тная химиотерапию (препаратами доксоруби цин , фармарубицин , или митомицин С).
ЛЕЧЕНИЕ МЫШЕЧНО-ИНВАЗИВНОГО РАКА МОЧЕВОГО ПУЗЫРЯ

Инвазивны м считается рак мочевого пузыря , прорастающий в мышечн ый слой мочевого пузыря. Оптимальным методом при запущенных инвазивных опухолях является удаление мочевого пузыря и тазовых лимфоузлов ( цистэктомия и тазовая лимфаденэктомия ). У мужчин вместе с мочевым пузырем удаляются простата, семенные пузырьки, а у женщин – передняя стенка влагалища и матка с придатками.
Современное оборудование и высокая квалификация специалистов онкоурологического отделения Клиники Урологии Сеченовского Университета позволяет выполнять сложные пластические операции, по результатам которых возможно формирование искусственного мочевого пузыря и самостоятельное мочеиспускание.
Высокая послеоперационная летальность (15-50%) после цистэктомии, а также большое количество осложнений различных методов деривации мочи и связанные с этим серьезные проблемы дальнейшей социальной реабилитации пациентов служат стимулом для выполнения органосохраняющих операций при раке мочевого пузыря (РМП).
Основным принципом их применения при мышечно-инвазивной опухоли является то, что эти операции должны выполняться как один из этапов комбинированного лечения, т.е. лечение необходимо дополнить неоадъювантной и/или адъювантной системной химиотерапией и/или лучевой терапией (ЛТ).
Трансуретральная резекция мочевого пузыря
Трансуретральная резекция (ТУР) мочевого пузыря (МП) широко применяется при лечении поверхностного РМП, однако в последнее время используется рядом авторов и при инвазивных новообразованиях. Данное оперативное вмешательство, как правило, является первым этапом в диагностике и лечении этого заболевания и носит лечебно-диагностический характер, его основная цель — максимально радикально удалить имеющуюся опухоль и установить стадию заболевания. Анализ достаточного количества гистологического материала, полученного при ТУР, дает возможность определить дальнейшую тактику лечения больного.
Решающими моментами в выборе тактики ведения пациента и прогнозирования дальнейшего развития заболевания являются прежде всего гистологическое заключение о строении опухоли и степени ее дифференцировки (категория G), а также глубина инвазии в стенку МП (категория Т). Однако существует ряд моментов, сдерживающих применение трансуретральная резекция при инвазивном раке. В первую очередь к ним следует отнести невозможность гарантированно удалить всю опухоль.
При инфильтративном росте всегда существует вероятность оставить резидуальную опухолевую ткань в макроскопически неизмененных участках стенки МП. Если применение ТУР при стадии заболевания T2а, т.е. новообразовании, инфильтрирующем внутреннюю половину мышечного слоя, при отрицательной биопсии из ложа опухоли можно считать радикальным, то при распространении заболевания на всю толщу стенки МП (Т2b), а тем более за ее пределы радикальность выполнения данного оперативного вмешательства представляется сомнительной.
Другим отрицательным моментом является то. что при этой операции не удаляются регионарные лимфатические узлы, довольно часто поражаемые метастазами инвазивного РМП (до 10% при стадии Т2, до 37% случаев при стадии Т3). Нередко использование метода ТУР при мышечно-инвазивной опухоли может быть ограничено локализацией в труднодоступных участках мочевого пузыря и размерами образования, степенью инвазии в стенку органа, мультифокальностью и распространенностью онкологического заболевания, а также зависит от наличия сопутствующей CIS.
В настоящий момент не существует однозначного мнения в отношении показаний к трансуретральной резекции при инвазивном раке мочевого пузыря, Некоторые урологи считают ТУР основным методом лечения при стадии заболевания Т2. Другие исследователи считают возможным выполнять ТУР только при высокой и умеренной степенях дифференцировки (Gr G2) в стадии Т2, предполагая необходимость выполнения цистэктомии при низкодифференцированных опухолях и считая, что трансуретральные оперативные вмешательства при стадии Т3 носят лишь паллиативный характер.
Присутствие рака in situ не считается противопоказанием, но подчеркивается необходимость адъювантной БЦЖ-терапии и более тщательного наблюдения. По данным различных авторов в 40% случаев трансуретральной резекции выявляет первоначально заниженную степень инвазии опухоли в стенку МП.
Техника ТУР при мышечно-инвазивном РМП заключается в следующем (рис. 3.58-3.60).

Рис. 3.58. Цистоскопия. Инвазивная опухоль мочевого пузыря (рТ2в)

Рис. 3.59. ТУР-биопсия мышечного слоя (основание опухоли). Удалена опухоль
Предварительно эндоскопическими щипцами выполняется биопсия экзофитной части и основания опухоли. После этого первым этапом осуществляется трансуретральная резекция экзофитного компонента опухоли путем горизонтальной или вертикальной резекции, затем выполняется полная резекция видимых участков поражения, включая послойную глубокую биопсию основания опухоли.
При ТУР боковых стенок вводятся миорелаксанты короткого действия для предотвращения возможной неконтролируемой перфорации стенки МП в результате синдрома запирательного нерва. В случаях сдавления или прорастания опухолью мочеточникового устья выполняется его резекция с катетеризацией (стентированием) соответствующего мочеточника.
Во всех случаях экзофитную часть удаленной опухоли и резецированные фрагменты стенки МП маркируют для гистологического исследования раздельно. При множественном росте материал от каждого опухолевого образования подлежит раздельной маркировке. После удаления видимых опухолей обязательно выполняется полифокальная биопсия остальных участков стенки МП для возможной верификации CIS. Операция заканчивается визуальным контролем и дренированием мочевого пузыря катетером Фолея, в ряде случаев с применением ирригационной системы.
В течение нескольких лет ведутся дискуссии о целесообразности применения в качестве лечебно-диагностического метода ранней повторной цистоскопии и ТУР-биопсии, широко известной в зарубежной литературе под названием second look TUR. Ранняя повторная цистоскопия и биопсия являются методом, позволяющим установить истинную стадию заболевания путем повторной трансуретральной резекции МП, таким образом она приобретает особое значение при определении дальнейшей тактики лечения инвазивного РМП. Среди ряда зарубежных урологических клиник пациентам с поверхностным раком мочевого пузыря введено в практику выполнение ранней повторной цистоскопии и ТУР-биопсии (second look TUR) в сроки от 2 до 8 нед после первой ТУР.
Хорошо известен тот факт, что переходно-клеточный рак в стадиях T1-T2 со степенью дифференцировки G2 и G3 склонен к прогрессивному течению заболевания. Поэтому многие авторы считают достаточно рискованным удлинять интервал между проведением контрольных цистоскопии у пациентов со степенью дифференцировки G2 и G3, предполагая тем самым выполнение ранней повторной цистоскопии и биопсии.
В одном из последних исследований, проведенном в больнице Memorial Sloan-Kettering, 170 пациентам как с поверхностным, так и с инвазивным РМП после первичного трансуретрального оперативного вмешательства была выполнена ранняя повторная цистоскопия и биопсия. При этом у 114 (76%) больных выявлены резидуальные опухоли.
В группе пациентов с поверхностным РМП (Та, Тis, Тx) рецидивы выявлены у 72 (75%) патентов, из которых у 28 (22%) обнаружены инвазивные опухоли. А у больных с первичным мышечно-инвазивным раком мочевого пузыря (стадия Т2) только у 12 (22%) при ранней повторной цистоскопии и биопсии не выявлено рецидивов заболевания.
Основываясь на результатах данного исследования, можно предположить, что трансуретральная резекция, выполненная в качестве монотерапии у пациентов с мышечно-инвазивным РМП, не может быть рассмотрена как стандартный алгоритм лечения этой категории больных. Таким образом, необходим строго дифференцированный подход у больных с мышечно-инвазивным РМП при выборе органосохраняющей оперативной тактики лечения.
Кроме того, возможно применение ТУР МП с паллиативной целью у неоперабельных больных. ТУР может быть выполнена у пациентов со стадией заболевания Т3a, у которых в результате неоадъювантной химиотерапии или химиолучевой терапии достигнута полная регрессия опухоли, подтвержденная данными повторной цистоскопии и биопсии, а также на основании гистологического исследования. Однако для однозначного решения вопроса о целесообразности трансуретральной резекции при инвазивном раке мочевого пузыря необходимо дальнейшее проведение рандомизированных исследований.
Резекция мочевого пузыря
Резекции МП нередко технически сложны и сопровождаются послеоперационными осложнениями у значительной части больных, но выбор уролога чаще продиктован несовершенством принятых методов деривации мочи и стремлением обеспечить пациенту приемлемое качество жизни, а не отсутствием желания выполнять радикальную цистэктомию.
В зарубежной практике урологи выполняют так называемую парциальную цистэктомию при инвазивном раке в случае первичного, солитарного поражения и при наличии возможности выполнения резекции стенки МП, отступив на 2 см от края опухоли. При этом необходимо выполнить биопсию из различных участков стенки мочевого пузыря.
Отечественные исследователи также считают, что эта операция может быть произведена при первичном поражении МП; при этом опухоль должна быть одиночной, локализованной на подвижных стенках МП и отстоять от шейки не менее чем на 3 см; размеры опухоли не должны превышать 5-6 см в диаметре; в окружающей макроскопически неизмененной слизистой оболочке и простатическом отделе уретры не должно быть рака in situ или тяжелых диспластических изменений.
Следует отметить, что при резекции МП необходимо удаление регионарных лимфатических узлов, так как при инвазивном раке увеличивается риск их поражения. Гистологическое исследование удаленных лимфатических узлов способствует правильному установлению стадии заболевания и решению вопроса о проведении дополнительного лечения после операций.
Только при соблюдении этих условий отдаленные результаты резекции мочевого пузыря не уступают таковым после радикальной цистэктомии. Исследования, основанные на вышеизложенных критериях отбора пациентов для выполнения резекции МП, показывают, что только 6-19% больных в последующем была выполнена радикальная цистэктомия. По данным РОНЦ РАМН, 5-летняя выживаемость больных инвазивным РМП после резекции составила 70,5%.
В зарубежной практике общая 5-летняя выживаемость варьирует от 25 до 60%, при этом уровень общего рецидивирования РМП составляет 40-78%. Рецидивы после выполнения резекции МП выявлены при стадии заболевания Т2 у 29% пациентов, при стадии Т3 в 33% и при стадии Т4 в 20% случаев. По данным М.Э. Ситдыковой и Э.Н. Ситдыкова, частота рецидивов также зависит от стадии рака мочевого пузыря. Она составляет 31,5% при стадии Т2 и 70,1% при опухолевой инвазии Есей толщи стенки МП. Авторы считают, что резекция мочевого пузыря является эффективным методом лечения при стадии Т2 и нерадикальна в стадии Т3.
С другой стороны, некоторые авторы полагают, что вышеперечисленные показания к резекции МП могут быть расширены у больных, получавших неоадъювантную химиотерапию с хорошим эффектом. Органосохраняющие техники могут использованы при центральной локализации опухоли, включая основание МП.
Некоторые урологи считают допустимой резекцию с реимплантацией устья мочеточника при расположении в данной зоне опухоли МП. Кроме того, некоторые авторы не считают противопоказанием наличие рака in situ в оставшейся слизистой оболочке или по краю резекции, так как данным больным после операции может быть проведена внутрипузырная БЦЖ-терапия. Насколько оправданы такие расширенные показания для выполнения резекции у больных с инвазивным РМП, должны показать последующие рандомизированные исследования.
Лучевая терапия
ЛТ — метод лечения злокачественных новообразований при помощи ионизирующего излучения, в основе которого лежит его повреждающее воздействие на злокачественные клетки, приводящее к их гибели. Лучевая терапия как радикальный метод лечения больных инвазивным РМП вызывает противоречивые суждения среди врачей и исследователей как в России, так и за рубежом. Неоднозначны результаты ЛТ и их интерпретация.
В литературе накопилось достаточно данных о положительных результатах — стойкой ремиссии заболевания и сохранности адекватной функции мочевого пузыря. Существующие мнения разнятся и зависят от наличия соответствующей оперативной или радиологической базы. Так, урологи США и Канады больше предпочитают оперативные пособия при мышечно-инвазивном раке мочевого пузыря. В Великобритании, напротив, лучевая терапия является стандартным методом лечения при данной стадии заболевания. Большинство специалистов все-таки предпочитают оперативные пособия ЛТ, которая редко используется в качестве первичного лечения инвазивного РМП.
Многие авторы полагают, что при соответствующих критериях отбора пациентов для ЛТ удается в 60-70% случаев достичь полной регрессии опухоли, сохранить функцию МП и обеспечить высокое качество жизни. При этом результаты лечения коррелируют с дозой облучения: чем выше подведенная доза, тем лучше ожидаемые результаты лечения. Однако следует отметить, что с увеличением дозы облучения возрастает вероятность возникновения как непосредственных, так и отсроченных (поздних) лучевых осложнений лечения.
Эффективность ответа на лучевую терапию выше при низкодифференцированных опухолях (G3). Местные рецидивы чаще развиваются у больных с меньшей степенью злокачественности опухоли В различных зарубежных исследованиях приводятся данные о 5-летней выживаемости практически 40% пациентов с инвазивным РМП после ЛТ. При этом уровень рецидивирования составляет 40-50%.
Отдаленные метастазы выявляются всего у 10% пациентов, 5-летняя выживаемость и уровень рецидивирования зависят от стадии заболевания. Так, при стадии Т 5-летняя выживаемость составляет приблизительно 20%, а уровень рецидивирования рака мочевого пузыря варьирует от 50 до 70%. Соответственно, при стадии заболевания Т4 5-летняя выживаемость больных составляет всего 10%.
Большинство авторов предлагают следующие критерии отбора пациентов для применения ЛТ в качестве первичного лечения инвазивного РМП: наличие папиллярной опухоли высокой степени дифференцировки меньше чем 5 см в диаметре. При этом предварительно выполненная ТУР перед началом облучения позволяет улучшить качество лечения.
Тем не менее результаты исследований ряда авторов о применении лучевой терапии в лечении инвазивного РМП остаются неутешительными. Holmang и соавт. сообщают о 74 пациентах с инвазивным раком мочевого пузыря, которым выполнялась ЛТ, В 84% случаев наблюдалось персистирование опухоли, рецидивирование и сморщивание МП. Средняя выживаемость пациентов со стадиями заболевания Т2 и T3 составила 16 мес, при этом наблюдался высокий уровень непосредственных и отсроченных осложнений лечения.
Из-за осложнений ЛТ, как ранних, так и поздних, умерли 7 (9,5%) больных. Отмечено, что наибольшая смертность была среди пациентов пожилого возраста (70-75 лет), а также при высокой дозе облучения — 65 Гр и выше. Наибольшая выживаемость была в группе больных, которым перед началом лучевой терапии была выполнена ТУР мочевого пузыря. Таким образом, результаты первичного применения ЛТ примерно одинаковы с результатами трансуретральной резекции МП, выполненной в качестве монотерапии инвазивного РМП.
В своем исследовании Montie приводит данные об улучшении результатов ЛТ на 10-20% при применении радиосенсибилизаторов (cisplatin) у больных с инвазивным РМП. Канадские исследователи сообщают о 104 пациентах, которым удалось вызвать клиническую ремиссию заболевания в 90% случаев путем комбинированного использования лучевой терапии и интраартериального введения цисплатина.
8 литературе, также приводятся данные о комбинированном использовании 1921г и экстракорпоральной ЛТ, что приводит к улучшению результатов лечения пациентов с инвазивным раком мочевого пузыря, но при этом значительно увеличивается токсичность и смертность. Так, Wijnmaalen и соавт. сообщают о 66 больных РМП в стадии Т1 с солитарным поражением и размером опухоли менее 5 см, которым первично была выполнена ТУР с последующим комбинированным назначением ЛТ и 1921г. При данном лечении выживаемость пациентов составила 60%, а безрецидивное течение заболевания наблюдалось более чем у 61% больных.
Основываясь на вышеизложенных данных литературы, лучевая терапия, используемая в качестве монометода у пациентов с инвазивным РМП, не дает результатов выживаемости, сравнимых с эффективностью радикальной цистэктомии.
Считается, что ЛТ показана при местно-распространенном раком мочевого пузыря (Т3b, Т4, N+), а также в случаях невозможности выполнения оперативных вмешательств пациентам с выраженными интеркурентными заболеваниями и в пожилом возрасте. В данных случаях лучевая терапия играет паллиативную роль в лечении пациентов с мышечно-инвазивным РМП. Таким образом, этот вид терапии занимает свое место з лечении определенного контингента больных.
Читайте также:

