Car t cell therapy при лейкозе

Наша статистика - за полтора года успешно проведенная адаптивная клеточная терапия (CAR T-Сell Therapy) привела к устойчивой ремиссии от 75 до 90% пациентов. Если бы не это лечение, у них не было шанса прожить и пару месяцев.
Количество статистических данных еще очень маленькое - за это время (середина 2016-до конца 2017 года) у нас прошли лечение всего лишь около 30 человек, но мы - самая первая клиника за пределами США, где стало возможно лечение по этому протоколу.
Более того, наши врачи в тесном сотрудничестве с коллегами в США, вели исследования на протяжении более 30 лет, чтобы прийти к простому и недорогому варианту лечения практически любого типа рака.
На данном этапе мы можем сообщить, что у каждого пациента с раком крови лейкозом или лимфомой есть шанс на излечение в Израиле.
Группа израильских ученых обнаружила, что ключ для борьбы с раком - это изменение иммунной системы
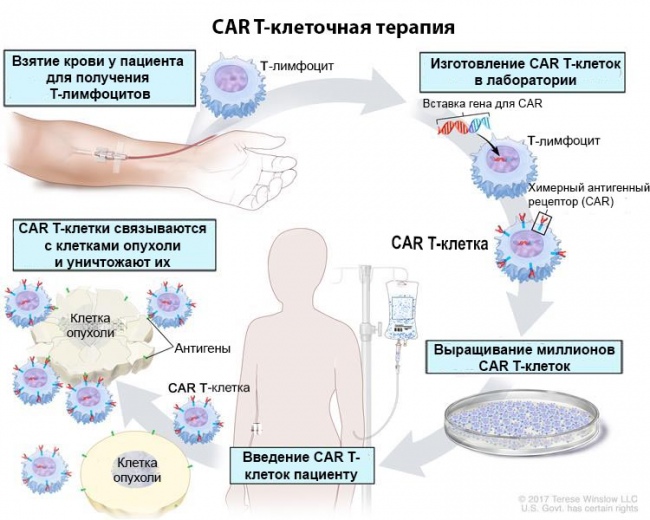
Лечение выполняется для каждого пациента индивидуально с использованием выделенным у него Т-клеток, которые генетически модифицируются для повышения их способности распознавать и атаковать раковые клетки.
Процесс занимает около 22 дней и включает выделение клеток у пациента, генетическую инженерию и выращивание их в лаборатории, а также возвращение измененных лимфоцитов пациенту.
Метод CAR Т-клеточной терапии предполагает выделение Т-клеток из организма пациента и их генетическую модификацию с целью экспрессии белка, распознающего специфический антиген, который был найден на поверхности лейкозных клеток. Сама технология зарагистрированна компанией Новартис и назван персональной модифицированный генный препарат Кимрия.
Kymriah — персонализированная генная терапия. 30 августа 2017 года Управление по контролю за продуктами и лекарствами (FDA) одобрило иммунотерапию под названием CAR T-cell therapy для некоторых детей и молодых людей до 25 лет с B-формой острого лимфобластного лейкоза (ALL). Лечение препаратом Tisagenlecleucel (Kymriah ™) на основе генетической модификации собственных клеток пациента является первой генетической терапией видоизмененных Т-клеток CAR, получившее одобрение FDA.
Критерии CAR T-Сell Therapy
Терапия применяется для лечения B-клеточного острого лимфобластного лейкоза после повторной рецидива или при отсутствии ответа на стандартное лечение. Метод CAR T-Сell Therapy Kymriah действует только для тех видов лейкемии, при которой нарушается работа B-лимфоцитов. К ним относится 15%—20% всех случаев острой лимфобластной лейкемии.
FDA одобрил терапию CAR T-Сell Therapy от компании Novartis, для пациентов в возрасте до 50 лет с B-клеточной острой лейкемией ALL, которая не реагирует на лечение или рецидивирует два или более раз.
Терапия предоставляется только пациентам, которые прошли как минимум два предыдущих курса лечения лейкемии. Протокол CAR T-клетками показывает очень успешные результаты у молодых пациентов.
На декабрь 2017 года стоимость одной (и зачастую единственно необходимой) процедуры CAR T-Cell в Израиле - около 90.000$. Время госпитализации - примерно 22 день. В стоимость лечения не включена цена обследования, для получения персональной программы пожалуйста оставьте ваши контактыне данные или свяжитесь с нами через Вотсапп/телеграмм/Вибер +972-547751852.
Помимо Израиля, технология CAR T-Сell терапия лечения рака крови и лимфы доступна только в США.

Самое дорогое лечение рака.
Министерство здравоохранения США впервые разрешили к применению CAR-T-клеточную терапию рака. Препарат Kymriah (Tisagenlecleucel) может применяться у пациентов моложе 25 лет, которые заболели лимфобластной лейкемией, если проведенное ранее лечение было не результативно или привело к рецидиву заболевания. С расходами на лечение в размере 450.000$ за однократное введение препарата это может стать самым дорогим лечением рака.
Для CAR-T-клеточной терапии Т-клетки из крови пациента изолируются сначала посредством лейкофереза. В лаборатории Т-клетки снабжают химерным антигенным рецептором, который облегчает распознавание Т-киллерами антигена CD19 на поверхности В-лимфоцитов. Сначала Т-клетки модифицируют в лабораторных условиях и затем отдельно вводятся пациенту.
В принципе, данная терапия может применяться при всех раковых заболеваниях, в которых задействованы В-лимфоциты. К ним относятся острый лимфобластный лейкоз, множественная миелома, неходжкинская лимфома. Во всех этих группах заболеваний лечение проводилось в течение последних лет с частично хорошими долговременными результатами.
Достоверно известен случай с шестилетней девочкой, которая заболела острым лимфобластным лейкозом: после того, как были применены все известные способы лечения, ребенок получил в 2012 году CAR-T-клеточную терапию в детской больнице Филадельфии. Девочка с тех пор без рецидива заболевания.
Много пациентов в полной ремиссии, но риски не исключены.
Полученные результаты были предметом исследования программы ELIANA, которое производитель препарата провел в течение последних 25 лет в Северной Америке, Европе, Австралии и Японии. При этом 52 из 63 пациентов достигали полной ремиссии. У всех пациентов костный мозг после лечения был свободен от опухолевых клеток.
Тем не менее, эта терапия не без риска, поскольку описывались смертельные случаи. Вероятно, самое опасное осложнение — это синдром освобождения цитокинов. При этом освобожденные Т-клетками нейромедиаторы вызывают опасное для жизни системное заболевание с высокой температурой и похожими на грипп симптомами. Также возможны тяжелые неврологические осложнения, присоединение тяжелых инфекций, снижение артериального давления, развитие острой почечной недостаточности и гипоксии. Эти симптомы развивались в течение 22 дней после введения Kymriah.
Риск инфекции повышен в течение более длинного периода, так как CAR Т-клетки также уничтожают и здоровые В-лимфоциты. Пациент может снова бороться с инфекцией только тогда, когда костный мозг образовал новые В-лимфоциты.
С синдромом освобождения цитокинов может бороться Tocilizumab. В клинических исследованиях синдром освобождения цитокинов у 69 % пациентов полностью стихал после одного или двукратного введения Tocilizumab в течение 2 недель.
Исследователи пытаются найти возможность лечить также другие виды рака, например, опухоли молочных желез, яичников, легких или поджелудочной железы, с помощью CAR Т-клеток, но, разумеется, до сих пор с небольшим успехом.


История одной девочки

Но как раз тогда в Детской больнице Филадельфии появилась возможность включить Эмили в клиническое испытание новейшего метода — CAR T-клеточной терапии. Никто не знал, как девочка перенесет экспериментальное лечение, но других шансов не было.
Конечно, не у всех участников тогдашних клинических испытаний все сложилось так же счастливо. Но в целом результаты оказались все равно потрясающими. Многие дети и взрослые получили новый и совершенно реальный шанс на жизнь. И история Эмили стала символом этого шанса.
В чем суть CAR T-клеточной терапии?
Важнейшую роль в распознавании и уничтожении чужеродных клеток играют особые иммунные клетки — Т-лимфоциты. Но сами по себе наши лимфоциты недостаточно сильны и специфичны, чтобы справляться с опухолями. Поэтому возникла идея их генноинженерной модификации, чтобы улучшить распознавание опухолевых клеток и усилить иммунный ответ.
Радости и трудности

Первые успехи новой технологии действительно впечатляют. На CAR Т-клеточную терапию хорошо отвечает 80-90% получающих ее больных острым лимфобластным лейкозом и лимфомами. Причем речь идет о самых трудноизлечимых пациентах, которым не помогают никакие стандартные методы! А приблизительно у 50%, насколько можно судить сейчас, болезнь удается победить полностью. То есть кратковременная терапия клетками — конечно, очень сложно модифицированными клетками — способна привести к излечению.
Как отметил Мишель Саделайн, один из изобретателей метода CAR T-клеточной терапии, во время своей прошлогодней лекции в Центре детской гематологии им. Дмитрия Рогачева:
Сейчас многие говорят, что их цель — превратить рак в хроническое заболевание, при котором пациенты живут всё дольше. Наша цель другая. Мы ищем излечивающую терапию.
Но, конечно, многое пока еще совсем непросто.
Во-первых, область успешного клинического применения этой терапии пока довольно узка. Она касается только опухолей, которые состоят из В-лимфоцитов (особых клеток иммунной системы, отличающихся от Т-лимфоцитов) и их клеток-предшественников. То есть это только лейкозы и лимфомы, и то не все. И врачи с нетерпением ждут появления методов CAR T-клеточной терапии, которые будут эффективны и при других опухолях. По всему миру, в первую очередь в США и Китае, ведутся сотни клинических испытаний. Если хотя бы небольшая их доля приведет к успеху, это изменит лицо современной онкологии.
Другая проблема — токсичность. Грозным осложнением оказался синдром выброса цитокинов: сильная иммунная реакция иногда сопровождается очень высокой температурой, повышением давления, сердечно-сосудистыми и дыхательными проблемами. Есть и другие опасности. Поэтому новая терапия требует тщательного наблюдения за пациентами и их ведения опытными врачами.
Ну и, наконец, все-таки речь идет о революционной технологии, требующей необычных подходов.
Долгое время фармацевтическая промышленность была консервативной. Она знает, как производить химические соединения, антитела, вакцины, факторы свертывания, но не клетки.
Ситуация в России

И в 2018 году эта работа стала приносить плоды. На базе Центра детской гематологии CAR T-клеточную терапию по индивидуальным показаниям получили 20 пациентов Центра — детей и молодых взрослых с острым лимфобластным лейкозом и В-клеточными лимфомами. Для каждого из них собирался консилиум, устанавливавший, что все остальные варианты лечения уже исчерпаны и оказались неэффективными. Только клеточная терапия давала им шанс. Как лечение этих пациентов, так и работа с клетками велись и ведутся на базе НМИЦ ДГОИ.
Сейчас, когда с начала терапии первых пациентов прошел почти год, можно осторожно подвести первые итоги. Конечно, прошло еще слишком мало времени, чтобы говорить об окончательном выздоровлении, но многие из участников исследования сейчас живут без признаков болезни и имеют хорошие перспективы.
Не у всех пациентов НМИЦ ДГОИ, получивших новую терапию, все сложилось удачно. Но удач все же немало. А учитывая, что это были действительно самые сложные и тяжелые случаи, каждый успех можно считать чудом. И в будущем году врачи рассчитывают, что число больных, получающих эту терапию на базе Центра детской гематологии, увеличится в полтора раза. Есть надежда, что технологию удастся реализовать и в других российских клиниках — в нескольких учреждениях уже начаты соответствующие исследования.
По нашим оценкам, сейчас такое лечение в России может быть ежегодно показано нескольким десяткам детям и нескольким сотням взрослых.
Но, возможно, в будущем, когда CAR T-клеточная терапия станет доступнее и прояснится вопрос с ее долговременной эффективностью, сфера ее применения расширится. И может даже случиться так, что когда-нибудь она частично заменит традиционные методы, включая химиотерапию и трансплантацию костного мозга.

В течение последующих пяти лет на основе разработки израильских ученых были созданы экспериментальные препараты нового поколения для лечения онкологических заболеваний крови. Их эффективность проверялась в ходе клинических испытаний, которые координировал Национальный институт по изучению рака в США. В испытаниях принимали добровольцы с лейкозом, невосприимчивым к стандартной терапии, или же с рецидивом заболевания после ранее полученного лечения. Результаты испытаний превзошли все ожидания: более 70% испытуемых полностью выздоровели от лейкоза.
Стоимость процедуры CAR T-Cell в Израиле — 90.000$, что в несколько раз дешевле, чем в медицинских центрах США.
Иммунотерапию CAR Т-лимфоцитами назначают пациентам, которые отвечают следующим критериям:
— диагноз неходжкинская лимфома (В-клеточный тип) или В-клеточный острый лимфобластный лейкоз (ОЛЛ);
— возраст не старше 50 лет;
— терапия первой и второй линии не привела к наступлению ремиссии.
На начальном этапе производится забор Т-лимфоцитов из периферической крови. Для этой цели пациента подсоединяют к аппарату лейкофореза – устройству, отфильтровывающему из круга кровообращения Т-лимфоциты. Полученные Т-лимфоциты выращивают в лабораторных условиях, а затем вводят в состав их ДНК определенную последовательность генов, кодирующую белок CAR. Белок распознает специфические антигены на поверхности раковых клеток, в частности, антиген CD19. Антиген CD19 играет роль маркера, по которому Т-лимфоцит опознает раковую клетку и запускает процесс ее уничтожения.
В период, когда аутологичные Т-лимфоциты культивируются в лабораторных условиях, пациенту назначают курс химиотерапии. Дозы препаратов для химиотерапии в данном случае будут невысокими. Их задача заключается в подавлении иммунной системы, чтобы в дальнейшем она не препятствовала деятельности CAR Т-лимфоцитов и не снижала их активность.
Процесс культивации в лаборатории занимает в среднем 10 дней. По его окончании аутологичные CAR Т-лимфоциты вводятся пациенту внутривенно. После их введения больной должен оставаться в стационаре под наблюдением врачей в течение двух недель.
Число вводимых пациенту клеток, как правило, невелико – около 1 миллиона на килограмм веса. Принцип лечения состоит в том, что попав в организм человека, модифицированные Т-лимфоциты начинают делиться, а затем – по достижении необходимой концентрации – идентифицируют опухолевые клетки и приступают к их уничтожению.
Терапия сопровождается определенными побочными эффектами, поэтому больному потребуется госпитализация и наблюдение специалистов. В целом, побочные эффекты напоминают признаки тяжелого гриппа: высокая температура, озноб, перепады артериального давления, одышка. В некоторых случаях возможно появление неврологической симптоматики: головной боли, судорог и, крайне редко, развития отека головного мозга.
Тяжесть побочных эффектов находится в прямой зависимости от объема опухолевой массы. При обширном поражении костного мозга вероятность выздоровления будет ниже, а риск побочных эффектов выше, и они будут носить более тяжелый характер. В таких ситуациях целесообразно назначить пациенту предварительный курс химиотерапии, чтобы снизить опухолевую массу, и лишь затем – иммунотерапию.
Действительно ли пациенты полностью излечиваются?
В 2017 году завершился ряд крупных клинических исследований новой методики лечения рака, CAR Т-клеточной терапии. По их результатам были разрешены к применению два препарата – Kymriah и Yescarta. По сути, CAR Т-клеточная терапия одновременно является генной терапией, иммунотерапией.
В 2017 году завершился ряд крупных клинических исследований новой методики лечения рака, CAR Т-клеточной терапии. По их результатам были разрешены к применению два препарата – Kymriah и Yescarta. По сути, CAR Т-клеточная терапия одновременно является генной терапией, иммунотерапией и клеточной терапией.
Эта методика изменяет собственные лейкоциты пациента таким образом, чтобы они могли распознавать и уничтожать раковые клетки. Несмотря на ряд побочных эффектов, CAR T-клеточная терапия будет эффективной для большинства пациентов при отсутствии ответа на другие виды лечения или развитии рецидива.
Общие принципы лечения онкологических заболеваний
Традиционно в клинической практике широко применяются следующие методики:
- Хирургическое лечение, для удаления первичного опухолевого очага и метастазов, а также лечения осложнений основного заболевания
- Химиотерапия, для уменьшения опухоли в размерах, устранения метастазов и профилактики рецидивов
- Лучевая терапия, для местного воздействия на опухоль и подавления роста
- Пересадка костного мозга, для восстановления функции кроветворения при раке крови.
В настоящее время для получения более эффективных результатов лечение рака индивидуализируют. Безусловно, все виды терапии подбирают с учетом особенностей опухоли и состояния пациента. Тем не менее, протоколы химиотерапии утверждаются авторитетными организациями на международном уровне и не адаптируются к потребностям конкретного пациента.
Более того, каждый из методов терапии имеет свои ограничения, побочные эффекты и противопоказания, что в итоге не всегда приводит к достижению стойкой ремиссии заболевания.
Первым шагом к разработке индивидуального лечения рака стала таргетная терапия. Таргетная терапия включает применение лекарственных препаратов или вакцин, действие которых направлено на строго определенные виды раковых клеток. В частности, хорошо зарекомендовали себя в клинических исследованиях такие препараты, как Гливек (международное название – иматиниб) и Герцептин (международное название – трастузумаб). В состав этих препаратов входят моноклональные антитела к конкретным компонентам раковых клеток, присутствующих у пациента. Из-за высокой специфичности действия антитела атакуют и разрушают только онкологические клетки, не затрагивая здоровые ткани и органы.
Иммунотерапия, или адаптивная клеточная терапия, развивается в нескольких направлениях:
- Создание противоопухолевых эффекторных лимфоцитов (tumor infiltrating lymphocytes, TIL). Измененные лимфоциты приобретают способность распознавать опухоль, проникать в злокачественные ткани и оказывать там прямое цитотоксическое действие. Это означает, что противоопухолевые эффекторные лимфоциты буквально убивают опухоль.
- Создание специфических Т-клеточных рецепторов (T-cell receptors, TCR). Лимфоциты пациента обрабатывают веществами, похожими по составу на клетки опухоли. При этом на поверхности лимфоцитов появляется большое количество специфических рецепторов, которые способны легко находить подобные опухолевые клетки в организме.
- Создание лимфоцитов с химерными рецепторами антигена (chimeric antigen receptor, CAR). В этом случае при помощи методик генной инженерии создаются специальные рецепторы, которые идеально подходят к клеткам опухоли пациента. После этого рецепторы размещают на собственных лимфоцитах пациента, которые начинают активно размножаться и бороться с опухолевой тканью.

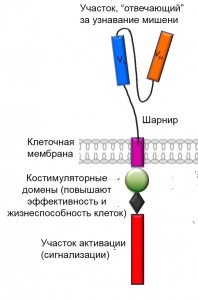
Что представляет из себя CAR
CAR – тщательно разработанные искусственные молекулы, которых не существует в естественной среде. Цель создания CAR – атака особых молекул-мишеней на поверхности раковых клеток. Обычно это антигены CD19 и CD22, которые специфичны для злокачественных клеток при раке крови. Крайне важно, чтобы аналогичных молекул не было на поверхности здоровых клеток. В противном случае, здоровые клетки также подвергнутся атаке, что сведет к минимуму эффект от лечения.
Молекула CAR имеет сложное строение. Каждая часть химерного рецептора, или каждый домен, имеет свое значение в достижении конечного результата – уничтожении раковых клеток.
CAR состоит из следующих частей, начиная с поверхности:
За счет комплексного строения активированные лейкоциты с CAR разрушают раковые клетки по нескольким механизмам:
- Выброс в кровь цитотоксических веществ, перфорина и гранзимов. Цитотоксические вещества оказывают прямое действие на раковые клетки, приводя к их гибели.
- Синтез цитокинов и факторов транскрипции. Эти вещества создают благоприятные условия для размножения и выживания лейкоцитов, позволяют лейкоцитам дольше находиться в крови и воздействовать на опухоль.
Сфера применения CAR Т-клеточной терапии
Изначально идея CAR Т-клеточной терапии зародилась в Израиле, в 1989 году. Первое исследование клинического применения CAR было проведено в 1996 году на пациентах с раком яичника. Полученные результаты не были многообещающими, с тех пор методика CAR Т-клеточной терапии прошла длинный путь усовершенствования.
Период активного изучения CAR Т-клеточной терапии в рандомизированных клинических исследованиях пришелся на 2015-2017 годы. Учитывая особенности молекул CAR, эта методика применялась в небольших исследованиях, которые включали взрослых и детей. По итогам наилучшие результаты были получены при лечении острого лимфобластного лейкоза у детей, а также неходжкинских лимфом у взрослых. При этом CAR Т-клеточная терапия проводилась пациентам на поздних стадиях заболевания – при отсутствии эффекта от двух и более видов предшествующего лечения или при развитии рецидива.
В 2017 году были официально разрешены к применению 2 препарата, Kumriah и Yescarta. По результатам исследований было доказано, что CAR Т-клеточная терапия эффективно убивает раковые клетки и их предшественников.
Другая перспективная область применения CAR Т-клеточной терапии – лечение множественной миеломы. Для проведения клинических испытаний создаются новые CAR против антигена BCMA (B-cell maturity antigen), который появляется на зрелых онкологических клетках. Такой препарат сейчас находится на стадии разработки в Университете Пенсильвании при участии компании Novartis.
В будущем ученые рассмотрят вариант проведения CAR Т-клеточной терапии для лечения солидных опухолей, т.е. опухолей из эпителиальных низкодифференцированных клеток (в частности, рака молочной железы и рака кишечника). Сложность в создании специфичных для таких опухолей CAR заключается в постоянной мутации злокачественных клеток и непостоянстве состава поверхностных антигенов (молекул, которые распознают лимфоциты с CAR).
Схема проведения CAR Т-клеточной терапии
CAR Т-клеточная терапия использует собственные лейкоциты пациента для борьбы с раковыми клетками. Соответственно, первый этап терапии заключается в получении лейкоцитов пациента – это происходит в ходе экстракорпорального забора крови и лейкофереза (прямого получения из крови лейкоцитов). Помимо самого отбора лейкоцитов важен их качественный состав. В частности, из общего количества лейкоцитов удаляют моноциты, которые в естественных условиях тормозят активацию и размножение необходимых при проведении CAR Т-клеточной терапии Т-клеток.
В генетический код отобранных лейкоцитов внедряют новые участки, которые в дальнейшем обеспечат появление специфичных CAR на поверхности клеток. Новый генетический материал переносят в ДНК лейкоцитов при помощи обезвреженного вируса или транспозона (молекулы ДНК, способной мигрировать между геномами), эта методика не несет опасности заражения для пациента.
После получения обновленных лейкоцитов, содержащих CAR, клетки размножают в лабораторных условиях. Введение пациенту достаточного числа активных лейкоцитов с CAR – обязательное условие проведения эффективного лечения. Этот лабораторный этап наиболее продолжителен по времени и может занимать до 22 дней.
Для экономии времени был предложен вариант использования донорских лейкоцитов. Это позволило бы заранее подготовить вакцину в необходимом количестве. В дополнение, можно было бы избежать травматичного забора крови у пациента с лейкемией. Работу в этом направлении вела компания Cellectis, при участии компаний Servier и Pfizer. К сожалению, созданный на основе донорских лейкоцитов препарат UCART19 не был допущен к применению из-за высокой смертности среди пациентов.
В 2017 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration, FDA) по результатам клинических исследований утвердило два препарата для проведения CAR Т-клеточной терапии.
Первым препаратом, разрешенным к применению 30.08.2017, стал Kymriah (международное название – тисагенлеклусел) компании Novartis. Kymriah эффективен в лечении В-клеточного острого лимфолейкоза (ОЛЛ) у детей и взрослых в возрасте до 25 лет. Особое значение это имеет при лечении более взрослых пациентов, поскольку в детском возрасте пятилетняя выживаемость при ОЛЛ достигает 90 %.
Согласно результатам клинического исследования ELIANA, при лечении этим препаратом 83 % пациентов достигают ремиссии. Также стоит отметить, что терапию Kymriah рекомендуют тем пациентам, которые не ответили на несколько видов лечения, включая безуспешную пересадку костного мозга. Развитие рецидива заболевания также не является препятствием к применению Kymriah.
Препятствием к широкому применению Kymriah остается высокая стоимость терапии. Цена за создание и введение препарата, без учета стоимости госпитализации, достигает 475 000 долларов. На первый взгляд эта сумма довольно существенна, но она гораздо меньше затрат на пересадку костного мозга и последующее пожизненное медикаментозное лечение. В дополнение, производители препарата обещают сделать лечение бесплатным для тех пациентов, которые не получили от него значимой пользы в течение 1 месяца.
Несмотря на утверждение препарата для применения в практической медицине, исследования его действия продолжаются. Сейчас Kymriah проходит этап постмаркетинговых наблюдательных исследований.
Вторым препаратом, разрешенным к применению для CAR Т-клеточной терапии 18.10.2017, является Yescarta (международное название – аксикабтаген цилолейцел) компании Kite Pharma Inc. Yescarta применяется для лечения поздних стадий неходжкинских лимфом у взрослых.
Аналогично Kymriah, Yescarta назначают пациентам при отсутствии ответа на лечение или рецидиве после проведения минимум двух типов терапии. Единственное ограничение к применению препарата – первичное поражение лимфомой головного или спинного мозга.
Что касается эффективности, то при обследовании 100 пациентов с резистентной к лечению или рецидивирующей В-клеточной лимфомой 51 % пациентов достиг полной ремиссии после однократного вливания препарата. У 72 % пациентов наблюдалась положительная реакция на препарат.
Стоимость курса CAR Т-клеточной терапии препаратом Yescarta достигает 373 000 долларов. Производители ищут способы удешевить этапы производства препарата, делая лечение более доступным для рядового пациента.
Побочное действие CAR Т-клеточной терапии
CAR Т-клеточная терапия дает шанс собственным иммунным клеткам пациента увидеть и уничтожить клетки опухоли. При этом мощная стимуляция иммунитета неизбежно оказывает действие на организм в целом и часто приводит к развитию серьезных побочных явлений. Медицинские учреждения, в которых проводится CAR Т-клеточная терапия, проходят специальную сертификацию. Перед началом лечения пациентам подробно рассказывают о возможных побочных явлениях, чтобы у них была возможность оценить все риски лечения.
Побочные реакции на препараты развиваются в течение 1-22 дней после инфузии. К побочным реакциям относят:
- Снижение количества лейкоцитов, ослабление иммунной системы, развитие инфекционных заболеваний
- Анемию, артериальную гипотензию
- В редких случаях – острую почечную недостаточность
- Неврологическую симптоматику, в тяжелых случаях – отек головного мозга
Наиболее действенный способ противодействовать синдрому выброса цитокинов – применение лекарственных средств-блокаторов. В частности, к таким препаратам относится Актемра (международное название – тоцилизумаб), которая блокирует действие интерлейкина-6. Также эффективны обычные нестероидные противовоспалительные средства (например, Диклофенак).
Перспективы CAR Т-клеточной терапии
CAR Т-клеточная терапия – молодая методика, требующая длительного дальнейшего изучения. В настоящее время проходит более 200 клинических исследований, ставящих перед собой различные вопросы.
Наиболее актуальны следующие из них:
ГМ-лимфоциты помогли половине испытуемых с множественной миеломой
Китайские исследователи опубликовали в журнале Proceedings of the National Academy of Sciences результаты предварительного клинического испытания терапии ГМ-лимфоцитами множественной миеломы (Xu et al., Exploratory trial of a biepitopic CAR T-targeting B cell maturation antigen in relapsed/refractory multiple myeloma). Из семнадцати испытуемых восемь достигли полной ремиссии или значительного уменьшения опухоли, один пациент умер от цитокинового шторма.
При рецидивирующей множественной миеломе происходит злокачественная трансформация В-клеток, локализующихся в костном мозге. ГМ-лимфоциты (CAR-T) хорошо показали себя при лечении других опухолей крови, но пока только два вида терапии одобрены FDA и оба используются для лечения острого лимфобластного лейкоза. Лечение CART подразумевает модификацию Т-клеток пациента, в которые встраивают химерные рецепторы. ДНК-последовательности этих рецепторов сконструированы в лаборатории и при их вставке клетки пациента получают способность довольно аккуратно распознавать клетки опухоли и уничтожать их так же, как они это обычно делают с чужеродными патогенами.
Чтобы рецептор смог распознать раковую клетку, необходимо предварительно определиться с мишенью, которую он будет связывать: в идеале это должен быть белок, который есть на поверхности всех злокачественных клеток и отсутствует у здоровых. При остром лейкозе это обычно белок CD19, а в данном случае было решено выбрать белок BCMA. Он необходим для выживания плазматических B-клеток и его ген обычно довольно активен в миеломе. Клетки LCAR-B38M умеют узнавать его сразу по двум участкам и хорошо себя зарекомендовали в предыдущих исследованиях, поэтому были выбраны для клинических испытаний группой под руководством Цзе Сюй (Jie Xu).
В испытаниях приняли участие 17 пациентов с рецидивирующей формой множественной миеломы, при которой прогноз особенно неблагоприятный. Было протестировано два варианта терапии, при которых доза LCAR-B38M попадает в организм сразу или же разделена на три части и вводится поэтапно, но никакой разницы между этими способами исследователи не заметили. Терапия поначалу оказала положительный эффект на 15 человек, но к завершению наблюдений, длившихся в среднем 417 дней, у семерых из них миелома рецидивировала.

Динамика состояния пациентов. Рисунок из статьи в PNAS.
На одного из двух оставшихся пациентов терапия не подействовала, а другой умер от цитокинового шторма — так называют ситуацию, при которой реакция иммунной системы на опухолевые клетки оказывается настолько сильной и резкой, что организм не успевает подготовиться и воспаление выходит из-под контроля, охватывая весь организм. Это распространенный побочный эффект при терапии ГМ-лимфоцитами и не первый случай гибели пациентов в ходе клинических испытаний. Все остальные пациенты в данном исследовании тоже испытали этот побочный эффект терапии в разной степени, но его удалось скомпенсировать.
В ходе недавнего исследования ученым удалось подобрать средство, помогающее при цитокиновом шторме. Они предлагают блокировать рецепторы к молекулам цитокинов при помощи ингибиторов, вводимых извне или уже встроенных в ГМ-лимфоцит.
Читайте также:

