Валентность алюминия в соединениях с хлором
Общие сведения о валентности алюминия
Алюминий – серебристо-белый легкий металл. Он легко вытягивается в проволоку и прокатывается в тонкие листы. Кристаллизуется в гранецентрированной кубической решетке. Обладает высокой электрической проводимостью и теплопроводностью. Температуры плавления и кипения равны 660 o С и -2500 o С, соответственно.
При комнатной температуре алюминий не изменяется на воздухе, но лишь потому, что его поверхность покрыта тонкой пленкой оксида, обладающей очень сильным защитным действием.
Валентность алюминия в соединениях
Алюминий — тринадцатый по счету элемент Периодической таблицы Д.И. Менделеева. Он находится в третьем периоде в IIIA группе. В ядре атома алюминия содержится 13 протонов и 14 нейтронов (массовое число равно 27). В атоме алюминия есть три энергетических уровня, на которых находятся 13 электронов (рис. 1).
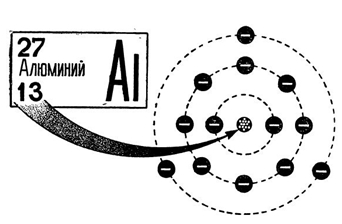
Рис. 1. Строения атома алюминия.
Электронная формула атома алюминия в основном состоянии имеет следующий вид:
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
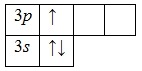
Так как на третьем энергетическом слое помимо 3s-подуровня есть еще и 3p-подуровень, две орбитали которого не заняты электронами, то пара электронов 3s-подуровня распаривается и один из них занимает вакантную орбиталь 3p-подуровня. Это означает, что для атома алюминия характерно наличие возбужденного состояния:
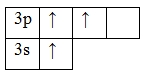
Наличие трех неспаренных электронов свидетельствует о том, что алюминий проявляет валентность III в своих соединения (Al III 2O3, Al III (OH)3, Al III Cl3и др.). Валентность алюминия постоянная.
Примеры решения задач
| Задание | С какими из перечисленных ниже веществ реагирует алюминий: а) хлор; б) сера; в) серная кислота; г) гидроксид калия; д) хлорид калия? Составьте уравнения реакций. |
| Ответ | Алюминий взаимодействует с простыми веществами неметаллами хлором (обычные условия) и серой (при нагревании) с образованием хлорида и сульфида алюминия: |
Алюминий способен растворяться в щелочах с образованием комплексных солей — алюминатов:
Алюминий растворяется в разбавленной серной кислоте с образованием сульфата алюминия:
| Задание | Вычислите объем водорода (н.у.), который образуется при растворении алюминия массой 8,1 г в водном растворе щелочи (гидроксида натрия). |
| Решение | В ходе указанной реакции происходит образование комплексной соли – тетрагидроксоалюмината натрия: |
Рассчитаем количество вещества алюминия, вступившего в реакцию (молярная масса равна 23 г/моль):
n(Al) = m (Al) / M (Al);
n(Al) =8,1 / 23 = 0,35 моль.
Согласно уравнению реакции n (Al) :n (H2) = 2: 3. Значит, количество моль водорода будет равно:
n (H2) = 3/2 × n (Al) = 3/2 × 0,35 = 0,525 моль.
Тогда, объем выделившегося водорода будет равен:
V (H2) = 0,525 × 22,4 = 11,76 л.
I. Понятие “валентность”

Состав большинства веществ постоянен. Например, молекула воды всегда содержит 2 атома водорода и 1 атом кислорода – Н2О. Возникает вопрос: почему вещества имеют постоянный состав?
Проанализируем состав предложенных веществ: Н2О, NaH, NH3, CH4, HCl. Все они состоят из атомов двух химических элементов, один из которых водород. На один атом химического элемента может приходиться 1,2,3,4 атома водорода. Но ни в одном веществе не будет на один атом водорода приходиться несколько атомов другого химического элемента. Таким образом, атом водорода может присоединять к себе минимальное количество атомов другого элемента, а точнее, только один.
Валентность – это способность атомов присоединять к себе определенное число других атомов.
Валентность элемента можно представить как число, которое показывает, со сколькими атомами одновалентного элемента может соединяться атом данного элемента. Валентность элемента – это число связей, которое образует атом:

Na – одновалентен (одна связь)
H – одновалентен (одна связь)
O – двухвалентен (две связи у каждого атома)
S – шестивалентна (образует шесть связей с соседними атомами)
II. Правила определения валентности элементов в соединениях
Посмотрите видео по данной теме:

Валентность элементов необходимо знать, чтобы составлять химические формулы соединений.
Зная формулу вещества, состоящего из атомов двух химических элементов, и валентность одного из них, можно определить валентность другого элемента.
Пример 1. Определим валентность углерода в веществе СН4.
Пример 2. Определим валентность фосфорав соединении Р2О5.
Для этого необходимо выполнить следующие действия:
1. Над знаком кислорода записать значение его валентности – II (кислород имеет постоянное значение валентности);
2. Умножив валентность кислорода на число атомов кислорода в молекуле, найти общее число единиц валентности – 2·5=10;
3. Разделить полученное общее число единиц валентностей на число атомов фосфора в молекуле – 10:2=5.
IV. Cоставление бинарных формулпо валентностям химических элементов

Бинарная химическая формула – это формула химического соединения, в состав которого входят два вида атомов.
V. Задания для закрепления
Задание №1.
Даны химические элементы и указана их валентность. Составьте соответствующие химические формулы:
I II V IV III VII III II IV III
Li O, Ba O, P O, SnO, P H, MnO, Fe O, H S, N O, Cr Cl
Задание №2.
Составьте формулы молекул для следующих соединений:
1) меди и кислорода,
2) цинка и хлора,
4) магния и серы.
Задание №3.
Используя материалы лекции составьте бинарные формулы следующими элементами:
А) бор и кислород;
Б) алюминий и хлор;
В) литий и сера.
Задание №4
Определите валентность химических элементов по формулам их соединений:
Алюминий в таблице менделеева занимает 13 место, в 3 периоде.
| Символ | Al |
| Номер | 13 |
| Атомный вес | 26.9815385 |
| Латинское название | Aluminium |
| Русское название | Алюминий |
Электронная схема алюминия
Al: 1s 2 2s 2 2p 6 3s 2 3p 1
Короткая запись:
Al: [Ne]3s 2 3p 1
Одинаковую электронную конфигурацию имеют атом алюминия и Si +1 , P +2 , S +3 , Cl +4
Порядок заполнения оболочек атома алюминия (Al) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ - до 6, на ‘d’ - до 10 и на ‘f’ до 14
Алюминий имеет 13 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
1 электрон на 3p-подуровне
Степень окисления алюминия
Атомы алюминия в соединениях имеют степени окисления 3, 1.
Степень окисления - это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы алюминия
Валентность Al
Атомы алюминия в соединениях проявляют валентность III, I.
Валентность алюминия характеризует способность атома Al к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Al
Квантовые числа определяются последним электроном в конфигурации, для атома Al эти числа имеют значение N = 3, L = 1, Ml = -1, Ms = ½
Видео заполнения электронной конфигурации (gif):
Результат: 
Энергия ионизации
Чем ближе электрон к центру атома - тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации - это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Перейти к другим элементам таблицы менделеева
Валентность (лат. valere - иметь значение) - мера "соединительной способности" химического элемента, равная числу индивидуальных химических связей, которые может образовать один атом.
Определяют валентность по числу связей, которые один атом образует с другими. Для примера рассмотрим молекулу

Для определения валентности нужно хорошо представлять графические формулы веществ. В этой статье вы увидите множество формул. Сообщаю вам также о химических элементах с постоянной валентностью, знать которые весьма полезно.

В электронной теории считается, что валентность связи определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии. Мы касались с вами темы валентных электронов и возбужденного состояния атома. На примере фосфора объединим эти две темы для полного понимания.

Подавляющее большинство химических элементов обладает непостоянным значением валентности. Переменная валентность характерна для меди, железа, фосфора, хрома, серы.
Ниже вы увидите элементы с переменной валентностью и их соединения. Заметьте, определить их непостоянную валентность нам помогают другие элементы - с постоянной валентностью.

Запомните, что у некоторых простых веществ валентность принимает значения: III - у азота, II - кислорода. Подведем итог полученным знаниям, написав графические формулы азота, кислорода, углекислого и угарного газов, карбоната натрия, фосфата лития, сульфата железа (II) и ацетата калия.

Как вы заметили, валентности обозначаются римскими цифрами: I, II, III и т.д. На представленных формулах валентности веществ равны:
- N - III
- O - II
- H, Na, K, li - I
- S - VI
- C - II (в угарном газе CO), IV (в углекислом газе CO2 и карбонате натрия Na2CO3
- Fe - II
Степенью окисления (СО) называют условный показатель, который характеризует заряд атома в соединении и его поведение в ОВР (окислительно-восстановительной реакции). В простых веществах СО всегда равна нулю, в сложных - ее определяют исходя из постоянных степеней окисления у некоторых элементов.
Численно степень окисления равна условному заряду, который можно приписать атому, руководствуясь предположением, что все электроны, образующие связи, перешли к более электроотрицательному элементу.
Определяя степень окисления, одним элементам мы приписываем условный заряд "+", а другим "-". Это связано с электроотрицательностью - способностью атома притягивать к себе электроны. Знак "+" означает недостаток электронов, а "-" - их избыток. Повторюсь, СО - условное понятие.

Сумма всех степеней окисления в молекуле равна нулю - это важно помнить для самопроверки.
Зная изменения электроотрицательности в периодах и группах периодической таблицы Д.И. Менделеева, можно сделать вывод о том какой элемент принимает "+", а какой минус. Помогают в этом вопросе и элементы с постоянной степенью окисления.
Кто более электроотрицательный, тот сильнее притягивает к себе электроны и "уходит в минус". Кто отдает свои электроны и испытывает их недостаток - получает знак "+".

Самостоятельно определите степени окисления атомов в следующих веществах: RbOH, NaCl, BaO, NaClO3, SO2Cl2, KMnO4, Li2SO3, O2, NaH2PO4. Ниже вы найдете решение этой задачи.
Сравнивайте значение электроотрицательности по таблице Менделеева, и, конечно, пользуйтесь интуицией :) Однако по мере изучения химии, точное знание степеней окисления должно заменить даже самую развитую интуицию ;-)

Особо хочу выделить тему ионов. Ион - атом, или группа атомов, которые за счет потери или приобретения одного или нескольких электронов приобрел(и) положительный или отрицательный заряд.
Определяя СО атомов в ионе, не следует стремиться привести общий заряд иона к "0", как в молекуле. Ионы даны в таблице растворимости, они имеют разные заряды - к такому заряду и нужно в сумме привести ион. Объясню на примере.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Алюминий в таблице менделеева занимает 13 место, в 3 периоде.
| Символ | Al |
| Номер | 13 |
| Атомный вес | 26.9815385 |
| Латинское название | Aluminium |
| Русское название | Алюминий |
Электронная схема алюминия
Al: 1s 2 2s 2 2p 6 3s 2 3p 1
Короткая запись:
Al: [Ne]3s 2 3p 1
Одинаковую электронную конфигурацию имеют атом алюминия и Si +1 , P +2 , S +3 , Cl +4
Порядок заполнения оболочек атома алюминия (Al) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ - до 6, на ‘d’ - до 10 и на ‘f’ до 14
Алюминий имеет 13 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
1 электрон на 3p-подуровне
Степень окисления алюминия
Атомы алюминия в соединениях имеют степени окисления 3, 1.
Степень окисления - это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы алюминия
Валентность Al
Атомы алюминия в соединениях проявляют валентность III, I.
Валентность алюминия характеризует способность атома Al к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Al
Квантовые числа определяются последним электроном в конфигурации, для атома Al эти числа имеют значение N = 3, L = 1, Ml = -1, Ms = ½
Видео заполнения электронной конфигурации (gif):
Результат: 
Энергия ионизации
Чем ближе электрон к центру атома - тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации - это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Перейти к другим элементам таблицы менделеева
Степень окисления алюминия характеризует валентность химического элемента, отражает его способность образовывать соединения. Это свойство учитывается при разведке месторождений руд, богатых на ценный компонент, технологии их обогащения, очистки от примесей второстепенных соединений и применении в разных отраслях производства.

Физические и химические параметры элемента
Алюминий — химический элемент с атомным номером 13, представляющий собой металл серебристо-белого цвета. Его название происходит от латинского слова alumen — квасцы. Практически во всех соединениях химический элемент проявляет валентность 3.
- Кристаллизация химического элемента происходит в кубической гранецентрированной решетке. Металл может окисляться при комнатной температуре. При этом его поверхность покрывается тонкой оксидной пленкой, выполняющей защитную функцию.
- Температура плавления химически чистого алюминия 660 °C, кипения – 2450 °C. Плотность металла при нормальных условиях составляет 2,6989 г/см3.
- На воздухе алюминий окисляется с образованием тонкой пленки, которая препятствует дальнейшему реагированию с металлом. Такое защитное соединение формируется, если поместить алюминий в концентрат азотной кислоты.
- Металл активно взаимодействует с соляной кислотой. При реакции со щелочами сначала разрушается защитный оксидированный слой, а затем происходит реакция с образованием алюминатов натрия, калия (в зависимости от вида щелочного соединения).
- При нагревании химический элемент реагирует с бромом и хлором. При взаимодействии с серой образуется сульфид алюминия, который легко растворяется в воде. С водородом металл реагирует косвенно путем искусственного синтеза органических соединений. В результате образуется сильнейший восстановитель — полимерный гидрид алюминия.
- При сжигании порошкообразного металла на воздухе образуется тугоплавкий порошок оксида химического элемента, соединение которого обладает высокой прочностью. Это свойство используется для восстановления металлов из их окислов.
- В лабораторных условиях соединения алюминия, содержащие гидроксильную группу OH, можно получить в результате обменных реакций или за счет добавления в раствор соды или аммиака. Соединение алюминия оседает на дно в виде гелеобразного осадка.
Технологии извлечения алюминия
Химический элемент № 13 является самым распространенным в природе, его содержание в земной коре составляет около 9%. Металл входит в состав более 250 минералов, главным образом, алюмосиликатов, из которых состоит земная кора.
Продуктом разрушения образований является глина, состоящая из каолинита. В ней иногда содержится примесь железа, придающая бурый цвет.
Несмотря на то, что в природе существует много минеральных образований, не все они являются рудным материалом для извлечения ценного компонента. Для добычи используют бокситовые руды, в которых содержится промышленная концентрация металла.
Алюминий образует минерал корунд, по твердости уступающий алмазу. Содержание в алюминиевом соединении Al2O3 примеси оксида хрома, титана и железа формирует драгоценные минералы рубин и сапфир.
- Из обогащенной руды ценный компонент извлекают путем электролиза раствора оксида в расплавленном соединении фтора, натрия и алюминия (криолите). Такой способ позволяет проводить электролиз при температуре менее 1000 °C.
- Благодаря низкой плотности расплава, жидкое соединение опускается на дно, что облегчает извлечение. При электролитическом получении металла для начала из глинозема выделяют чистый оксид Al2O3.
- Перед использованием руду очищают от примесей соединений железа, кремния, кальция. При обжиге бокситов испаряется содержащаяся в минералах вода. Полученный материал разделяют при воздействии углекислого газа на соединение.
Широко применяется в производстве чистого алюминия химический способ. Он состоит в обработке руды щелочью NaOH при температуре 220 °C с получением Al (OH)2. В результате гидролиза раствора происходит окисление алюминия и осаждение его соединения.

Потом в результате использования углекислого газа получают соду и поташ. Для получения химически чистого материала технический материал нагревают в парах AlF3 с последующим охлаждением. В результате изменения температуры происходит выделение чистого алюминия.
Производство металла высокой чистоты предусматривают разработку новых технологий и создание условий, при которых металл может оксидировать без дополнительных затрат энергии.
Один из новых методов предусматривает синтез оксида алюминия высокой чистоты методом каталитического окисления металла кислородом воды с применением ультразвуковых колебаний, разработку автокаталитического способа получения субмикронного порошка с последующим формирование брикет высокой плотности.
Сферы использования металла и его соединений
Значительное количество алюминия находится в фарфоре, кирпиче, цементе. По масштабам использования сплавы металла уступают место железу. Широкое применение алюминиевых материалов в различных отраслях связано с рядом физических и химических параметров:
- невысокая плотность;
- металл не ржавеет, обладает устойчивостью к коррозии;
- имеет высокую электропроводность;
- легко поддается штамповке, прокату и обладает ковкостью;
- пластичен и прочен;
- на поверхности алюминиевых сплавов легко наносятся декоративные и защитные покрытия.
При добавлении разных лигатурных компонентов сплавы на основе алюминия приобретают новые свойства, формируя интерметаллические соединения или твердые растворы.
Не все материалы способны образовывать оксидные пленки даже принудительно. Для сохранения антикоррозионных свойств материала кислотно-щелочной баланс должен соответствовать диапазону от 6 до 8 единиц.
Чистый алюминий практически не подвергается воздействию агрессивной среды. Даже тонкое покрытие поверхности металлом без примесей способно предотвратить реакцию.
Основную массу металла используют для получения легких сплавов:
- дюралюминия, в котором находится 94% алюминия, 4% меди, по 0,5% железа, марганца, кремния и магния;
- силумина — до 90% основа, до 14% кремний и натрий.

В металлургии химический элемент используют в качестве лигатурной добавки в составы на основе меди, никеля, железа, магния. Такие соединения широко применяются в автомобилестроении, в быту, авиационной технике.
Из сплава с основным содержанием алюминия был изготовлен первый искусственный спутник планеты Земля. В виде порошка его используют как компонент ракетного топлива. Эта идея принадлежит Ф. А. Цандеру. Сплав металла с цирконием используют в строительстве ядерных реакторов, изготовлении взрывчатых материалов.
Электрохимическим способом на поверхности ювелирной бижутерии наносят защитные окрашенные пленки, по внешнему виду напоминающие золото. Сплав алюминия с золотом, обладающий насыщенным фиолетовым цветом, используют в качестве вставок в украшения.
При обращении с металлом в домашних условиях нужно соблюдать правила эксплуатации посуды из алюминия. Чтобы продукты не окислились, то их стоит хранить в эмалированной или стеклянной посуде.
Готовить в посуде из алюминия можно нейтральные жидкости, например, воду или молоко. Кислые блюда реагируют с металлом и приобретают неприятный вкус в результате разрушения оксидной пленки.
Металл можно расплавить в домашних условиях с целью изготовления различных деталей методом литья. В промышленном производстве в качестве материала для форм используют металл с высшей температурой плавления, а в кустарных условиях для этой цели применяют гипс.
Валентность химических элементов – это способность у атомов хим. элементов образовывать некоторое число химических связей. Принимает значения от 1 до 8 и не может быть равна 0.
Определяется числом электронов атома затраченых на образование хим. связей с другим атомом. Валентность это реальная величина. Обозначается римскими цифрами (I ,II, III, IV, V, VI, VII, VIII).
Валентность химических элементов (Таблица)
Как можно определить валентность в соединениях:
- Валентность водорода (H) постоянна всегда 1. Отсюда в соединении H2O валентность O равна 2.
- Валентность кислорода (O) постоянна всегда 2. Отсюда в соединении СО2 валентность С равно 4.
- Высшая валентность всегда равна № группы.
- Низшая валентность равна разности между числом 8 (количество групп в Таблице Менделеева) и номером группы, в которой находится элемент.
- У металлов в подгруппах А таблицы Менделеева, валентность = № группы.
- У неметаллов обычно две валентности: высшая и низшая.

Валентность химических элементов может быть постоянной и переменной. Постоянная в основном у металлов главных подгрупп, переменная у неметаллов и металлов побочных подгруп.
| Атомный № | Химический элемент | Символ | Валентность химических элементов | Примеры соединений |
| 1 | Водород / Hydrogen | H | I | HF |
| 2 | Гелий / Helium | He | отсутствует | — |
| 3 | Литий / Lithium | Li | I | Li2O |
| 4 | Бериллий / Beryllium | Be | II | BeH2 |
| 5 | Бор / Boron | B | III | BCl3 |
| 6 | Углерод / Carbon | C | IV, II | CO2, CH4 |
| 7 | Азот / Nitrogen | N | III, IV | NH3 |
| 8 | Кислород / Oxygen | O | II | H2O, BaO |
| 9 | Фтор / Fluorine | F | I | HF |
| 10 | Неон / Neon | Ne | отсутствует | — |
| 11 | Натрий / Sodium | Na | I | Na2O |
| 12 | Магний / Magnesium | Mg | II | MgCl2 |
| 13 | Алюминий / Aluminum | Al | III | Al2O3 |
| 14 | Кремний / Silicon | Si | IV | SiO2, SiCl4 |
| 15 | Фосфор / Phosphorus | P | III, V | PH3, P2O5 |
| 16 | Сера / Sulfur | S | VI, IV, II | H2S, SO3 |
| 17 | Хлор / Chlorine | Cl | I, III, V, VII | HCl, ClF3 |
| 18 | Аргон / Argon | Ar | отсутствует | — |
| 19 | Калий / Potassium | K | I | KBr |
| 20 | Кальций / Calcium | Ca | II | CaH2 |
| 21 | Скандий / Scandium | Sc | III | Sc2S3 |
| 22 | Титан / Titanium | Ti | II, III, IV | Ti2O3, TiH4 |
| 23 | Ванадий / Vanadium | V | II, III, IV, V | VF5, V2O3 |
| 24 | Хром / Chromium | Cr | II, III, VI | CrCl2, CrO3 |
| 25 | Марганец / Manganese | Mn | II, III, IV, VI, VII | Mn2O7, Mn2(SO4)3 |
| 26 | Железо / Iron | Fe | II, III | FeSO4, FeBr3 |
| 27 | Кобальт / Cobalt | Co | II, III | CoI2, Co2S3 |
| 28 | Никель / Nickel | Ni | II, III, IV | NiS, Ni(CO)4 |
| 29 | Медь / Copper | Сu | I, II | CuS, Cu2O |
| 30 | Цинк / Zinc | Zn | II | ZnCl2 |
| 31 | Галлий / Gallium | Ga | III | Ga(OH)3 |
| 32 | Германий / Germanium | Ge | II, IV | GeBr4, Ge(OH)2 |
| 33 | Мышьяк / Arsenic | As | III, V | As2S5, H3AsO4 |
| 34 | Селен / Selenium | Se | II, IV, VI, | H2SeO3 |
| 35 | Бром / Bromine | Br | I, III, V, VII | HBrO3 |
| 36 | Криптон / Krypton | Kr | VI, IV, II | KrF2, BaKrO4 |
| 37 | Рубидий / Rubidium | Rb | I | RbH |
| 38 | Стронций / Strontium | Sr | II | SrSO4 |
| 39 | Иттрий / Yttrium | Y | III | Y2O3 |
| 40 | Цирконий / Zirconium | Zr | II, III, IV | ZrI4, ZrCl2 |
| 41 | Ниобий / Niobium | Nb | I, II, III, IV, V | NbBr5 |
| 42 | Молибден / Molybdenum | Mo | II, III, IV, V, VI | Mo2O5, MoF6 |
| 43 | Технеций / Technetium | Tc | I — VII | Tc2S7 |
| 44 | Рутений / Ruthenium | Ru | II — VIII | RuO4, RuF5, RuBr3 |
| 45 | Родий / Rhodium | Rh | I, II, III, IV, V | RhS, RhF3 |
| 46 | Палладий / Palladium | Pd | I, II, III, IV | Pd2S, PdS2 |
| 47 | Серебро / Silver | Ag | I, II, III | AgO, AgF2, AgNO3 |
| 48 | Кадмий / Cadmium | Cd | II | CdCl2 |
| 49 | Индий / Indium | In | III | In2O3 |
| 50 | Олово / Tin | Sn | II, IV | SnBr4, SnF2 |
| 51 | Сурьма / Antimony | Sb | III, IV, V | SbF5, SbH3 |
| 52 | Теллур / Tellurium | Te | VI, IV, II | TeH2, H6TeO6 |
| 53 | Иод / Iodine | I | I, III, V, VII | HIO3, HI |
| 54 | Ксенон / Xenon | Xe | II, IV, VI, VIII | XeF6, XeO4, XeF2 |
| 55 | Цезий / Cesium | Cs | I | CsCl |
| 56 | Барий / Barium | Ba | II | Ba(OH)2 |
| 57 | Лантан / Lanthanum | La | III | LaH3 |
| 58 | Церий / Cerium | Ce | III, IV | CeO2 , CeF3 |
| 59 | Празеодим / Praseodymium | Pr | III, IV | PrF4, PrO2 |
| 60 | Неодим / Neodymium | Nd | III | Nd2O3 |
| 61 | Прометий / Promethium | Pm | III | Pm2O3 |
| 62 | Самарий / Samarium | Sm | II, III | SmO |
| 63 | Европий / Europium | Eu | II, III | EuSO4 |
| 64 | Гадолиний / Gadolinium | Gd | III | GdCl3 |
| 65 | Тербий / Terbium | Tb | III, IV | TbF4, TbCl3 |
| 66 | Диспрозий / Dysprosium | Dy | III | Dy2O3 |
| 67 | Гольмий / Holmium | Ho | III | Ho2O3 |
| 68 | Эрбий / Erbium | Er | III | Er2O3 |
| 69 | Тулий / Thulium | Tm | II, III | Tm2O3 |
| 70 | Иттербий / Ytterbium | Yb | II, III | YO |
| 71 | Лютеций / Lutetium | Lu | III | LuF3 |
| 72 | Гафний / Hafnium | Hf | II, III, IV | HfBr3, HfCl4 |
| 73 | Тантал / Tantalum | Ta | I — V | TaCl5, TaBr2, TaCl4 |
| 74 | Вольфрам / Tungsten | W | II — VI | WBr6, Na2WO4 |
| 75 | Рений / Rhenium | Re | I — VII | Re2S7, Re2O5 |
| 76 | Осмий / Osmium | Os | II — VI, VIII | OsF8, OsI2, Os2O3 |
| 77 | Иридий / Iridium | Ir | I — VI | IrS3, IrF4 |
| 78 | Платина / Platinum | Pt | I, II, III, IV, V | Pt(SO4)3, PtBr4 |
| 79 | Золото / Gold | Au | I, II, III | AuH, Au2O3, Au2Cl6 |
| 80 | Ртуть / Mercury | Hg | II | HgF2, HgBr2 |
| 81 | Талий / Thallium | Tl | I, III | TlCl3, TlF |
| 82 | Свинец / Lead | Pb | II, IV | PbS, PbH4 |
| 83 | Висмут / Bismuth | Bi | III, V | BiF5, Bi2S3 |
| 84 | Полоний / Polonium | Po | VI, IV, II | PoCl4, PoO3 |
| 85 | Астат / Astatine | At | нет данных | — |
| 86 | Радон / Radon | Rn | отсутствует | — |
| 87 | Франций / Francium | Fr | I | — |
| 88 | Радий / Radium | Ra | II | RaBr2 |
| 89 | Актиний / Actinium | Ac | III | AcCl3 |
| 90 | Торий / Thorium | Th | II, III, IV | ThO2, ThF4 |
| 91 | Проактиний / Protactinium | Pa | IV, V | PaCl5, PaF4 |
| 92 | Уран / Uranium | U | III, IV | UF4, UO3 |
| 93 | Нептуний | Np | III — VI | NpF6, NpCl4 |
| 94 | Плутоний | Pu | II, III, IV | PuO2, PuF3, PuF4 |
| 95 | Америций | Am | III — VI | AmF3, AmO2 |
| 96 | Кюрий | Cm | III, IV | CmO2, Cm2O3 |
| 97 | Берклий | Bk | III, IV | BkF3, BkO2 |
| 98 | Калифорний | Cf | II, III, IV | Cf2O3 |
| 99 | Эйнштейний | Es | II, III | EsF3 |
| 100 | Фермий | Fm | II, III | — |
| 101 | Менделевий | Md | II, III | — |
| 102 | Нобелий | No | II, III | — |
| 103 | Лоуренсий | Lr | III | — |
| Номер | Элемент | Символ | Валентность химических элементов | Пример |
Электроотрицательность. Степень окисления и валентность химических элементов
Электроотрицательность — способность атома какого-либо химического элемента в соединении оттягивать на себя электроны связанных с ним атомов других химических элементов.
Электроотрицательность, как и прочие свойства атомов химических элементов, изменяется с увеличением порядкового номера элемента периодически:
- График выше демонстрирует периодичность изменения электроотрицательности элементов главных подгрупп в зависимости от порядкового номера элемента.
- При движении вниз по подгруппе таблицы Менделеева электроотрицательность химических элементов уменьшается, при движении вправо по периоду возрастает.
- Электроотрицательность отражает неметалличность элементов: чем выше значение электроотрицательности, тем более у элемента выражены неметаллические свойства.
Степень окисления – условный заряд атома химического элемента в соединении, рассчитанный исходя из предположения, что все связи в его молекуле ионные, т.е. все связывающие электронные пары смещены к атомам с большей электроотрицательностью.
Степень окисления химических элементов в простых веществах всегда равна нулю.
Существуют элементы, проявляющие в сложных веществах постоянную степень окисления:
| Щелочные металлы, т.е. все металлы IA группы — Li, Na, K, Rb, Cs, Fr | +1 |
| Все элементы II группы, кроме ртути: Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd | +2 |
| Алюминий Al | +3 |
| Фтор F | -1 |
Существуют химические элементы, которые проявляют в подавляющем большинстве соединений постоянную степень окисления. К таким элементам относятся:
| водород H | +1 | Гидриды щелочных и щелочно-земельных металлов, например: |
| кислород O | -2 | Пероксиды водорода и металлов: Фторид кислорода — |
Алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю. Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
Высшая (максимальная) степень окисления равна номеру группы. Исключения, которые не попадают под это правило, — элементы побочной подгруппы I группы, элементы побочной подгруппы VIII группы, а также кислород и фтор.
Химические элементы, номер группы которых не совпадает с их высшей степенью окисления (обязательные к запоминанию)
| Кислород | VI | +2 (в OF2) |
| Фтор | VII | |
| Медь | I | +2 |
| Железо | VIII | +6 (например K2FeO4) |
Низшая степень окисления металлов всегда равна нулю, а низшая степень окисления неметаллов рассчитывается по формуле:
- низшая степень окисления неметалла = №группы − 8
Отталкиваясь от представленных выше правил, можно установить степень окисления химического элемента в любом веществе.
Валентность — число химических связей, которые образует атом элемента в химическом соединении.
Валентность атомов обозначается римскими цифрами: I, II, III и т.д.
Валентные возможности атома зависят от количества:
- неспаренных электронов
- неподеленных электронных пар на орбиталях валентных уровней
- пустых электронных орбиталей валентного уровня
Было сказано, что на валентные возможности могут влиять три фактора — наличие неспаренных электронов, наличие неподеленных электронных пар на внешнем уровне, а также наличие вакантных (пустых) орбиталей внешнего уровня.
Мы видим на внешнем (и единственном) энергетическом уровне один неспаренный электрон. Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне есть только один подуровень — s, т.е. атом водорода на внешнем уровне не имеет как неподеленных электронных пар, так и пустых орбиталей.
Таким образом, единственная валентность, которую может проявлять атом водорода, равна I.
Рассмотрим электронное строение атома углерода. В основном состоянии электронная конфигурация его внешнего уровня выглядит следующим образом:
Т.е. в основном состоянии на внешнем энергетическом уровне невозбужденного атома углерода находится 2 неспаренных электрона. В таком состоянии он может проявлять валентность, равную II.
Однако атом углерода очень легко переходит в возбужденное состояние при сообщении ему энергии, и электронная конфигурация внешнего слоя в этом случае принимает вид:
Несмотря на то что на процесс возбуждения атома углерода тратится некоторое количество энергии, траты с избытком компенсируются при образовании четырех ковалентных связей.
По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
Помимо неспаренных электронов и неподеленных электронных пар на валентные возможности также влияет наличие вакантных ( ) орбиталей валентного уровня.
Наличие таких орбиталей на заполняемом уровне приводит к тому, что атом может выполнять роль акцептора электронной пары, т.е. образовывать дополнительные ковалентные связи по донорно-акцепторному механизму.
Так, например, вопреки ожиданиям, в молекуле угарного газа CO связь не двойная, а тройная, что наглядно показано на следующей иллюстрации:
Резюмируя информацию по валентным возможностям атома углерода:
- Для углерода возможны валентности II, III, IV
- Наиболее распространенная валентность углерода в соединениях IV
- В молекуле угарного газа CO связь тройная (!), при этом одна из трех связей образована по донорно-акцепторному механизму
Как видно из иллюстрации выше, атом азота в своем обычном состоянии имеет 3 неспаренных электрона, в связи с чем логично предположить о его способности проявлять валентность, равную III. Действительно, валентность, равная трём, наблюдается в молекулах аммиака (NH3), азотистой кислоты (HNO2), треххлористого азота (NCl3) и т.д.
Выше было сказано, что валентность атома химического элемента зависит не только от количества неспаренных электронов, но также и от наличия неподеленных электронных пар.
Связано это с тем, что ковалентная химическая связь может образоваться не только, когда два атома предоставляют друг другу по одному электрону, но также и тогда, когда один атом, имеющий неподеленную пару электронов — донор( ) предоставляет ее другому атому с вакантной ( ) орбиталью валентного уровня (акцептору). Т.е.
для атома азота возможна также валентность IV за счет дополнительной ковалентной связи, образованной по донорно-акцепторному механизму. Так, например, четыре ковалентных связи, одна из которых образована по донорно-акцепторному механизму, наблюдается при образовании катиона аммония:
Несмотря на то что одна из ковалентных связей образуется по донорно-акцепторному механизму, все связи N-H в катионе аммония абсолютно идентичны и ничем друг от друга не отличаются.
Валентность, равную V, атом азота проявлять не способен. Связано это с тем, что для атома азота невозможен переход в возбужденное состояние, при котором происходит распаривание двух электронов с переходом одного из них на свободную орбиталь, наиболее близкую по уровню энергии.
Атом азота не имеет d-подуровня, а переход на 3s-орбиталь энергетически настолько затратен, что затраты энергии не покрываются образованием новых связей.
Многие могут задаться вопросом, а какая же тогда валентность у азота, например, в молекулах азотной кислоты HNO3 или оксида азота N2O5? Как ни странно, валентность там тоже IV, что видно из нижеследующих структурных формул:
Резюмируя информацию по валентным возможностям атома азота:
- Для азота возможны валентности I, II, III и IV
- Валентности V у азота не бывает!
- В молекулах азотной кислоты и оксида азота N2O5 азот имеет валентность IV, а степень окисления +5 (!).
- В соединениях, в которых атом азота четырехвалентен, одна из ковалентных связей образована по донорно-акцепторному механизму (соли аммония NH4+, азотная кислота и д.р).
Читайте также:

