Шунтирование печени при онкологии
1. Когда необходимо шунтирование сосудов печени?
Показанием для проведения внутрипеченочного портосистемного шунтирования является портальная гипертензия, для которой характерно устойчиво повышенное кровяного давление в воротной вене. Воротная вена является основным каналом доставки крови от кишечника к печени.
Если портальную гипертензию не лечить, развиваются тяжёлые осложнения, связанные с варикозным расширением вен органов пищеварения, а также печёночная энцефалопатия (наиболее опасное осложнение, при котором угнетаются нормальные функции печени).
Следствием высокого портального давления также становится увеличение селезёнки в размерах. Возникает высокий риск кровотечений из расширенных вен, проходящих в желудке и пищеводе.
2. Показания и противопоказания к внутрипечёночному портосистемному шунтированию
Наиболее частыми показаниями к имплантации шунта в портальную систему печени являются:
- острые кровотечения пищевода и желудка, связанные с варикозным расширением вен, не устраняемым терапевтически и не поддающимся другим методам лечения;
- профилактика при высоком риске кровотечений на фоне варикоза вен желудка и пищевода;
- портальная гастропатия (застой венозной крови в стенках желудка, угрожающий кровотечениями);
- гепаторенальный синдром;
- синдром Бадда-Киари (образование тромба в одной из вен, проходящих от печени к сердцу);
- рефрактерный асцит (скопление жидкости в брюшной полости);
- профилактическая хирургия после трансплантации печени при угрозе развития портальной гипертензии.
Ограничением к проведению портосистемного шунтирования могут стать тяжёлые печёночные нарушения, которые могут усугубиться после имплантации шунта. Кроме того, следует учитывать, что попадание продуктов метаболизма, из кишечника в общее кровяное русло, минуя печень, может вызвать специфическое поражение нервной системы – портосистемную энцефалопатию. Врач тщательно взвешивает и опирается на анамнестические сведения, оценивая существующую склонность к проявлениям энцефалопатии. Иногда побочный эффект от занесения в кровь неотфильтрованных печенью токсических веществ можно усранить посредством диеты или перестановкой стента.
Детям портосистемное шунтирование проводится, в основном, после пересадки печени. При этом возникают определённые трудности и риски, связанные с последующим ростом и изменением объёма перекачиваемой крови.
Стоит также упомянуть общие противопоказания для всех видов оперативного лечения:
- инфекционные заболевания в острой стадии;
- нарушения функции почек, сердечной деятельности;
- тяжёлые системные и психические заболевания.
Эти ограничения относительны, поэтому при наличии указанных обстоятельств в каждом конкретном случае решение о проведении операции принимается на медицинском консилиуме.
3. Техника проведения и риски операции внутрипеченочного портосистемного шунтирования
Современное медицинское оборудование позволяет проводить шунтирование печени малоинвазивно. Все манипуляции производятся под контролем мониторинга эндоскопически. Тем не менее, операционная должна быть укомплектована и готова к проведению экстренных реанимационный мероприятий, поскольку любые вмешательства на печени несут риск кровотечений, и других стремительно развивающихся осложнений.
При необходимости (сопутствующих патологиях или трудностях оперативного доступа) шунтирование проводится путём открытой полостной операции. Такой подход удлиняет восстановительный период, но может быть оправдан в ряде случаев.
Успешность операций внутрипечёночного портосистемного шунтирования составляет 90%, однако в ходе разработки плана операции врач всегда учитывает возможные риски:
- вероятность инфицирования (как при любой другом хирургическом лечении), этот риск в разы меньше при эндоскопическом методе;
- возможные аллергические реакции на используемые препараты;
- нарушения работы почек и сердца во время действия наркоза;
- кровотечения (риск такого плана всегда учитывается при любых операциях на сосудах).
Хирургическое удаление опухоли — единственный радикальный метод лечения рака печени. Однако, операцию можно выполнить далеко не у всех пациентов. Зачастую очагов много, и они разбросаны по всему органу, опухоли оказываются слишком большими или успевают прорасти в кровеносные сосуды, желчевыводящие пути, соседние органы.
При раке печени проводят два вида хирургических вмешательств:
- резекция — удаление части органа;
- трансплантация.
Возможность радикального хирургического лечения определяют по данным КТ и МРТ с ангиографией. При неоперабельных опухолях прибегают к возможностям интервенционной хирургии.
Резекция печени
Такая операция может быть выполнена только при определенных условиях:
- Опухоль локализованная (находится в одном месте) и не прорастает в кровеносные сосуды.
- Очаг относительно небольшого размера.
- Нет метастазов в лимфатических узлах и других органах.
- Ткань печени не поражена циррозом и может нормально справляться со своими функциями.
К сожалению, возможность удалить злокачественную опухоль есть далеко не всегда. В зависимости от объема, резекция печени может быть долевой, сегментарной, атипичной.

Насколько большую часть печени можно удалить во время операции? Печень обладает высокой способностью к регенерации, поэтому во время резекции врач может удалить достаточно большую часть органа. Прежний размер восстанавливается примерно через 6 месяцев. Однако, хирург должен действовать предельно аккуратно. Нужно постараться полностью удалить опухоль, при этом оставить как можно больший объем здоровой ткани.
Если обнаружен цирроз — означает ли это, что врачи однозначно откажут в операции? В целом цирроз является противопоказанием к резекции. Даже если удалить небольшое количество ткани, есть риск, что оставшаяся часть печени не сможет адекватно справляться со своими функциями.
Но иногда, если функции печени нарушены не сильно, операция всё же возможна. Для того чтобы оценить функциональное состояние органа, пользуются пятью критериями Чайлда-Пью: уровень билирубина и альбумина в крови, протромбиновое время (показатель свертываемости крови), наличие асцита (скопления жидкости в брюшной полости), печеночной энцефалопатии (поражения мозга в результате нарушения функции печени).
Пациентов делят на три класса:
- Класс A — когда все пять показателей в норме. У таких больных резекция, скорее всего, возможна.
- Класс B — легкие отклонения от нормы. Вероятность того, что пациента возьмут на операцию, ниже.
- Класс C — тяжелые отклонения. Хирургическое лечение противопоказано.
Почему резекция печени считается сложным хирургическим вмешательством? Проведение операции требует от хирурга большого опыта, потому что:
В Европейской онкологической клинике работают опытные врачи-гепатоонкологи и функционирует превосходно оснащенная операционная. Мы выполняем операции любой сложности при раке печени и других органов пищеварительной системы.
Трансплантация печени
Для некоторых онкобольных с нерезектабельным раком альтернативой может стать трансплантация печени. Хирург удаляет пораженный опухолью орган и заменяет его на донорский. Трансплантация возможна, когда есть один очаг не более 5 см в диаметре или 2–3 очага, диаметр каждого из которых не превышает 3 см. При этом опухоль не должна прорастать в кровеносные сосуды, не должно быть метастазов.
Получить донорскую печень можно от трупа или от живого донора, в роли которого обычно выступает близкий родственник. В России, как и во всех странах мира, ситуация с донорскими органами напряженная. Пересадка печени бывает необходима не только при раке, но и при других заболеваниях: вирусных гепатитах, циррозе, болезни Вильсона-Коновалова.
Хирургическая тактика в зависимости от стадии
Резектабельная опухоль I–II стадии. К сожалению, такая ситуация встречается редко, но она позволяет провести радикальную операцию, удалить пораженную часть органа, и после этого может наступить ремиссия. Хирургическое лечение дополняют курсом неоадъювантной химиотерапии.
Нерезектабельная опухоль, когда не поражены регионарные (близлежащие) лимфатические узлы, нет метастазов. Проводят паллиативную терапию. Прибегают к методам интервенционной хирургии:
- Радиочастотная аблация — процедура, во время которой тонкий электрод в виде иглы вводят в опухоль и разрушают её током высокой частоты.
- Химиоэмболизация — введение в сосуд, питающий опухоль, особого эмболизирующего препарата в сочетании с химиопрепаратом. Эмболизирующий препарат состоит из микрочастиц, которые блокируют приток крови к опухолевой ткани, а химиопрепарат уничтожает раковые клетки.
- Интраартериальное введение химиопрепаратов. Лекарство вводят в печеночную артерию, благодаря чему оно оказывает более мощное локальное действие и не поступает в общий кровоток. Такое лечение пациенты переносят лучше, чем системную химиотерапию (внутривенное введение препаратов).

Иногда эти меры помогают уменьшить опухоль и сделать её резектабельной.
Небольшая опухоль, которая неоперабельна из-за другого заболевания. Бывают ситуации, когда операцию нельзя проводить из-за цирроза или других противопоказаний, не связанных с самим раком. В таких случаях применяют радиочастотную аблацию, химиоэмболизацию, химиотерапию, таргетную терапию.
Рак печени, который успел распространиться в лимфатические узлы и метастазировать. Такие опухоли имеют неблагоприятный прогноз. Но даже в запущенных случаях пациенту можно помочь, облегчить симптомы при помощи правильного паллиативного лечения.
Рецидивирующий рак печени. Если рецидив локальный, без распространения в лимфоузлы и метастазов, можно повторно провести резекцию. В других случаях лечение будет носить паллиативный характер.
Операции при метастазах рака в печень
Чаще всего раковые клетки метастазируют в печень из опухолей легких, кишечника, желудка. Если есть один или несколько мелких очагов, проводят резекцию. В других случаях применяют радиочастотную аблацию, химиоэмболизацию, назначают химиотерапию, таргетную терапию.
В Европейской онкологической клинике проводятся миниинвазивные вмешательства, которые помогают справиться с осложнениями рака: механической желтухой, асцитом.
Сколько живут после операции при раке печени?
Рак печени — злокачественная опухоль, с которой очень сложно бороться. Даже после резекции в течение 5 лет остается в живых не более 20% больных.
После радикальной операции в печени могут продолжаться патологические процессы, которые вызвали рак, со временем они приведут к рецидиву.
Возникающая на поздних стадиях болезни, портальная гипертензия считается одним из наиболее тяжёлых осложнений цирроза. Её характеризует увеличение давления в портальной вене органа, из-за чего кровь не может нормально циркулировать через печень, а в пищеварительном тракте открываются смертельно опасные для больного кровотечения.
Портокавальное шунтирование считается достаточно эффективным методом лечения портальной гипертензии у пациентов с заболеваниями печени.
Портальная гипертензия: механизм развития, опасность патологии
Гипертензия в портальной вене – синдром, который формируется на фоне нарушения кровообращения и повышения кровяного давления в полости воротной вены печени. Его локализация может диагностироваться на уровне больших вен портальной области, нижней полой вены, печёночных вен, а также капилляров.
- Портальная гипертензия: механизм развития, опасность патологии
- Особенности диагностирования и лечения патологии
- Показания и противопоказания к осуществлению шунтирования печени
- Как подготовиться к шунтированию
- Осуществление операции портокавального шунтирования
- Прогнозы эффективности операции
Этиология формирования синдрома очень широка. Изначально причиной его развития становится обширное поражение паренхимы печени из-за различных заболеваний – вирусных гепатитов, цирроза различных типов, доброкачественных и злокачественных опухолей, значительной паразитарной инвазии, опухолей холедоха и новообразований в печёночном жёлчном протоке, желчнокаменной болезни, рака головки поджелудочной железы. Также влияние на появление гипертензии может оказывать отравление гепатотропными ядами, например, отравление грибами.
То есть, сама по себе портальная гипертензия не является болезнью – она формируется как совокупность признаков и состояний, как синдром на фоне заболеваний, вызывающих разрушение тканей печени.
Пациенты с диагностированным тромбозом, врождённой атрезией, стенозом портальной вены, синдромом Бадда-Киари, конструктивным перикардитом находятся в зоне риска развития синдрома портальной гипертензии.
Существуют также случаи, когда появление гипертензии связано с перенесенными обширными ожогами, сепсисом, травмами и операциями.
Симптоматика может различаться на разных стадиях развития патологии. На начальном этапе пациент сталкивается с такими проявлениями;
- повышенный метеоризм;
- расстройства стула;
- тошнота и отсутствие аппетита;
- боли в эпигастрии и области правого подреберья;
- потеря веса;
- желтушность кожи и слизистых;
- повышенная утомляемость.
Устойчивость асцита к проводимой медикаментозной терапии может быть ещё одним признаком наличия у пациента портальной гипертензии.
Наиболее опасные признаки патологии, которые свидетельствуют о тяжёлом состоянии больного – обширные кровотечения из патологически изменённых вен желудка, кишечника, пищевода. Такие кровотечения быстро приводят к постгеморрагической анемии, и могут становиться причиной ранений слизистой желудочно-кишечного тракта.
При первом желудочно-кишечном кровотечении погибает примерно половина поражённых. Из тех, кто пережил кровотечение, у 60% больных в течение первого года случается рецидив, которого большинство из них не переживёт.
Особенности диагностирования и лечения патологии
Определение развития патологии возможно по совокупности данных клинической картины и анамнеза больного. Доктор обращает внимание на наличие асцита, геморроя, извитых заметных сосудов в области пупка, околопупочной грыжи.
Лабораторная диагностика включает в себя сдачу общего анализа мочи и крови, биохимии крови, антител к вирусам гепатита. Кроме того, лечащий врач назначает различные рентгенографические методы обследования:
- портографию;
- кавографию;
- ангиографию;
- целиакографию.
В обязательном порядке больному назначается ультразвуковое исследование органов брюшной полости, эзофагоскопия. В крайних случаях прибегают к биопсии тканей печени для гистологического исследования.
Методы лечения терапевтического характера могут быть эффективны только при функциональных изменениях внутрипечёночной гемодинамики. Если у больного отмечается острое развитие кровотечений, ему назначаются процедуры склерозирования или эндоскопического лигирования стенок сосудов.
Однако в тяжёлых случаях все эти мероприятия оказываются неэффективными, поэтому пациенту назначается осуществление шунтирования:
- портокавального “конец в конец”;
- портокавального “бок в бок”;
- портокавальное “конец в бок”;
- шунтирования Н-образным шунтом.
Показания и противопоказания к осуществлению шунтирования печени
- варикозное кровотечение из поражённых сосудов, которые ведут кровь от желудка, пищевода и кишечника в сторону печени;
- портальная гастропатия, которая представляет собой венозный застой в стенках желудка, провоцирующий появление кровотечений;
- асцит и гидроторакс: скопление жидкости в брюшной полости и области грудной клетки;
- синдром Бадда-Киари: тромбоз печёночных вен на уровне их впадения в нижнюю полую вену, из-за которого нарушается отток крови из печени.
Причём кровотечение пищеварительного тракта, хотя и является прямым показанием к осуществлению операции, считается запоздалым проявлением портальной гипертензии, когда, даже при условии успешно проведённой операции, есть большая вероятность летального исхода для больного. Поэтому медики рекомендуют проводить шунтирование в так называемом “холодном” периоде – то есть до того, как начнётся кровотечение, угрожающее жизни поражённого.
Противопоказаниями являются такие факторы как наличие постсинусоидального блока в печени, и расширение диаметра венул в портальных триадах – такие состояния дают крайне негативные прогнозы для больного.
Как подготовиться к шунтированию
Мероприятия по подготовке, в первую очередь, требуют сдачи общих анализов крови и мочи, биохимического исследования крови, коагулограммы и других лабораторных показателей. Кроме того, хирургу потребуется вся актуальная информация по обследованиям вроде УЗИ, эндоскопии и прочих.
За 2-3 суток необходимо начать придерживаться бесшлаковой диеты, то есть отказаться от продуктов, способствующих усилению образования газов в кишечнике.
Проведение операции возможно только строго натощак, поэтому за 12 часов до её начала пациенту запрещено есть и пить, курить, жевать жевательную резинку.
Перед сном необходимо поставить очистительную клизму и принять таблетку слабительного, чтобы очистить кишечник.
Приём любых медикаментов за 14 дней до даты операции должен быть согласован с лечащим врачом.
Осуществление операции портокавального шунтирования
Впервые такая процедура была в экспериментальном виде осуществлена в 1877 году – тогда в качестве подопытных выступали собаки. До сих пор шунтирование признаётся одним из наиболее эффективных способов продления жизни больным с портальной гипертензией, не считая трансплантации органа.
На сегодняшний день, большинству поражённых с болезнями печени, осложнением которых является портальная гипертензия и кровотечения, назначается склеротерапия или перевязка варикозных узлов. Если же разрушение органа зашло слишком далеко, больным назначается трансплантация печени.
Ещё один способ лечения – трансъюгулярное внутрипечёночное портосистемное шунтирование, которое исключило необходимость экстренных хирургических вмешательств. Следует отметить, что такая процедура не предназначена для создания длительно проходимых шунтов, однако она даёт возможность взять под контроль состояние портальной гипертензии, и эффект её сохраняется в течение длительного времени.
Шунты методом “бок в бок” формируется быстро и с малой кровопотерей. Такой тип процедуры не применяется для больных с асцитом, который показывает резистентность к медикаментозной терапии. Если же у пациента асцит отсутствует, и при этом выявлен ретроградный кровоток по полости воротной вены, портокавальный шунт имеет некоторые преимущества.
Шунтирование “конец в бок” может стать причиной развития печёночной энцефалопатии, хотя после шунтирования “бок в бок” это осложнение проявляется несколько чаще. Такой шунт можно применять при асците, который не поддаётся другим видам терапии. Он способствует понижению давления в брыжеечных венах, при этом воротная вена играет роль пути оттока крови от печени.
Шунт, осуществляемый по технике “бок в бок” более сложен в исполнении. Часто для сопоставления нижней полой и воротной вен необходимо проводить частичную резекцию хвоста печени. Он предпочтителен для пациентов, у которых диагностирован синдром Бадда-Киари, однако, из-за гипертрофирования хвостатой доли печени при синдроме, его тяжело выполнить.
Н-образный шунт считается наиболее современным. Его формируют за счёт интерпозиции сосудистого протеза между нижней полой и воротной венами. Учитывая небольшой диаметр просвета шунта, он работает селективно, и сохраняет центробежный кровоток в сторону печени по воротной вене. При этом давление в портальной системе медленно снижается, что способствует предупреждению кровотечений из варикозных вен пищевода.
Возможным осложнением Н-образного шунта является ранний тромбоз, однако, в таких случаях успешна практика осуществления тромболитической терапии посредством установки катетеров. Их внедряют чрескожным способом в воротную или нижнюю полую вену.
Установка шунта даёт возможность понизить давление в печёночной и воротной венах, а также усилить кровоток в печёночной артерии.
Операция проводится только в соответствующим образом оборудованной операционной, в условиях стационара, и требует соблюдения всех правил асептики.
После любого типа шунтирования, кроме мезокавального, осуществление трансплантации органа значительно затрудняется.
Прогнозы эффективности операции
Портокавальное шунтирование снижает вероятность развития асцита и бактериального перитонита, однако опасно появлением печёночной энцефалопатии.
Риск летального исхода после операции колеблется от 5 до 50% вероятности, в зависимости от исходного состояния больного.
Нередко, в процессе операции на воротной вене, которая поражена патологическим процессом, шунт закрывается, что приводит к смерти оперируемого в результате печёночной недостаточности.
Если портокавальный анастомоз, наложенным способом “конец в бок”, функционирует нормально, это даёт возможность предотвратить возможное кровотечение из вен в стенках пищевода или желудка.
- Почему нельзя самостоятельно садиться на диету
- 21 совет, как не купить несвежий продукт
- Как сохранить свежесть овощей и фруктов: простые уловки
- Чем перебить тягу к сладкому: 7 неожиданных продуктов
- Ученые заявили, что молодость можно продлить
Шунтирование способствует уменьшению размера селезёнки, а также сужению варикозно расширенных вен.
Неселективные шунты снижают не только портальное давление, но и печёночный кровоток, из-за чего существенно ухудшается функционирование печени.
Частым осложнением после операции является развитие желтухи, отёк лодыжек, печеночная энцефалопатия.
Портокавальное шунтирование – один из способов спасти жизнь больного с обширными и запущенными поражениями печени, особенно если осуществить трансплантацию органа нет возможности. Однако нельзя переоценивать возможности медиков – нередко операция назначается, когда пациент уже находится в наиболее тяжёлом состоянии, когда никто не может гарантировать, что он выживет, поэтому шунтирование рекомендуется проводить в “холодный” период, до развития острых кровотечений в пищеводе, желудке, кишечнике.
- Отделение анестезиологии и реанимации
- Метастазы рака
- Химиотерапия
- Хоспис для онкологических больных
- Иммунотерапия в центре платной онкологии Медицина 24/7
- КТ-исследования
- МРТ-исследования
Лечение рака печени за последнее десятилетие изменилось благодаря инновационным технологиям, тем не менее в 2017 году диагноз был установлен 8 796 взрослых россиян, а умерло от злокачественного заболевания 9 959. И подобная ущербная динамика прослеживается не один год, что свидетельствует о не слишком успешной противоопухолевой терапии и невысокой продолжительности жизни пролеченных.
Основное большинство в 58% на момент обнаружения имеет 4 стадию заболевания, ещё 22.5% с 3 стадией карциномы не лишены шансов на жизнь, но только у каждого седьмого при благополучном стечении клинических обстоятельств есть хорошие перспективы на будущее.

Принципы лечения рака печени
Единственный радикальный способ лечения гепатоцеллюлярной карциномы — хирургический, успешность химиотерапии не высока, лучевая терапия не нашла широкого применения в клинической практике из-за невозможности её использования при циррозе, слишком частом у этой категории больных.
Особенность развития карциномы печени — наличие хронического печеночного заболевания у подавляющего большинства пациентов, только у каждого десятого рак возникает в до того момента здоровом органе.
План лечения обязательно учитывает функциональные возможности печени и различается тактика лечения пациентов без цирроза и с различной выраженностью цирроза. Фактически при 2 — 3 баллах цирроза по шкале Child-Pugh можно рассчитывать только на пересадку органа.
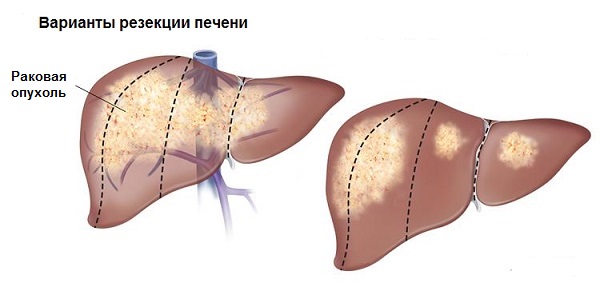
Размер печёночного новообразования важен для выбора тактики, но много важнее, с чем останется больной. При исходном циррозе после операции не может остаться менее половины печени, без цирроза достаточно сохранить одну треть органа.
Во всех случаях проводится только анатомическая резекция, то есть удаление части органа с учётом системы локального кровоснабжения, что способствует удалению тромбированных раковыми эмболами сосудов и располагающихся рядом с первичным очагом микроскопических отсевов рака. За год после резекции печеночная ткань восполняет три четверти утраченного объёма.
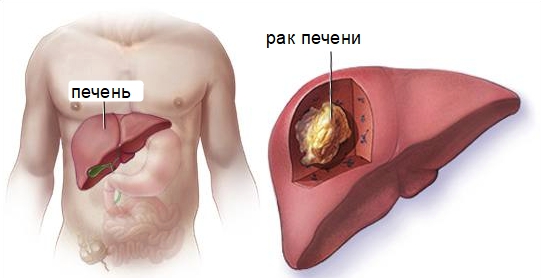
Лечение раннего рака печени
Ранний рак печени констатируется при наличии одного единственного узла не более 5 см и обязательно без вовлечения сосудов, что по стандартной классификации означает 1 стадию процесса. Операция выполняется и при нескольких узлах, но числом не больше трёх и до 3 см в диаметре, также без признаков сосудистой инвазии.
Резекция печени всегда предпочтительна, если технически невозможно удалить часть органа пациенту рекомендуется пересадка донорской печени. Выживаемость в течение года после пересадки высокая — 85-88%.
Методы лечения рака печени
В трансплантации больному отказывают при наличии отдалённых метастазов, а цирроз не помешает операции, потому что это самый радикальный способ терапии всех печеночных заболеваний. Другое дело, что тяжелое состояние вследствие осложнений цирроза — асцит, варикозное расширение вен желудочного тракта, серьезные нарушения свертывания крови мешают ждать оперативное вмешательство.
В период ожидания возможны:
- химиотерапия увеличивающим продолжительность жизни пациентов сорафенибом или комбинацией цитостатиков при прогрессировании процесса на фоне сорафениба;
- введение в питающий опухоль сосуд цитостатика с жировой эмульсией или в форме микросфер — транс-артериальная химиоэмболизация (ТАХЭ);
- разрушение очага высокочастотным электрическим током — метод радиочастотной абляции (РЧА);
- разрушение ракового конгломерата жидким азотом — криодеструкция;
- введение внутрь опухоли этанола (спирта);
- локальное — стереотаксическое облучение.
У пациента может использоваться в разной последовательности несколько инвазивных методов, для каждого метода существует свой список противопоказаний, преимущественно обусловленных циррозом и его осложнениями, количеством и размером опухолевых узлов.
Лечение метастазов рака печени
При противопоказаниях к пересадке, а также при рецидиве рака после резекции, прибегают к локальным методам терапии, перечисленным выше. Наличие метастазов — полное противопоказание к хирургии, но не исключает дополнительные локальные способы лечения, в первую очередь направленные на улучшение состояния пациента и изменения качества его жизни в лучшую сторону.
Асцит характеризуется скоплением жидкости брюшной полости, это заболевание называют водянкой. Возникает оно как следствие заболеваний органов брюшной полости или патологических новообразований в них. Асцит при онкологии наблюдается в 10% случаев.
Появление выпота в животе при онкологии осложняет течение болезней из-за нарушения обменных процессов. Прогноз на выздоровление при прогрессирующем заболевании во многих случаях неутешительный, так в жидкой среде активно развиваются раковые клетки и инфекции.
О чем я узнаю? Содержание статьи.
Что такое асцит?
В здоровом организме жидкий секрет, производимый железистыми клетками брюшины, непрерывно всасывается тканями. Жидкость, выделяемая выстилающими тканями, смазывает внутренние органы малого таза, выполняет защитную функцию, оберегает от инфекций. Транссудат постоянно вырабатывается и утилизируется.
Что такое асцит? Нарушение процесса обновления секрета. При появлении в брюшной полости патогенной флоры объем выработки жидкости увеличивается. Когда она перестает всасываться, возникают застойные явления. При онкологии в животе накапливается до 25 литров транссудата. Он давит на внутренние органы, становится полигоном для роста микробов, бактерий, развития и распространения раковых клеток.
Асцит при раке печени, желудка, кишечника, половых органов возникает на фоне поражения выстилающих листков брюшины патогенными клетками. Они раздражают железистые ткани. Начинается воспалительный процесс, возникают отеки, лимфа перестает впитывать производимый транссудат.
Опухоли каких органов сопровождаются асцитом?
Накопление жидкости в брюшной полости возникает далеко не при всех онкологических заболеваниях. Наиболее распространенной причиной возникновения заболевания у женщин является запущенный рак яичников.
Также он диагностируется при раке:
- молочной железы;
- толстого кишечника;
- прямой кишки;
- органов желудочно-кишечного тракта.
В 70% случаев возникает асцит при раке печени. При поражениях желудка, поджелудочной железы и желчного пузыря встречается реже.
При раке желудка жидкость появляется в 5% случаев. При этом пациент постоянно ощущает сдавливание в области желудка, кислота забрасывается в пищевод. Канцероматоз брюшины и асцит возникают как следствие онкологических поражений органов, значительно осложняя состояние пациентов.
Раковые клетки попадают в брюшину только при тесном контакте с пораженными органами, нередко это связано с опухолью кишечника. Метастазы распространяются после перенесённых операций по резекции онкологических тканей.
Причины
Очень часто асцит брюшной полости при онкологии приводит к нарушениям обменных процессов. Скапливается жидкость в брюшной полости при нарушении водно-солевого баланса.
Это возникает по ряду причин:
- при раковых поражениях почек и надпочечников нарушается утилизация продуктов обмена.
- Чаще болезнь развивается при следующих физиологических особенностях:
- при плотном прилегании стенок брюшины к органам;
- когда активно разрастаются сосуды.
Симптомы
Асцит при раке нередко возникает при сильной интоксикации организма. Сначала он развивается незаметно, проявляется чрез недели или месяцы. Основным характерным признаком является раздутый живот. У женщин при онкологии с поражением яичников меняется фаза циклов, иногда вообще прекращается менструация. Живот увеличивается как при беременности.
Когда жидкость скапливается в большом количестве, она давит на диафрагму, появляются характерные симптомы:
- чувство тяжести в области желудка;
- ощущение вздутости кишечника сопровождается ноющими болями;
- при сдавливании легких при нагрузке возникает одышка, затрудняется дыхание в горизонтальном положении;
- кислота их желудка попадает в пищевод, появляется изжога;
- нарушается процесс пищеварения.
Общее состояние онкобольного на фоне асцита брюшной полости заметно ухудшается. Это проявляется слабостью, утомляемостью, бывают серьезные отеки тела. Появляются проблемы с работой ЖКТ. Человек худеет, а живот постоянно увеличивается.
Диагностика
Болезнь выявляется только при диагностическом обследовании больного. Врач выявляет характерное распределение живота в стороны, когда пациент лежит. При простукивании грудной клетки звук при разных позициях тела меняется.
Ультразвуковая диагностика выявляет скопления жидкости до 200 мл, позволяет определить состояние соседствующих с брюшиной органов. Другие методы лучевой диагностики (рентген и томография) выявляют асцит, наблюдая за тем, как перемещается жидкость при изменениях позы больного.
При подозрении на онкологию, скопившийся в брюшной полости секрет, проверяют на наличие раковых клеток и патогенной микрофлоры, для этого делается лапароцентез.
Как лечить асцит брюшной полости при онкологии?
При выявлении жидкости в брюшной полости, больному назначают комплексную терапию. Лечение асцита при онкологии проводится сразу в нескольких направлениях. Продолжается лечение основного заболевания и устраняются последствия. Пациенту проводят поддерживающую терапию, восстанавливают иммунную систему. Ему прописывают комплекс препаратов, останавливающих воспалительный процесс.
Комплекс включает следующие методы:
- медикаментозное лечение;
- диагностические (пункция);
- хирургические;
- терапевтические: химиотерапия, облучение.
Как лечить асцит брюшной полости при онкологии, окончательно решает лечащий врач-онколог.
При лапароцентезе откачивается до 10 литров экссудата. Пункции можно проводить до трех раз в месяц. Состояние больного после процедуры заметно улучшается. Прокол делается в условиях хирургического отделения, игла вводится в область пупка под ультразвуковым наблюдением. Экссудат вытекает самопроизвольно, под давлением мышц пресса. Уменьшившийся живот после процедуры обязательно плотно стягивают. При большом объеме жидкости возможна установка дренажа: отходящую трубку перекрывают до проведения следующей процедуры.
Пункция не проводится больным с пупочными грыжами, в период реабилитации после их оперирования и при сильном газообразовании.
Для выведения токсинов необходимо много пить. Онкология и асцит протекают на фоне нарушения обменных процессов. Для активации выведения воды в комплексе лечения предусмотрен прием диуретиков. Выбор конкретного препарата зависит от стадии онкологии, степени поражения внутренних органов.
Верошпирон, Диакарб и Фуросемид оказывают на организм примерно одинаковое действие, только одни препараты выводят преимущественно натрий, другие – совместно с калием. Больным важно соблюдать дозировку препарата и придерживаться схемы лечения.
Пищевые ограничения направлены на ускорение обменных процессов, выведение воды и поддержку жизненных сил организма пациента. Больным ограничивают прием сладкой и соленой пищи, рекомендуют отказаться от еды, нагружающей печень: кислого, жареного, копченого. Рекомендуются молочные продукты, сухофрукты с большим содержанием калия, овощи, серые каши.
Профилактика
Для того, чтобы не возникало скопление транссудата в животе, необходимо заниматься профилактикой заболеваний, его провоцирующих: цирроза, онкологии яичников, заболеваний желудочно-кишечного тракта.
Своевременное лечение сердечно-сосудистых патологий снижает риск заболевания. Для нормального обмена веществ нужны здоровые секреторные органы: печень, поджелудочная железа, селезенка. Почки отвечают за выведение токсинов из организма.
К профилактическим мерам можно отнести:
- регулярную лучевую диагностику (флюорография);
- осмотры у гинеколога;
- диспансеризацию;
- профилактические осмотры;
- соблюдение здорового образа жизни;
- правильное питание.
Осложнения и выживаемость
Вылечить асцит без последствий можно на ранних стадиях при своевременном выявлении онкологических заболеваний.
При длительном течении болезни нередко возникают осложнения:
- перитонит (гнойное воспаление брюшной полости);
- непроходимость кишечника;
- почечная и сердечная недостаточности;
- гидроторакс (накопление воды в легких);
- недостаточность дыхания (из-за изменения положения диафрагмы).
Сколько живут пациенты с диагнозом асцит, во многом зависит от их отношения к лечению и стадии развития онкологического заболевания.
При слабовыраженных формах асцита и начальных стадиях рака прогноз выживаемости высокий, при регулярном откачивании жидкости люди живут десятки лет.
В ряде случаев болезнь излечивается полностью. При асците на фоне длительного цирроза шансы не велики, не более 20%. При развитии сердечной недостаточности снижаются до 10%. Заболевание редко протекает в прогрессирующей форме, поэтому при лечении качество жизни пациента продлевается на годы. Важен настрой на излечение и помощь близких.

Асцит брюшной полости при онкологии яичников

Асцит брюшной полости: причины, виды, симптомы и лечение

Жидкость в животе при циррозе печени: причины, лечение и прогноз

Рак желудка 4 стадии с метастазами в печень, легкие, лимфоузлы, брюшину, кости: сколько живут люди, лечение, прогноз

Асцит у детей: фото, симптомы, причины и лечение водянки брюшной полости
Читайте также:





