Сегидрин при мелкоклеточном раке
При обследовании у большинства больных (две трети) обнаруживаются признаки обширного опухолевого процесса: поражение одной или обеих сторон грудной клетки или распространение метастазов. Облучение таких больных проводят только с паллиативными целями, и при назначении им даже современных химиотерапевтических препаратов прогноз оказывается крайне неблагоприятным.
Для больных с более ограниченным характером заболевания (поражение одной стороны грудной клетки) основным методом лечения является химиотерапия.
Давно известно, что мелкоклеточная карцинома легкого является быстрорастущей опухолью, которая к моменту постановки диагноза уже дает метастазы. Поэтому при лечении таких больных используется системный подход. Опухоль довольно чувствительна (по крайней мере вначале) к цитотоксическим препаратам, и основным методом лечения стала химиотерапия.
Крайне редко при мелкоклеточном раке легкого обнаруживают лишь небольшую опухоль, не затрагивающую лимфатические узлы средостения. В таких случаях опухоль можно удалить и после операции назначить больному курс химиотерапии. По данным клинических исследований, проведение операции после назначения больным курса химиотерапии для снижения размеров опухоли не дает преимуществ. Поэтому обычно хирургический метод играет лишь незначительную роль в лечении мелкоклеточного рака легкого.
В одном из ранних рандомизированных исследований сравнивали эффективность лучевой терапии и ее совместного применения с химиотерапией. При этом было показано увеличение кратковременной выживаемости в группе больных, леченных двумя методами, по сравнению с группой, получавшей только курс лучевой терапии.

Некоторые химиотерапевтические препараты эффективны при изолированном применении. К числу наиболее часто используемых алкилирующих агентов относятся циклофосфамид и ифосфамид. Среди других эффективных препаратов можно отметить этопозид, таксаны, иринотекан, алкалоиды винки, цисплатин и антрациклины.
От изолированного применения препаратов в основном отказались, за исключением некоторых специальных случаев (рассматриваются ниже). В многочисленных исследованиях с использованием различных режимов и схем назначения препаратов показана их полная (25-50%) или частичная (30-50%) эффективность.
В нескольких крупных исследованиях оценивалась оптимальная продолжительность курса химиотерапии. В соответствии с общепринятой точкой зрения, оптимальным считается проведение шести курсов химиотерапии. Основным ограничивающим обстоятельством является развитие у больных нейтропении, которую частично можно предотвратить назначением гемопоэтических факторов. По данным рандомизированных исследований, при увеличении дозы препаратов выживаемость больных увеличивается.
Это достигается за счет снижения интервала между курсами или при назначении более высоких доз препаратов совместно с факторами гемопоэза. В общем, исследования не продемонстрировали настолько значимого увеличения выживаемости больных, которое оправдывало бы проявления у них токсических реакций и высокую стоимость лечения. Попытки увеличить интенсивность химиотерапии при еженедельном назначении препаратов также не привели к увеличению выживаемости больных.
Аналогичным образом, назначение в качестве средства первичного лечения больших доз препаратов с поддержкой аутологичных стволовых клеток не выявило каких-либо преимуществ, хотя большинство больных реагировало на лечение.
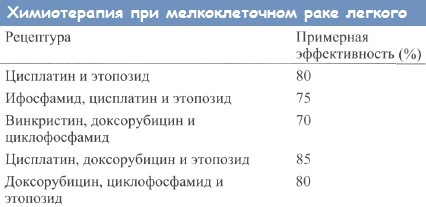
Химиотерапевтические препараты обладают высокой токсичностью и лишь незначительно увеличивают выживаемость больных. В настоящее время удается на 2 года продлить жизнь 15-20% больных с ограниченным опухолевым процессом. Анализ выживаемости среди больных с мелкоклеточным раком легкого показал, что 8% больных с ограниченным процессом и 2,2% с распространенной опухолью живут не менее 2 лет.
Через 6 лет наблюдается рецидивирование опухоли; к этому моменту времени выживают лишь 2,6% всех больных. Даже если химиотерапия дает какой-то шанс продлить больному жизнь и, возможно, излечиться, последствия лекарственного лечения, развивающиеся особенно у ослабленных или пожилых людей, заставляют прибегать к паллиативным методам терапии. Всегда необходимо иметь в виду, что болезненная симптоматика является основной причиной плохого качества жизни.
Например, в качестве простого паллиативного средства широко практиковалось пероральное назначение этопозида. Однако, по данным двух рандомизированных исследований, оказалось, что при этом у больных развиваются признаки сильного токсикоза, резко ухудшается качество жизни, и в результате их жизнь укорачивается. При проявлении благоприятного эффекта препарата, который компенсирует развитие тяжелой побочной симптоматики, лечение отменять не следует.
Неблагоприятный прогноз мелкоклеточного рака легкого определяется рядом факторов. К числу наиболее существенных относятся: обширное заболевание, плохое физическое состояние больного, низкий уровень альбумина и ионов натрия в плазме крови, а также нарушение функции печени. Больным пожилого возраста, для которых часто характерно наличие неблагоприятных прогностических факторов, нецелесообразно назначать продолжительное лечение химиотерапевтическими препаратами.
Если опухоль не реагирует на препарат и улучшения состояния не происходит, то можно ограничиться проведением лишь 2-3 начальных циклов. Интенсивная комбинированная химиотерапия часто позволяет продлить жизнь людям молодого возраста, с опухолью в начальной стадии развития и с относительно благоприятным прогнозом. Многие больные занимают промежуточное положение между двумя этими крайними категориями, и в каждом отдельном случае врач должен выбирать наиболее подходящий метод лечения.
Неблагоприятные прогностические факторы при мелкоклеточном раке легкого:
- Плохое общее состояние больного
- Обширный опухолевый процесс
- Низкое содержание альбумина и ионов натрия в плазме крови
- Повышенный уровень щелочной фосфатазы или лактатдегидрогеназы
- Наличие метастазов в головном мозге
- Инфильтрация костного мозга опухолью или анемия
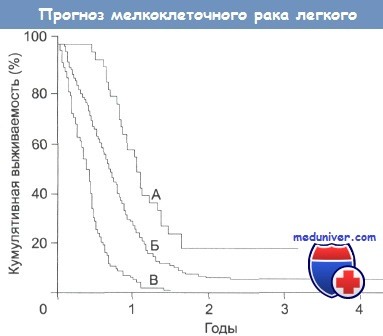
Значение прогностических факторов при мелкоклеточном раке легкого:
А — Больные характеризуются хорошим общим состоянием; результаты биохимических анализов в норме.
В — Больные с плохим общим состоянием; результаты более двух биохимических анализов отличаются от уровня нормы.
Б — Построено по данным разницы между первой и второй группой.

Инструкция по применению
Немного фактов
Сегидрин противораковый препарат, устраняющий клинические проявления онкологических заболеваний. Входящий в его состав гидразина сульфат влияет на многие биохимические процессы в тканях, что приводит к уменьшению выраженности болей, лихорадки и дыхательной недостаточности. Применяется в комбинированной химиотерапии злокачественных опухолей различной локализации.

Нозологическая классификация болезней (МКБ-10)
Противоопухолевое средство используется при лечении онкопатологий II класса группы C00-C97 недоброкачественные опухоли неуточненной локализации.
Лекарственная форма и состав
Лекарство выпускается в форме темно-красных таблеток, покрытых кишечнорастворимыми оболочками. В их состав входит несколько активных и неактивных веществ:
- гидразина сульфат;
- гидроортофосфат кальция;
- поливинилпирролидон;
- эмульгатор Е551 и Е572;
- полидиметилсилоксан;
- тальк;
- полимеры этиленгликоля;
- полиакрилат;
- пищевые добавки Е171 и Е172.
Таблетки выпускаются в полимерных банках по 50 штук или в блистерных упаковках по 10 штук. В картонной пачке содержится 1 банка или 5 блистерных упаковок вместе с инструкцией по применению противоракового средства.
Фармакологические свойства
Медпрепарат Сегидрин используется в качестве противоопухолевого лекарства при лечении неоперабельных форм онкологических патологий. Молекулы гидразина сульфата ингибируют функциональную активность моноамиооксидазы, блокируют метаболизм ксенобиотических факторов и снижают проницаемость субклеточных структур.
Противоопухолевое средство оказывает симптоматическое действие на пациентов с онкологическими патологиями. При этом, гидразина сульфат не обладает миелодепрессивной активностью. Курсовое применение таблеток способствует восстановлению двигательной активности и функций дыхательной системы, устранению астенических проявлений, лихорадки, кашля и болевого синдрома.
Фармакокинетические свойства
При пероральном приеме средняя сывороточная концентрация гидразина сульфата достигается в течение 120 минут. Большая часть активных метаболитов локализуется в тканях легких, печени и почек. Сегидрин подвергается окислению под воздействием печеночных изоферментов.
Большая часть лекарственных метаболитов выводятся с уриной, частично вместе с каловыми массами в ацетилированной форме. Первичный период полувыведения 50% продуктов распада составляет 3 суток. Согласно результатам исследований, лекарство проявляет склонность к кумуляции у больных-опухоленосителей.
Показания к применению
Противоопухолевые таблетки используются в химиотерапии неоперабельных форм диссеминированных, рецидивирующих и метастазирующих форм недоброкачественных новообразований. Показаниями к назначению противоракового лекарства считаются:
- фибросаркома;
- опухоли эндометрия;
- лимфома Ходжкина;
- десмоидный рак;
- саркома мягких тканей;
- рак шейки матки;
- карцинома молочных желез;
- злокачественные опухоли желудка;
- немелкоклеточная бронхогенная карцинома;
- злокачественные опухоли лимфатической ткани;
- недоброкачественные новообразования поджелудочной железы.
В составе комплексной химиотерапии медпрепарат используется при лечении пациентов с цитопенией, возникающей на фоне лучевой терапии. Также рекомендуется применять таблетки при обтурационной желтухе, спровоцированной метастазированием опухоли в печеночную ткань.
Режим дозирования
Противораковое средство Сегидрин используется как в монотерапии, так и в комплексной химиотерапии злокачественных новообразований. Рекомендуется принимать таблетки за 60-90 минут до или через 60-90 минут после приема других медикаментов и пищи. Дозировка определяется возрастом больных и формой патологии.
Взрослым назначают по 50 мг гидразина сульфата (1 таблетка) 3 раза в сутки. При плохой переносимости химиопрепарата дозу уменьшают до 100 мг (2 таблетки) в сутки. В течение всего курса фармакотерапии пациент должен принять 100 таблеток. Таким образом продолжительность терапии может колебаться в пределах от 33 до 50 дней.

В случае необходимости химиотерапию повторяют, но не ранее, чем через 2 недели после завершения предыдущего курса. Количество курсов не ограничивается, но зависит от терапевтического ответа пациента и функционального состояния жизненно важных органов.
Особые указания
Химиотерапия проводится под постоянным наблюдением врача-онколога, имеющего опыт применения таблетированных противоопухолевых средств. В случае возникновения выраженных признаков токсического синдрома дозировочный режим корректируют.
С особой осторожностью нужно использовать химиопрепарат при лечении пациентов с умеренной и тяжелой недостаточностью органов детоксикации. Развитие обтурационной желтухи, вызванной метастазированием новообразований в печень, не является основанием для уменьшения суточной дозы гидразина сульфата.
На время лечения следует полностью исключить из рациона продукты, в которых содержится тирамин: свежие яйца, плавленый сыр, цельное молоко, консервированные продукты, сухофрукты и т.д. Это связано с высоким риском повышения сывороточной концентрации гидразина сульфата и, как результат, токсичности.

Химиопрепарат не используют в педиатрической практике по причине возможного нарушения функций иммунной и кроветворной системы. Согласно результатам испытаний на животных, гидразина сульфат негативно влияет на физическое и умственное развитие, а также приводит к нарушению функций печени.
Взаимодействие с медикаментами
Сочетанное применение барбитуратов, бензодиазепинов и гидразина сульфата чревато развитием токсических эффектов. Поэтому в процессе химиотерапии больным не назначаются следующие медикаменты:
- Мидазолам;
- Фенобарбитал;
- Гидазепам;
- Хлоразапат;
- Алюрат;
- Клобазам;
- Талбутал;
- Фиоринал;
- Суритал;
- Репозал;
- Лоразепам;
- Бутизол.
С осторожностью нужно принимать гипогликемические препараты, т.к. они потенцируют побочное действие гидразина сульфата. Чтобы предотвратить развитие осложнений, перед приемом любых медикаментов, в особенности сердечных гликозидов, противопаркинсонических средств и диуретиков, нужно советоваться с врачом.
Во время химиотерапии нужно полностью отказаться от употребления этанолсодержащих напитков и лекарств по причине резкого повышения токсичности.
Противоопухолевое лекарство не может применяться в период беременности и лактации по причине тератогенной активности его составляющих. Нерациональное использование химиопрепарата может привести к нарушению функций органов репродуктивной системы и порокам в развитии плода.
Передозировка
В случае несоблюдения дозировочного режима у больных могут возникать нейротоксические и диспепсические явления:
- изжога;
- тошнота;
- отрыжка;
- повышение уровня трансмиттеров;
- расстройства цветного зрения;
- нарушение концентрации внимания;
- тревожность и депрессия.
Вышеперечисленные побочные эффекты быстро проходят в случае временного прекращения химиотерапии. Для уменьшения выраженности диспепсии назначают спазмолитические, вяжущие, противорвотные и антифлогистические препараты. Купировать нейротоксические проявления можно поливитаминными средствами, в состав которых входит тиамин и пиридоксин.
Побочные эффекты
Зачастую Сегидрин переносится пациентами нормально, но примерно у 15% из них диагностируются следующие побочные реакции:
- боль в животе;
- рвотные позывы;
- гипертермия;
- чувство голода;
- незначительная атрофия мышц;
- головные боли;
- неравномерное дыхание;
- тремор конечностей;
- повышенная тревожность;
- зрительные галлюцинации;
- полиневрит;
- пространственная дезориентация;
- кожные высыпания;
- нарушение сердечного ритма;
- повышенная потливость;
- обратимая алопеция.
Из-за токсичности гидразина сульфата чаще всего возникают нарушения со стороны нервной системы. Больные могут жаловаться на периферическую нейропатию, парестезию, головокружение, неравномерное дыхание и судороги. При появлении нежелательных эффектов рекомендуется уменьшить дозу химиопрепарата и контролировать функциональную активность ЦНС на протяжении всего курса фармакотерапии.
Противопоказания
Во избежание системных аллергических реакций химиопрепарат не назначают при гиперчувствительности к сульфату гидразина. Абсолютными противопоказаниями к приему противоопухолевых таблеток являются:
- беременность и лактация;
- возраст до 18 лет;
- печеночный цирроз;
- нарушение гломерулярной фильтрации;
- тяжелая сердечная недостаточность.
Больные с патологиями печени и почек должны находиться под постоянным контролем медперсонала. При развитии гипербилирубинемии следует на время прекратить фармакотерапию, после чего уменьшить начальную дозу гидразина сульфата на 25%.
Аналоги
Заменителями (аналогами) химиопрепарата Сегидрин могут стать лекарства из той же фармакологической группы, использующиеся при лечении неоперабельных форм злокачественных опухолей:
- Фоксан;
- Гексален;
- Гидроксиуреа;
- Мебифон;
- Золина;
- Аспарагиназа;
- Гливек;
- Велкейд.
Вышеперечисленные средства могут применяться в комбинированной терапии диссеминированных форм онкопатологий для уменьшения выраженности признаков болезни.
Условия продажи и хранения
Противоопухолевые таблетки отпускаются в аптеках по предписанию врача. Хранятся в темном и проветриваемом месте не более 36 месяцев с момента выпуска.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
НИИ онкологии им. проф. Н.Н. Петрова МЗ РФ, Санкт-Петербург
С егидрин, основным ингредиентом которого является гидразин сернокислый, не обладает прямым цитотоксическим действием, но является весьма биологически активным веществом (В. Я. Русин). При этом его токсичность сравнительно невелика (так, ЛД50 для мышей при введении внутрь составляет 740 мг/кг).
Сегидрин был изучен нами в эксперименте на противоопухолевую активность. Использованы солидные (саркома 37, карцинома Эрлиха, плоскоклеточный рак кожи, саркома 180, карциносаркома Уокер) и асцитные (саркома 37, карцинома Эрлиха, гепатома Зайдела, лимфолейкоз NK/Ly) варианты аллогенных опухолей (В.А. Филов и др., 1983). В случае солидных опухолей эффект торможения роста опухоли получен только на карциносаркоме Уокер. При лечении асцитных опухолей умеренный, но достоверный эффект торможения роста опухоли достигнут на саркоме 37 и лимфолейкозе NK/Ly (50–55%) и существенный эффект на гепатоме Зайдела – 85%.
Полученные результаты были достаточны для представления препарата в Фармакологический комитет Минздрава для рассмотрения вопроса о проведении его клинических испытаний, хотя по сравнению с обычными цитостатиками они были более скромными. Однако необычность вещества, явно иной в сравнении с другими противоопухолевыми препаратами механизм его возможного действия, отсутствие гематологических и каких–либо иных существенных побочных эффектов свидетельствовали о целесообразности такого исследования. В результате первой фазы клинического изучения была отработана схема применения препарата: сегидрин в таблетках, покрытых кишечно–растворимой оболочкой, назначали 3 раза в день по 60 мг через 1-2 часа после еды ежедневно в течение 30–40 дней. После перерыва в 2–3 недели курс можно повторять. Принципиально количество курсов не ограничено при условии постепенного увеличения промежутков между ними.
Клиническое изучение по 2 фазе проведено в 5 клиниках (Московский Институт онкологии им. Герцена; Институт радиологии и онкологии в Вильнюсе; Ростовский НИИ онкологии; Киевский Институт проблем онкологии им. Р.Е. Кавецкого и НИИ онкологии им. Н.Н. Петрова в С.–Петербурге). Лечение проводилось больным с распространенными формами солидных злокачественных опухолей, в том числе с рецидивами и метастазами, злокачественными лимфомами в генерализованных стадиях и рецидивами десмоидов, подлежащим только симптоматической терапии, не принимавшим никакого лечения не менее чем за 2 месяца до начала курса сегидрина. Подавляющее большинство этих больных ранее подвергалось различным видам специального лечения (оперативного, лучевого, цитостатического, гормонального), возможности которого к моменту назначения сегидрина оказались исчерпанными. Повторные курсы назначались в случае стабилизации процесса, обычно их число составляло 2–3, но в отдельных случаях достигало 10, 20, 40 (в частности, при нейробластоме). Больным, которые отмечали затруднение при приеме таблеток (при раке пищевода, гортани, глотки) сегидрин назначали в виде 0,4% раствора, дозируя его по объему (1 таблетка эквивалентна 15 мл). Одновременно с сегидрином запрещался прием алкоголя и барбитуратов и ограничивалось употребление сыра.
Особый интерес с нашей точки зрения имеет симптоматическое действие сегидрина, которое в разной степени выраженности имело место у 344 больных (46,5%). При этом корреляции между объективным и симптоматическим эффектами установить не удалось.
В случаях симптоматического эффекта обычно улучшение общего состояния больного наступало на 2–3 неделе лечения, иногда в его конце и даже во время 2 курса. Это же относится и к уменьшению болей даже при метастазах рака бронха в кости (позвоночник, ребра, таз). У некоторых больных с метастазами опухоли этой локализации с помощью сегидрина удавалось достичь такого уменьшения болей, что они оказывались в состоянии удовлетворительной активности, вплоть до самообслуживания и прогулок. Указанный эффект мог сохраняться до 2 месяцев даже на фоне прогрессирования процесса. Подобный эффект наблюдался и при метастазах в кости рака молочной железы, но в более редких случаях и с меньшей выраженностью.
К числу характерных проявлений симптоматического эффекта сегидрина относится его своеобразное психотропное влияние. Уже на 2–3 неделе приема препарата у значительной части больных наступало улучшение настроения со снижением критической оценки своего состояния, вплоть до переоценки возможности двигательной активности. Подобное влияние сегидрина могло сохраняться и при прогрессировании опухоли. В некоторых наблюдениях больные выражали желание вернуться к выполнению служебных обязанностей. Общая частота описанных позитивных симптоматических эффектов, характеризуемая как улучшение качества жизни, составила у терминальных больных при лимфогранулематозе 37%, раке молочной железы – 53%, раке желудка – 44%, раке гортани – 57%, нейробластоме – 71%, десмоидах – 90%.
Из побочных эффектов весьма редко – в 2–3% случаев – наблюдали только диспепсические явления в виде тошноты и рвоты. Однако следует учесть, что в число исследованных больных вошли те, у которых эти явления могли быть обусловлены интоксикацией, сопровождающей далеко зашедший опухолевый процесс. Это тем вероятнее, что для ликвидации подобного осложнения таблетка покрыта кишечнорастворимой оболочкой. Тошнота и рвота могли регрессировать без специального лечения, лишь при снижении на начальном этапе дозы сегидрина со 180 мг/сутки до 120 мг.
При первичных опухолях головного мозга (глиобластома, дедифференцированная астроцитома, злокачественная менингиома, астроцитома, эпендимома, менингиома, невринома (гигантская) слухового нерва) сегидрин был испытан в 4 клиниках: нейрохирургическом отделении НИИ экспериментальной медицины (СПб), Нейрохирургическом институте им. Поленова (СПб), нейрохирургическом отделении Мариинской больницы (СПб) и Институте радиологии и онкологии в Вильнюсе (В.А. Филов и др.). Испытуемыми являлись больные после паллиативных операций и в случаях неоперабельных опухолей при исчерпанных возможностях терапии (52 человека, из которых 46 со злокачественными опухолями). У всех больных опухоли отличались крайне быстрым темпом рецидивирования даже при видимой радикальности операции. Обычный срок жизни таких больных со дня установления диагноза (краниотомии) не превышает 6 месяцев. Частичное удаление опухоли до начала лечения сегидрином выполнено у 38 больных глиобластомой и недифференцированной астроцитомой. Во всех случаях имела место выраженная симптоматика продолженного роста опухолей в виде токсических и неврологических нарушений (признаки повышения внутричерепного давления, эпилептические припадки, головные боли, сенсорные и моторные расстройства и др.). Такая же симптоматика наблюдалась при рецидивах у 5 из 6 ранее оперированных больных с доброкачественными опухолями. Лечение выполняли описанными ранее курсами.
Выраженный лечебный эффект у всей объединенной группы больных с опухолями мозга весьма высок (63,5%), а в совокупности с частичной регрессией общемозговой и очаговой неврологической симптоматики – еще выше (73,1%). В случае только злокачественных опухолей (46 больных) эти показатели составляют 60,8% и 71,7% соответственно. Полученные результаты превышают эффективность лечения опухолей головного мозга с помощью производных нитрозомочевины.
Применение сегидрина в группе больных с глиобластомами привело к стабилизации с частичной регрессией симптоматики у 27 из 38 человек (71%) и сопровождалось существенным улучшением качества жизни. Срок жизни в этой группе составил в среднем 13,0 ± 0,6 месяцев, т.е. оказался в 2 раза большим, чем после обычного хирургического вмешательства. Из этих 27 человек 8 (30%) оставались живы свыше 19 месяцев (в том числе 1 – сверх 30 месяцев). При отсутствии эффекта у 11 больных их срок жизни после операции составил обычно наблюдаемый период 4–5 месяцев. Анализ историй болезни остальных больных злокачественными опухолями приводит к сходным результатам. В группе из 6 больных с доброкачественными опухолями положительный, продолжающийся 5 лет (далее они выбыли из наблюдения по бытовым причинам) клинический и реабилитационный эффект отмечен в 5 случаях в результате 8 курсов сегидрина, проведенных с интервалами от 5 до 7 месяцев.
Начальные признаки позитивных сдвигов в лечении становились заметными обычно на второй неделе приема сегидрина (четко выраженное улучшение общего состояния с той или иной степенью регресса симптоматики).
На фоне применяемых в настоящее время для лечения опухолей головного мозга нитрозомочевин выгодно отличаются не только лечебные эффекты сегидрина, но и практическое отсутствие у него побочных эффектов (исключение – тошнота в 3% случаев).
Сегидрин является фармакопейным препаратом, его регистрационный № в виде таблетки 94/229/3.
Механизмы действия сегидрина
1. В многократных опытах в системах in vitro и на животных было показано ингибирующее метаболизм ксенобиотиков действие сегидрина (В.А. Филов и др.). Ингибирующий эффект ответственен за модифицированное сегидрином действие ксенобиотиков. В частности, было замечено резкое усиление сегидрином токсичности этанола и барбитуратов (А.Н. Стуков и др.). Препятствующее микросомному окислению влияние сегидрина предотвращает нормальный метаболизм этих соединений, что и ведет к резкому увеличению их токсичности. Однако ингибирование метаболизма не обязательно увеличивает токсичность ксенобиотика. Здесь все зависит от характера токсического действия ксенобиотика и его метаболитов, от соотношения доз сегидрина и ксенобиотика, от последовательности и временных соотношений их введения и др.
Так, изучали эффекты сегидрина и тиофосфамида по отдельности и в различных сочетаниях. Сегидрин вводили внутрибрюшинно за 30–45 минут до введения цитостатика. В случае с карциносаркомой Уокер комбинация препаратов увеличивает противоопухолевый эффект, при этом тиофосфамид комбинируется в неэффективной дозе (то же с асцитной гепатомой Зайдела). Иначе говоря, применение сегидрина позволяет при уменьшении дозы тиофосфамида получить противоопухолевый эффект, превосходящий таковой от полной терапевтической дозы алкилирующего препарата. В случае остальных использованных штаммов эффект, и немалый, проявляется только при комбинировании, в то время как каждый препарат по отдельности в использованных дозах оказывается неэффективным.
Другим примером является комбинация сегидрина с циклофосфамидом. На саркоме 180 сегидрин в дозе 60 мг/кг абсолютно неэффективен. Циклофосфамид на этом штамме в дозе 50 мг/кг приводит к задержке роста опухоли на 70%. Комбинация этих препаратов снижает степень задержки роста до 40%.
Результаты объясняются ингибирующим эффектом сегидрина. Метаболизм тиофосфамида, при его использовании после сегидрина, замедляется и он более длительный срок проявляет свои противоопухолевые свойства. В случае же с циклофосфамидом для проявления его противоопухолевых свойств необходим метаболизм последнего, что ингибируется сегидрином с соответствующим снижением противоопухолевого эффекта. Весьма интересно и важно перенести эти результаты в клинику.
2. Сегидрин сильно воздействует на активность и изоферментный состав митохондриальной моноаминооксидазы (МАО) опухолей (В.А. Филов и др.). В опытах in vitro показано выраженное ингибирование активности МАО. В результате лечения крыс с карциносаркомой Уокер методом электрофореза установлено, что активность изоформ МАО с Rst = 0,63 и 0,78–0,94 уменьшается до 40–60%. Сходнонаправленные результаты получены при исследовании изоферментного состава митохондриальной МАО асцитной гепатомы Зайдела в максимуме ее роста через 24 часа после однократного в/б введения 100 мг/кг сегидрина. В опытах на интактных кроликах также установлено ингибирующее действие сегидрина на активность МАО.
Известно, что гидразины являются конкурентными ингибиторами МАО за счет связывания с активными центрами фермента. Как видно, сегидрин не является исключением в этом отношении. При этом возможен и дополнительный вариант действия сегидрина – его специфического влияния на биосинтез фермента. В пользу этого предположения свидетельствует как изменение фракционного состава белков митохондриальных мембран карциносаркомы Уокер после воздействия сегидрина, так и, в частности, уменьшение числа белковых фракций.
Ингибирование МАО ведет к накоплению биогенных аминов (серотонин, адреналин и др.). Еще у Л.Ф. Ларионова имеются указания на противоопухолевую активность биогенных аминов. Позже это не раз подтверждалось, и даже были небезуспешные попытки найти противоопухолевую активность у производных адреналонов (Л.Л. Малюгина и др.). Весьма вероятно, что сегидрин оказывает противоопухолевое действие опосредованно, путем накопления в организме биогенных аминов. В пользу этого приведем еще два соображения. Первое – нами показано, что бензиламин (субстрат МАО) в дозе 15 мг/кг устраняет противоопухолевый эффект сегидрина. Второе – клиническая картина симптоматического действия сегидрина на больных может быть объяснена влиянием биогенных аминов.
3. Сравнительное исследование карциносаркомы Уокер до лечения и после воздействия сегидрином в дозе 60 мг/кг х 10 показывает, что препарат вызывает значительное снижение митотической активности. Митотический индекс в результате лечения снижается в 2 раза. Анализ соотношения фаз митоза свидетельствует о том, что уменьшение числа делящихся клеток происходит, в основном, за счет снижения количества профаз (9,3 в опыте против 29,9 в контроле). Это дает основания полагать, что сегидрин действует на опухолевые клетки, находящиеся в интерфазе, замедляя их прохождение по клеточному циклу и задерживая их вступление в митоз.
Нельзя также исключить, что препарат способен повреждать митотический аппарат опухолевых клеток. В пользу этого свидетельствует появление значительного числа патологических фигур митоза, количество которых достигает 27,6% в опыте против 5,7% в контроле. Наиболее часто обнаруживались такие формы патологических фигур митоза, как рассеивание хромосом и отставание хромосом или хроматид в метакинезе и при расхождении к полюсам в анафазе.
4. Сегидрин является стабилизатором цитомембран. Причем это относится как к клеточной мембране, так и к мембранам клеточных органелл (В.А. Филов, и др.). При этом на искусственные мембраны сегидрин не влияет.
Сегидрин является ингибитором витамина В6, что было показано в следующих опытах. Сегидрин применяли в дозе 60 мг/кг, витамин В6 в дозе 4 мг/кг. В6 вводили животным в утренние часы, сегидрин – днем. В такой постановке эксперимента наблюдалось ослабление противоопухолевого действия сегидрина. Так, если сегидрин в дозе 60 мг/кг тормозит рост карциносаркомы Уокер в среднем на 50%, то при совместном его применении с В6 торможение роста составляет 20–25% (Р Литература:
1. Л. Ф. Ларионов. Химиотерапия злокачественных опухолей. М. 1962. С. 106.
2. Л. Л. Малюгина, Р. И. Полькина, А. Л. Ремизов. Противоопухолевое действие некоторых производных адреналонов. // Хим.–фарм. Журнал. 1979. № 7. С. 56–58.
3. В. С. Мишенева, Т. М. Бурова, Т. А. Горюхина. Влияние гидразинсульфата на активность фосфоэнолпируваткарбоксикиназы и рост экспериментальных опухолей. // Вопросы онкологии. 1980. № 2. С. 71–73.
4. В. Я. Русин. Сульфат гидразиния. // Вредные химические вещества. Неорганические соединения элементов V–VIII групп. Ред. В. А. Филов. Л.: Химия. 1989. С. 18–23.
5. А. Н. Стуков, О. Б. Разумейко, В. А. Филов. О несовместимости гидразинсульфата с этанолом и барбитуратами. // Деп. ВИНИТИ № 1706–75 Деп. 1975.
6. В. А. Филов. Сегидрин – противоопухолевый препарат нового типа. // Вопросы онкологии. 1994. Т. 40, № 1–3. С. 3–14.
7. В. А. Филов, Т. М. Бурова. Глюконеогенез при лечении животных с экспериментальными опухолями гидразинсульфатом. // Бюллетень эксперим. биол. мед. 1984. № 1. С. 73–74.
8. В. А. Филов, М. Л. Гершанович, Б. А. Ивин и др. Лечение первичных опухолей головного мозга сегидрином. // Вопросы онкологии. 1994. Т. 40, № 7–12. С. 332–336.
9. В. А. Филов, Л. А. Данова, М. Л. Гершанович и др. Гидразинсульфат: экспериментальные и клинические данные, механизмы действия. // Лекарственная терапия опухолей в эксперименте и клинике. Ред. Н. П. Напалков, В. А. Филов и др. Л.: НИИ онкологии. 1983. С. 91–139.
10. В. А. Филов, Л. А. Данова, М. Л. Гершанович и др. Результаты клинического изучения препарата гидразинсульфат. // Вопросы онкологии. 1990. Т. 36, № 6. С. 721–726.
11. В. А. Филов, А. В. Третьяков, А. Э. Гринфельдт. Гидразинсульфат как стабилизатор цитомембран. // Бюллетень эксперим. биол. мед. 1986. № 5. С. 610–611.
12. В. С. Шапот, В. П. Шелепов, В. А. Ушаков. Глюконеогенез и расстройства гомеостаза в опухолевом организме. // Вестник АМН СССР. 1982. № 9. С. 29–34.
13. V. A. Filov et al. Experience of the treatment with Sehydrin in the advanced cancer patients. // Investigational New Drugs.1995. V. 13. P. 89–97.
14. J. Gold. Hydrazine sulfate and cancer cachexia. // Nutrition and Cancer. 1979. V. 1, n 4. P. 4–9.
15. P. D. Ray, R. L. Hanson, H. A. Lardy. Inhibition by Hydrazine of gluconeogenesis in the rat. // J. biol. Chem. 1970. V. 245. P. 690–696.
Читайте также:

