Раковая клетка не стареет
Чтобы опасные старые клетки не накапливались и не провоцировали хронические болезни, их можно устранить с помощью Т-лимфоцитов, распознающих клеточную старость.
Со временем в наших клетках накапливаются разнообразные дефекты – в генах появляются мутации, повреждённые белки перестают работать, как надо. Обычно в ответ на дефекты и повреждения должна включаться программа клеточного суицида: клетка уничтожает сама себя, и делает это так, чтобы доставить окружающим как можно меньше беспокойства. Но часто случается иначе: программа суицида не срабатывает, и клетка продолжает стареть.
С одной стороны, в стареющей клетке отключён механизм деления, и стать раковой она не сможет. (И даже размножение раковой клетки можно остановить, если спровоцировать в ней старение.) С другой стороны, она активно выделяет в окружающую среду целый набор соединений, воспалительные сигналы, ферменты, расщепляющие другие белки и пр. – такой коктейль, выделяемый дряхлеющей клеткой, плохо влияет на окружающую ткань. Стареющие клетки провоцируют общее фоновое воспаление в организме, повышают риск атеросклероза, вредят мозгу и вообще укорачивают жизнь. В норме их должны уничтожать иммунные клетки, которые приходят, так сказать, на запах старости, то есть по следам тех молекул, которые выбрасывают из себя стареющие клетки. Но бывает, что они продолжают накапливаться, накапливаться и накапливаться.
Чтобы избавиться от них, можно использовать специальные сенолитические препараты, уничтожающие старые клетки, и поиском таких препаратов занимаются множество лабораторий по всему миру. Однако исследователи из Мемориального онкологического центра им. Слоуна–Кеттеринга поступили иначе – они улучшили собственные иммунные клетки организма, чтобы они активнее уничтожали клеточный балласт.
Собственно, авторы работы использовали метод CAR Т-лимфоцитов, где CAR означает chimaeric antigen receptor – то есть Т-лимфоциты с химерным рецептором к антигену. Т-клетки узнают, кого нужно уничтожить, с помощью поверхностных рецепторов, которые узнают определённые молекулы – антигены. Но рецепторы работают с разной эффективностью; кроме того, у Т-лимфоцитов вообще может не оказаться рецепторов к нужному антигену. Суть метода CAR Т-лимфоцитов в том, что у индивидуума берут Т-клетки и модифицируют их рецепторы так, чтобы они узнавали конкретные молекулы-антигены и узнавали их хорошо. Обычно CAR T-лимфоциты настраивают на раковые клетки, конструируя им такие рецепторы, которые узнавали бы только раковые молекулы-антигены, отсутствующие на здоровых клетках.
Можно ли Т-лимфоциты настроить на старые клетки? Для начала в старых клетках нужно найти такие белки, которые бы сидели на их наружной клеточной мембране и которые были бы свойственны только старым клеткам. У человеческих и мышиных старых клеток удалось найти восемь наиболее многообещающих в этом смысле белков, из которых выбрали рецептор uPAR, который активно участвует в деградации старой ткани и которого почти нет у нестарых клеток. (Кстати, тот же uPAR, только в растворимой форме, считается одним из маркеров разных хронических болезней, включая диабет и почечные болезни, в которых клеточное старение играет большую роль.)
Исследователи настроили мышиные Т-лимфоциты распознавать рецептор uPAR и запустили их обратно в мышей, откуда их и взяли. В статье в Nature говорится, что модифицированные Т-лимфоциты справились с задачей и уничтожили старые клетки. Причём эти старые клетки были как раз раковые, которых сначала заставили состариться, чтобы они перестали делиться. То есть CAR T-лимфоциты, нацеленные против стареющих клеток, можно использовать как дополнение к противораковой терапии – потому что всё равно раковые клетки, пусть и состарившиеся, нужно куда-то девать. Кроме того, CAR T-лимфоциты улучшили состояние печени у мышей с неалкогольным стеатогепатитом, когда в печени начинается воспаление на фоне жирового перерождения.
Модифицированные Т-лимфоциты, нацеленные против стареющих клеток, могли бы стать удачной альтернативой сенолитическим препаратам, которые, как пишет портал Nature, порой оказываются токсичны, то есть вредят не только старым клеткам, но и всем остальным. Но такие Т-лимфоциты предстоит ещё испытать на людях, и, возможно, для уничтожения человеческих старых клеток Т-лимфоцитам нужен рецептор против какого-то другого белка. Наконец, не стоит забывать, что метод CAR T-клеток пока что очень недёшев, и можно только надеяться на то, что когда-нибудь он станет более-менее обычной медицинской услугой.
Мастерок.жж.рф
Когда мне было лет 10 все вокруг практически уверенно говорили, что пройдет буквально 50 лет и люди будут жить не менее 200 лет. Наука и медицина несомненно должна была шагать семимильными шагами и мы точно должны были увидеть прорыв. Но сейчас понятно, что на это надо наверное еще лет 200. Однако, смотрите про что я узнал .
Оказывается существуют теломеры - это концевые участки линейной молекулы ДНК, которые состоят из повторяющейся последовательности нуклеотидов. У человека и других позвоночных повторяющееся звено имеет формулу TTAGGG (буквы обозначают нуклеиновые основания). В отличие от других участков ДНК теломеры не кодируют белковые молекулы, в некотором роде это "бессмысленные" участки генома.
В 1971 году российский ученый Алексей Матвеевич Оловников впервые предположил, что при каждом делении клеток эти концевые участки хромосом укорачиваются. То есть длина теломерных участков определяет "возраст" клетки - чем короче теломерный "хвост", тем она "старше".
Через 15 лет это предположение экспериментально подтвердил английский ученый Говард Кук. Правда, нервные и мышечные клетки взрослого организма не делятся, теломерные участки в них не укорачиваются, а между тем они "стареют" и умирают. Поэтому вопрос о том, как "возраст" клетки связан с длиной теломер, остается по сей день открытым. Одно несомненно - теломеры служат своего рода счетчиком клеточных делений: чем они короче, тем большее число делений прошло с момента рождения клетки-предшественницы.

Сколько отведено человеку для жизни, мало кто может сказать, почему человек стареет. Ученые уже давно задаются вопросом: что происходит в организме и запускает процесс старения? Клетки могут делиться, и казалось бы, организм будет вечно молодым, здоровым и жить вечно, но оказывается наши клетки могут обновляться до определенного количества раз, а потом наступает время болезней и процесса старения, что приводит к смерти, невозможности клеток возобновляться. Существует много теорий, рассматривающие разные аспекты, как первопричину старения, но сегодня известная настоящая причина, с которой справиться никто не может.
Одни ученые говорят, что старение начинается с процессом повреждения и распада белка. А белок, как мы уже знаем, является строительным материалом нашего тела, в частности костей. Другие исследователи видят гены смерти, которые начинают активизироваться в старости. Еще одно мнение: организм накапливает загрязнения, если доза мусора в организме превышает допустимую, то запускается очередность заболеваний, организм истощается и умирает. Также существует иммунологическая теория. В какую из них верить, дело каждого. Истинная причина, почему человек стареет и начинается отмирание клеток находится в нашем генетическом коде.
Старение начинается из-за укорачивания длины теломер – это конечный участок генетического кода (ДНК). Теломеры направлены защищать хромосомы от прилипания друг к другу, что может повлечь потерю информации. Такие выводы сделали ученные в процессе наблюдения за жизнью клеток молодых и в процессе их старения. Длина теломер в генах молодых клеток отличается от состарившихся. Теломеры ДНК в молодых клетках длиннее, чем концы в старых клетках. Когда теломера разрушается, погибает клетка. Клетка имеет способность делиться до тех пор, пока ее теломера не разрушиться.
Такая теория должна была найти объяснения и доводы. Были проведены опыты над мышами. Специалисты в области генетики искусственным образом укорачивали теломеры клетки ДНК у здоровой молодой мыши. Чем короче становилась теломера, тем больше появлялось заболеваний, характеризующих процесс старения. Полученные результаты послужили доказательством теории зависимости молодости и старения от длины теломер в клетках. При укорачивании длины теломер возникают такие заболевания: артрит, артроз, дегенеративный и дистрофические процессы, заболевания, связанные с сердечно-сосудистой системой, нарушения нервной системы, остеопороз, изменения в кожном покрове.

Теломераза - это фермент-"удлинитель", его функция - достраивать концевые участки линейных молекул ДНК, "пришивая" к ним повторяющиеся нуклеотидные последовательности - теломеры. Клетки, в которых функционирует теломераза (половые, раковые), бессмертны. В обычных (соматических) клетках, из которых в основном и состоит организм, теломераза "не работает", поэтому теломеры при каждом делении клетки укорачиваются, что в конечном итоге приводит к ее гибели.
В 1997 году американские ученые из университета Колорадо получили ген теломеразы. Затем в 1998-м исследователи из Юго-Западного медицинского центра Техасского университета в Далласе встроили ген теломеразы в клетки кожи, зрительного и сосудистого эпителия человека, где фермент в обычных условиях "не работает". В таких генетически модифицированных клетках теломераза находилась "в рабочем состоянии" - пришивала к концевым участкам ДНК нуклеотидные последовательности, поэтому длина теломер от деления к делению не менялась. Таким способом ученым удалось увеличить жизнь обычных клеток человека в полтора раза. Не исключено, что этот метод поможет найти ключ к продлению жизни.
Итак, теломераза остается главным кандидатом на звание эликсира бессмертия. И в то же время этот фермент - один из главных факторов злокачественного перерождения клеток. Раковые клетки бессмертны благодаря тому, что в них "работает" теломераза. Вот почему бессмертие и рак в природе как бы уравновешивают друг друга: бессмертный организм теоретически может жить вечно, но он неминуемо погибнет от рака.
И вот в прошлом году был найден способ удлинения теломер для продления жизни. Ученые из Стэнфордского университета разработали метод стимуляции концевых участков хромосом, которые отвечают за старение человека.

Таким образом удалось удлинить теломеры более чем на 1000 нуклеотидов, что эквивалентно нескольким годам человеческой жизни. Что важно, процесс совершенно безопасен для здоровья и не приводит к неконтролируемому делению клеток: иммунная система просто не успевает отреагировать на введенную в организм РНК, которая бесследно распадается. Открытие поможет увеличить количество клеток для исследований медицинских препаратов и моделирования заболеваний, а в перспективе и для продления жизни.
И еще немного интересного по медицинской тематики: вот например Профессор Преображенский в реальности, а вот как вам Робот из крысиных сердец. Давайте вспомним, что такое Эффект плацебо и узнаем, как Микробы заставляют нас пить пиво
Раковые клетки не бессмертны , как и все остальные. Образование обычной клетки в раковую происходит на самых ранних этапах развития этой клетки , когда способность к размножению превышает таковую у других клеток в сотни раз. Это по сути те же стволовые клетки. Отсюда такая " живучесть" , но не бессмертность. Клетки иммунной системы не сразу могут распознать онкологическую клетку , потому что генетически она "родная" для организма. И к тому моменту , когда клетки - киллеры начинают уничтожать раковые клетки , их становится слишком много - останется хоть одна и процесс начнется заново. Кроме того, новые технологии лечения онкологических заболеваний связаны с фактором некроза опухоли , который синтезируется организмом постоянно . Поэтому бессмертия им точно не видать. А вот омоложение с помощью стволовых клеток давно используется . Но это очень противоречивая тема.
Хороший пример бессмертия раковых клеток — это клетки HeLa, изначально полученные из опухоли шейки матки Генриетты Лекс в 1951 г. Эта культура по сей день используется в лабораторных исследованиях. Клетки Hela в самом деле бессмертны: по оценкам, ежедневно производится несколько тонн этих клеток, причём все они являются потомками нескольких клеток, извлечённых из опухоли Г. Лекс.
Чтобы клетка стала раковой (запустив механизм своего размножения и деления в организме человека), она проходит несколько этапов мутаций (трансформируется). Не любых мутаций, а именно критичных для превращения в канцерогенную клетку. Их должно быть не менее пяти (8-10), их комбинации - самые разные. Нет абсолютно одинаковых опухолей, как и одинаковых причин их возникновения.
У каждой нашей клетки (их около 100 триллионов) - своя продолжительность жизни, у каждого органа - свои клетки. И программа клеточной гибели срабатывает только после многократного "сигнала смерти". Сигнал может прийти из окружающей клетку среды или собственных внутриклеточных "датчиков неблагополучия".
В здоровом и нормально функционирующем организме ежесекундно(!) погибает огромное количество клеток и столько же образуется вновь. Опухоль возникает, когда этот процесс иногда выходит из-под контроля. И появляются мутантные клетки, которых ежедневно(!) в организме возникает до сотни тысяч. Их постоянно отслеживают и уничтожают две системы контроля нашего организма: система клеточного генетического самоконтроля и система противоопухолевого иммунитета.
Сложность в том, что если клетка в результате мутации не поддастся действию одной из этих двух систем контроля, то она будет неуязвима и для другой. И потомки этой клетки положат начало формированию мутантного клона - они приобретают способность ускользать от системы генетического самоконтроля и в дальнейшем избегать гибели при тиражировании вновь появившихся мутаций.
Таким образом, опухолевая клетка постоянно эволюционирует, порождая новые клеточные клоны, наиболее злокачественные из которых начинают вытеснять менее злокачественные. Остановить это возможно, лишь удалив опухоль, ограничивая их рост.
Сейчас ученые работают над тем, чтобы раковая клетка совершила самоубийство, поедая саму себя.
КЛЕТОЧНЫЙ КЛЮЧ ДОЛГОЛЕТИЯ
- Может быть, можно будет применять метод, который сейчас используется для лечения некоторых видов рака — инъекции прицельно в определенное место, конкретный орган?
- Да, теоретически это один из возможных подходов.
РАЗ И НА ВСЮ ЖИЗНЬ
Словом, биология-анатомия-медицина сделали виток по спирали, и после глубоких исследований новейшими методами вернулись к тезису о том, что нервные клетки практически не восстанавливаются. Это значит, что их нужно усиленно беречь.
ЭТО ПРИГОДИТСЯ
Как продлить жизнь нервных клеток
1. Побольше кислорода!
Для хорошего питания клеток мозга нужен полноценный приток кислорода. Улучшить его помогают аэробные физнагрузки, самая безопасная из которых при любом состоянии здоровья и возрасте — ходьба быстрым шагом: максимально быстро, насколько это возможно без одышки.
2. Поменьше сладкого
Вы, конечно, с детства помните, что клеткам мозга нужна глюкоза, но если будете часто подкармливать свои нейроны чистым сахаром из конфет и печенья, то начнутся неблагоприятные процессы, повреждающие кровеносные сосуды в мозге. Гораздо безопаснее и полезнее обеспечивать мозг глюкозой, которая образуется при усвоении медленных (сложных) углеводов, то есть: круп с минимальной обработкой (монастырская овсянка, темный рис); хлеба и макаронов из муки грубого помола; овощей. Кондитерские изделия желательно заменять фруктами.
3. Недосыпам — нет
ЯЙЦЕКЛЕТКИ: А ЧАСИКИ ВСЕ-ТАКИ ТИКАЮТ
Как и нейроны, яйцеклетки (точнее, их предшественницы клетки-ооциты) даются женщине раз и на всю жизнь. Это значит, что ввиду естественных ежемесячных потерь, а также по некоторым другим причинам запас женских половых клеток истощается и полностью иссякает в среднем к возрасту 50 - 55 лет. Тем, кто планирует иметь детей, но по каким-либо обстоятельствам затягивает с беременностью, современная медицина предлагает замораживать яйцеклетки и хранить в криобанке (в Москве стоимость процедур, необходимых для забора женских половых клеток и помещения на хранение, может достигать 170 — 175 тыс. руб. плюс около 15 — 17 тыс руб. в год за само хранение в криобанке).
ДЕЛАЙ ТАК
Чтобы сердце стало долгожителем
Врач-кардиолог, кандидат медицинских наук, главный терапевт Ильинской больницы Ярослав Ашихмин советует:
- Избавляйтесь от лишнего веса. Для здорового сердца нормальным показателем индекса массы тела (ИМТ) считается цифра до 25. Чтобы посчитать ИМТ, возведите свой рост (в метрах) в квадрат, затем свой вес (в кг) разделите на полученное число.
- Бросьте курить и не злоупотребляйте алкоголем. При отсутствии противопоказаний (заболевания пищеварения, беременность и др .), относительно безопасным считается 1 бокал сухого вина в день не чаще 5 раз в неделю для женщин и до 2 бокалов в день не более 5 раз в неделю для мужчин.
- Старайтесь как можно больше двигаться: согласно последним международным рекомендациям для здоровья сердца и сосудов требуется еженедельно не менее 150 минут умеренных физнагрузок (по 30 минут 5 дней в неделю) либо не менее 75 минут высокоинтенсивных физнагрузок (по 15 минут в день 5 дней в неделю).
КОЖА ЛЕГКО МЕНЯЕТСЯ РАЗ В МЕСЯЦ? НЕ ОБОЛЬЩАЙТЕСЬ
Большинство других клеток нашего организма, кто быстрее, кто медленнее, но так или иначе обновляется. К примеру, жировые клетки живут 7,5 — 8 лет, клетки печени гепатоциты в среднем 327 дней, клетки эпителия (внутренней оболочки кишечника) 2 — 4 дня, клетки кожи 10 — 30 дней, а срок жизни сперматозоида 2 месяца.
Однако и здесь не все так просто, как представляют авторы многочисленных картинок и видеороликов в Интернете, предупреждает профессор Гладышев. Не стоит обольщаться, что ваша печень полностью обновляется каждый год, а вся кожа легко меняется раз в месяц.
- Часто все упрощают, но в жизни многое происходит по-другому: скажем, некоторые клетки биологически способны обновляться, но по факту такая клетка живет в своем органе и, если убрать ее, то заместится другой клеткой хоть в течение дня, а если не трогать - может сидеть 10 лет и не меняться. Еще бывает, что один и тот же тип клеток в одном месте организма за какое-то время полностью поменялся, а в другом месте живет как ни в чем не бывало. Какие факторы на это влияют, пока во многом остается загадкой внутренней саморегуляции организма.
ЗАГАДКА ЛИЦЕВЫХ МЫШЦ
- Чем именно займутся ученые?
- В первую очередь мы будем анализировать многообразие мышц. Считается, что у человека всего три типа мышц: сердечная (миокард), гладкие мышцы и скелетные. Но одних только скелетных мышц больше 600! И по сей день не известно, что делает их схожими и разнообразными. Судя по всему, есть некая особая генетическая программа: несмотря на то, что все это в целом скелетные мышцы, у них есть собственные компоненты, которые определяют, каким именно видом они становятся.
- Почему это так важно выяснить?
- Помните, недавно умер знаменитый ученый Стивен Хокинг? У него была тяжелая стадия бокового амиотрофического склероза (наследственное заболевание нервной системы, которое сопровождается атрофией мышц. - Авт.). Поразительно то, что при полной парализации у Хокинга сохранялась мимика лица. А ведь заболевание наследственное, это значит, что во всех клетках тела мутация одна и та же. Однако, как оказалось, дистрофии (истощению) с возрастом подвергаются не все типы мышц — что при заболевании, как у Стивена, что у здоровых пожилых людей. В частности, выяснилось, что глазные мышцы и мышцы лица у человека самые устойчивые. И теперь важно понять: почему, например, мышцы конечностей становятся первыми жертвами дистрофии (с возрастом или при болезни. - Авт.), а другие типы мышц - нет. Что в них такого особенного? Если это выяснить, то появляются перспективы использовать генную терапию, чтобы вернуть дряхлеющие мышцы в хорошее состояние. Это и есть цель нашего проекта.
Сопоставляя результаты исследований у приматов и человека, по разным мышцам и в разном возрасте, исследователи планируют создать самый масштабный атлас работы разных типов мышц. И вычислить факторы, которые влияют на изменения и суперустойчивость мышц.
ВОПРОС-РЕБРОМ
Почему, обновляясь, мы стареем?
- Безусловно, в нашем организме есть инструменты репарации, то есть исправления повреждений, возникающих в ДНК материнских и дочерних клеток, - добавляет биолог Вадим Гладышев. - Однако, чем старше организм, тем медленнее и хуже работают механизмы починки, дефектов накапливается все больше. Процесс накопления таких неблагоприятных изменений это и есть старение, а его внешние проявления — дряхление и болезни, которые развиваются с возрастом. Однако биологически у нас нет препятствий, которые не позволили ли бы вмешаться в конвейер старения и затормозить его — так же, как мы уже научились тормозить и излечивать многие тяжелые болезни.

Как обновляется наш организм Фото: Рушан КАЮМОВ
28 октября 2012
- 14117
- 11,6
- 4
- 5
Деление клетки. Клеточный цикл.
![]()
Наталья Малыгина
![]()
Антон Чугунов![]()
Андрей Панов

Спонсор конкурса — дальновидная компания Thermo Fisher Scientific.
В организме человека присутствует примерно 300 типов клеток, и все они делятся на две большие группы: одни могут делиться и размножаться (то есть, они митотически компетентны), а другие — постмитотические — не делятся: это достигшие крайней стадии дифференцировки нейроны, кардиомиоциты, зернистые лейкоциты и другие.
В нашем организме существуют обновляющиеся ткани, в которых есть пул постоянно делящихся клеток, которые заменяют отработанные или погибающие клетки. Такие клетки есть в криптах кишечника, в базальном слое эпителия кожи, в костном мозге (кроветворные клетки). Обновление клеток может происходить довольно интенсивно: так, клетки соединительной ткани в поджелудочной железе заменяются каждые 24 часа, клетки слизистой желудка — каждые три дня, лейкоциты — каждые 10 дней, клетки кожи — каждые шесть недель, примерно 70 г пролиферирующих клеток тонкого кишечника удаляется из организма ежедневно [1].
Стволовые клетки, существующие практически во всех органах и тканях, способны делиться неограниченно. Регенерация тканей происходит за счет пролиферации стволовых клеток, которые могут не только делиться, но и дифференцироваться в клетки той ткани, регенерация которой происходит. Стволовые клетки есть в миокарде, в головном мозге (в гипокампе и в обонятельных луковицах) и в других тканях. Это открывает большие надежды в плане лечения нейродегенеративных заболеваний и инфаркта миокарда [2–4].
Постоянно обновляющиеся ткани способствуют увеличению продолжительности жизни. При делении клеток происходит омоложение тканей: новые клетки приходят на место поврежденных, при этом интенсивнее происходит репарация (устранение повреждений ДНК) и возможна регенерация при повреждении тканей. Не удивительно, что у позвоночных значительно выше продолжительность жизни, чем у беспозвоночных — тех же насекомых, у которых во взрослом состоянии клетки не делятся.
Но в то же время обновляющиеся ткани подвержены гиперпролиферации, что ведет к образованию опухолей, в том числе — злокачественных. Это происходит из-за нарушений регуляции деления клеток и повышенной частоты мутагенеза в активно делящихся клетках. По современным представлениям, чтобы клетка приобрела свойство злокачественности, ей необходимо 4–6 мутаций . Мутации возникают редко, и для того, чтобы клетка стала раковой — это подсчитано для фибробластов человека — должно произойти около 100 делений (такое число делений обычно происходит у человека примерно в возрасте 40 лет) [5].
В целях защиты от самого себя, в организме сформировались специальные клеточные механизмы супрессии опухолей. Один из них — репликативное старение клеток (сенесценция), заключающееся в необратимой остановке деления клетки в стадии G1 клеточного цикла. При старении клетка перестает делиться: она не реагирует на ростовые факторы и становится устойчивой к апоптозу.
Лимит Хейфлика
Феномен старения клеток был впервые открыт в 1961 г. Леонардом Хейфликом с коллегами на культуре фибробластов. Оказалось, что клетки в культуре фибробластов человека при хороших условиях живут ограниченное время и способны удваиваться примерно 50±10 раз, — и это число стали называть лимитом Хейфлика [6], [7]. До открытия Хейфлика господствовала точка зрения, что клетки бессмертны, а старение и смерть — это свойство организма в целом.
Эта концепция считалась неопровержимой во многом благодаря экспериментам Карреля, который поддерживал культуру клеток сердца цыпленка 34 года (ее выбросили лишь после его смерти). Однако, как выяснилось впоследствии, бессмертие культуры Карреля было артефактом, поскольку вместе с эмбриональной сывороткой, которая добавлялась в культуральную среду для роста клеток, туда попадали и сами эмбриональные клетки (и, скорее всего, культура Карреля стала уже далеко не тем, чем была в начале).
По-настоящему бессмертными являются раковые клетки. Так, клетки HeLa, выделенные в 1951 г. из опухоли шейки матки Генриетты Лакс , до сих пор используются цитологами (в частности, c помощью клеток HeLa была разработана вакцина против полиомиелита). Эти клетки даже побывали в космосе.
Еще один важный фактор биологического старения — строение хромосом и их кончиков — теломеров.
Теломерная теория старения
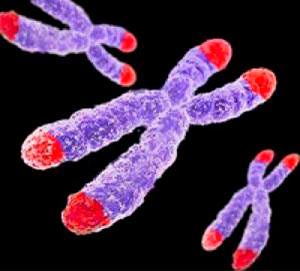
Рисунок 1. Теломеры — концевые участки хромосом. Поскольку хромосом у человека 23 пары (то есть, 46 штук), теломер получается 92.
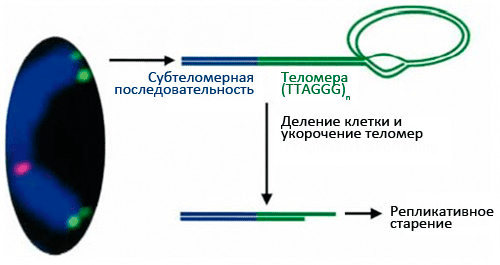
Рисунок 2. Состав и структура теломер. Многократное деление клетки в случае отсутствия активности теломеразы ведет к укорочению теломер и репликативному старению.
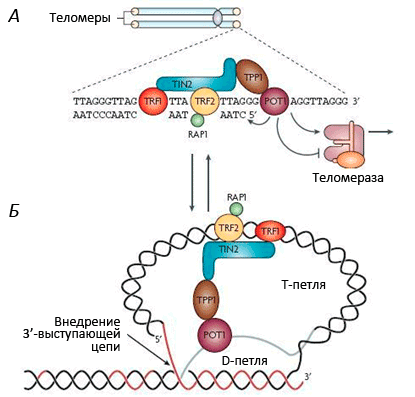
Рисунок 3. Строение теломерного комплекса (шелтерина). Теломеры находятся на концах хромосом и состоят из тандемных повторов TTAGGG, которые заканчиваются 32-членным выступающим одноцепочечным фрагментом. С теломерной ДНК связан шелтерин — комплекс из шести белков: TRF1, TRF2, RAP1, TIN2, TPP1 и POT1.
Длина теломер и скорость их укорочения зависит от возраста. У человека длина теломер варьирует от 15 тысяч нуклеотидных пар (т.н.п.) при рождении до 5 т.н.п. при хронических заболеваниях. Длина теломер максимальна у 18-месячных детей, а затем она быстро снижается до 12 т.н.п. к пятилетнему возрасту. После этого скорость укорачивания снижается [14].
Любопытно, что у мышей очень длинные теломеры (50–40 т.н.п., по сравнению с 10–15 т.н.п. у человека). У некоторых линий лабораторных мышей длина теломер достигает 150 т.н.п. Более того, у мышей теломераза всегда активна, что не дает теломерам укорачиваться. Однако это, как всем известно, не делает мышей бессмертными. Мало того: у них опухоли развиваются намного чаще, чем у людей, что позволяет предположить, что укорачивание теломер как механизм защиты от опухолей у мышей не работает [15].
При сравнении длины теломер и теломеразной активности у разных млекопитающих оказалось, что виды, для которых характерно репликативное старение клеток, имеют большую продолжительность жизни и большой вес. Это, например, киты, продолжительность жизни которых может достигать 200 лет. Таким организмам репликативное старение просто необходимо, поскольку слишком большое число делений порождает множество мутаций, с которыми необходимо как-то бороться. Предположительно, репликативное старение и есть такой механизм борьбы, который сопровождается к тому же репрессией теломеразы [16].
Старение диференцированных клеток происходит иначе. Стареют и нейроны, и кардиомиоциты, а ведь они не делятся! Например, в них накапливается липофусцин — старческий пигмент, который нарушает функционирование клеток и запускает апоптоз. В клетках печени и селезенки с возрастом накапливается жир.
Связь репликативного старения клеток со старением организма, строго говоря, не доказана, но возрастная патология сопровождается и старением клеток (рис. 4). Злокачественные новообразования пожилого возраста в большинстве своем связаны с обновляемыми тканями. Онкологические заболевания в развитых странах — одна из основных причин заболеваемости и смертности, причем независимым фактором риска раковых заболеваний является просто. возраст. Число смертей от опухолевых заболеваний увеличивается с возрастом по экспоненте, так же как и общая смертность. Это говорит нам, что между старением и канцерогенезом существует фундаментальная связь.
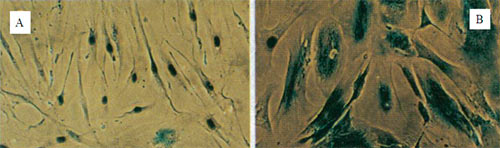
Рисунок 4. Гистохимически окрашенные на наличие β-галактозидазной активности фибробласты человека линии WI-38. A — молодые; B — старые (сенесцентные).
Теломераза — фермент, который был предсказан
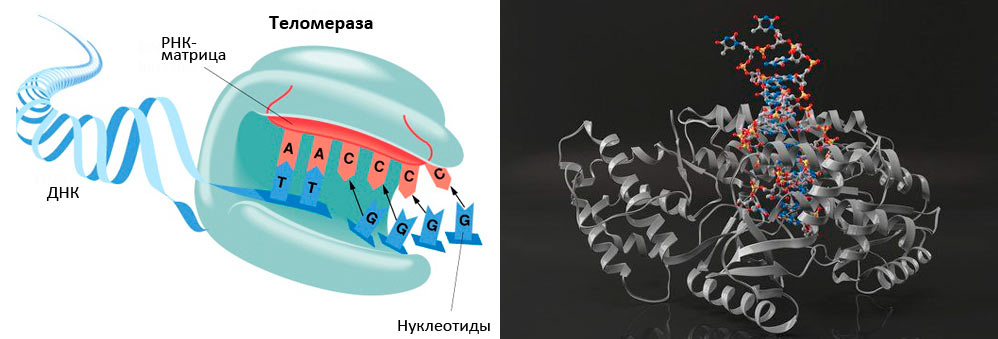
Рисунок 5. Теломераза содержит каталитический компонент (обратную транскриптазу ТERT), теломеразную РНК (hTR или TERC), содержащую две копии теломерного повтора и являющуюся матрицей для синтеза теломеров, и белок дискерин.
По данным Э. Блекберн, теломераза участвует в регуляции активности примерно 70 генов. Теломераза активна в зародышевых и эмбриональных тканях, в стволовых и пролиферирующих клетках. Ее обнаруживают в 90% раковых опухолей, что обеспечивает неудержимое размножение раковых клеток. В настоящее время среди препаратов, которые используют для лечения рака, есть и ингибитор теломеразы. Но в большинстве соматических клеток взрослого организма теломераза не активна.
В состояние сенесценции клетку могут привести многие стимулы — дисфункция теломер, повреждения ДНК, причиной которых могут быть мутагенные воздействия окружающей среды, эндогенные процессы, сильные митогенные сигналы (сверхэкспрессия онкогенов Ras, Raf, Mek, Mos, E2F-1 и др.), нарушения хроматина, стрессы и др. Фактически, клетки перестают делиться — становятся сенесцентными — в ответ на потенциально вызывающие рак события.
Страж генома
О молекулярных механизмах старения клеток
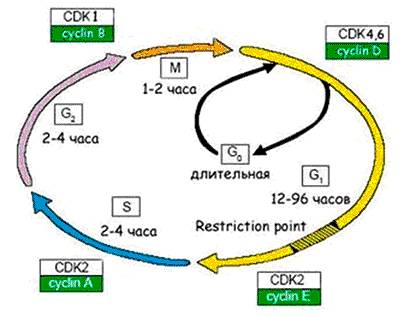
Рисунок 6. Схема клеточного цикла. Клеточный цикл подразделяют на четыре стадии: 1. G1 (предсинтетическая) — период, когда клетка готовится к репликации ДНК. В этой стадии может произойти остановка клеточного цикла в случае обнаружения повреждений ДНК (на время репарации). Если обнаруживаются ошибки в репликации ДНК, и они не могут быть исправлены репарацией, клетка не переходит на стадию S. 2. S (cинтетическая) — когда происходит репликация ДНК. 3. G2 (постсинтетическая) — подготовка клетки к митозу, когда происходит проверка точности репликации ДНК; если обнаружены недореплицированные фрагменты или другие нарушения в синтезе, переход на следующую стадию (митоз) не происходит. 4. М (митоз) — формирование клеточного веретена, сегрегация (расхождение хромосом) и формирование двух дочерних клеток (собственно деление).
Чтобы были понятны молекулярные механизмы перехода клетки в состояние сенесцентности, я напомню вам, как происходит деление клетки.
Процесс размножения клеток называют пролиферацией. Время существования клетки от деления до деления именуют клеточным циклом. Процесс пролиферации регулируется как самой клеткой — аутокринными ростовыми факторами, — так и ее микроокружением — паракринными сигналами.
Активация пролиферации происходит через клеточную мембрану, в которой присутствуют рецепторы, воспринимающие митогенные сигналы — это в основном ростовые факторы и межклеточные контактные сигналы. Ростовые факторы обычно имеют пептидную природу (к настоящему времени их известно около 100). Это, например, фактор роста тромбоцитов, который участвует в тромбообразовании и заживлении ран, эпителиальный фактор роста, различные цитокины — интерлейкины, фактор некроза опухолей, колониестимулирующие факторы и т.д. После активации пролиферации клетка выходит из фазы покоя G0 и начинается клеточный цикл [19] (рис. 6).
50% случаев злокачественных опохолей. Другое проявление активности р53 связано с апоптозом наиболее поврежденных клеток.
Сенесценция клеток и возраст-зависимые заболевания
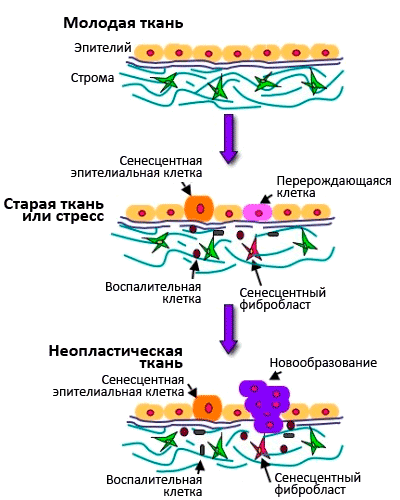
Рисунок 7. Взаимосвязь между старением клеток и старением организма.
Сенесцентные клетки накапливаются с возрастом и способствуют возрастным заболеваниям. Они снижают пролиферативный потенциал ткани и истощают пул стволовых клеток, что приводит к дегенеративным нарушениям ткани и снижает способность к регенерации и обновлению.
Сенесцентные клетки характеризуются специфической экспрессией генов: они секретируют воспалительные цитокины и металлопротеиназы, разрушающие межклеточный матрикс. Получается, что старые клетки обеспечивают вялотекущее старческое воспаление, а накопление старых фибробластов в коже служит причиной возрастного снижения способности к заживлению ран (рис. 7). Старые клетки также стимулируют пролиферацию и малигнизацию близлежащих предраковых клеток, благодаря секреции эпителиального фактора роста [20].
Сенесцентные клетки накапливаются во многих тканях человека, присутствуют в атеросклеротических бляшках, в язвах кожи, в пораженных артритом суставах, а также в доброкачественных и пренеопластических гиперпролиферативных поражениях простаты и печени. При облучении раковых опухолей некоторые клетки также переходят в состояние сенесценции, тем самым обеспечивая рецидивы заболевания.
Таким образом, клеточное старение демонстрирует эффект отрицательной плейотропии, суть которого состоит в том, что хорошее для молодого организма, может стать плохим для старого. Самый яркий пример — процессы воспаления. Выраженная реакция воспаления способствует быстрому выздоровлению молодого организма при инфекционных заболеваниях. В пожилом же возрасте активные воспалительные процессы приводят к возрастным заболеваниям. Сейчас принято считать, что воспаление играет определяющую роль практически при всех возраст-зависимых заболеваниях, начиная с нейродегенеративных.
Читайте также:




