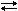Пропен с хлором при 500

Химические свойства и получение органических веществ в заданиях С3. Реакции, вызывающие наибольшие сложности у школьников, выходящие за рамки школьного курса.
Для решения заданий С3 школьникам нужно знать весь курс органической химии на профильном уровне. Конечно, не идет речь о том, что нужно помнить свойства всех классов органических веществ и способы их получения.
Мне хочется обратить ваше внимание:
1) на реакции, которые могут идти по-разному в зависимости от условий;
2) на преимущественные направления протекания некоторых реакций;
3) на реакции, которые не рассматриваются в школьном курсе, но используются в заданиях ЕГЭ.
1. Реакции, которые могут идти по-разному в зависимости от условий.
1.1. Взаимодействие галогеналканов с щелочами
При действии на галогеналкан водного раствора щелочи получается спирт (идет реакция замещения): С2Н5Cl + NaOH (водн.) → С2Н5ОН + NaCl
При действии на галогеналкан спиртового раствора щелочи получается алкен (идет реакция отщепления): С2Н5Cl + NaOH (спирт.) → С2Н4 + NaCl + Н2О
1.2. Взаимодействие гомологов бензола с галогенами
1.3. Взаимодействие пропена с хлором.
При взаимодействии пропена с хлорной водой при обычных условиях происходит присоединение по месту разрыва π- связи:
CH3 – CH = CH2 + Cl2 → CH3 – CHCl – CH2Cl
При взаимодействии пропена с газообразным хлором при 500оС идет замещение в метильном радикале. Это первая стадия промышленного производства глицерина.
CH3 – CH = CH2 + Cl2 → CH2Cl – CH = CH2 + HCl
1.4. Реакции дегидратации спиртов.
При температурах выше 140оС в присутствии избытка серной концентрированной кислоты происходит внутримолекулярная дегидратация спиртов с образованием алкенов: С2Н5ОН → С2Н4 + Н2О
! Внутримолекулярная дегидратация этанола может идти в присутствии оксида алюминия.
При температурах ниже 140оС в присутствии недостатка серной концентрированной кислоты происходит межмолекулярная дегидратация спиртов с образованием простых эфиров: 2С2Н5ОН → С2Н5–О–С2Н5 + Н2О
Для этанола так же возможна реакция Лебедева, которая идет в присутствии оксида цинка и оксида алюминия:
2С2Н5ОН → СН2=СН – СН = СН2 + 2Н2О + Н2
1.5. Реакция окисления кумола (изопропилбензола).
В присутствии перманганата калия или других окислителей в сернокислом растворе при нагревании происходит деструктивное окисление с образованием бензойной кислоты и углекислого газа:
В присутствии кислорода и раствора серной кислоты образуется ацетон и фенол:
Окисление органических веществ мы с вами подробно рассматривали в занятии № 2. Рекомендую вам вспомнить содержание этого занятия, прежде чем вы приступите к выполнению задания.
1.6. Реакция восстановления нитробензола.
Если восстановление идет атомарным водородом, образующимся при взаимодействии металла с раствором, то получается соль анилина:
2. Преимущественные направления протекания некоторых реакций
2.1. Правило Марковникова. При присоединении несимметричных реагентов Х+–У– положительно заряженная часть реагента присоединяется к более гидрированному атому углерода при кратной связи. В школьном курсе в качестве таких реагентов используются галогеноводороды и вода. Правило Марковникова соблюдается при взаимодействии алкенов, алкадиенов и алкинов с несимметричными реагентами. Правило Марковникова нарушается в присутствии пероксидов и молекулярного кислорода. Против правила Марковникова реакция может пойти при смещении электронной плотности от наиболее гидрированного атома углерода при кратной связи в результате отрицательного мезомерного эффекта (близость карбонильной, карбоксильной, циано-, нитро - групп) или отрицательного индуктивного эффекта (близость атомов фтора).
CH3 – CH = CH2 + НCl → CH3 – CHCl – CH3 (правило Марковникова соблюдается)
СН ≡ СН + HCl → CH2 = CHCl; CH2 = CHCl+ HCl → CH3 – CHCl2 (правило Марковникова соблюдается)
CH3 – C ≡ CH + Н2О → CH3 – C(O) – CH3 (правило Марковникова соблюдается)
CH2 = CH – COOH + HCl → CH2Cl – CH2 – COOH (правило Марковникова не соблюдается)
CH2 = CH – CF3 + HCl → CH2Cl – CH2 – CF3 (правило Марковникова не соблюдается)
2.2. Правило Зайцева - правило отщепления галогеноводородов и воды. Водород отщепляется от соседнего (по отношению к углероду, содержащему уходящий атом или группу) наименее гидрированного атома углерода.
соседние атомы углерода
OH – уходящая группа
2.3. Замещение у алканов. У алканов преимущественно происходит замещение водорода у третичного атома углерода. Это объясняется наименьшей энергией связи С – Н у третичного атома и наибольшей устойчивостью третичного радикала. Если третичных атомов в молекуле нет, то в наибольшей степени идёт замещение у вторичного атома углерода. Труднее всего идет замещение у первичных атомов.
Однако, замещение атомов водорода на объемные группировки (нитро - или сульфо-группы) у третичных атомов углерода пространственно затруднены, тогда замещение идет в основном у первичных атомов углерода.
2.4. Замещение в предельном радикале у разных классов веществ.
Замещение идет в α-положении (то есть ближайшем) по отношению к заместителю или функциональной группе, так как в этом положении связь С – Н наиболее поляризована.
R – CH2 – COOH + Cl2 → R – CHCl – COOH + HCl
2.5. Правила ориентации в бензольном кольце.
Если заместителем в кольце является углеводородный радикал, гидроксильная НО - (алкоксильная RO-) или амино - NH2 - (алкиламино- RNH -, диалкиламино - R2N-) группы, атомы галогена (за исключением фтора), то очередной заместитель идёт в орто - (2 и 6) и/или пара - (4) положения.
Если заместителем в кольце является фтор или группа, содержащая электроотрицательный элемент (азот, кислород) и кратную (двойную, тройную связь), то очередной заместитель идёт в одно мета – (3) положение:
2.6. Отщепление водорода на платиновом катализаторе легче всего идет от третичного атома углерода и от соседнего с ним, наименее гидрированного атома углерода. Если нет третичного, то от вторичного и от соседнего с ним, наименее гидрированного атома углерода.
СН3 – СН2 – СН2 – СН3 → СН3 – СН = СН – СН3 + Н2
3. Реакции, которые не рассматриваются в школьном курсе.
В основном, это реакции, взятые из ЕГЭ 2009 – 2010 годов. Школьники, как правило, с ними не справились.
3.1. Разложение первичных аминов азотистой кислотой (при этом образуется спирт, азот и вода): CH3 – NH2 + HNO2 → CH3 –OH + N2 + H2O
3.2. Термическое разложение солей двухвалентных металлов карбоновых кислот с образованием кетонов:
(СH3COO)2Ba → CH3 – C(=O) – CH3 + BaCO3
3.3. Гидролиз или щелочной гидролиз дигалоген- (с образованием альдегидов или кетонов) и тригалогенпроизводных (с образованием карбоновых кислот или их солей):
R – CCl2 – R + H2O → R – C(=O) – R + 2HCl
R – CCl2 – R + 2NaOH → R – C(=O) – R + 2NaCl + H2O
R – CCl3 + 2H2O → R – COOH + 3HCl
R – CCl3 + 4NaOH → R – COONa + 3NaCl + 2H2O
3.4. Взаимодействие солей карбоновых кислот с галогеналканами с образованием сложных эфиров: R – COONa + RCl → R – COOR + NaCl
3.5. Разложение щавелевой кислоты концентрированной серной кислотой:
НСОО-СООН + H2SO4 → CO + CO2 + H2SO4 ∙ H2O
3.6. В одном из входных заданий прозвучала просьба обратить внимание на электролиз солей карбоновых кислот. Разрядка органического аниона идет в соответствии со схемой: 2R – COO– – 2 е → 2СО2 + R–R
Вам предстоит решить цепочки превращений, содержащие те закономерности и особенности, о которых говорилось в рамках этого занятия. Цепочки взяты из ваших входных заданий. Все вещества записывайте в структурном виде!
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
H2O KMnO4 H2SO4 t H3PO4
CaC2 → X1 → K2C2O4 → X2 → HCOOK → X3
Ag2O+NН3×Н2О Сl2,hn NaOH CH3OH, H+ полимеризация
СН3-СН2СНО ® Х1 ® Х2 ® Х3 ® Х4 ® Х5
Br2, свет NH3 (изб) HNO2 CuO, t KMnO4, H2SO4
X1 → CH3Br → X2 → X3 → H2CO → X4
Контрольный срок выполнения задания 23.05.2011
Часть 2
В1. Установите соответствие между названием неорганического соединения и классом, к которому оно принадлежит.
| НАЗВАНИЕ СОЕДИНЕНИЯ | КЛАСС СОЕДИНЕНИЙ |
| А) угарный газ | 1) средние соли |
| Б) мрамор | 2) кислые соли |
| В) пищевая сода | 3) основные соли |
| Г) гашеная известь | 4) кислоты |
| 5) основания | |
| 6) оксиды |
Решение. Угарный газ имеет формулу СО - это оксид. Мрамор - карбонат кальция СаСО3 - средняя соль. Пищевая сода - гидрокарбонат натрия NaHCO3 - кислая соль. Гашеная известь - гидроксид кальция Са(ОН)2 - основание (щелочь). Выбираем нужные варианты:
| A | Б | В | Г |
| 6 | 1 | 2 | 5 |
В2. Установите соответствие между формулой соли и степенью окисления хрома в ней.
| ФОРМУЛА СОЛИ | СТЕПЕНЬ ОКИСЛЕНИЯ ХРОМА |
| А) K2CrO4 | 1) 0 |
| Б) CaCr2O7 | 2) +2 |
| В) CrO2F2 | 3) +3 |
| Г) Ba3[Cr(OH)6]2 | 4) +4 |
| 5) +5 | |
| 6) +6 |
Решение. Рассчитаем степени окисления хрома в перечисленных соединениях на основании условия электронейтральности (степень окисления кислорода -2, фтора -1, водорода +1, калия +1, кальция и бария +2, хрома х):
K2CrO4: 2(+1) + x + 4(-2) = 0, x = +6
CaCr2O7: 1(+2) + 2х + 7(-2) = 0, х = +6
CrO2F2: х + 2(-2) + 2(-1) = 0, х = +6
Ba3[Cr(OH)6]2: 3(+2) + 2х + 12(-2) + 12(+1) = 0, х = +3
Сравнивая возможные варианты, получаем ответ:
| A | Б | В | Г |
| 6 | 6 | 6 | 3 |
B3. Установите соответствие между формулой вещества и продуктом, выделяющимся на катоде при электролизе водного раствора этого вещества.
| ФОРМУЛА ВЕЩЕСТВА | КАТОДНЫЙ ПРОДУКТ |
| А) NaNO3 | 1) кислород |
| Б) Cu(NO3)2 | 2) только металл |
| В) RbHCO3 | 3) только водород |
| Г) SnCl2 | 4) металл и водород |
| 5) азот | |
| 6) хлор |
Решение. При электролизе водных растворов, катионы металлов, стоящих в ряду напряжений левее титана, на катоде не восстанавливаются, восстанавливается только вода и на катоде выделяется водород. Если металл находится в ряду напряжений между титаном и водородом, происходит обновременное восстановление катиона металла и воды, при этом на катоде выделяется и металл, и водород. И, наконец, если металл правее водорода, восстанавливаются только катионы металла и на катоде выделяется металл. NaNO3: натрий левее титана, поэтому на катоде - только водород. Cu(NO3): медь правее водорода, на катоде - только металл.RbHCO3: рубидий левее титана, поэтому на катоде - только водород. SnCl2 : олово между титаном и водородом, на катоде и металл, и водород.
| A | Б | В | Г |
| 3 | 2 | 3 | 4 |
В4. Установите соответствие между названием соли и способностью ее к гидролизу
| НАЗВАНИЕ СОЛИ | СПОСОБНОСТЬ К ГИДРОЛИЗУ |
| А) сульфид цезия | 1) гидролизу не подвергается |
| Б) нитрат бария | 2) гидролизуется по катиону |
| В) сульфат натрия | 3) гидролизуется по аниону |
| Г) карбонат аммония | 4) гидролизуется по катиону и аниону |
Решение. Сульфид цезия Cs2S образован сильным основанием CsOH и слабой кислотой H2S, гидролизуется по аниону:
Cs2S
2Cs + + S 2- - диссоциация соли
S 2- + H2O
HS - + OH - - гидролиз
Нитрат бария образован сильным основанием Ba(OH)2 и сильной кислотой HNO3, гидролизу не подвергается.
Сульфат натрия образован сильным основанием NaOH и сильной кислотой H2SO4, гидролизу не подвергается.
Карбонат аммония образован слабым основанием NH4OH и слабой кислотой H2CO3, подвергается гидролизу по катиону и аниону.
(NH4)2CO3
2NH4 + + CO3 2- - диссоциация соли
NH4 + + H2O
NH4ОН + Н + - гидролиз по катиону
CO3 2- + H2O
НCO3 - + ОН - - гидролиз по аниону
Н + + ОН - = H2O - среда не может быть одновременно кислой и щелочной.
| A | Б | В | Г |
| 3 | 1 | 1 | 4 |
В5. Установите соответствие между исходными веществами и основным продуктом их взаимодействия.
| НАЗВАНИЕ СОЛИ | СПОСОБНОСТЬ К ГИДРОЛИЗУ |
| А) Al(OH)3 + RbOH водн. р-р | 1) RbAlO2 |
Б) Al(OH)3 + Rb2O  | 2) Rb3[Al(OH)6] |
В) Al(OH)3 + CsOH  | 3) CsAlO2 |
Г) Al(OH)3 + Cs2CO3  | 4) Cs3[Al(OH)6] |
Решение. При взаимодействии гидроксида алюминия с водными растворами щелочей образуются гидроксиалюминаты состава Ме3[Al(OH)6], где Ме - щелочной металл, а при сплавлении - метаалюминаты состава МеAlO2. Метаалюминаты получаются также при сплавлении гидроксида алюминия с карбонатами щелочных металлов.
| A | Б | В | Г |
| 2 | 1 | 3 | 3 |
B6. По радикальному механизму протекает взаимодействие
1) пропена и бромной воды
2) пропена и бромоводорода
3) пропена и хлора (в водном растворе)
4) пропена и хлора (при 500 о С)
5) этана и кислорода
6) метана и хлора
Решение. Взаимодействие пропена и бромной воды - это реакция электрофильного присоединия, то же самое и для взаимодействия пробена с бромоводородом. Пропен присоединяет хлор в водном растворе также по ионному механизму. Пропен с хлором при 500 о С - реакция радикального замещения, этан окисляется кислородом также по радикальному механизму, последняя реакция - тоже радикальная. Подходят три последних варианта ответа.
B7. Метанол в соответствующих условиях мoжет быть получен по реакции
1) CH3ONa + H2O
2) CH4 + H2O
3) HCCl3 + KOH
4) HCOH + H2
5) CO + H2
6) CH3Cl + O2 + H2
Решение. Метанол получится при гидролизе метилата натрия (№ 1), при восстановлении водородом формальдегида (№ 2 - один из вариантов промышденного получения метанола) и при синтезе из смеси оксида углерода и водорода, такая смесь называется 'синтез-газ' (№ 5, тоже вариант промышленного получения метанола).
B8. Глицин вступает в реакцию этерификации с
1) пропанолом-1
2) пропанолом-2
3) уксусной кислотой
4) оксидом магния
5) этиловым спиртом
6) металлическим кальцием
Решение. Глицин - аминокислота, карбоксильная группа которой может этерифицироваться спиртами. Поэтому в реакцию этерификации глицин может вступать с пропанолом-1(№ 1 в списке), пропанолом-2 (№ 2) и этанолом (№ 5).
B9. Если 1кг 10%-ного раствора хлорида калия смешать с 3 кг 15%-ногораствора той же соли, тo получится раствор с массовой долей КСl, равной_________%.
Решение. Масса раствора, полученного после смешивания, будет равна сумме масс исходных растворов, т.е. 1 кг + 3 кг = 4 кг = 4000 г. Масса хлорида калия в полученном растворе также равна сумме масс КСl в исходных растворах: в первом было 1000 г * 0,1 = 100 г, во втором - 3000 г * 0,15 = 450 г, в полученном 100 г + 450 г = 550 г. Находим массовую долю хлорида калия в полученном растворе: 550 г / 4000 г = 0,1375 или, округлив до требуемой в задаче точности, 0,138. В процентах 13,8%. Ответ: 13,8%
B10. Объем фосфина, который выделится при гидролизе 35 г фосфидакальция, содержащего 4% примесей, равен__________л (н.у.).
Решение. Запишем реакцию:
Са3Р2 + 6Н2О = 2РН3 + 3Са(ОН)2
Рассчитаем массу чистого фосфида кальция. Если массовая доля примесей 4%, то фосфида кальция 100% - 4% = 96% или 0,96. Тогда m(Са3Р2) = 35 г * 0,96 = 33,6 г, количество вещества n(Са3Р2) = 33,6/182 = 0,185 моль (Молярная масса Са3Р2 равна 182 г/моль). По уравнению реакции из одного моля фосфида кальция получается два моля фосфина, соответственно из 0,185 моль получится 0,37 моль. Находим объем фосфина, умножая количество вещества на молярный обхем газа при н.у.: V(РН3) = 0,37*22,4 = 8,27 л, или, округляя до точности требуемого ответа, 8 л.
Тест по теме "Правило Марковникова" содержит 20 вопросов, ключ к решению.
Скачать:
| Вложение | Размер |
|---|---|
| test_po_teme_pravilo_markovnikova.doc | 44.5 КБ |
Предварительный просмотр:
- При взаимодействии пропена с бромом при обычных условиях преимущественно образуется:
- 1-бромпропан
- 2-бромпропан
- 1,1-дибромпропан
- 1,2-дибромпропан
2.При взаимодействии пропена с хлором при 500 ℃ преимущественно образуется:
3. При взаимодействии пропена с бромоводородом преимущественно образуется:
4. При гидратации бутена-1 преимущественно образуется:
5. При гидратации бутена-2 преимущественно образуется:
4) бутановая кислота
6. При взаимодействии бромоводорода с 2-бромпропеном преимущественно образуется:
7. При взаимодействии 1 моль пропина с 1 моль хлороводорода преимущественно образуется:
8. Один и тот же продукт образуется при гидратации каждого из двух веществ:
1) бутена-1 и бутена-2
2) бутена-1 и бутина-1
3) бутина-1 и бутена-2
4) бутена-1 и пропина
9. При взаимодействии акриловой кислоты с бромоводородом преимущественно образуется:
2) 2-бромпропановая кислота
3) 3-бромпропановая кислота
4) α-бромпропионовая кислота
10. Взаимодействие бутена-1 с бромоводородом в присутствии пероксида водорода приводит к преимущественному образованию:
11. По правилу Марковникова происходит взаимодействие:
1) пропена и бромоводорода:
2) бутена-1 и воды
3) бутена-1 и брома
4) бутена-2 и водорода
5) бутена-1 и хлороводорода
6) этилена и кислорода
12. Для взаимодействия пропена и бромоводорода справедливы утверждения:
1) в ходе реакции образуется 1,2-дибромпропан
2) реакция протекает по правилу Зайцева
3) реакция протекает по правилу Марковникова
4) в ходе реакции образуется 2-бромпропан
5) реакция относится к реакциям замещения
6) реакция идет по иному механизму
13. Для взаимодействия бутена-1 и хлороводорода справедливы утверждения:
1) в ходе реакции образуется 1,2-дихлорбутан
2) реакция протекает по правилу Марковникова
3) реакция является эндотермической
4) в ходе реакции образуется 2-хлорбутан
5) реакция относится к реакциям замещения
6) реакция идет по ионному механизму
14. Правило Марковникова не используют для объяснения хода реакции между:
1) бутеном-1 и бромоводородом
2) пропеном и водородом
3) пропеном и водой
4) бутеном-2 и бромоводородом
5) бутеном-1 и бромом
6) бутеном-1 и водой
1) осуществляется по правилу Марковникова
2) относится к радикальным реакциям
3) начинается с процесса разрыва связи в молекуле брома
4) протекает по схеме: CH 4 + Br 2 →CH 2 Br 2 +H 2
5) протекает не так энергично, как реакция хлорирования
6) относится к реакциям присоединения
16. Радикал этил C 2 H 5 - :
1) образует заряд -1
2) образуется при присоединении HCl к этилену
3) имеет нечетное число электронов
4) содержит атомы углерода в состоянии sp 3 -гибридизации
5) образуется при присоединении Cl 2 к этену
17. Карбокатион CH 3 -CH + -CH 3 :
1) образуется при хлорировании пропана
2) образуется при присоединении НВr к молекуле прпена
3) более устойчив, чем кабокатион CH 3 -CH 2 -CH 2 +
4) содержит атомы углерода только в sp 3 -гибридном состоянии
5) содержит центральный атом углерода в состоянии sp 2 -гибридизации
6) имеет линейное строение
18. Карбокатион CH 3 -CH 2 -CH 2 + :
1) образуется при бромировании пропана
2) образуется как основной промежуточный продукт при присоединении HBr к молекуле пропена
3) менее устойчив, чем карбокатион CH 3 -CH + -CH 3
4) содержит атомы углерода только в sp 3 -гибридном состоянии
5) содержит атомы углерода в состоянии sp 3 - и sp 2 -гибридизации
6) содержит четное число электронов
19. При присоединении бромоводорода к пропену :
1) преимущественно образуется 2-бромпропавн
2) образуется 1-бромпропан и 2-бромпропан в равных соотношениях
3) происходит промежуточное образование катиона CH 3 -CH + -CH 3
4) происходит промежуточное образование радикала CH 3 -CH 2 -CH 2 -
5) правило Марковникова не соблюдается
6) разрывается π-связь в молекуле пропена
20. При присоединении воды к пропену :
1) преимущественно образуется пропанол-1
2) образуется пропанол-1 и пропанол-2 в равных соотношениях
3) разрывается π-связь в молекуле пропена
4) происходит промежуточное образование катиона CH 3 -CH + -CH 3
5) правило Марковникова соблюдается
6) происходит промежуточное образование радикала CH 3 -CH 2 -CH 2 -
Алкены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна двойная связь между атомами углерода С=С.
Наличие двойной связи между атомами углерода очень сильно меняет свойства углеводородов.
Алкены – непредельные углеводороды, в молекулах которых есть одна двойная связь. Строение и свойства двойной связи определяют характерные химические свойства алкенов.
Двойная связь состоит из σ-связи и π-связи. Рассмотрим характеристики одинарной связи С-С и двойной связи С=С:
| Энергия связи, кДж/моль | Длина связи, нм | |
| С-С | 348 | 0,154 |
| С=С | 620 | 0,133 |
Можно примерно оценить энергию π-связи в составе двойной связи С=С:
Таким образом, π-связь — менее прочная, чем σ-связь. Поэтому алкены вступают в реакции присоединения, сопровождающиеся разрывом π-связи. Присоединение к алкенам может протекать по ионному и радикальному механизмам.
Для алкенов также характерны реакции окисления и изомеризации. Окисление алкенов протекает преимущественно по двойной связи, хотя возможно и жесткое окисление (горение).
1. Реакции присоединения
Для алкенов характерны реакции присоединения по двойной связи С=С, при которых протекает разрыв пи-связи в молекуле алкена.
Алкены реагируют с водородом при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt, Pd и др.).
| Например, при гидрировании бутена-2 образуется бутан. |

| Реакция протекает обратимо. Для смещения равновесия в сторону образования бутана используют повышенное давление. |
Присоединение галогенов к алкенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
| При взаимодействии с алкенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь. |
| Например, при бромировании пропилена образуется 1,2-дибромпропан, а при хлорировании — 1,2-дихлорпропан. |


Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
Алкены присоединяют галогеноводороды. Реакция идет по механизму электрофильного присоединения с образованием галогенопроизводного алкана.
| Например, при взаимодействии этилена с бромоводородом образуется бромэтан. |

При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
| Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
| Например, при присоединении хлороводорода HCl к пропилену атом водорода преимущественно присоединяется к атому углерода группы СН2=, поэтому преимущественно образуется 2-хлорпропан. |

Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
| Например, при взаимодействии этилена с водой образуется этиловый спирт. |

Гидратация алкенов также протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
| Например, при взаимодействии пропилена с водой образуется преимущественно пропанол-2. |

Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
| Например, при полимеризации этилена образуется полиэтилен, а при полимеризации пропилена — полипропилен. |


2. Окисление алкенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
Каталитическое окисление протекает под действием катализатора.
| Взаимодействие этилена с кислородом в присутствии солей палладия протекает с образованием этаналя (уксусного альдегида) |

| Взаимодействие этилена с кислородом в присутствии серебра протекает с образованием эпоксида |

Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
При этом образуются двухатомные спирты (диолы).

| Например, этилен реагирует с водным раствором перманганата калия при низкой температуре с образованием этиленгликоля (этандиол-1,2) |

При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойной связи С=С и связей С-Н у атомов углерода при двойной связи. При этом вместо разрывающихся связей образуются связи с кислородом.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Поэтому можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| >C= | >C=O | >C=O |
| -CH= | -COOH | -COOK |
| CH2= | CO2 | K2CO3 |
При окислении бутена-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента –CH=, поэтому образуется уксусная кислота:

При окислении метилпропена перманганатом калия в присутствии серной кислоты окислению подвергаются фрагменты >C= и CH2=, поэтому образуются углекислый газ и кетон:

При жестком окислении алкенов в нейтральной среде образующаяся щелочь реагирует с продуктами реакции окисления алкена, поэтому образуются соли (кроме реакций, где получается кетон — кетон со щелочью не реагирует).
| Например, при окислении бутена-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента –CH=, поэтому образуется соль уксусной кислоты – ацетат калия: |

| Например, при окислении метилпропена перманганатом калия в воде при нагревании окислению подвергаются фрагменты >C= и CH2=, поэтому образуются карбонат калия и кетон: |

Взаимодействие алкенов с хроматами или дихроматами протекает с образованием аналогичных продуктов окисления.
Алкены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
В общем виде уравнение сгорания алкенов выглядит так:
| Например, уравнение сгорания пропилена: |
Алкены с углеродной цепью, содержащей более двух атомов углерода, могут вступать в реакции замещения в боковой цепи, как алканы.

При взаимодействии алкенов с хлором или бромом при нагревании до 500 о С или на свету происходит не присоединение, а радикальное замещение атомов водорода в боковой цепи. При этом хлорируется атом углерода, ближайший к двойной связи.
| Например, при хлорировании пропилена на свету образуется 3-хлорпропен-1 |

При нагревании в присутствии катализаторов (Al2O3) алкены вступают в реакцию изомеризации. При этом происходит либо перемещение двойной связи, либо изменение углеродного скелета. При изомеризации из менее устойчивых алкенов образуются более устойчивые. Как правило, двойная связь перемещается в центр молекулы.
Читайте также: