Опухоли роль бластомогенных факторов
Причинами развития опухолей являются различные факторы, способные вызвать превращение нормальной клетки в опухолевую. Они называются канцерогенными или бластомогеннами. Это агенты химической, физической и биологической природы, а главным условием, способствующим реализации их действия (фактором риска), является снижение эффективности механизмов противоопухолевой защиты организма. В значительной мере это определяется генетической предрасположенностью. Свойствами канцерогенных факторов, обеспечивающими опухолевую трансформацию клеток, являются мутагенность (способность прямо или косвенно влиять на геном клетки, что в итоге приводит к мутациям), способность к проникновению через внешние и внутренние барьеры и дозированность действия, которая обеспечивает незначительное повреждение клетки, что позволяет ей выжить.
Наряду с канцерогенными факторами, существует целый ряд веществ, которые не вызывая сами мутаций, являются обязательными участниками канцерогенеза - коканцерогены и синканцерогены. Коканцерогены - немутагенные факторы (промоторы), усиливающие эффект канцерогенных агентов. Коканцеогенез – усиление мутагенного действия канцерогена соединениями, которые стимулируют пролиферацию клеток, инактивируя белки-продукты антионкогенов или усиливая передачу ростостимулирующих сигналов. Синканцерогены – канцерогенные факторы, вызывающие усиленное образование опухолей при комбинированном действии нескольких известных концерогенов.
По данным ВОЗ, более 75% случаев злокачественных опухолей человека вызвано воздействием химических факторов внешней среды. Потенциально канцерогенные вещества сами по себе не вызывают опухолевого роста. Поэтому их называют проканцерогенами, или преканцерогенами. В организме они подвергаются физико-химическим превращениям, в результате которых становятся истинными, конечными канцерогенами. Конечными канцерогенами являются алкилирующие соединения, эпоксиды, диолэпоксиды, свободнорадикальные формы ряда веществ.
К возникновению опухолей приводят преимущественно факторы сгорания табака (примерно 40%); химические агенты, входящие в состав пищи (25—30%) и соединения, используемые в различных сферах производства (около 10%). Известно более 1500 химических соединений, обладающих канцерогенным эффектом. Из них не менее 20 определённо являются причиной опухолей у человека. Наиболее опасные канцерогены относятся к нескольким классам химических веществ (рис. 1).
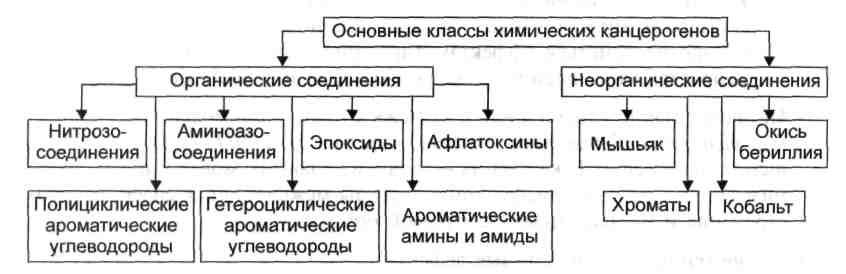
Рис. 1 Основные классы химических канцерогенов.
Органические химические канцерогены
• Полициклические ароматические углеводороды.
Наибольшей канцерогенной активностью среди них обладают 3,4-бензпирен, 20-метилхолантрен, диметилбензантрацен. Ежегодно в атмосферу промышленных городов выбрасываются сотни тонн этих и подобных им веществ.
• Гетероциклические ароматические углеводороды.
В эту группу входят дибензакридин, дибензкарбазол и другие соединения.
• Ароматические амины и амиды.
К ним относятся 2-нафтиламин, 2-аминофлюорен, бензидин и др.
• Нитрозосоединения. Наиболее опасные среди них — диэтилнитрозамин, ди-метилнитрозамин, нитрозометилмочевина.
Высокоэффективными канцерогенами среди них считаются 4-диметилами-ноазобензол и ортоаминоазотолуол.
• Афлатоксины — продукты метаболизма (производные кумаринов) плесневых грибов, в основном аспергилл Aspergillus flavus (отсюда название производимых ими веществ).
• Прочие органические вещества с канцерогенной активностью: эпоксиды, пластмассы, уретан, четырёххлористый углерод, хлорэтиламины и другие.
· Экзогенные канцерогены: хроматы, мышьяк и его соединения, кобальт, окись бериллия, асбест и ряд других. Эндогенные канцерогены. Эти соединения образуются в организме в результате физико-химической модификации продуктов нормального обмена веществ. Полагают, что такими потенциально канцерогенными веществами являются жёлчные кислоты, эстрогены, некоторые аминокислоты (тирозин, триптофан), липопе-роксидные соединения.
· Радиационный канцерогенез относится к числу стохастических эффек тов. Основной причиной злокачественной трансформации облученной клетки являются нелетальные повреждения генетического материала. На первых порах исследования радиационного канцерогенеза господствова ло представление о том, что прямой причиной злокачественной транс формации клетки является мутация, возникшая в результате поглощения порции энергии излучения соответствующим участком генома клетк
Вирусная и вирусо-генетическая теории этиологии опухолевого роста. Механизмы действия онковирусов на клетку. Понятие об онкогенах и антионкогенах, их роль в онкогенезе.
· Вирусно-генетическая теория отводит решающую роль в развитии неоплазм онкогенным вирусам. Сущность вирусно-генетической теории заключается в представлении об интеграции геномов вируса и нормальной клетки, т. е. в объединении нуклеиновой кислоты вируса с генетическим аппаратом клетки, которая превратится в опухолевую. Онкогенные вирусы могут быть ДНК- и РНК-содержащими (онкорнавирусы). Среди экзогенных вирусов (ДНК- и РНК-содержащих) в этиологии опухолей человека имеют значение герпесоподобный вирус Эпстайна - Барра (развитие лимфомы Беркитта), вирус герпеса (рак шейки матки), вирус гепатита В (рак печени) и некоторые другие. Наряду с экзогенными в настоящее время обнаружены и эндогенные онкогенные вирусы, относящиеся к онкорнавирусам. Эти вирусы в обычных условиях составляют интегральную часть клеточного генома, однако при определенных воздействиях они способны вызывать опухоли у человека. Согласно вирусно-генетической теории, процесс канцерогенеза распадается на две фазы, в которых роль вируса различна. Первая фаза - поражение вирусами клеточного генома и трансформация клеток в опухолевые. Опухолеродные ДНК-геномные вирусы и РНК-геномные ретровирусы, подобно возбудителям вирусных инфекций,- циклические внутриклеточные паразиты. Для размножения им необходимо извне проникнуть в клетку и встроить свой геном в ее геном. При первом попадании в клетку опухолеродные вирусы включают свой геном в ту часть генома клетки, где находится онкоген (протоонкоген), который представляет собой нормальные последовательности нуклеотидов клеточной ДНК (протоонкогены входят в состав генома каждой нормальной клетки и участвуют в регуляции ее деления и дифференцировки). Дочерние вирусы, уже содержащие онкоген, попадают затем в клетки-мишени. Онкоген, входящий в состав вирусного генома, активируется и трансформирует клетку в опухолевую. Вторая фаза - размножение образовавшихся опухолевых клеток, при котором вирус не играет существенной роли.
· Опухолевый супрессор, антионкоген, ген-супрессор опухолевого роста - (tumor suppressor, cancer susceptibility gene, antioncogene, лат. suppressio — подавление) - ген, продукт которого в норме оказывает негативное влияние на клеточный цикл, препятствуя этим образованию опухоли. Мутации в антионкогенах (точечные мутации, делеции или блокирование экспрессии) приводят к развитию опухоли.
· Онкоге́н — это ген, продукт которого может стимулировать образование злокачественной опухоли. Мутации, вызывающие активацию онкогенов, повышают шанс того, что клетка превратится в раковую клетку. Считается, что гены-супрессоры опухолей (ГСО) предохраняют клетки от ракового перерождения, и, таким образом, рак возникает либо в случае нарушения работы генов-супрессоров опухолей, либо при появлении онкогенов (в результате мутации или повышения активности протоонкогенов, см. ниже)[1].
Стадии онкогенеза, их механизм. Роль иммунного надзора и неиммунных факторов резистентности организма в онкогенезе. Предраковые состояния. Понятия: доброкачественная и злокачественная опухоль.
78. Стадии онкогенеза, их механизм. Роль иммунного надзора и неиммунных факторов резистентности организма в онкогенезе. Предраковые состояния. Понятия: доброкачественная и злокачественная опухоль.
в процессе онко-генеза можно условно выделить несколько общих этапов.
5. • На первом этапе происходит взаимодействие канцерогенов химической, физической и биологической природы с протоонкогенами и антионкогенами (онкосупрессорами) генома нормальной клетки.
6. • В результате такого взаимодействия на втором этапе канцерогенеза подавляется активность онкосупрессоров, а также происходит трансформация протоонкогенов в онкогены. Экспрессия онкогена — необходимое и достаточное условие для трансформации нормальной клетки в опухолевую.
7. • В результате подавления активности онкосупрессоров и экспрессии онкогенов на третьем этапе синтезируются и реализуют свои эффекты (непосредственно или с участием клеточных факторов роста и рецепторов к ним) он-кобелки. С этого момента генотипически изменённая клетка приобретает опухолевый фенотип.
8. • На четвёртом этапе опухолевая клетка начинает бесконтрольно проли-ферировать, что ведёт к формированию новообразования (опухолевого узла).
Неиммунные механизмы.Эти механизмы осуществляют надзор за сохранением нормального (индивидуального и однородного) клеточного состава организма. Реализуют эти механизмы как клетки, так и гуморальные факторы.
Иммунные механизмы. Эти механизмы реализуют клеточное и гуморальное звенья иммунитета.
Доброкачественные опухоли. Клетки доброкачественной опухоли морфологически идентичны или похожи на нормальные клетки—предшественники и формируют характерные — высокодифференцированные для данной ткани структуры. Такие опухоли растут медленно, не метастазируют и с клинической и прогностической точек зрения их расценивают как доброкачественные.
Злокачественные опухоли. Клетки злокачественной опухоли морфологически отличаются от нормальной клетки—предшественника, соседних опухолевых клеток и образуют искажённые тканевые структуры (или вовсе их не образуют) — низкодифференцированные, анапластические. Эти опухоли растут быстро, прорастают в соседние структуры, а отдельные опухолевые клетки формируют близко расположенные или отдалённые точки роста — метастазы.С клинической и прогностической точек зрения такие опухоли расценивают как злокачественные.
79. Нарушение всасывания углеводов пищи. Нарушение синтеза, депонирования, расщепления гликогена. Нарушения транспорта углеводов в клетке и их усвоения. Галактоземия, фруктозурия, пентозурия, гликогенозы, агликогеноз.
80. Гипогликемические состояния, их виды и механизм. Патогенез гипогликемической комы и ее проявления.
Гипогликемии — состояния, характеризующиеся снижением уровня глюкозы плазмы крови (ГПК) ниже нормы (менее 65 мг%, или 3,58 ммоль/л). В норме ГПК натощак колеблется в диапазоне 65—110 мг%, или 3,58—6,05 ммоль/л.
Причины Гипогликемии.
Патология печени.Наследственная и приобретённая патология печени — одна из наиболее частых причин гипогликемии. К гипогликемии приводят нарушения транспорта глюкозы из крови в гепатоциты, снижение активности гликогенеза в них и отсутствие (или малое содержание) депонированного гликогена. Гипогликемия развивается также при длительном голодании, а также может развиться при значительной активации жизнедеятельности организма (например, при физической нагрузке или стрессе).
Нарушения пищеварения. Нарушения пищеварения — полостного переваривания углеводов, а также их пристеночного расщепления и абсорбции — приводят к развитию гипогликемии. Гипогликемия развивается также при хронических энтеритах, алкоголь ном панкреатите, опухолях поджелудочной железы, синдромах нарушенного всасывания.
Патология почек. Гипогликемия развивается при нарушении реабсорбции глюкозы в проксимальных канальцах нефрона почек.
Эндокринопатии. Основные причины развития гипогликемии при эндокринопатиях: недостаток гипергликемизирующих факторов или избыток инсулина.
Углеводное голодание. Углеводное голодание наблюдается в результате длительного общего голодания, в том числе углеводного. Дефицит в пище только углеводов не приводит к гипогликемии в связи с активацией глюконеогенеза (образование углеводов из неуглеводных веществ).
Длительная значительная гиперфункция организма при физической работе. Гипогликемия развивается при длительной и значительной физической работе в результате истощения запасов гликогена, депонированного в печени и скелетных мышцах.
Последствия гипогликемии: гипогликемическая реакция, синдром и кома.
Гипогликемическая реакция — острое временное снижение ГПК до нижней границы нормы (как правило, до 80—70 мг%, или 4,0—3,6 ммоль/л).
Гипогликемический синдром — стойкое снижение ГПК ниже нормы (до 60— 50 мг%, или 3,3—2,5 ммоль/л), сочетающееся с расстройством жизнедеятельности организма.
Гипогликемическая кома — состояние, характеризующееся падением ГПК ниже нормы (как правило, менее 40—30 мг%, или 2,0—1,5 ммоль/л), потерей сознания, значительными расстройствами жизнедеятельности организма.
81. Гипергликемические состояния, их виды, этиология. Патогенные последствия острой и хронической гипергликемии. Гипергликемическая кома.
Гипергликемии.
Гипергликемии — состояния, характеризующиеся увеличением ГПК выше нормы (более 120 мг%, или 6,05 ммоль/л натощак).
Причины гипергликемии: эндокринопатии, неврологические и психогенные расстройства, переедание, патология печени.
Эндокринопатии.Эндокринопатии — наиболее частая причина гипергликемии. Основные причины развития гипергликемии при эндокринопатиях: избыток гипергликемизирующих факторов и дефицит инсулина.
Неврологические и психогенные расстройства. Нейро- и психогенные расстройства характеризуются активацией симпатико-адреналовой, гипоталамо-гипофизарно-надпочечниковой и тиреоидной систем. Гормоны этих систем вызывают ряд эффектов, приводящих к значительной гипергликемии.
Переедание. Переедание— одна из причин гипергликемии. Глюкоза быстро всасывается в кишечнике. ГПК повышается и превышает возможность гепатоцитов включать её в процесс гликогенеза. Кроме того, избыток углеводсодержащей пищи в кишечнике стимулирует гликогенолиз в гепатоци-тах, потенцируя гипергликемию.
Патология печени. При печёночной недостаточности может развиваться преходящая гипергликемия в связи с тем, что гепатоциты не способны трансформировать глюкозу в гликоген. Обычно это наблюдается после приёма пищи.
Последствия гипергликемии: гипергликемический синдром и гипергликемическая кома.
Гипергликемический синдром — состояние, характеризующееся значительным и относительно длительным увеличением ГПК выше нормы (до 190—210 мг%, т.е. 10,5-11,5 ммоль/л и более), сочетающееся с расстройством жизнедеятельности организма.
В развитии гипергликемической комы, различают два периода, по аналогии с гипогликемической комой: прекома и гипергликемическая кома. Но, время на их развитие измеряется не десятками минут, а днями.
При развитии гипергликемической прекомы, больного беспокоят:
Затем, по мере нарастания кетоновых тел, присоединяется тошнота и рвота. Причем, рвота не приносит облегчения. Часто отмечаются боли в животе. В критический момент, когда гипергликемия и кетоз (наличие кетоновых тел в крови) достигают значительных цифр, появляется спутанность сознания, увеличение частоты дыхания, которое становится шумным.
Кома имеет ряд особенных признаков, кроме потери сознания, что отличает ее от подобных состояний:
· кожа сухая, холодная на ощупь. Отмечается ее повышенное шелушение.
· дыхание частое, поверхностное и шумное. При этом, от больного исходит запах ацетона.
Скорость развития комы зависит от индивидуальных особенностей, но, в среднем, стадия прекомы длится 1-3 дня. А сама кома, без лечения, приводит к смерти не более чем за сутки. Хотя, может отмечаться и больший срок. К тому же, ряд клиницистов, выделяют промежуточную стадию - начинающейся комы, время которой исчисляется несколькими часами.
. С 82 ПО 85, ВОПРОСЫ ПО САХАРНЫЙ ДИАБЕТ, ВСЕ ЗДЕСЬ.
82. Этиология и патогенез сахарного диабета 1 типа. Роль вирусов и аутоиммунных процессов в механизмах развития СД 1 типа. Стадии течения СД 1 типа.
САХАРНЫЙ ДИАБЕТ - заболевание, которое характеризуется нарушением всех видов метаболизма и расстройством жизнедеятельности организма; развивается в результате гипоинсулинизма (т.е. абсолютной или относительной инсулиновой недостаточности).
Первичные формы сахарного диабета. Первичные формы СД характеризуются отсутствием у пациента каких-либо определённых заболеваний, вторично приводящих к развитию диабета. Выделяют две разновидности первичного СД:
• инсулинзависимый сахарный диабет (ИЗСД);
• инсулиннезависимый сахарный диабет (ИНСД).

Вторичные формы сахарного диабета. Вторичные формы СД характеризуются наличием у пациента какой-либо основной болезни или патологического состояния, повреждающих поджелудочную железу, а также действие на неё физических или химических факторов. Это приводит к возникновению СД. К таким болезням, патологическим состояниям и факторам относятся:
• Заболевания, поражающие ткань поджелудочной железы (например, панкреатит).
• Другие болезни эндокринной системы (например, семейный полиэндокринный аденоматоз).
• Воздействие на поджелудочную железу химических или физических агентов.
Сахарный диабет типов I и II
В более ранних классификациях выделяли СД типов I и II. Эти обозначения вначале применяли как синонимы ИЗСД и ИНСД соответственно. Современные специалисты считают такой подход не совсем корректным. Это объясняется тем, что, например, больные с ИНСД также могут приобрести зависимость от инсулина. При его недостатке у них развивается кетоацидоз, чреватый коматозным состоянием (например, это наблюдается у многих пациентов без ожирения, имеющих в крови AT.
Этиология.
СД развивается вследствие либо дефицита инсулина (ИЗСД), либо недостаточности его эффектов (ИНСД).
· Дефицит инсулинаможет возникнуть под влиянием факторов биологической, химической, физической природы, а также при воспалительных процессах поджелудочной железы
· Воспалительные процессы, возникающие в поджелудочной железе под действием факторов биологической (главным образом, микроорганизмов), химической и физической природы. Хронические панкреатиты примерно в 30% случаев являются причиной инсулиновой недостаточности.
· Недостаточность эффектов инсулинаразвивается под влиянием причин нейро- или психогенной природы, контринсулярных факторов, а также вследствие дефектов инсулиновых рецепторов и пострецепторных нарушений в клетках-мишенях.
При дефиците инсулина происходит: повреждение и гибель р-клеток островков Лангерханса, уменьшение суммарной массы β-клеток, подавление синтеза и выделения в кровь инсулина из повреждённых β-клеток.
Дата добавления: 2018-08-06 ; просмотров: 693 ;
Читайте также:

