При раке печени выведена трубка с желчью
Лечение раковых опухолей направлено на то, чтобы полностью удалить или уничтожить злокачественную опухоль, а также все ее метастазы. Такая терапия называется куративной. На поздних стадиях заболевания, когда полное излечение уже невозможно, применяется паллиативная терапия, направленная на улучшение качества жизни больного.
Рак печени (гепатома, гепатоцеллюлярная карцинома) встречается довольно редко.
Печень — самый крупный и один из самых сложных по строению внутренних органов человека.
После сбора анамнеза врач проводит клиническое обследование.
Реабилитация и наблюдение являются важными составляющими лечения онкологических больных.
В настоящее время при раке печени шанс на полное выздоровление есть только в случае успешного оперативного лечения. Существует два варианта удаления опухоли: удаление части органа (частичная резекция печени, гепатэктомия) и пересадка (трансплантация) печени.
Трудность заключается в том, что в большинстве случаев общее состояние пациента не позволяет провести оперативное вмешательство.
В ходе частичного удаления (резекции) печени хирургическим путём удаляется опухоль и часть окружающей её здоровой ткани. Различают анатомическую и атипичную резекцию печени.
Анатомическая резекция подразумевает удаление правой или левой половины печени (гемигепатэктомия), причем граница удаляемого участка не совпадает с границами долей печени, а определяется в зависимости от его кровоснабжения.
В некоторых случаях нужно удалять до 85 % ткани печени, но, если оставшаяся часть органа здорова, то он может нормально функционировать.
Однако если оставшаяся ткань печени поражена циррозом, есть вероятность, что после операции она уже не будет справляться со своими функциями, и пациент может умереть вследствие отказа печени.
Атипичная резекция печени проводится, чтобы сохранить как можно больше ее ткани. Она заключается в том, что иссекается только сама опухоль с минимальным количеством окружающей её здоровой ткани. Эта операция может быть альтернативой для больных циррозом печени, тем не менее, если цирроз находится на прогрессирующей стадии, то она не принесёт желаемого эффекта и её проведение исключается.
Кроме того, цирроз печени зачастую приводит к развитию портальной гипертензии (повышенного давления в воротной вене). В этом случае проведение операции также связано с большим риском.
Резекция печени не исключает вероятность возникновения рецидива. Причиной могут стать микроскопические части опухоли, которые не были удалены в ходе операции. Кроме того, иногда в оставшейся части печени развивается новая опухоль.
Пересадка печени (трансплантация) подразумевает полное удаление печени пациента и замену её здоровым донорским органом.
Этот метод лечения прежде всего рассматривается при циррозе печени с портальной гипертензией, так как трансплантация одновременно избавляет и от этого заболевания. Кроме того, пересадка печени показана пациентам с множественными мелкими очагами опухоли.
Обязательным условием для проведения трансплантации является хорошее общее состояние пациента и отсутствие сопутствующих заболеваний.
После пересадки печени пациент должен в течение долгого времени принимать специальные препараты для подавления активности иммунной системы, чтобы избежать отторжения трансплантата. При ослабленном иммунитете даже самое безобидное инфекционное заболевание может стать угрозой для жизни.
После трансплантации вероятность возникновения новой опухоли существует лишь с том случае, если в организме остались опухолевые клетки вне печени.
Если опухоль нельзя удалить, необходимо сдерживать её рост. В настоящее время существует много возможностей местного лечения опухолей печени, а так как злокачественные новообразования этого органа редко дают метастазы, это позволяет значительно продлить жизнь пациенту и улучшить её качество.
Цель местного лечения — остановить рост опухоли либо разрушить её. Для этого проводится либо склерозирование опухоли, либо остановка её кровоснабжения (эмболизация).
Печень снабжается кровью через две сосудистые системы: печеночную артерию и воротную вену. При этом в опухоль кровь практически всегда поступает по ветвям печеночной артерии. Эта особенность позволяет применять для разрушения опухоли трансартериальную химиоэмболизацию (TACE). Суть этого метода заключается в том, что артерии, по которым кровь поступает в опухоль, закупориваются, в результате чего раковые клетки погибают, а опухоль уменьшается.
В ходе трансартериальной химиоэмболизации через бедренную артерию под местной анестезией вплоть до сосуда, снабжающего опухоль, вводится тонкая трубочка (катетер). Затем в него впрыскивается смесь из нескольких медикаментов: средств, способствующих закупорке сосудов, контрастного вещества или цитостатических препаратов, уничтожающих раковые клетки. Таким образом, происходит двойное воздействие на опухоль: останавливается её кровоснабжение и разрушаются злокачественные клетки.
В ходе лечения может возникнуть ряд побочных эффектов, например, боли в верхней части брюшной полости, повышенная температура и тошнота. Эти симптомы хорошо поддаются лечению и обычно исчезают по окончании терапии.
Обязательным условием для проведения трансартериальной химиоэмболизации является проходимость как печеночной артерии, так и воротной вены. При нарушении проходимости воротной вены эта процедура не проводится, так как в противном случае кровоснабжение печени будет полностью остановлено, что приведёт к смерти пациента.
Одним из видов лечения при помощи теплового воздействия является радиочастотная термоабляция (РЧА). Она заключается в том, что в опухоль через кожу вводится специальный зонд, нагревание которого приводит к гибели раковых клеток.
РЧА проходит под контролем УЗИ или компьютерной томографии. Введение зонда абсолютно безболезненно, так как осуществляется под местным или общим обезболиванием. Сама процедура также не вызывает болевых ощущений, так как в печени нет нервных окончаний.
Аналогичной процедурой является микроволновая абляция (МВА).
Этот инновационный метод (Selective internal radiation therapy, SIRT) основан на введении мельчайших радиоактивных микросфер в опухолевые очаги печени. Они вводятся в организм через катетер в печёночную артерию, откуда частицы попадают в кровеносные сосуды, снабжающие опухоль. В результате происходит остановка кровоснабжения опухоли, а раковые клетки подвергаются радиоактивному облучению. В настоящее время эта терапия активно исследуется.

Лучевая терапия (радиотерапия) является одним из важнейших методов в лечении рака. Ионизирующее излучение воздействует на ядро клетки. Оно разрушает её генетическую информацию (ДНК), в результате чего клетка больше не может делиться. В то время как здоровые клетки в большинстве случаев восстанавливаются после таких изменений, раковые клетки не могут справиться с повреждениями, нанесёнными излучением, и поэтому погибают.
Особенность клеток печени состоит в том, что они не могут регенерироваться после облучения и погибают вместе с раковыми. Поэтому лучевая терапия при лечении опухолей печени применяется только для болеутоления, лечения метастазов и в рамках клинических исследований.
Если опухоль печени уже метастазировала, или же, если очаг расположен так, что проведение локального лечения затруднено, используется системная терапия, воздействующая на весь организм. Под ней подразумевают биологическую, антигормональную или химиотерапию.
В последние годы для лечения рака печени применяют специальные молекулы, подавляющие рост опухолевых клеток (биотерапия). В настоящее время единственным официально разрешенным препаратом является сорафениб. Этот препарат рекомендуется только тем пациентам, чье состояние оценивается как стадия А по Чайлд-Пью.
Эффективность этого метода при раке печени пока не доказана.
Зачастую в ходе операции не удаётся удалить все раковые клетки, например, когда некоторые из них через лимфатические и кровеносные сосуды успели попасть в другие части тела, или если раковая опухоль уже дала отдалённые метастазы. В этом случае назначается химиотерапия.
В ходе химиотерапии разрушаются быстро делящиеся клетки. Медикаменты (цитостатические средства), используемые для этого вида терапии, препятствуют их делению, таким образом предотвращая дальнейшее разрастание опухоли. Кровь распределяет медикаменты по всему организму (системная терапия). Но у этого метода есть недостаток — разрушаются и здоровые быстро делящиеся клетки. К ним относятся, например, клетки слизистых оболочек и волосяных луковиц.
Для лечения рака печени химиотерапия применяется очень редко. Она эффективна только для лечения редкого вида опухоли печени, фиброламеллярной карциномы, при условии отсутствия цирроза печени.
Новые подходы к лечению рака печени с помощью химиотерапии находятся в настоящее время в процессе разработки.
На поздних стадиях, когда состояние пациента оценивается как стадия C по Чайлд-Пью, применение лечения считается нецелесообразным, так как существующие методы терапии не дают положительных результатов и тяжело переносятся пациентами. В таком случае принимается совместное решение врача и пациента о дальнейших действиях, с учетом их преимуществ и недостатков.

Цель генной терапии — встроить в опухолевые клетки такую генетическую информацию, которая приведёт к их гибели.
Например, в ДНК раковых клеток помещаются такие вещества, которые влияют на выработку определённых белков. Эти белки, в свою очередь, могут подавить рост раковой опухоли.
Кроме того, генная терапия подразумевает использование так называемых костимуляторов, благодаря которым иммунная система начинает активно бороться с опухолевыми клетками.
Активация иммунной системы для борьбы против опухоли возможна также при помощи специальной вакцины. Данный метод существует только в рамках исследований и ещё не применялся для лечения людей.
При раке желчных протоков оперативное лечение — единственный шанс на полное выздоровление.
Зачастую опухоль расположена так, что требуется не только удаление самой опухоли, но и удаление значительной части печени. Поэтому оперирование рака желчных протоков — это, как правило, очень обширное вмешательство. Чтобы его перенести, пациент должен находиться в хорошем общем состоянии.
Хирургическое лечение имеет смысл только в том случае, если опухоль резектабельна, то есть если её с технической точки зрения можно полностью удалить. Поэтому на поздних стадиях и при наличии метастазов оперативное вмешательство нецелесообразно.
Иногда перед операцией необходимо выполнить дренирование желчных протоков или эмболизацию (закупорку) сосудов печени, снабжающих опухоль кровью. При местно распространённой опухоли желчных протоков в большинстве случаев требуется расширенная гемигепатэктомия, подразумевающая удаление шести из восьми сегментов печени. Оставшейся части печени обычно достаточно, чтобы этот орган нормально функционировал. Затем удаляется часть желчных протоков и желчный пузырь. Оставшийся желчный проток (правый или левый) соединяется с тонкой кишкой.
Иногда действительный размер опухоли можно оценить только в ходе операции. Поэтому в некоторых случаях, если хирург понимает, что опухоль слишком большая и полностью удалить её не удастся, операцию останавливают.
Раковая опухоль желчных путей и желчного пузыря может привести к их закупорке, в результате чего возникает воспаление желчных протоков. Поэтому пациентам, страдающим от желтухи, необходимо восстановить отток желчи. Это требуется как перед оперативным вмешательством, так и в том случае, когда операция невозможна.
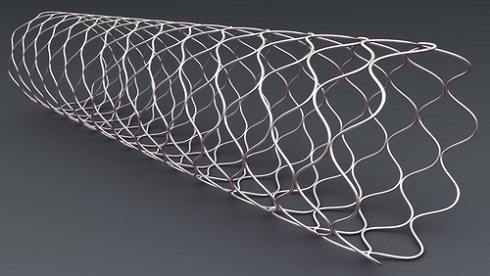
Дренирование обычно проводят в ходе эндоскопической ретроградной холангиопанкреатографии (ЭРХПГ) — в желчные протоки устанавливаются специальные трубочки (стенты). Стенты бывают пластиковыми — их необходимо заменять каждые три месяца, и металлическими — их заменять не требуется.
Иногда установки стента бывает недостаточно для восстановления нормального оттока желчи. В этом случае применяется дренирование наружным способом (через печень и кожу). Установка такого дренажа происходит под рентгеновским контролем.
После такого дренирования необходим постоянный контроль дренажной трубки. Ее закупорка очень быстро приводит к воспалению желчных протоков.
На ранних стадиях опухоли желчных протоков обычно относительно небольшого размера, однако в некоторых случаях их расположение не позволяет провести удаление оперативным путём. В этом случае применяется фотодинамическая терапия с использованием лазера.
Фотодинамическая терапия проводится в 2 этапа. На первом этапе, который длится один-два дня, пациенту в форме инъекции вводится специальное вещество (фотосенсибилизатор), которое накапливается в опухоли и делает её восприимчивой к лазерному излучению. На втором этапе в рамках эндоскопической ретроградной холангиопанкреатографии (ЭРХПГ) в желчный проток вводят эндоскоп с закреплённым на нём источником лазерного излучения, разрушающего раковые клетки. В здоровой ткани фотосенсибилизатор почти не накапливается, поэтому лазер её не повреждает или повреждает очень незначительно.
Побочным эффектом этого метода лечения является повышенная светочувствительность кожи в течение месяца после лечения.
Эффективность данного вида терапии также изучена не до конца.

Лучевая терапия (радиотерапия) является одним из важнейших методов в лечении рака. Ионизирующее излучение воздействует на ядро клетки, разрушая её генетическую информацию (ДНК), в результате чего клетка больше не может делиться. В то время как здоровые клетки в большинстве случаев восстанавливаются после таких изменений, раковые клетки не могут справиться с повреждениями, нанесёнными излучением, и поэтому погибают. Излучение, используемое при лучевой терапии, аналогично рентгеновскому, но намного сильнее.
В некоторых случаях для симптоматического лечения рекомендуется местная брахитерапия, которая заключается в том, что облучение опухоли производится изнутри. Для этого при помощи гибкой трубки в область опухоли доставляется радиоактивный источник. Брахитерапия уменьшает риск закупорки желчных протоков и, следовательно, возникновения желтухи. Зачастую она проводится в сочетании с фотодинамической терапией.
В некоторых случаях брахитерапия применяется для лечения метастазов.
Для лечения рака желчных протоков химиотерапия применяется только в том случае, если опухоль невозможно удалить оперативным путём, а также, если желчные протоки проходимы. Тем самым замедляется рост новообразования и продлевается жизнь пациента.
В рамках клинических исследований химиотерапия применяется в сочетании с лучевой терапией, после чего проводится трансплантация печени.
Во многих случаях на поздних стадиях рак желчных протоков не поддаётся лечению. В этом случае применяется паллиативная терапия, задача которой заключается в повышении качества жизни больного.

Билирубин – это конечный продукт метаболизма гемоглобина, который содержится в эритроцитах. Когда состарившиеся эритроциты распадаются, содержащийся в них гемоглобин в ходе нескольких процессов трансформации в итоге превращается в билирубин.
В норме билирубин должен был бы выводиться с желчью в просвет двенадцатиперстной кишки, однако при наличии препятствия такому оттоку он попадает в кровь и оказывает токсическое действие на весь организм.
В онкологической практике причиной механической желтухи, как правило, является сдавление желчных протоков первичными или метастатическими опухолями печени, поджелудочной железы, забрюшинного пространства.
Чем опасна механическая желтуха?
Билирубин обнаруживается в крови и в норме. Однако его максимальные концентрации, как правило, не превышают 20,5 мкмоль/л.
При механической желтухе его концентрация в крови начинает постоянно нарастать и может достигать нескольких сотен мкмоль/л. Такой высокий уровень билирубина оказывает выраженное токсическое действие практически на все биохимические процессы, органы и системы организма. Кроме того, при наличии механической желтухи невозможно ни хирургическое, ни химиотерапевтическое лечение основного заболевания. Дальнейший рост концентрации билирубина приводит к гибели пациента.

Как лечат механическую желтуху опухолевой этиологии?
В настоящее время наиболее эффективной тактикой борьбы с механической желтухой, обусловленной сдавлением желчных протоков опухолями являются дренирующие вмешательства на желчных протоках. Как правило, они выполняются под контролем рентгенотелевидения и (или) ультразвука.

Чаще всего на первом этапе при помощи тонкой и длинной иглы (игла Chiba) доступом через межреберье пунктируются желчные протоки. Через иглу вводят специальное контрастное вещество, которое позволяет увидеть на рентгене сами желчные протоки, а также определить уровень, на котором они заблокированы. Это вмешательство называют пункционная холангиография.
Далее при помощи специального инструмента возможна установка в желчные протоки специального дренажа. Различают дренирование:
- наружное - при котором вся желчь отводится только наружу;
- и наружно-внутреннее - при котором дренаж ставится таким образом, что желчь эвакуируется как наружу, так и в естественном направлении, в кишку.
Как правило, наружно-внутреннее дренирование более физиологично, поскольку при этом не теряются многие важные вещества, содержащиеся в желчи, которое в норме всасываются обратно в кишечнике.
В некоторых случаях, когда опухолевое сдавление изолирует несколько разных сегментов желчного дерева, может потребоваться установка нескольких дренажей.
Хотя дренирование и позволяет справиться с самим симптомом, оно существенно ограничивает качество жизни пациента – дренаж постоянно раздражает брюшную стенку, требует постоянного ухода, есть риск его смещения или даже случайного удаления, а также развития инфекционных осложнений в месте стояния.
Для преодоления этих недостатков дренирования относительно недавно было предложено завершать дренирующие вмешательства стентированием желчных протоков. Суть стентирования заключается в установке в зону сдавления желчного протока специального (чаще металлического) эндопротеза – стента, который поддерживает желчный проток в открытом состоянии за счет большой радиальной жесткости. При этом дренажную трубку можно удалить совсем, отток желчи будет осуществляться в нормальном направлении по стенту, а точнее по желчному протоку, восстановленному при помощи стента.

-
4 минут на чтение

Злокачественные новообразования, хронические или острые формы патологий неизбежно приводят к сужению желчных протоков. Это является предпосылкой возникновения механической формы желтухи, характерной чертой которой является увеличение показателей желчного пигмента (билирубина) и интоксикация. Единственным эффективным путем решения представленной проблемы оказывается осуществление дренирования в целях нормализации желчного оттока. Также именно это является главным и единственным путем устранения механической желтухи.
- Показания
- Противопоказания
- Виды
- Наружное
- Внутреннее
- Наружно-внутреннее
- Чрескожное
- Чем промывать дренажную трубку желчного пузыря
- Результат
Показания
Необходимость проведения дренажа желчевыводящих протоков может быть связана с грубостью тканевых стриктур. В перечне показаний находится:
- холангит, который сопровождается гнойным воспалением;
- острая форма панкреатита;
- отсутствие положительных результатов оперативного вмешательства на билиарном тракте;
- повреждения области холедоха (расширение желчного протока, принимающее форму мешка).

- Онкогастроэнтерология
![]()
Наталья Геннадьевна Буцык- 6 декабря 2019 г.
Еще одним показанием оказываются вколоченные конкременты, которые с трудом поддаются извлечению. Проводится медицинское осушение желчных протоков при наличии опухолевых формирований.
Осуществляться вмешательство может, если присутствуют изменения в связи с проточной гипертензией, если необходима в дальнейшем интраоперационная холангиография (методика обследования общего прохода в области пузыря). И, наконец, еще одним показанием является осуществление наблюдение за восстановлением течения желчи в область 12-перстной кишки.
Противопоказания
Перечень ограничений включает в себя наличие острой формы желтухи, беременность на последних месяцах или наличие определенных патологий у женщины. Также дренирование желчевыводящих протоков не осуществляется пациентам с высоким индексом тела и при сложностях в деятельности респираторной и сердечно-сосудистой системы.
Существует четыре разновидности этого оперативного вмешательства: наружный, наружно-внутренний, внутренний и чрескожный. В первом случае отток содержимого пузыря будет происходить по оборудованным трубочкам-проводникам к специальному приемнику.
При внедрении наружно-внутреннего дренирования речь идет о том, что значительная часть желчи проникает в область кишки по искусственно образованному хирургом каналу. В то время как оставшееся содержимое будет направлено в специальный приемник, размещенный снаружи.
Внутреннее дренирование подразумевает под собой искусственное формирование эндопротеза такого протока, который обеспечивает оптимальное прокачивание, выведение желчи. Чрескожный дренаж желчных протоков оценивается, как наименее травматичный.
Представляет собой один из методов подготовки пациентов к последующему оперативному вмешательству. Специалисты обращают внимание на то, что:
- Вмешательство является малоинвазивным, оно не требует специализированной подготовки и может осуществляться у любых категорий пациентов.
- К преимуществам методики причисляют возможность контроля над проникновением содержимого желчного пузыря, гнойных масс и крови.
- Через катетер может осуществляться промывание полой части пузыря и протоков антисептическими составами. Это позволяет исключить воспалительные процессы.
- Посредством специального доступа, который осуществляется для последующей установки дренажа, можно не только удалить конкременты, но и иссечь рубцы, которые сужают протоковый просвет.
Объективными ограничениями к наружному дренажу следует считать нарушение степени свертываемости крови, уменьшение показателей тромбоцитов меньше 50 Г на литр. Следующим ограничением является не только асцит (наличие свободной жидкости в области брюшины), но и усугубленная форма печеночной недостаточности.
Очевидным противопоказанием следует считать обширные, многочисленные метастазы, имеющие злокачественный характер. Кроме того, не следует забывать о присутствии гиперваскулярных опухолей в печени на пути оборудования катетера.
После осуществления хирургического вмешательства настоятельно рекомендован постоянный контроль над дренажными трубками. Катетер в течение первых 24 часов рекомендуется промывать специальной смесью, включающей в себя физиологический раствор с новокаином или же гепарином.
Внутренний тип дренирования желчных протоков осуществляется в качестве паллиативного (улучшающее качество жизни) лечения пациентам с усугубленной формой онкологии. В представленной ситуации оборудуется постоянный эндоскопический протез, который обеспечивает оптимальный ток желчи в кишечную полость.
Наружно-внутренний вид дренажа протоков оценивается, как наиболее эффективный. При представленном типе вмешательства у пациента и хирурга есть возможность контролировать степень проходимости трубки и промывать дренаж за счет антисептических растворов.
Помимо этого, большая часть желчи не будет выводиться наружу, а будет проникать по специфическому анастомозу в область 12-перстной кишки. Таким образом, можно говорить о прекращении образования или прогрессирования электролитных нарушений.
За счет наружно-внутреннего дренажа можно говорить о более удачной и полноценной подготовке пациента к будущей операции, если таковая должна проводиться. Чаще всего это удаление конкрементов или новообразований. В случае паллиативного лечения наружно-внутреннее дренирование позволяет продлить жизнь пациентам на срок до 12 месяцев.
В рамках чрескожного дренажа во внутрипеченочные желчные протоки вводится контрастное вещество. Обращают внимание на то, что:
- вмешательство осуществляется под местной анестезией в отделении рентгенологии;
- в качестве предварительной медикаментозной подготовки внутривенно вводится Диазепам;
- за 40-45 минут до дренирования вводится антибиотик или группа средств.
Рак желчных протоков (холангиокарцинома) является довольно редкой мутационной опухолью, рост которой начинается из патологических клеток внутренней оболочки желчных протоков. На начальных стадиях развития данная коварная патология может протекать без характерных симптомов, что затрудняет её раннюю диагностику. Чаще всего рак желчных протоков обнаруживается уже в неоперабельной фазе.
Лечение рака желчных протоков врачи-онкологи Юсуповской больницы проводят с применением самых эффективных подходов и расширенных инновационных методов, обеспечивающих существенное улучшение прогноза заболевания и качества жизни пациентов, страдающих онкопатологиями.
Рак желчных протоков: симптомы
На ранних стадиях рак желчевыводящих путей протекает, как правило, бессимптомно. Однако по мере роста мутационного очага происходит закупорка желчевыводящих путей, в результате чего нарушается отток желчи в тонкий кишечник. Вследствие всасывания желчи в кровь у больных возникает механическая желтуха.
К характерным, хотя и неспецифическим признакам прогрессирующей опухоли относятся следующие симптомы:
- желтуха;
- болевой синдром в области правого подреберья;
- появление тошноты и рвоты;
- снижение аппетита (иногда полный отказ от пищи);
- похудение;
- развитие общей слабости;
- повышенная утомляемость.
Рак желчных протоков: диагностика
Своевременная диагностика рака желчевыводящих путей имеет огромное значение для благоприятного исхода. При подозрении на опухоль желчных протоков врачи Юсуповской больницы назначают пациентам тщательное обследование. В распоряжении специалистов центра онкологии Юсуповской больницы имеется высокотехнологичное оборудование, позволяющее выявить рак желчных протоков на начальных стадиях развития, благодаря чему значительно улучшается прогноз лечения.
Оценить функцию органов ЖКТ позволяет проведение расширенных анализов крови. Решающая роль принадлежит инструментальным методам исследования, самым доступным и безвредным из которых является ультразвуковое исследование.
Наиболее информативной методикой визуализации желчевыводящих путей, выявления канцерогенного очага, а также оценки его локализации и размеров на сегодняшний день является холангиопанкреатография. Суть данного исследования заключается во введении с помощью эндоскопа контрастного вещества в желчный и панкреатический протоки (через фатеров сосочек) и последующем рентгенологическом сканировании.
Если по тем или иным причинам не удается провести холангиопанкреатографию, пациентам Юсуповской больницы назначают чрескожную или чреспеченочную холангиографию с введением контрастного вещества в один из протоков инъекционно.
Исследовательский курс в Юсуповской больнице пациентам при наличии подозрений на рак желчевыводящих путей проводится с использованием таких общепринятых исследовательских мероприятий, как магнитно-резонансная томография и позитронно-эмиссионная томография.
Кровоснабжение патологического очага оценивается с помощью ангиографии – сканирования сосудистой системы.
Опухоль в желчном протоке: лечение хирургическим способом
Единственным радикальным и высокоэффективным методом лечения рака желчевыводящих путей является хирургическое удаление опухоли.
Окончательный вывод о том, является ли патобразование операбельным или неоперабельным, специалисты центра онкологии Юсуповской больницы делают на основании результатов проведенного обследования.
При выявлении холангоцеллюлярного рака точное определение объема онкопоражения, планирование индивидуальной лечебной схемы и прогноз дальнейшего течения онкопатологии не представляет сложности для квалифицированных врачей-онкологов Юсуповской больницы.
Если диагностированы проксимальные онкоопухоли, полученные результаты обследования не всегда могут быть однозначными, что объясняется особенностями анатомического строения этого отдела.
Степень операбельности внутрипеченочной неоплазии определяется в процессе проведения оперативных мер.
При неоплазии, развившейся в воротах печени, проводится резекция опухоли с близлежащими тканями. При вовлечении в патологический процесс печеночной артерии или воротной вены и полном нарушении оттока желчи больным назначают паллиативную терапию.
При диагностике неоперабельной неоплазии разрабатывается протокол поддерживающей терапии.
Химиотерапевтические методы могут применяться в следующих случаях:
- после радикального удаления патологического очага с целью полной ликвидации оставшихся злокачественных клеток;
- для симптоматической онкотерапии при тяжелой онкологии желчевыводящих путей, в случае её неоперабельности;
- при рецидивах рака желчевыводящих протоков после лечения.
После хирургического вмешательства пациент находится под строгим врачебным наблюдением. В первые двое суток – в палате интенсивной терапии. Как правило, после операции пациенты пребывают в стационаре две недели.
Опухоль в желчном протоке: лечение другими способами
В основе радиотерапии лежит высокоэнергетическое излучение, которое разрушает клетки опухоли. Как правило, подобный вид лечения применяется после хирургического удаления злокачественного новообразования для того, чтобы предупредить рецидивы.
Для того, чтобы уменьшить размеры опухоли и добиться её резектабельности, применяют предоперационную и адъювантную лучевую терапию.
Кроме того, лучевую терапию могут назначать без операции, а также без химиотерапии или в комплексе с ней, что позволяет улучшить выживаемость пациентов с неоперабельной опухолью желчных протоков.
Химиотерапия предполагает уничтожение опухолевых клеток специальными препаратами.
Химиотерапевтическое лечение применяется в следующих случаях:
- после хирургического лечения рака желчных протоков для ликвидации оставшихся опухолевых клеток;
- при рецидивах заболевания;
- для облегчения симптомов в ходе паллиативного лечения.
Чаще всего химиотерапию используют в качестве системного воздействия на организм, обеспечивающего уничтожение раковых клеток любой локализации. Однако данный вид лечения имеет и свои недостатки: ни один современный химиопрепарат не обладает направленным действием, в результате чего могут страдать не только опухолевые, но и здоровые ткани организма больного. Этим обусловлено развитие побочных эффектов, для преодоления которых химиотерапевтическое лечение в Юсуповской больнице проводится курсами, с перерывами между ними.
Паллиативная терапия позволяет уменьшить проявления заболевания и улучшить качество жизни больных, страдающих онкозаболеваниями. Она назначается при отсутствии эффективности радикальных вариантов лечения. Паллиативное лечение в Юсуповской больнице состоит из различных способов отведения желчи (оперативных и неоперативных), химиотерапии, радиотерапии и симптоматической терапии.
Одним из современных методов, восстанавливающих нормальную проходимость протока, является стентирование желчных протоков при опухоли. Отзывы пациентов Юсуповской больницы, перенесших данную процедуру, подтверждают её эффективность.
В ходе проведения стентирования в желчный проток вводится специальное устройство, благодаря которому восстанавливается его просвет, чем создаются условия для беспрепятственного прохождения желчи.
После выписки из Юсуповской больницы пациенты находятся под наблюдением врачей-гастроэнтерологов, которые следят за строгим выполнением всех полученных рекомендаций и контролируют процесс восстановления. Это необходимо для достижения максимально положительного результата лечения и предупреждения или раннего выявления осложнений и рецидивов опухоли.
Рак желчных протоков: продолжительность жизни
Холангиокарцинома относится к злокачественным новообразованиям с неблагоприятным прогнозом. Выживаемость пациентов, страдающих данной патологией, даже после операции, как правило, составляет около двух лет.
Благодаря применению в центре онкологии Юсуповской больницы современных методик лучевой и химиотерапии обеспечивается профилактика рецидивов заболевания и улучшение прогноза на излечение.
Читайте также:


