Предположить наследственную природу рака молочной железы позволяет
Наследственная форма рака молочной железы: генетические причины
Как правило, наследственный рак молочной железы (РМЖ) развивается из-за мутаций в генах BRCA1 и BRCA2.
Существуют исследования, в которых доказано, что около 30% женщин, у которых в семьях были случаи РМЖ, имеют мутации в генах BRCA. При этом у них тоже существенно повышается риск развития данного заболевания. По различным данным, он составляет от 60 до 85%, в то время как общепопуляционный показатель составляет 5-7%.
Мутации BRCA могут наследоваться как по материнской, так и по отцовской линии. Соответственно и передаваться они могут как дочерям, так и сыновьям. Страдают от них не только женщины. У мужчин также повышается риск развития онкологии грудных желез и простаты.
Мутации можно обнаружить с помощью молекулярно-генетического тестирования. Его необходимо проводить всем пациентам, страдающим раком молочных желез в следующих ситуациях:
- отягощённый семейный анамнез (наличие у родственников РМЖ в возрасте моложе 50 лет, РМЖ у мужчин, рак яичников, метастатический рак предстательной железы, рак поджелудочной железы);
- злокачественная опухоль развилась в молодом возрасте (до 45 лет);
- пациенты в возрасте до 60 лет с тройным негативным подтипом РМЖ;
- наличие множественных злокачественных опухолей;
- рак молочной железы у мужчин.
Если наследственный характер РМЖ подтверждается, лечение будет проводиться по особому протоколу. В частности, такие опухоли хуже реагируют на терапию таксанами, в то же время хорошие результаты дают антрациклины и препараты платины. Также изучается вопрос применения ингибиторов PARP.
Помимо этого, тестирование рекомендуется пройти в следующих случаях:
- если у пациентки диагностировали рак яичников. При наследственной форме заболевания возможно развитие синхронных опухолей МЖ;
- наличие близких родственников, у которых были диагностированы злокачественные опухоли в возрасте до 45 лет;
- наличие рака любой локализации у 2 и более кровных родственников в семье;
- eсли у близких родственников установлено наличие мутаций в генах;
- тестирование можно пройти самостоятельно при отсутствии факторов риска для исключения наличия мутаций.
Что делать, если у меня обнаружена мутация
Следует отметить, что следующие рекомендации касаются здоровых пациенток с мутациями в гене BRCA.
В первую очередь, необходимо обратиться к врачу-онкологу. Помимо этого, необходимо регулярно проходить ряд обследований:
- ежемесячно проводить самообследование молочных желез;
- начиная с 25 лет, раз в полгода необходимо обследовать грудь у маммолога, а также раз в полгода-год проводить маммографию и раз в год МРТ;
- определение уровня маркера СА-125 (начиная с 35 лет, каждые полгода.
Кроме того, ведутся исследования в направлении химиопрофилактики наследственного РМЖ. Изучается влияние антигормональной терапии (удаление яичников или применение тамоксифена), а также применение препаратов на основе производных кремния.
Рак часто наблюдается у членов одной семьи, объективно подтверждена наследственная природа некоторых злокачественных опухолей. Есть точка зрения, что наследственная предрасположенность — самая вероятная причина всех онкологических заболеваний, и только дело времени, чтобы наука точно установила, мутация какого гена за какой конкретный рак отвечает. Но уже сейчас наследственную передачу рака можно прервать.
Если у человека возникло онкологическое заболевание, очень важно выяснить, есть ли в его роду другие случаи злокачественных новообразований. Семьям, в которых имеется более одного такого случая, нужно пройти консультацию врача-генетика, чтобы понять, есть ли в семейной истории основания для подозрений на наследственный характер патологии. Особенно настораживающим признаком будет онкологическое заболевание в нескольких поколениях семьи. Одним из основных методов работы врача-генетика является составление родословных. Другая важная часть медико-генетической консультации — осмотр и опрос пациента: наследственные заболевания нередко проявляются специфическими признаками.
Принципиальным отличием наследственного рака является возможность его прогнозировать путем выявления патогенных мутаций. На первом этапе семьям, в которых имеется более одного случая развития рака, рекомендуется пройти консультацию врача-генетика, по результатам которого можно будет понять, есть ли в семейной истории основания для подозрения на наследственный характер патологии.
Если в процессе консультации возникают подозрения на наследственную природу заболевания, то следующий этап — целенаправленное генетическое тестирование, поиск мутаций, которые могут вызывать конкретное заболевание. Одни исследования позволяют обнаружить изменения в самом гене, другие — в белке, который кодируется измененным геном. Один ген может претерпеть до 300 мутаций.
В последние годы найдены мутации, ответственные за возникновение и развитие рака молочной железы, яичников, толстой кишки и др. Цель генетического тестирования, или скрининга,— выявить риск возникновения заболевания до появления симптомов. Это дает возможность в одних случаях провести своевременное лечение, в других — рекомендовать меры, позволяющие избежать передачи наследственного заболевания потомству. Мутации генов найдены для нескольких видов рака, тесты на некоторые из них уже используют в клинике — например, тесты на рак груди и кишечника.
От предков или не от предков
Все онкологические заболевания имеют генетическую природу, поскольку при раке гены, отвечающие за правильное деление клетки, повреждены. Но в одних случаях имеют место наследственные мутации, а в других — приобретенные. Результатом повреждения (мутации) гена во всех случаях является бесконтрольное неограниченное деление клеток, что и является сутью ракового процесса.
Несмотря на то что онкологические заболевания имеют генетическую природу, только 10–15% из них передаются по наследству. Почему важно знать, наследственный или ненаследственный рак? Потому что если установлена его наследственная природа, то есть выявлена мутация, вызвавшая его, то известен прогноз и понятна тактика в отношении самого больного и его родственников. Особенно отчетливо наследование мутации прослеживается в случаях так называемого семейного рака молочной железы и яичников, при семейном аденоматозном полипозе и различных опухолевых синдромах (Линча — рак толстой кишки, Ли-Фраумени — разнообразные саркомы и др.). Многие люди, сами будучи здоровыми, являются носителями мутаций, приводящих к наследственным заболеваниям. Если носители одной и той же мутации — оба родителя, заболевание становится неизбежным. Генетическое тестирование позволяет это выявить.
Следует подчеркнуть, что наличие мутации не означает заболевания. Мутация может сидеть в гене много лет до того, как начнет развиваться опухоль. Но, зная про мутацию, врачи могут назначить рациональный режим обследования и профилактического лечения.
Например, у женщин—носительниц гена BRCA1 в 95% случаев в течение жизни разовьется рак груди и в 65% — рак яичников, причем часто рак развивается в молодом возрасте, до 50 лет. Это означает, что носительница должна все время находиться под наблюдением, а в некоторых случаях целесообразно ставить вопрос о профилактическом удалении груди и (или) яичников. У всех на слуху история Анджелины Джоли, которая настояла на удалении обеих молочных желез, поскольку у нее обнаружили мутацию гена BRCA1.
Специалисты знают результаты исследования ткани удаленных молочных желез у 54 шведских женщин—носительниц этого гена в возрасте до 51 года. Ни у одной из них обследование не показывало опухоли груди до операции, но гистологическое изучение удаленной ткани выявило наличие раковых клеток у пяти (10%!) из них.
К профилактической хирургии прибегают и при семейном аденоматозном полипозе, при котором вероятность развития рака толстой кишки после 40 лет достигает 100%, и при других онкологических заболеваниях, если установлена онкогенная мутация.
Понятно, что женщины с отрицательным результатом теста на мутации генов BRCA1 и BRCA2 не застрахованы от спорадического рака груди и яичников. Однако вероятность его возникновения несопоставимо ниже, чем у женщин с положительным тестом.
Женщине следует заподозрить у себя предрасположенность к наследственному раку груди, пройти консультацию врача и генетика и генетическое тестирование, если в семье:
— было более одного случая рака груди или яичников по женской линии (у матери, бабушки, тетки, сестер и т. д.);
— заболевание было диагностировано в молодом возрасте (до наступления климакса);
— были случаи рака груди у мужчины;
— были больные c множественными опухолями (например, у одного человека — рак груди, толстой кишки, матки, рак поджелудочной железы и т. д.);
— были случаи двустороннего рака обеих молочных желез или обоих яичников.
Тестирование и его последствия
Генетическое тестирование имеет несколько преимуществ. Отрицательный результат может принести человеку облегчение, избавить от страха ожидания тяжелой болезни, от которой, возможно, погибли его близкие, а также от регулярных обследований, которые должны быть обязательны в семьях с высоким онкологическим риском. Положительный результат дает человеку возможность принимать обдуманные решения о будущем своем и своего потомства.
Сегодня возможна профилактика наследственного рака, то есть возможность не передать от родителей потомству ген, несущий опасную мутацию. Метод, который позволяет это сделать, называется преимплантационная генетическая диагностика (ПГД). Он заключается в следующем: для пары выполняют ЭКО, проводят генетическую диагностику полученных эмбрионов и переносят в матку женщины только те из них, в которых нет онкогенных мутаций. У родившегося ребенка их не будет, а значит, не будет и наследственного рака.
Открытое письмо Анджелины Джоли, New York Times, 14 мая 2013 года
ПГД проводится не на всем эмбрионе, а на нескольких клетках, которые получают путем его биопсии. Доказано, что биопсия не оказывает влияния на здоровье и состояние ребенка. Другими словами, ПГД не снижает частоту наступления беременности и безопасна для будущего ребенка.
Кроме мутаций, отвечающих за развитие рака груди и яичников, установлены мутации, несущие предрасположенность к меланоме, раку желудка, матки, предстательной, поджелудочной и щитовидной железы, толстой и прямой кишки. Если мутация определена и в семье есть люди, которые хотят иметь ребенка, важно, чтобы они знали о возможности предотвратить передачу следующим поколениям этой мутации и связанного с ней рака с помощью ЭКО и ПГД.
Нас всех шокировал поступок 39-летней голливудской звезды Анджелины Джоли, которая пошла на удаление груди и яичников в целях профилактики онкологического заболевания, которого у нее не было. По утверждению врачей, у актрисы вероятность заболеть раком груди и яичников была очень высокой из-за мутации генов BRCA1, которую она унаследовала от своих предков. Бабушка, мама и тетя Анджелины Джоли умерли от рака молочной железы.
"Я знаю, невозможно полностью спастись от рака, но я буду искать все возможные пути, чтобы мои дети не пугались, думая: "Моя мама умерла от рака" - заявила Джоли. Нелегко принимать такие решения, но брать контроль над своим здоровьем и принять все меры, чтобы разорвать цепочку передачи злокачественных опухолей из поколения в поколение, конечно, здорово.
Действительно, рак груди и яичников нередко передаются по наследству. Более того, до 10% женщин во всем мире имеют такие же мутации генов BRCA1, как у Джоли, и сверхвысокий риск заболеть онкологией молочной железы. Но это вовсе не значит, что от молочных желез и яичников надо избавляться. Мастэктомия - тяжелая операция, доставляющая не только физическую боль, но и психологическую травму женщине. За сохранность своих органов всегда надо бороться, особенно если речь идет не об уже поставленном диагнозе, а только о наследственной предрасположенности.
На сегодняшний день существует более 30 маркеров - анализов, по которым можно определить риск развития разных видов рака. По их результатам можно установить наличие неблагоприятных мутаций в генах и предотвратить развитие онкологических заболеваний. 20-30 лет назад в нашей стране при выявлении рака груди, удаляли не только молочные железы, но и вырезали яичники. С тех пор медицина ушла далеко вперед и сейчас существует специальные препараты, принимая которые можно существенно снизить риск развития женской онкологии.
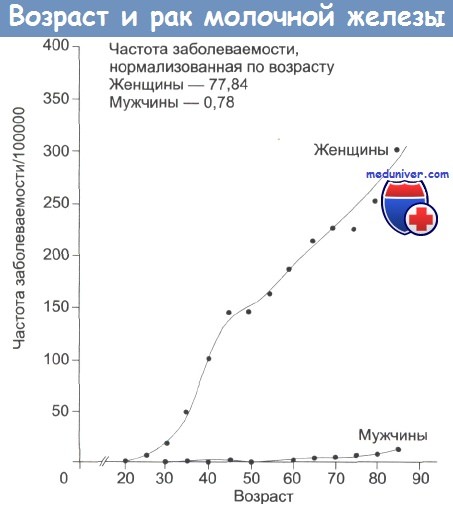
Увидев соответствующие наследственные мутации в генах, врачи назначают регулярные профилактические осмотры. Женщинам от 20 до 35 лет нужно посещать гинеколога один раз в два года, при наличии наследственной предрасположенности к развитию рака молочной железы обязательно надо пройти УЗИ и маммографию. После 35 лет уже каждой женщине раз в два года надо проходить рентгеновскую маммографию, а при обнаружении любых уплотнений должны назначаться дополнительные обследования. Возраст старше 40 лет и поздняя менопауза - основные факторы риска развития онкологии молочных желез.
Уже давно доказано, женщины, кормившие грудью своих детей, реже страдают от рака молочной железы, чем нерожавшие. Поэтому чтобы не допустить развития женской онкологии надо рожать детей и кормить их грудью. Если же болезнь все-таки проявилась, ее можно полностью вылечить на ранних стадиях. Ранняя диагностика онкологических заболеваний молочных желез позволяет полностью вылечить от рака почти 90 % женщин в цивилизованных странах, а в России этот показатель пока составляет лишь 30%. Связано это с тем, что в нашей стране женщины слово "рак" воспринимают, как приговор и затягивают обращение к врачу. Между тем, крайне важно знать, рак - это диагноз, своевременная диагностика и начатое вовремя лечение дают реальный шанс на полное выздоровление от этого опасного заболевания.
Возможность полного излечения рака груди напрямую зависит от 3-х факторов:
1. Стадии заболевания, на которой поставлен диагноз. Если опухоль в груди небольшого размера и не имеет метастазов в пределах других органов, шансы на полное выздоровление очень высокие.
2. Точности диагностики и правильности подбора лечения. Одно из последних достижений маммологии - методика аспирационной вакуумной биопсии, которое позволяет определить природу опухоли и удалить фиброаденомы, чтобы исключить развитие мастита в груди. Мастопатия чаще всего является предшественницей онкологии груди.
3. Возможности учреждения, где проводится лечение. Сегодня во многих клиниках небольшие опухоли в груди удаляют под местным наркозом, при помощи УЗИ или при рентгенологическом контроле. В несложных случаях уже через час женщина отправляется домой, а от операции у нее остается лишь небольшой след на груди. В учреждениях, где работают квалифицированные врачи, и имеется высокотехнологическое оборудование, сначала делают все, чтобы не только удалить опухоль, но и сохранить молочную железу. Ведь ни один имплантат не заменит родную здоровую ткань.
Безусловно, наследственная предрасположенность не является единственным фактором, исключив который можно не бояться развития рака груди. Особенно внимательной надо быть к своему здоровью молочных желез женщинам, у которых были травмы груди или имеется разные гинекологические заболевания. Избыточный вес, курение, употребление алкоголя, стрессы и возраст старше 40 лет также относятся к ключевым факторам риска развития женской онкологии. Следовательно, чтобы не заболеть раком груди, независимо от того, была ли у вашей бабушки, мамы или сестры злокачественная опухоль в груди, надо с оптимизмом относиться ко всем проявлениям жизни и радоваться малому, не растрачивая энергию и нервы на разные проблемы, которые представляют собой мелочи жизни по сравнению с нашим здоровьем.

- Рекомендуем посетить раздел статьей об "Опухолях молочной железы"

Наследственный рак молочной железы – онкологическое заболевание, обусловленное генетической мутацией и проявляющееся повышенным риском развития злокачественных опухолей молочной железы у кровных родственников. Отличается от спорадических неоплазий более ранним началом, большим количеством двухсторонних поражений и частыми сочетаниями с новообразованиями других органов. Диагностируется с учетом семейной истории, данных молекулярно-генетического анализа и инструментальных исследований. При наличии предрасположенности проводятся регулярные осмотры, по показаниям осуществляется профилактическая мастэктомия. Лечение – операции, химиотерапия, радиотерапия.
- Причины наследственного рака молочной железы
- Симптомы наследственного рака молочной железы
- Диагностика и лечение наследственного рака молочной железы
- Цены на лечение
Общие сведения
Наследственный рак молочной железы – заболевание, сопровождающееся повышением вероятности возникновения злокачественных новообразований молочной железы вследствие генетической мутации, передающейся из поколения в поколение. Является одной из наиболее распространенных наследственных форм рака. Составляет от 5 до 10% от общего количества неоплазий молочной железы. Характеризуется частым ранним началом (в возрасте до 50 лет). Распространенность двухсторонних поражений при разных мутациях колеблется от 5-20 до 60%.
При наследственном раке молочной железы существует высокая вероятность развития других опухолей, в том числе – рака яичников, эндометрия, толстого кишечника, желудка, поджелудочной железы и мочевого пузыря, а также меланомы кожи. При наличии одной близкой родственницы, страдавшей данным заболеванием, риск неоплазии увеличивается в два раза, при двух случаях рака молочной железы в семье – в пять раз. Вероятность развития новообразования еще больше возрастает, если у одной или более родственницы симптомы болезни появились в возрасте младше 50 лет. Лечение проводят специалисты в сфере онкологии и маммологии.

Причины наследственного рака молочной железы
Специалистам известен целый ряд генетических мутаций, увеличивающих вероятность возникновения рака молочной железы. В литературе чаще всего упоминаются мутации генов-супрессоров BRCA1 и BRCA2. Связь этих генов с опухолями данного органа была достоверно установлена в 1994 году. Проведенные исследования позволили повысить уровень ранней диагностики наследственного рака молочной железы и стали основой для последующих изысканий в этой области. В последующем ученым удалось обнаружить, что перечисленные гены выявляются всего у 20-30% больных с семейными случаями рака молочной железы и рака яичников.
У остальных пациенток заболевание провоцируется другими мутациями, при этом в разных регионах планеты преобладают различные генетические аномалии. Наряду с повышенной вероятностью развития наследственного рака молочной железы дефектные гены могут увеличивать риск возникновения других злокачественных новообразований, чаще всего – уже упомянутого выше рака яичников. Несколько реже у пациенток возникают опухоли эндометрия, еще реже – неоплазии органов, не являющихся частью женской репродуктивной системы.
Существует ряд факторов риска, провоцирующих наследственный рак молочной железы у носительниц дефектного гена. В числе таких факторов – раннее менархе (частое явление при данной патологии), позднее начало климакса, отсутствие беременностей и родов, длительный прием гормональных препаратов, сахарный диабет, ожирение, гипертоническая болезнь, курение, злоупотребление алкоголем, наличие доброкачественных пролиферативных изменений ткани молочной железы и некоторых заболеваний женских половых органов.
Симптомы наследственного рака молочной железы
На ранних стадиях наследственный рак молочной железы протекает бессимптомно. Иногда первыми признаками становятся болезненность в молочных железах (при наличии мастопатии) и интенсивные боли во время менструаций. Как правило, опухоль обнаруживают до возникновения развернутой клинической картины. Возможно как самостоятельное выявление узла (случайное или в процессе самоосмотра), так и возникновение подозрений на онкологическое заболевание при проведении очередного обследования.
Отмечаются различия в течении наследственного рака молочной железы, вызываемого разными генетическими мутациями. Новообразования, выявляемые у женщин-носительниц гена BRCA1, характеризуются высокой степенью злокачественности. Рак, ассоциированный с мутациями BRCA2, протекает более благоприятно по сравнению со спорадическими случаями заболевания. Отличительной особенностью всех форм наследственного рака молочной железы является высокая вероятность возникновения контрлатеральных поражений и рецидивов опухоли в той же молочной железе после проведения органосохраняющих операций. Для сравнения: средняя частота местных рецидивных неоплазий при спорадическом раке составляет 1-1,5% в течение года. При наследственном раке молочной железы контрлатеральные новообразования выявляются у 42%, ипсилатеральные – у 49% больных.
Диагностика и лечение наследственного рака молочной железы
Диагноз устанавливается с учетом семейного анамнеза, результатов молекулярно-генетических исследований и данных дополнительного обследования. Генетический анализ выполняют после выявления семейно-анамнестических признаков наследственного рака молочной железы (наличия заболевания у близких родственников, раннего начала, высокой частоты двухсторонних поражений). При положительном результате анализа регулярно назначают маммографию. При образовании узла осуществляют УЗИ молочной железы, дуктографию, МРТ и другие диагностические процедуры. При подозрении на наличие отдаленных метастазов проводят рентгенографию грудной клетки, сцинтиграфию всего скелета, УЗИ печени, МРТ головного мозга и другие исследования.
Традиционно при наследственном раке молочной железы применяли стандартные схемы, составленные с учетом более высокой вероятности рецидивирования. Однако в последние годы в литературе все чаще встречаются указания на необходимость использования специальных лечебных программ, составленных с учетом чувствительности наследственного рака молочной железы, ассоциированного с различными генетическими аномалиями. Так, пациенткам с дефектом BRCA1 из-за низкой эффективности не рекомендуют назначать средства из группы таксанов. При наследственном раке молочной железы с мутацией BRCA2 успешно применяют цисплатин – препарат, не входящий в стандартную схему лечения рака молочной железы, но успешно используемый при лечении опухолей других локализаций. Для снижения частоты рецидивов даже на начальных стадиях выполняют радикальную мастэктомию, а не органосохраняющие операции.
Меры по предотвращению и своевременному выявлению наследственного рака молочной железы включают в себя отказ от вредных привычек, регулярные самоосмотры и осмотры специалиста. Основной инструментальной методикой, используемой при проведении профилактических обследований, является маммография, однако в последние годы при наличии возможностей ее все чаще заменяют ЯМР, исключающим облучение пациентки. При высоком риске развития наследственного рака молочной железы (более 25%) осуществляют профилактическую двухстороннюю мастэктомию, иногда – в сочетании с оофорэктомией.
1. По западным странам подсчитана частота встречаемости наследственного РМЖ среди женщин по отношению к общей популяции и среди всех случаев заболевания раком груди. Каковы эти цифры для России? Каковы риски развития рака молочной железы и рака яичников при таких показателях по сравнению с рисками в общей популяции?
2. В каких случаях женщине рекомендуют сделать генетическое тестирование? Врач какой специальности обычно рекомендует его провести? Можно ли выделить “группы риска” - женщин, которые по некоторым особенностям должны особенно внимательно подходить к вопросу наследственного РМЖ?
Вопрос о генетическом тестировании встает тогда, когда случаи рака прослеживаются в нескольких поколениях семьи пациетнки, особенно при возникновении рака яичников и рака молочных желез до 35ти лет и РМЖ у мужчин. Также учитывают и степень родства онкологического/ой больного/больной к консультируемой женщине. Чтобы подтвердить наличие наследственной предрасположенности, нужна консультация онколога- генетика и молекулярно-генетическое исследование. Важно помнить, что не все семейные случаи являются наследственными - они могут быть связаны с соматическими мутациями, которые не передаются по наследству. С другой стороны, если никто из родственников не болел раком, это не значит, что у него нет такой предрасположенности. Это обстоятельство многих, вероятно, насторожит и испугает. Но ситуации действительно бывают разные: можно не знать всех своих родственников или их диагнозы – люди порой скрывают от родных, что больны онкологическим заболеванием и т.д., и тогда проведение генетического обследования поможет прояснить ситуацию.
Общепринятых критериев включения в группы риска нет - они варьируют в разных странах. Есть обстоятельства, когда обратиться к генетику желательно, даже если нет поводов подозревать, что есть наследственная предрасположенность к онкологическим заболеваниям. Например, сделать это стоит в том случае, если у пациента или родственников были или есть множественные доброкачественные опухоли (полипы, пигментные невусы), или если супруги с онкологически отягощенным семейным анамнезом планируют беременность или процедуру ЭКО.
Вопрос о назначении необходимого объема молекулярно-генетического тестирования решается врачом-генетиком в ходе медико-генетического консультирования. Показания для проведения самого консультирования определяют врач онколог, маммолог, гинеколог, химиотерапевт, врач общей практики.
3. Какие специалисты принимают участие в консультировании женщины, которой рекомендовано провести анализ ДНК на наличие значимых мутаций в целевых генах? Какие линейки генов помимо BRCA1/2 смотрят в России?
Медико-генетическое консультирование сегодня является обязательной составляющей онкологической помощи и проводится сертифицированным врачом-генетиком, специализирующимся в области онкологии, с привлечением медицинского психолога при возникновении этических и психологических проблем. На первом этапе производится сбор личного и семейного онкологического анамнеза, составляется родословная пациента, определяется соответствие критериям включения в группы риска с наследственной предрасположенностью к РМЖ и/или РЯ. При получении информированного согласия проводится генетическое тестирование. На повторной консультации пациенту сообщаются результаты генетического тестирования, обсуждаются программа динамического наблюдения и необходимость информирования родственников I степени родства.
В ходе расширенного обследования с целью дифференциальной диагностики и исключения ложноотрицательного результата при отсутствии мутаций в генх BRCA1 и BRCA2 может быть исследована структура других генов: MLH1, MSH2, TP53, CHEK2, PALB2, PTEN, NBN, ATM, BRIP1, RAD50, BLM, FGFR2, ассоциированных с риском развития РМЖ и/или РЯ.
4. Если ДНК-анализ выявил у пациентки мутации в целевых генах, то какова схема ее дальнейшего наблюдения?
При выявлении мутации генов BRCA у здорового члена семьи рекомендуются самообследование молочных желез, посещение маммолога 2-4 раза в год и ежегодная маммография и/или магнитно-резонансная томография молочных желез после достижения 25 лет. Однако необходимо помнить, если мама заболела в возрасте 40 лет, то такая предрасположенность может реализовываться в следующем поколении на 5-10 лет раньше. Близким родственникам рекомендована консультация врача-генетика. Патологический BRCA-генотип повышает риск возникновения рака желудка, толстой кишки, эндометрия, поджелудочной железы, мочевого пузыря, опухолей головы и шеи, железы, а также меланомы кожи.
5. Существует ли единое мнение врачей по поводу превентивных операций? В каком возрасте и при каких показателях риска их рекомендуют проводить? Как часто в России проводят превентивные мастэктомия и (сальпинго)-оофоректомию?
В мировой онкологической практике показан хороший эффект профилактических операций – двусторонних мастэктомии и сальпинго-овариэктомии, которые снижают и заболеваемость, и смертность от РМЖ и РЯ. Профилактическая мастэктомия исключительно эффективна, она снижает риск развития РМЖ на 90–95%. Двусторонняя сальпинго-овариэктомия снижает риск развития РЯ, рака фаллопиевых труб, первичного перитонеального рака и РМЖ. У носителей BRCA мутаций овариоэктомия снижает риск развития рака яичников на 90%, рака молочной железы на 50%, а защитный эффект сохраняется в течении 15 лет. С одной стороны, считается оправданным рекомендовать профилактическую овариоэктомию носительницам BRCA, кто завершил детородную функцию, с последующей заместительной гормонотерапией до достижения 50 лет. С другой стороны, есть мнение, что даже яичники даже после наступления менопаузы продолжают продуцировать гормоны, которые защищают женщин от остеопороза и других возрастзависимых заболеваний.
Наибольший опыт в выполнении контрлатеральных профилактических мастэктомий (более 60) имеет ФГБУ "РОНЦ им. Н.Н. Блохина" РАМН в связи с наличием официального разрешения Росздравнадзора РФ на выполнение подобных операций. Методика и профессиональный уровень выполнения операций в РОНЦ соответствует мировому.
6. Можно ли говорить, что по сравнению с западными странами России не отстает в диагностике, наблюдении и лечении данного вида новообразований? В каких российских центрах можно провести ДНК-тестирование и последующую консультацию специалистов? Есть ли потребность усиленно развивать данную область (или она уже развита, или не является приоритетной?
Оказание данного вида помощи в РФ находится на мировом уровне. Помощь можно получить помимо ФГБУ “РОНЦ им.Н.Н.Блохина” в крупных онкологических центрах Томска, Новосибирска, Санкт-Петербурга.
В московском РОНЦ разработана стратегия медико-генетического консультирования семей с онкологически отягощенным анамнезом с использованием высокотехнологичных диагностических методик в том числе и при наследственном раке молочной железы и рака яичников, которая предусматривает расчет риска развития заболевания, возможность ранней диагностики, выбор тактики лечения и профилактики, а также решение проблем планирования семьи и деторождения.
Для развития этого научного направления на базе Онкологического Центра функционируют медико-генетические кабинеты для детей и взрослых. Основная задача которых - выявлять семьи с наследственными формами злокачественных опухолей, формировать группы риска из числа родственников больных и наблюдать их.
7. Каковы юридические аспекты, связанные с наследственным РМЖ, о которых надо помнить врачу и пациенту?
Зав.лабораторией клинической онкогенетики РОНЦ Л.Н.Любченко
Читайте также:

