Полиорганная недостаточность у больных раком 4 стадии

Синдром полиорганной недостаточности развивается в результате одновременного или последовательного нарушения функций нескольких органов. В большинстве случаев полиорганная недостаточность является терминальной стадией тяжелых заболеваний, в том числе и последних стадий рака. Термин был введен относительно недавно — в 1973 году и на протяжении более 45 лет продолжает оставаться одной из самых частых причин смерти среди пациентов, которые находятся в реанимационных отделениях.
- Особенности полиорганной недостаточности
- Как проявляется синдром полиорганной недостаточности
- Почему развивается полиорганная недостаточность
- Методы диагностики заболевания
- Методы лечения
- Чем опасна полиорганная недостаточность
Особенности полиорганной недостаточности
Патологические изменения в органе или системе органов не развиваются одномоментно. Этот процесс протекает в три основные стадии:
- Компенсация. Длится от трех до пяти дней. В ответ на повреждение, организм старается компенсировать утраченную функцию. На начальных этапах ему удается сделать это относительно просто, поэтому полного отказа в работе органа не возникает. Если на этом этапе провести лечение, то можно будет избежать серьезных последствий, которые характерны для других стадий.
- Субкомпенсация. В этот период организм не может в полной мере восполнить утраченную функцию, поэтому пациент нуждается в медикаментозном лечении. Для того чтобы скорректировать имеющиеся нарушения, достаточно небольших доз лекарственных препаратов.
- Декомпенсациия. Эта стадия характеризуется выраженными изменениями в органах и полной утратой работоспособности. Состояние пациента становится крайне тяжелым. Он нуждается в больших дозировках лекарственных препаратов и проведении дополнительных мероприятий, которые призваны поддерживать жизнеобеспечение (ИВЛ, гемодиализ).
Степень тяжести полиорганной недостаточности определяется исходя из объема поражения. Декомпенсация двух систем соответствует тяжелой, а трех — крайне тяжелой степени.
Как проявляется синдром полиорганной недостаточности
Точный набор симптомов зависит от поражения тех или иных органов. Как правило, самыми отчетливыми являются признаки нарушения функций дыхательной системы. Об этом могут свидетельствовать следующие клинические проявления:
- Одышка.
- Активация вспомогательных мышц в процессе дыхания.
- Цианоз кожных покровов.
- Выраженная потливость.
- Нарушение сознания и заторможенность на поздних стадиях.
При поражении сердечно-сосудистой системы отмечаются боли за грудиной, различные нарушения гемодинамики, отеки мягких тканей и внутренних органов. На начальном этапе присутствует выраженная тахикардия, вплоть до 180 ударов в минуту. Она развивается с целью компенсации нарушений и со временем сменяется брадикардией, при которой частота сердечных сокращений может опускать до 40 ударов в минуту и даже ниже. На поздних стадиях пациент слабо отвечает на препараты, которые помогают нормализовать деятельность сердечно-сосудистой системы. Это одна из причин, по которой лечение полиорганной дисфункции становится сложным.
Нарушение деятельности желудочно-кишечного тракта при полиорганной недостаточности проявляется симптомами механического сдавления кишечника. К этим симптомам относятся:
- Нарушение процесса дефекации.
- Задержка газов.
- Вздутие и асимметрия живота.
- Рвота.
- Потеря аппетита.
В некоторых случаях развивается желудочно-кишечное кровотечение, которое усугубляет течение основного заболевания и нередко становится причиной смерти пациента.
Достаточно часто в клинической картине присутствуют признаки, которые характерны для почечной недостаточности. Прежде всего, это выраженное снижение объема мочи с последующим развитием анурии, что является показанием для проведения гемодиализа. Кроме того, у пациентов выявляется снижение уровня калия в крови, почечные отеки, нарушение водно-электролитного баланса и др.
Почему развивается полиорганная недостаточность
Среди причин, которые приводят к развитию синдрома полиорганной недостаточности, отмечаются тяжелые заболевания и состояния, которые оказывают существенное влияние на функции организма. К ним относятся тяжелые травмы, сепсис, инфекционно-токсический шок и др.
У онкологических пациентов синдром полиорганной недостаточности развивается после радикального удаления опухоли. Отличительной особенностью оперативных вмешательств в онкологии является необходимость удаления части одного или нескольких органов, которые поражены опухолевым процессом. При этом часто такие операции сопровождаются массивной кровопотерей, что увеличивает вероятность развития синдрома.
Полиорганная недостаточность развивается постепенно. В ее течении выделяют три основных этапа:
- Выработка различных активных молекул, которые приводят к развитию системного воспалительного ответа. Такими молекулами могут быть интерлейкины, фактор активации тромбоцитов, фактор некроза опухоли, гормоны, ферменты, свободные радикалы и др. В результате нарушается проницаемость и тонус сосудов, изменяются механизмы иммунной защиты и важнейшие биохимические процессы. Все эти изменения соответствуют индукционной фазе полиорганной недостаточности.
- Во время каскадной фазы отмечается развитие системных повреждений, которые проявляются характерными симптомами — тромбоцитопенией, лейкоцитозом, нарушением микроциркуляции, гипоксией и т.д.
- Фаза вторичной аутоагрессии характеризуется выраженной дисфункцией органов и нарушением гомеостаза.
Для полиорганной недостаточности характерно несколько повреждающих механизмов, среди которых ведущее значение имеет ишемия, активное тромбообразование и нарушение мозгового кровообращения.
Методы диагностики заболевания
Симптомы полиорганной недостаточности могут быть похожими на другие заболевания, поэтому для подтверждения диагноза врач назначает комплексное обследование, в которое входят следующие методы диагностики:
- Осмотр пациента, анализ жалоб, сбор анамнеза. Уже на этом этапе специалист может заметить характерные признаки, которые свидетельствуют о поражении одного или нескольких органов. Это могут быть нарушения дыхательной и сердечной деятельности, метаболические изменения, отклонения в гемодинамике.
- Инструментальное обследование. Его объем зависит от проявлений полиорганной недостаточности. В распоряжении врача имеются все неинвазивные методы, например, УЗИ, рентген, КТ, МРТ и др. Кроме того, важно регулярно отслеживать основные показатели жизнедеятельности организма — артериальное давление, частоту сердечных сокращений, частоту дыхания и др.
- Лабораторные методы диагностики. Обычно назначаются базовые анализы, которые позволяют оценить и в дальнейшем контролировать основные показатели гемодинамики, уровень электролитов и ферментов в крови и др.

С учетом того факта, что пациенты в большинстве случаев находятся в условиях палаты реанимации и интенсивной терапии, полиорганную недостаточность удается выявить на ранних стадиях, когда полного отказа органа или системы не произошло.
Методы лечения
Основная цель лечения пациента заключается в восстановлении утраченных функций, устранении негативных последствий полиорганной недостаточности и предупреждении осложнений. Для этого назначаются медикаментозные препараты из группы антибиотиков, НПВС, гормонов, антикоагулянтов и др. При необходимости выполняется переливание крови или ее компонентов, проводится профилактика ДВС-синдрома, внутренних кровотечений, коллапса. На всем протяжении лечения, пациент должен соблюдать строгий постельный режим.
При тяжелом течении применяются хирургические методы лечения. К ним относятся экстракорпоральная детоксикация, устранение кишечной непроходимости, удаление нежизнеспособных органов, которые начали некротизироваться.
Чем опасна полиорганная недостаточность
Основная опасность полиорганной недостаточности заключается в высоком риске летального исхода. В зависимости от объема поражения, смертность может составлять от 30% до 100%. Даже если основные проявления синдрома удается своевременно устранить, вероятность развития отсроченных заболеваний остается очень высокой. Среди наиболее частых осложнений отмечаются:
- Хроническая почечная недостаточность.
- Ишемическая болезнь сердца.
- Различные заболевания легких.
- Блокады проводящих путей сердца.
- Неврологические нарушения.
- Энцефалопатия и др.
Несмотря на развитие методов хирургического лечения и систем мониторинга основных показателей работы организма во время операции, а также подходов к послеоперационному ведению пациентов, частота развития полиорганной недостаточности продолжает оставаться высокой. Ввиду актуальности данной проблемы специалисты ищут новые пути ее решения, начиная от своевременной диагностики и заканчивая эффективным лечением.
Почему на вопрос о том сколько живут больные раком IV стадии нет и не может быть четкого ответа? От чего зависит продолжительность жизни пациента с этой самой поздней стадией онкологического заболевания? Этот вопрос мы задали врачу высшей категории, заведующей научным отделом инновационных методов терапевтической онкологии и реабилитации НИИ онкологии им. Н.Н. Петрова, доктору медицинских наук Семиглазовой Татьяне Юрьевне.
Клетки рака – это собственные клетки человека над ростом и размножением которых организм потерял контроль.
Эволюция рака насчитывает 4 этапа – 4 стадии, каждую из которых принято обозначать римскими цифрами от I до IV. Обнаружение опухоли на этапе, когда уже появились метастазы в отдаленные лимфоузлы и/или ткани и органы, автоматически определяет стадию процесса как четвертую.
Что влияет на продолжительность жизни пациента с 4 стадией рака?
Прогноз жизни больных злокачественной опухолью IV стадии определяется скоростью распространения опухоли в окружающие ткани и отдаленные органы.
Пример из практики . В 1997 году под руководством профессора Михаила Лазаревича Гершановича мы лечили больную неходжкинской лимфомой IV стадии. Муж больной спрашивал нас о том, сколько осталось жить его молодой жене? После проведенной полихимиотерапии и лучевой терапии на оставшиеся очаги, больная вот уже 20 лет приходит ко мне на прием в полном здравии, а ее сын успешно поступил в Университет.
В ряде случаев резко усугубляют прогноз жизни больного сопутствующие заболевания (тяжелая форма сахарного диабета, хроническая декомпенсированная сердечная недостаточность, дыхательная или почечная недостаточность, цереброваскулярные и тромбоэмболические заболевания, хронические инфекции и т.д.), которые не дают провести лечение в полном объеме.
Парадоксы возраста
Существует мнение, что пожилым людям сложнее бороться с недугом под названием рак. Ведь большое количество сопутствующих заболеваний ограничивает применение тех или иных видов лечения, в связи с риском развития различных осложнений. С другой стороны — у пожилых людей обменные процессы замедлены, и течение самого заболевания не активное, вялотекущее. При этом важно помнить, что на сегодняшний день пожилой и старческий возраст не является сам по себе противопоказанием к назначению противоопухолевой лекарственной терапии. Большее значение имеет биологический возраст больного, а не тот, что указан в паспорте.
У молодых пациентов напротив — количество сопутствующих заболеваний в разы меньше, а серьезных и вовсе может не быть. Но активные обменные процессы могут отчасти способствовать агрессивному течению опухоли. Так что возраст становится и союзником, и врагом.
Большое значение имеет длительность анамнеза (истории) болезни, а также резервы противоопухолевого лечения.

Все зависит зависят от ряда важных факторов, главным из которых является паспорт опухоли, который определяется результатами гистологического, иммуногистохимического + молекулярно-генетического заключения.
Противоопухолевое лечение при IV стадии рака на сегодняшний день может включать:
- все виды лекарственной противоопухолевой терапии (химиотерапию, гормонотерапию, таргетную, иммунотерапию, иммуноконъюгаты);
- сопроводительную терапию (остеомодифицирующие агенты, например, бисфосфонаты или деносумаб, медикаментозную профилактику наиболее частых осложнений химиотерапии: тошноты и рвоты, нейтропении и анемии и т.д.);
- лучевую терапию, прежде всего с противоболевой целью;
- циторедуктивное хирургическое лечение (направленное на уменьшение объема опухолевых масс);
- локальные физические методы — фотодинамическую терапию, криодеструкцию и т.д.;
- симптоматическую терапию (направленную на коррекцию различных симптомов болезни) – противоболевую, седативную, коррекцию нутритивной недостаточности и т.д.
Поэтому опухоли подразделяются на 3 основные группы:
- Высоко чувствительные к химиотерапии, которые с ее помощью могут излечиваться (герминогенные опухоли, пузырный занос, лимфома Ходжкина и т.д.).
- Опухоли, которые отвечают на химиотерапию, но с ее помощью до конца не излечиваются (неходжкинские лимфомы, рак молочной железы, мелкоклеточный рак легкого, рак яичников и т.д.).
- Опухоли, которые плохо поддаются химиотерапевтическому лечению, такие как рак желудка, рак печени, рак поджелудочной железы, меланома и т.д..
Лаборатория молекулярной онкологии
Среди пациентов с 4 стадией онкологического заболевания нужно особо выделить паллиативных пациентов.
Этап, когда паллиативный пациент испытывает сильную слабость, не встает с постели и самостоятельно не передвигается, не ест, у него наблюдается спутанность сознания — называют термальным. Все возможные виды лечения уже испробованы и перестали работать, возможна лишь симптоматическая помощь (например, купирование болевого синдрома). Причиной гибели онкологических пациентов зачастую является полиорганная недостаточность. Опухоль угнетает функции важных органов и систем организма, опухолевая масса растет и становится несовместимой с жизнью. Тем не менее, пациенты с 4 стадией рака, получающие грамотную паллиативную медицинскую помощь, которая в настоящее время оказывается в полном объеме квалифицированным и специально подготовленным персоналом ХОСПИСов, могут жить достаточно долго и с хорошим качеством жизни. У каждого больного всегда есть шанс дождаться новых видов лечения, к которым рак будет чувствителен. Наука двигается вперед семимильными шагами!

Что дает онкологическому больному психологическая помощь?
- Улучшается эмоциональное состояние больных и родственников;
- преодолеваются тревоги, страхи, возникшие сложности в семейных взаимоотношениях;
- укрепляется мотивация к прохождению лечения;
- повышается качество жизни больных и членов их семей;
- приобретаются навыки эффективного общения с медицинским персоналом, коллегами, друзьями и близкими людьми.


Авторская публикация:
Татьяна Юрьевна Семиглазова
врач высшей категории
доктор медицинских наук
заведующая научным отделом инновационных методов терапевтической онкологии и реабилитации НИИ онкологии им. Н.Н. Петрова

Многие больные, страдающие онкологическими заболеваниями, испытали на себе проявление синдрома интоксикации. Поэтому давайте разберём в этой статье, какими симптомами сопровождается интоксикация при онкологии? Что ждёт онкологических больных в терминальной стадии? Какие методы на дому и в стационаре способны максимально помочь организму при интоксикации? Существуют ли народные средства детоксикации?
Но прежде всего, уместным будет разобраться в понятиях. Многие думают, что онкология, это только раковые опухоли. На самом деле, онкология — понятие, объединяющее все злокачественные опухоли, возникающие в разных органах и развивающиеся вследствие перерождения любой ткани организма. Раковая же интоксикация более узкий термин — это группа новообразований из эпителиальной ткани и является разделом онкологии.
Симптомы интоксикации организма у онкологических больных
Проявления онкологической интоксикации зависят от расположения опухоли, стадии процесса, размера новообразования, наличия метастазов, их количества и прочего.
При интоксикации организма у онкологических больных общие симптомы наблюдаются следующие:
- головная боль;
- повышение температуры;
![]()
тошнота, рвота, неустойчивый стул, пониженный аппетит;- общая слабость, быстрая утомляемость, сонливость;
- ощущение перебоев в сердце, тахикардия, перепады артериального давления;
- снижение веса;
- возможно, появление одышки;
- бледность кожи, акроцианоз (посинение кончика носа, ушей), синюшность губ;
- признаки почечной и печёночной недостаточности;
- в крови повышается количество лейкоцитов и СОЭ (скорость оседания эритроцитов), снижается уровень белка, эритроцитов, возникают и другие изменения.
В терминальной (то есть конечной) стадии онкологических заболеваний симптомы эндотоксикоза ярко выражены и протекают наиболее тяжело по сравнению с ранними фазами. Больные испытывают сильную слабость, большую часть дня они лежат. Настроение снижено, они унылы, раздражительны, апатичны, плаксивы и тревожны. Аппетита практически нет. Наблюдается сильно истощение. Появляется патологическое нерегулярное, аритмичное дыхание. Они сильно потеют, периодически повышается температура. Онкологическим больным знакома постоянная ноющая боль в мышцах и суставах. Артериальное давление снижено. Кожа может иметь желтушный или даже сероватый оттенок.
Методы дезинтоксикационной терапии при онкологии
Одной из причин возникновения интоксикации организма при онкологии на ранних стадиях является циркуляция продуктов метаболизма клеток новообразования в крови, на поздних — распад опухоли. Поэтому упор надо делать на лечение основного заболевания. Детоксикацию проводят при подготовке к оперативному лечению, а также во время химиотерапии и лучевой терапии.
У каждого метода дезинтоксикационной терапии при онкологии имеются показания и противопоказания. Применение их во многом зависит от клинических проявлений, вида опухоли, состояния организма, стадии заболевания.
Метод основан на создании разведения крови (гемодилюции). Внутривенно капельно вводят до нескольких литров растворов:
- глюкозы;
- бикарбоната натрия;
- альбумина и другие.
При достижении наводнения организма делают инъекцию Фуросемида. При этом контролируются сердечно-сосудистые показатели, дыхательная функция и другие значения гомеостаза.
Этот метод базируется на установке дренажей в брюшной полости. В верхние трубки вливают до 20 литров жидкости в первые сутки, а через нижние она самостоятельно выливается.
Таким образом, из брюшной полости происходит вымывание токсинов. Процедура длится 2–3 дня.
Энтеросорбция заключается в приёме сорбента в большой дозе (до 1 грамма на 1 килограмм веса больного).
Лекарство больной принимает самостоятельно или его вводят через зонд в разведённом состоянии. Курс лечения продолжается до 5 дней.
Непрямое окисление крови проводится с помощью гипохлорита натрия (ГХН). Внутривенно вводится ГХН, который участвует в дезинтоксикации при онкологии печени, поджелудочной железы, почек, сопровождающейся их недостаточностью.
Обезвреживание токсинов происходит за счёт образования активного кислорода. По времени сеанс может длиться до 6 часов. Всего используют для очистки организма 2–3 процедуры. Непрямое окисление применяют в случае полиорганной недостаточности у тяжёлых больных.
Гемодиализ не проводится при злокачественных опухолях в запущенных стадиях и при онкологии кроветворной системы, а также при 2 и более выраженных сопутствующих заболеваниях. Для каждого больного расписывают индивидуальную программу диализа. Сеанс гемодиализа длится 4–5 часов.
При плохой переносимости гемодиализа используют временную замену на изолированную ультрафильтрацию. Она эффективна в случае развития отёчного синдрома у онкологических больных.
Гемофильтрация состоит из проведения крови через гематологический фильтр и восполнения жидкости электролитными растворами. Таким образом, происходит замещение до 7 литров жидкости без снижения объёма крови.
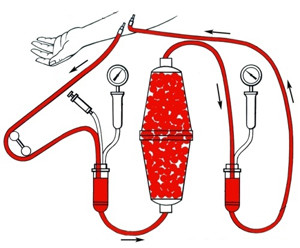
Гемосорбция применяется для выведения из крови токсинов с крупной и средней молекулярной массой. Осуществляется доступ в две вены. Кровь пропускается через специальный аппарат с 200–400 граммами сорбента. Длится процедура 50 минут, проводят её 2–3 раза в день.
Гемосорбция противопоказана при:
- кровотечениях;
- полиорганной недостаточности;
- низком артериальном давлении;
- нестабильности сердечно-сосудистых показателей;
- обезвоживании.
Этот метод основан на замещении плазмы. Её забирают в объёме от 700 миллилитров до полутора литров в течение одной процедуры. Вместо неё вливают:
- замороженную плазму;
- Реополиглюкин;
- Полиглюкин;
- белковые растворы.
Детоксикацию проводят за 1–4 процедуры. Такие методы очистки при онкологии осуществляют снижение крупномолекулярных соединений и в меньшей степени — низкомолекулярных.
Народные методы очистки организма при онкологии

Как ещё снять интоксикацию при онкологии? Существуют народные методы, которые основаны на приёме растительных сборов в маленьких дозах с плавным её увеличением до максимальной и с последующим постепенным снижением. Лечение проводится под тщательным контролем общего состояния больного.
Применять растительные яды фитотерапевты рекомендуют с большой осторожностью, особенно у ослабленных больных. Назначает такое лечение только врач. Далее, будут приведены щадящие способы, которые можно применять в домашних условиях без ограничения дозы.
- Отвар из семян льна, корня солодки. На один стакан отвара можно добавить одну чайную ложку мёда. Если кислотность желудка снижена, в отвар добавляют 1–2 столовые ложки сока облепихи или граната. Приготовление: 1,5 столовые ложки семян, щепотка корня солодки на 200 миллилитров воды. Варить на маленьком огне полчаса. Приём: полстакана через каждые 2 часа, плюс на ночь.
- Отвар геркулеса кипятить на молоке 30 минут, затем процедить.
- Чай из иголок сосны или пихты, луковой шелухи и шиповника. Залить кипятком и оставить на ночь. Принимать в любых количествах.
При онкологии применяются разные методы очистки. Часть из них может проводиться в стационаре, часть — амбулаторно и на дому. Приведёнными народными рецептами можно пользоваться всем. Остальные методы очистки выполняются под руководством врача, они подбираются индивидуально с учётом течения заболевания, развития интоксикации и состояния больного.

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Впервые полиорганная недостаточность описана у хирургических больных; в последующем она была выделена в отдельный синдром (Baue A., 1975; 1980). По мнению В. А. Гологорского и соавт. (1985), А. В. Конычева (1988), J. Zahringer и соавт. (1985), полиорганную недостаточность можно рассматривать как срыв органной адаптационной реакции, а неспецифический характер возникающих при этом изменений проявляется в однотипности нарушений вне зависимости от вызывающего их этиологического фактора и патологического процесса.

[1], [2], [3], [4], [5]
Как развивается полиорганная недостаточность?
Полиорганная недостаточность сопровождается значительными метаболическими нарушениями.
Вещества, выделяемые активированными микробными и вирусными токсинами, макрофагами, мастоцитами, лейкоцитами (лейкотриены, лизосомальные ферменты, кислородные радикалы, различные БАВ) сами способны индуцировать клеточные и тканевые повреждения. Особое место в патогенезе полиорганной недостаточности отводится свободнорадикальному окислению - одному из универсальных механизмов повреждения клеток.
Накоплен материал о ведущей роли нарушений иммунной системы и септических процессов при полиорганной недостаточности, причем среди возбудителей сепсиса основное значение имеют грамотрицательные бактерии, проникающие из ЖКТ больных в кровь и органы, в связи с чем предположено, что ЖКТ является своеобразным генератором полиорганной недостаточности.
Особенности развития полиорганной недостаточности
Общие особенности больных в критическом состоянии - инфекция, травма, воспаление, гипоперфузия тканей и гиперметаболизм Итог - развитие полиорганной недостаточности.
Любая травма приводит к развитию мультифокальных патофизиологических процессов. Медиаторы занимают ведущее место в происхождении клеточных повреждений в органах и тканях. Их выброс зависит от степени тяжести травмы и шока, активации различных медиаторных каскадов во время посттравматических (постоперационных) повреждений. Степень повреждений, возникающих в течение первых суток после травмы, влияет на исход полиорганной недостаточности. Медиаторы воспаления - показатели органных повреждений - служат для уточнения этого прогноза.
При полиорганной недостаточности основное значение имеют:
- бактериальные токсины,
- медиаторы воспаления,
- повреждение эндотелия,
- нарушения гомеостаза,
- повреждение микроциркуляции.
В результате гипоксии и реперфузии происходит агрегация и адгезия нейтрофилов, вместе с активацией эндотелия. Нейтрофилы используют свои медиаторы кислородные радикалы, миелопероксидазу, гипохлорит, протеазы. Все они разрушают клеточную мембрану в органах и тканях и усугубляют тканевую гипоксию.
В начальной фазе травмы и шока происходит активация системы комплемента, коагуляции, фибринолиза, калликреин-кининовой системы. Тканевая травма активирует комплемент по альтернативному пути, а бактерии - по классическому и альтернативному. Активированный комплемент увеличивает продукцию провоспалительных цитокинов [ФНО, ИЛ-1, фактор активации тромбоцитов (ПАФ)] макрофагами. Мембрано-атакующий комплекс комплемента (С5b-С9) вызывает продукцию вторичных медиаторов воспаления ПГЕ2, тромбоксана и лейкотриенов. Концентрация СЗа и С5b-С9 в первый день после травмы выше у тех пациентов, у которых развивается полиорганная недостаточность. Выброс свободных радикалов, протеаз, гистамина, комплекса С5b-С9, тромбина приводит к увеличению экспрессии Р- и L-селектинов и усилению адгезии нейтрофилов к эндотелию, что способствует дальнейшему нарастанию тканевых повреждений и усугубляет тяжесть полиорганной недостаточности.
В начальной стадии тяжелой травмы активируется большое количество клеток, которые синтезируют медиаторы, токсически действующие на ткани. Результат действия медиаторов - системная воспалительная реакция. Во многих случаях системное воспаление приводит к гипоксии и повреждению функции органов с развитием полиорганной недостаточности. Гипоксия и реперфузионные повреждения вызывают некроз энтероцитов и увеличивают проницаемость кишечной стенки. В тонкой и толстой кишке (уже на ранних стадиях шока) происходит транслокация бактерий и их токсинов из просвета кишки в кровоток. Гипоксия кишечной стенки приводит к активации лимфоидной ткани, ассоциированной с кишечником. В системный кровоток поступает большое количество медиаторов воспаления (ФНО, ИЛ-1, ИЛ-2, ИЛ-4, ИЛ-6, лизоцим, гистамин, дифензины), вызывающих сосудистую недостаточность. Ее главной причиной считают оксид азота (NO). Увеличение продукции NO происходит при гипоксии из-за индукции NО-синтазы в легких, печени, селезенке и кишечнике. Важное место в регуляции органного кровотока занимает ренин-ангиотензиновая система. Ангиотензин II - медиатор, увеличивающий общее сосудистое сопротивление и уменьшающий мезентериальный кровоток. Существует положительная корреляция между содержанием фосфолипазы А2 (ПЛА2), развитием ОРДС и летальностью. Ишемическое повреждение слизистой кишечника при шоке сопровождается транслокацией бактерий и повышением ПЛА2. Слизистая кишечника содержит большое количество ПЛА2, которая гиперактивируется при органной гипоперфузии. Под действием ПЛА2 синтезируются провоспалительные липиды лизифосфолипиды (предшественники ПАФ) и арахидоновая кислота (субстрат для синтеза эйкозаноидов) Результат - ускорение и усиление процессов тканевого повреждения.
Уже на ранних стадиях система коагуляции участвует в патогенезе полиорганной недостаточности. Происходит активация внешнего и внутреннего образования тромбина, который стимулирует экспрессию Р-селектинов на эндотелиальных клетках, переводит фибриноген в фибрин-мономер и способствует образованию из него тромбов Отложение фибрина в просвете альвеол, увеличение сосудистой проницаемости и транссудация плазменных белков в интерстициальное пространство легочной ткани приводят к развитию ОРДС. Активация коагуляции по внешнему пути происходит при участии тканевого и VII фактора свертывания. Тканевой фактор содержится во многих тканях, включая головной мозг, эндотелий, макрофаги, интерстиций легочных альвеол. Отложение фибрина, в сочетании с угнетением фибринолитической активности (повышение концентрации ингибитора активатора плазминогена), считают причиной развития ателектазов, нарушения соотношения вентиляция (перфузия), морфологического повреждения альвеолярной структуры легких. Гиперкоагуляция способствует развитию ДВС-синдрома, отложение фибрина в микроваскулярном русле уменьшает тканевой кровоток и ускоряет развитие полиорганной недостаточности. Высокая прокоагулянтная активность характерна для пациентов с травмой и сепсисом, что вызывает в цепи медиаторных повреждений органную дисфункцию, особенно в лёгких ПАФ - токсический медиатор, приводящий к развитию полиорганной недостаточности из-за увеличения сосудистой проницаемости.
Активация системы коагуляции и угнетение фибринолиза вызывают тяжелую органную гипоперфузию. Негативные моменты этого явления корригируют при помощи активированного протеина С. Он обладает противовоспалительным, антикоагулянтным и профибринолитическим эффектом. Активированный протеин С осуществляет деградацию Va и VIlla факторов свертывания, что приводит к уменьшению процессов тромбообразования и ингибированию синтеза тромбина В результате подавления ингибитора активатора плазминогена происходит активация фибринолиза. Действие активированного протеина С приводит к сохранению функций эндотелия благодаря уменьшению взаимодействия лейкоцитов и селектинов на эндотелий. Уменьшается синтез цитокинов (особенно ФНО) моноцитами. Происходит защита эндотелия от апоптоза. Активированный протеин С оказывает противовоспалительное действие на нейтрофилы и эндотелиальные клетки.
У больных в критическом состоянии (из-за выраженного вторичного иммунодефицита) отмечают повышенную восприимчивость к инфекции. Существует взаимосвязь между тяжелым состоянием пациента и развитием генерализованных инфекционных осложнений. Критическое состояние пациента всегда, по объективным причинам, сопровождается большим количеством инфекционных осложнений. Нарушения в системе иммунитета при критических состояниях способствуют одновременно возникновению инфекции и полиорганной недостаточности.
В данный момент рассматривают вопрос о включении в состав полиорганной недостаточности недостаточности иммунной системы (вторичный иммунодефицит).

[6], [7], [8], [9], [10], [11], [12], [13], [14], [15]
Симптомы полиорганной недостаточности
Клинические симптомы полиорганной недостаточности и ухудшение прогноза болезни чаще всего обусловлены сочетанными нарушениями сердечно-сосудистой, дыхательной систем, функции почек и печени.
Различают несколько стадий полиорганной недостаточности - латентную, явную, декомпенсированную и терминальную. Однако своевременная диагностика полиорганной недостаточности представляет значительные трудности: лишь при специальном исследовании или ретроспективном анализе выясняется, что уже в ранней стадии болезни у пациентов была скрытая недостаточность многих органов. Поздняя диагностика полиорганной недостаточности объясняется не только различной степенью поражения отдельных органов и систем, но и недостаточной чувствительностью методик, применяемых для оценки их функционирования.
Развивается ли синдром полиорганной недостаточности у детей с инфекционными болезнями? Можно утверждать, что она манифестирует при самых тяжелых формах заболеваний. У детей с легкими формами инфекционных заболеваний клинических симптомов поражения отдельных органов обычно не определяется. Однако с помощью лабораторных и инструментальных тестов нередко удается обнаружить компенсированную или субкомпенсированную полиорганную недостаточность, что можно трактовать как предстадию полиорганной недостаточности, готовность к тотальному срыву компенсаторных возможностей организма. Своевременное и детальное определение функционального состояния органов и систем в предстадии полиорганной недостаточности, а также наличия резервов их компенсации позволило бы выбрать оптимальный спектр терапевтических вмешательств и режим их осуществления, упреждая развитие клинически явной полиорганной недостаточности.
При нарастании тяжести токсического синдрома у детей прогрессируют нарушения гемодинамики в коже, почках, печени вплоть до возникновения их ишемии, циркуляторной блокады, обнаруженной у больных с наиболее тяжелыми формами токсикоза в терминальной стадии болезни. Параллельно с гемодинамическими расстройствами в крови детей накапливаются различные метаболиты, обладающие токсическими свойствами, что свидетельствует о нарушении выделительной функции почек, печени и ЖКТ. На нарушение биохимических процессов детоксикации в печени указывает также накопление аммиака в крови детей с токсикозами, поскольку реакция перевода токсичного аммиака в относительно безвредную мочевину является одной из наиболее устойчивых в филогенетическом плане. То же можно сказать о накоплении в крови свободного фенола, который в печени связывается с глюкуроновой или серной кислотой и должен выделяться в этом виде с мочой. Накопление в крови пептидов средней массы (в норме 90 % их выводится через почки) является свидетельством почечной недостаточности. Кроме того, нами установлено, что связывающая способность альбумина, являющегося главным циркулирующим сорбентом токсинов в крови, также резко понижается пропорционально тяжести токсического синдрома, степени токсемии.
Следовательно, ретенция метаболитов в крови детей на высоте клинических проявлений токсикоза обусловлена не только механическими причинами, связанными с ухудшением поступления (доставки) токсинов в экскретирующие их органы, но и с нарушением всего детоксицирующего комплекса, включающего этап предварительного биохимического превращения метаболитов и процессы их выведения из организма. Вместе с тем пусковым моментом развития эндотоксемии у детей с токсикозами мы считаем реакцию централизации системного кровообращения, являющуюся основной причиной циркуляторной гипоксии органов и тканей детского организма. Без сомнения, ряд органов, принимающих непосредственное участие в регуляции адаптационного синдрома, описанного Г. Селье (1955), оказывает прямое воздействие на осуществление и поддержание централизации гемодинамики. К ним, в частности, относятся гормоны ренин-ангиотензиновой системы, надпочечников (катехоламины, ГКС, альдостерон), гипофиза (вазопрессин), а также ряд БАВ, участвующих в регуляции кровобращения и влияющих на проницаемость сосудистой стенки: гистамин, серотонин, кинины и др., высвобождающиеся из клеток-депо вследствие стрессовой реакции у детей с тяжелыми формами инфекционных заболеваний.
В норме утилизация большинства гормонов, БАВ и метаболитов происходит в печени. В условиях инфекционной патологии повышенное продуцирование этих веществ, сочетающееся с угнетением функции печени, ведет к их накоплению и длительному сохранению высоких концентраций в крови. Патологическое их действие в организме усиливается в связи с тем, что при развитии токсических синдромов у детей происходит инактивация их специфических ингибиторов и инактиваторов, циркулирующих в крови.
Следовательно, в патогенезе полиорганной недостаточности, закономерно развивающегося у детей с токсикозом, основное значение имеют инфекционный стресс, нарушение системного кровообращения с развитием ишемии большинства органов и тканей детского организма, нарастающая гипоксия и прогрессирующее нарушение метаболизма с накоплением продуктов обмена веществ, угнетение иммунитета и защитных возможностей биологических барьеров для микрофлоры и ее токсичных субстанций, повышение концентрации в крови всевозможных токсинов, включая микробы и их токсины, а также гормоны и БАВ. Причем ретенция токсичных веществ в организме больного ребенка обусловлена не только ухудшением возможности доставки токсинов в экскретирующие органы, но и нарушением всего детоксицирующего комплекса, включая этапы предварительного их обезвреживания, биохимического превращения и выведения.
Третьим звеном патогенеза полиорганной недостаточности, по-видимому, является формирование множественных порочных кругов, взаимное отягощение которых приводит к неотвратимому фатальному исходу. Как правило, в основе порочных кругов лежат приспособительные реакции, превращающиеся в конечном счете в патологические. Декомпенсация сердечно-сосудистой системы, почек и (или) печени тоже является причиной сильнейшего длительного стимулирования вегетативных центров головного мозга и гипофизарно-надпочечниковой системы. Истощение этой системы обнаружено нами при изучении патогенеза острой надпочечниковой недостаточности у детей с тяжелыми формами ОКИ и менингококковой инфекции. Выявлена взаимосвязь тяжести токсического синдрома и пареза кишечника, а также уровня токсичных субстанций (например, ПСМ, накапливающихся при токсикозах) и функциональной недостаточности почек и печени. Значит, с появлением функциональной декомпенсации даже одного органа системы детоксикации и элиминации формируется порочный круг эндотоксинообразования и дальнейшего углубления патологического процесса. В определенной степени развитие полиорганной недостаточности напоминает снежную лавину, вовлекающую в свое движение все, что оказывается на ее пути. Так и в детском организме: сбой в работе одного органа при тяжелом инфекционном заболевании сказывается на работе других, как обвал.
Читайте также: