Пивник а в биопсия при лимфогранулематозе
Диагноз лимфогранулематоза устанавливается только на основании гистологического исследования лимфатического узла или другого очага первичной локализации (при необходимости дополнительно проводится иммуногистохимическое исследование).
Изменения данных лабораторных исследований неспецифичны, однако некоторые из них имеют прогностическое значение. Инструментальные исследования необходимы для определения стадии заболевания. Это чрезвычайно важно, поскольку стратегия лечения больных лимфогранулематозом в ранних и далеко зашедших стадиях заболевания различна.
Клинический анализ крови при лимфогранулематозе. Для начала заболевания наиболее характерны умеренный нейтрофильный лейкоцитоз, а также увеличение СОЭ, которое хорошо коррелирует с активностью процесса и является важным прогностическим фактором. В редких случаях лимфогранулематоза сопровождается высокой эозинофилией. При рецидиве возможен тромбоцитоз. В далеко зашедших стадиях часто развиваются лимфопения, а также панцитопения, обусловленная проводимым лечением или поражением костного мозга.
Биохимические исследования при лимфогранулематозе проводятся с целью определения биологической активности заболевания (фибриноген, гаптоглобин, церулоплазмин, а2 и у-глобулины); кроме того, перед началом лечения необходимо исследование функции печени и почек.
Исследование костного мозга при лимфогранулематозе. Для определения стадии лимфогранулематоза обязательно проведение трепанобиопсии костного мозга, при которой специфическая инфильтрация обнаруживается у 20% больных. Независимо от объема поражения лимфатических узлов у этих пациентов диагностируется IV стадия заболевания. Исследование миелограммы при лимфогранулематозе не относится к обязательным исследованиям и проводится при развитии выраженной цитопении или вторичного онкогематологического заболевания.
Цитогенетические и молекулярно-генетические изменения при лимфогранулематозе. Результаты хромосомного анализа при лимфогранулематозе отличаются от таковых при неходжкинских лимфомах (НХЛ), несмотря на некоторое сходство заболеваний. Если для НХЛ необычны случаи с числом хромосом, большим 50, то при лимфогранулематозе модальное число хромосом в большинстве случаев является около-триплоидным (около 69 хромосом) или около-тетраплоидным (около 92 хромосом). Чаще всего клональные изменения при лимфогранулематозе ассоциируются с перестройками 2р, 4р, 6q, 8q, 9p, 12p, 14q и 16q.
Наиболее часто выявляемыми молекулярно-генетическими изменениями являются клональные реаранжировки генов Ig, различные мутации гена р53. Патогно-моничных структурных хромосомных перестроек и их молекулярно-гене-тических эквивалентов для лимфогранулематоза, в отличие от некоторых типов неходж-кинских лимфом, в настоящее время не описано.
Исследования, необходимые для диагностики и определения стадии лимфогранулематоза
| Наименование исследования | Цель проведения |
| Анамнез заболевания | Выявление В-симптомов |
| Физикальное обследование | Выявление лимфоаденопатии, гепато- и спленомегалии |
| Биопсия лимфатического узла | Морфологическая диагностика лимфогранулематоза |
| Радиологические исследования (рентгенография, компьютерная томография) | Определение распространенности поражения лимфоидной ткани и нелимфоидных органов (стадирование) |
| Общий анализ крови, фибриноген, белковые фракции, церулоплазмин | Определение биологической активности заболевания |
| Трансаминазы, билирубин, ЛДГ, щелочная фосфатаза, креатинин, мочевина | Определение функции печени и почек до начала лечения |
| Трепанобиопсия костного мозга | Уточнение стадии заболевания |
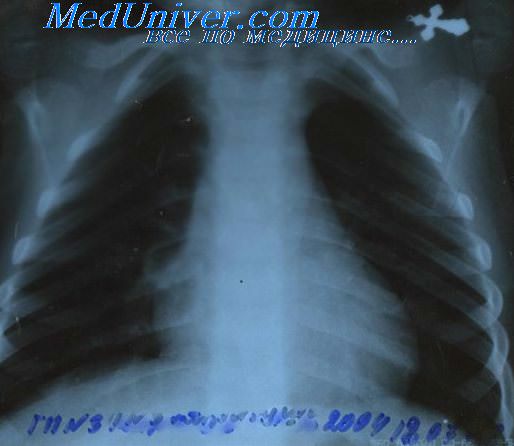
Рентгенография органов грудной клетки при лимфогранулематозе в двух проекциях проводится для выявления поражения медиастинальных лимфатических узлов, легких и плевры.
Ультразвуковое исследование органов брюшной полости при лимфогранулематозе позволяет диагностировать поражение печени, селезенки и внутрибрюшных лимфатических узлов.
Компьютерная томография органов грудной клетки, брюшной полости и малого таза при лимфогранулематозе — оптимальный метод для определения объема поражения при первичном обследовании и контроля результатов лечения. Исследование позволяет значительно точнее, чем рентгенография и УЗИ, определить стадию процесса, выявить увеличение тех групп лимфатических узлов, которые плохо визуализируются другими методами.
Внедрение компьютерной томографии позволило отказаться от применявшихся ранее для определения стадии лимфогранулематоза методов (нижней лим-фографии и диагностической лапаротомии со спленэктомией).
По показаниям проводятся и другие исследования (радионуклидные — для выявления поражения костной системы, магнитно-резонансная томография — с целью диагностики поражения центральной нервной системы и др.).
В последнее время для оценки объема опухоли и ее ответа на терапию все шире используется более точный, чем КТ, метод — позитронно-эмиссионная томография (ПЭТ). Использование ПЭТ позволяет дифференцировать опухолевые и увеличенные вследствие воспаления лимфатические узлы, обнаруживать минимальные признаки опухоли в нормальных по размеру лимфатических узлах (минимальная остаточная болезнь), точнее диагностировать поражение костного мозга. Использование комбинированной методики (ПЭТ-КТ) еще более увеличивает диагностические возможности.
Наиболее адекватным методом для морфологической диагностики лимфогранулематоза и дифференциального диагноза с другими заболеваниями (инфекции, диффузные болезни соединительной ткани, онкогематологические заболевания, в редких случаях — метастазы солидной опухоли) является гистологическое исследование лимфатического узла, которое при необходимости дополняется иммуногистохимией.
Цитологическое исследование аспирата лимфатического узла обычно позволяет поставить диагноз лимфогранулематоза, однако возможности метода существенно ниже. В связи с этим при увеличении одного лимфатического узла проводится его операционная биопсия и гистологическое исследование. При генерализованной лимфоаденопатии дополнительно к операционной биопсии может быть выполнена аспирационная биопсия другого лимфатического узла. Основное преимущество цитологического метода — быстрая диагностика (один день). В то же время планирование лечения следует проводить только после получения гистологического заключения.
При решении вопроса о целесообразности проведении операционной биопсии следует руководствоваться следующими правилами:
1) биопсия показана при наличии в течение 3-4 недель наблюдения врачом даже одного увеличенного лимфатического узла (размером не менее 2 см) без признаков воспаления;
2) если предполагается связь лимфоаденопатии с перенесенной инфекцией, может быть проведен курс антибактериальной терапии (компрессы, сухое тепло и другие физиотерапевтические методы категорически противопоказаны!), после чего принимается окончательное решение о целесообразности биопсии;
3) для иссечения выбирают наиболее измененный, крупный, глубоко лежащий лимфатический узел;
4) при генерализованной лимфаденопатии используют биопсию шейных, надключичных или подмышечных лимфатических узлов (биопсия паховых лимфатических узлов нежелательна, поскольку интерпретация гистологических изменений затруднена из-за следов массивной антигенной стимуляции).
Обычно лимфатический узел иссекают целиком (эксцизионная биопсия). Частичное иссечение лимфатического узла (инцизионная биопсия) используется при наличии конгломерата лимфатических узлов. При проведении диагностической торако- или лапаротомии (в тех случаях, когда у больного выявлено только увеличение висцеральных лимфатических узлов) и подтверждении при экспресс-исследовании операционного материала диагноза лимфогранулематоза выполняется только биопсия. Радикальное удаление пораженных лимфатических узлов или их конгломератов противопоказано. Это приводит к значительному ухудшению результатов лечения, поскольку:
1) большой объем оперативного вмешательства сопровождается диссеминацией опухоли;
2) на длительный срок откладывается проведение оптимальных при лимфогранулематозе методов лечения: лучевой и/или химиотерапии.
Лимфома Ходжкина
В обзорной клинической статье приводятся сведения о патогенезе, диагностике и лечении лимфомы Ходжкина, рассматриваются вопросы ранней диагностики, подчеркивается роль раннего морфологического исследования, лучевых методов диагностики, необходимость создания семенного фонда у молодых мужчин перед началом химиотерапии, важность строгого соблюдения стадирования, уточнения факторов прогноза, неукоснительного соблюдения программ терапии.
Лимфома Ходжкина (болезнь Ходжкина, лимфогранулематоз) – группа заболеваний лимфоидной ткани, включающая как минимум классическую лимфому Ходжкина и нодулярный тип лимфоидного преобладания. Классическая лимфома Ходжкина (ЛХ) – моноклональная опухоль, субстратом которой являются клетки Березовского-Рид-Штернберга (БРШ) и Ходжкина, которые происходят из В-клеток герминального центра фолликула. Они составляют около 1% от массы всей опухолевой ткани, состоящей из реактивных, неопухолевых Т- и В-лимфоцитов с примесью гранулоцитов и макрофагов.
В РФ общее количество впервые заболевших лимфогранулематозом составляет около 3,5 тыс. человек в год. Выявляются 2 основных пика заболеваемости ЛХ: первый приходится на 15–35 лет, второй наблюдается после 60 лет; соотношение мужчины/женщины примерно равное. В средней полосе России заболеваемость ЛХ составляет около 2,5 на 100 тыс. человек за год. В Москве и Московской области с численностью около 20 млн человек число заболевших может составить около 500 человек в год.
Этиология заболевания не известна. Пристально изучается роль вируса Эпштейна-Барр в возникновении заболевания.
В патогенезе ЛХ рассматриваются следующие проблемы. Морфологическим субстратом болезни является небольшое количество опухолевых клеток в массе опухоли, которая в основном состоит из реактивных Т-клеток, в частности CD4+. Цитокины, выделяемые этими клетками в ответ на опухоль, определяют клинические В-симптомы болезни, а также структуру опухоли, инвазирующей соседние ткани.
С.М. Алещенко с соавт. выделили группы генов, сцепленные с плохим прогнозом – резистентностью к терапии и рецидивирующим на фоне полихимиотерапии (ПХТ) течением.
В целом патогенез ЛХ может рассматриваться как ряд последовательных событий: больной ЛХ получает по одному неблагоприятному признаку вероятности развития ЛХ от каждого из родителей, став гомозиготой по этому признаку. Родители больного ЛХ передают HLA-DR признак, который выявляется определенным набором HLA-DR маркеров. Гены системы HLA-DR локализованы на коротком плече 6-й хромосомы.
По данным Алещенко, у части больных ЛХ выявлены генетические маркеры. Она исследовала 112 больных ЛХ, наблюдавшихся в отделении химиотерапии гематологических заболеваний и интенсивной терапии (ГИИТ) ГНЦ РАМН с 1996 по 2000 г. Изучены образцы геномной ДНК из лимфоцитов периферической крови. Показано, что существует положительная ассоциация между развитием ЛХ и наличием генов Cw7 и DRB1*11. Для носителей специфичности DRB1*07 выявлена значимая отрицательная ассоциация с восприимчивостью к ЛХ. Выявлено снижение риска развития ЛХ в молодом возрасте для лиц, имеющих в HLА-генотипе специфичность DRB1*01. Установлено повышение частоты общих НLA-специфичностей 1-го класса у родительских пар, имеющих больного ребенка. Значение данного показателя составляет соответственно 100% против 60%. Ген DRB1*04 ассоциирован у больных ЛХ с достижением полной ремиссии – частота DRВ1*04 в группе пациентов в ремиссии 5 и более лет (20%) выше частоты данной специфичности в группе больных, рефрактерных к ПХТ первой линии (8%) [1]. У пациентов с факторами риска по системе немецких авторов Хасанклевера и Уолкера Диля, основанной на наблюдении почти 6 тыс. больных ЛХ (мужской пол, возраст старше 45 лет, IV стадия заболевания, уровень гемоглобина менее 105 г/л, лейкоцитоз более 16х10/*9, лимфопения
Представляет интерес изучение полиморфизма генов, ответственных за метаболизм цитостатических препаратов, т. к. в ряде случаев при малой активности соответствующих ферментов мы не получаем противоопухолевого эффекта, при повышенной активности ферментов наблюдаются проявления избыточной токсичности. Возможно, полиморфизм генов системы HLA-DR и генетические механизмы лекарственной резистентности взаимосвязаны.
При изучении изолированных клеток БРШ выявлены глобальные механизмы, которые подавляют специфическую экспрессию генов В-клеток. Показано нарушение активности рецептора тирозинкиназы в клетках БРШ при классическом варианте ЛХ и в меньшей степени при варианте лимфоцитарного преобладания. Эта находка является уникальной для ЛХ и может способствовать более успешной химиотерапии [2].
Наши наблюдения за больными ЛХ с ВИЧ-инфекцией выявляют очень интересную проблему. При рассмотрении кривых заболеваемости ВИЧ-инфицированных больных разными болезнями в течение 15 лет до начала высокоактивной антиретровирусной терапии (ВААРТ) (1981–1996 гг.) и в течение такого же времени после введения ВААРТ (1996 – по настоящее время) оказалось, что в левой части графика заболеваемость злокачественными лимфомами, включая первичную лимфому ЦНС и саркому Капоши, возросла в сравнении с неинфицированной популяцией в 168 раз! Заболеваемость ЛХ и солидными опухолями до начала ВААРТ не отличалась от таковой в здоровой популяции (2,5 на 100 тыс. населения). Напротив, в правой половине графика (т. е. после начала ВААРТ) кривые первых двух болезней резко снизились, первичная лимфома ЦНС и саркома Капоши стали встречаться очень редко. Заболеваемость солидными опухолями не изменилась. Интересным фактом стало увеличение заболеваемости ЛХ до 8 раз с началом приема ВААРТ! Это означает, что для реализации ЛХ как болезни необходимо как минимум присутствие CD4+-лимфоцитов. Продолжение наблюдения за больными ЛХ с ВИЧ-инфекцией показало, что ЛХ у этой группы пациентов излечивается лучше, чем у неинфицированных больных: быстрый регресс симптомов, возможность достичь излечения при грубых нарушениях протокола лечения по времени (чрезмерно затянутые интервалы между курсами ПХТ). Эти два факта, полученные при непосредственном наблюдении и лечении больных ЛХ с ВИЧ-инфекцией, нуждаются в научном объяснении, которого пока нет.
Известен воспалительный синдром иммунологического восстановления у ВИЧ-инфицированных больных (Immune Reconstitution Inflammatory Syndrome – IRIS) –появление новых или обострение ранее пролеченных инфекционных или неинфекционных заболеваний на фоне положительного иммунологического и вирусологического ответа на ВААРТ. Он изучен при туберкулезе и грибковых инфекциях у ВИЧ-инфицированных больных. Оказалось, что при сочетании туберкулеза и ВИЧ-инфекции начало ВААРТ с повышением CD4+ клеток приводит к резкому ухудшению течения туберкулеза, и, напротив, первоначальная терапия туберкулеза с последующим присоединением ВААРТ не сопровождается развитием IRIS. CD4+ клетки необходимы для реализации туберкулезного процесса. Аналогичную картину мы наблюдаем при росте заболеваемости ЛХ в начале ВААРТ. Рассмотрение этого феномена в рамках IRIS заслуживает внимательного изучения. Если при туберкулезе в случае IRIS этиологическим фактором являются микобактерии, то при ЛХ одним из этиологических факторов может быть вирус Эпштейна-Барр.
Ранее в комплексе работ акад. В.Т. Иванова с соавт., А.А. Карелина с соавт. [3, 4] показано, что короткие пептиды обладают действием нейропептидов, обусловливая, в частности, гибернацию некоторых животных (медведей). Поводом для этих экспериментов явились клинические наблюдения врачей-гематологов за проявлением высшей нервной деятельности у пациентов, страдающих ЛХ. А.В. Пивник с соавт. [5] отметил своеобразные черты личности и характера этих пациентов: эмоциональная холодность, упрямство, скрытность. Отмечено, что характерологические особенности больных ЛХ ярко проявляются у матерей заболевших. До трети пациентов ЛХ категорически отказываются от рекомендованной полихимио- и лучевой терапии, что ведет к гибели больных в течение ближайших лет.
В результате обсуждений этих психологических особенностей пациентов с ЛХ с психологами и психиатрами было сделано заключение, что для больных ЛХ характерна особенность, отмеченная ранее у пациентов со злокачественными опухолями, а именно инфантильность – отказ согласиться с существованием болезни.
Психиатрами отмечены пограничные состояния и достоверное увеличение числа истинной шизофрении среди пациентов с ЛХ.
Таким образом, накапливается все больше данных об этиотропном действии вируса Эпштейна-Барр у субъекта с широким фоном разнообразных событий, таких как наличие сцепленных с плохим прогнозом генов системы HLA, наличие коротких пептидов, факты их онкогенного действия (О.Н. Блищенко с соавт.), наличие достаточного количества CD4+ Т-лимфоцитов [6, 7].
Морфологические варианты ЛХ
Выделяют следующие морфологические варианты лимфо¬гранулемато¬за (классификация ВОЗ, 2008 г.):
Лимфома Ходжкина, нодулярный тип лимфоидного преобладания.
Классическая лимфома Ходжкина:
• классическая лимфома Ходжкина, лимфоидное преобладание (С81.0 по МКБ);
• классическая лимфома Ходжкина, нодулярный склероз (С81.1);
• классическая лимфома Ходжкина, смешанно-клеточная (С81.2);
• классическая лимфома Ходжкина, лимфоидное истощение (С81.3).
При диагностике обычно биопсии подвергается один из увеличенных периферических лимфоузлов. В случае увеличения только внутригрудных или абдоминальных лимфоузлов или селезенки производится диагностическая торакотомия и лапаротомия или спленэктомия.
При первичном осмотре отсутствие общих симптомов (т. н. В-симптомы активности заболевания) определяется как А-стадия заболевания.
Увеличение лимфоузлов относится к местным симптомам ЛХ, чаще всего это периферические лимфоузлы выше диафрагмы (подчелюстные, шейные, надключичные, подмышечные, лимфоузлы средостения). Выявление увеличенных лимфоузлов в нетипичных местах – по ходу нервно-сосудистого пучка плеча, в кубитальной ямке, в поясничной области или экстранодальной локализации (молочная железа, мягкие ткани) – всегда свидетельствует о запущенной стадии ЛХ и неблагоприятном прогнозе. В этих случаях проводится дифференциальная диагностика между неопухолевым и опухолевым поражением лимфоузлов. Поражения ЦНС крайне редки, мы наблюдали одну пожилую больную ЛХ с общемозговой симптоматикой и объемным поражением мозга, доказанным с помощью МРТ. Обязательно исключается диагноз боковой кисты шеи, нередко симулирующей ЛХ. Увеличение размеров селезенки обычно выявляется при первичном осмотре, она плотная, гладкая, пальпируется ниже края реберной дуги на несколько сантиметров. Иногда спленомегалия может быть массивной, достигая массы 1 кг и более. Чаще небольшая спленомегалия выявляется при УЗИ живота, превышая нормальные размеры 11х4 см. Значительное увеличение размеров печени подтверждает IV стадию заболевания, которая выявляется нечасто. При ЛХ отмечается появление В-симптомов: лихорадка 38 °С в течение нескольких недель, профузная потливость с необходимостью смены постельного белья, потеря веса на 10% за последние 6 месяцев. Кожный зуд исключен из этих признаков, однако он является прогностическим признаком, который, так же как и гиперэозинофилия, превышающая 10–15% в общем анализе крови, определяет эффект терапии и возникновение рецидивов.
Дифференциальный диагноз проводится с метастазами рака, опухолями головы и шеи, включая назофарингеальную карциному, опухоль Шнитке, опухоли щитовидной железы, опухоли слюнных желез, а также опухолями других локализаций – молочной железы, ЖКТ, гениталий, внегонадными герминогенными опухолями. К неопухолевым заболеваниям относятся: вирусные лимфаденопатии, в первую очередь инфекционный мононуклеоз, в этих случаях не следует торопиться с биопсией лимфоузла, наблюдая за больным несколько недель. Также нельзя забывать о бактериальных лимфаденитах, обычно одонтогенного происхождения. В этих случаях следует назначить пациенту санацию полости рта, лечение антибиотиками и понаблюдать больного в течение нескольких недель. Все чаще при биопсии шейных и надключичных лимфоузлов наблюдается туберкулезное поражение. Мы наблюдали больных с шейной лимфаденопатией при локализации сифилитического шанкра на миндалине и губе. Нам приходилось за 1 неделю работы получать заключения по биопсии лимфоузлов этой области с диагнозами: беспигментная меланома, саркома Капоши, болезнь Гоше, туберкулезный лимфаденит.
Диагноз ЛХ всегда ставится морфологически – по результатам биопсии лимфоузла, селезенки или другой пораженной ткани. Исследование включает описание гистологических срезов, окрашенных гематоксилин-эозином, при световой микроскопии. Недопустимым является предположительный диагноз по цитологическому анализу тонкоигольной пункционной биопсии, полученной при пункции лимфоузла.
Морфологи ввели новые методы исследования, без которых современный диагноз лимфомы, ЛХ был нередко недостижим. Были введены анти-CD-антитела – иммунные маркеры, прицельно высвечивающие характерные для каждого варианта лимфом клетки. Молекулярно-биологические методы с использованием единичной изолированной опухолевой клетки позволяют изучать в деталях геном опухолевой клетки. Именно комплексные исследования (световое микроскопическое, иммуногистохимическое, молекулярно-биологическое) позволяют сделать патологоанатомическое заключение по поводу конкретного больного [8]. Результаты этих методов исследований, проведенных у нескольких тысяч больных лимфомами, легли в основу классификации злокачественных заболеваний кроветворной и лимфоидной ткани, предложенной ВОЗ в 2008 г.
После завершения этих исследований проводится стадирование с определением объема поражения лимфатической ткани, т. е. устанавливается стадия ЛХ.
Классификация по стадиям ( Ann . Arbor , 1971, с дополнением в Costwolds , 1989)
Поражение одной лимфатической зоны или одного лимфоидного органа (селезенка, тимус, Вальдейрово кольцо) или одного нелимфоидного органа
Поражение 2 и более лимфатических зон с одной стороны диафрагмы (поражение воротных лимфоузлов с обеих сторон диафрагмы относят ко II стадии); локализованное поражение только одного нелимфоидного органа или ткани (например, стенки грудной клетки) по протяжению с одной стороны диафрагмы (IIE). Число пораженных анатомических зон указывается арабской цифрой, нижним индексом (II 3 )
Поражение лимфатических зон с обеих сторон диафрагмы (III), которое может сопровождаться поражением селезенки (III S ) или локальным поражением по протяжению только одного нелимфоидного органа/ткани или и того и другого (IIISE).
III 1 с поражением селезеночных, воротных или портальных лимфоузлов либо без него
III 2 с поражением парааортальных, подвздошных и мезентериальных лимфоузлов
Диффузное или диссеминированное поражение нелимфоидного органа (или ткани) с поражением лимфоузлов или без него
Дополнительные обозначения, указываемые с любой стадией
Видео-интервью профессора А.В. Пивника
Эпидемиология и демография
Лимфома Ходжкина (название введено ВОЗ в 2001 г., синонимы – лимфогранулематоз, болезнь Ходжкина) – это опухолевое заболевание лимфатической системы. Впервые описано Томасом Ходжкиным в 1832 г. Заболеваемость в России составляет 2,3 на 100000 населения. Болеют лимфомой Ходжкина люди любого возраста. Мужчины заболевают несколько чаще, чем женщины. До последнего времени полагали, что кривая заболеваемости имеет два пика – первый приходится на возраст 15-40 лет, а второй постепенно нарастает после 50 лет.
Однако использование иммунофенотипирования при пересмотре гистологических препаратов у больных старше 50 лет показало, что второй пик либо очень незначителен, либо полностью отсутствует, так как большая часть гистологических препаратов после ретроспективного анализа была отнесена к крупноклеточным неходжкинским лимфомам.
Заболевание, ранее бывшее неизлечимым, в настоящее время при своевременном выявлении и применении современных методик может быть излечено или достигнута стойкая ремиссия. Причины возникновения в настоящий момент окончательно не установлены. Описаны редкие случаи заболевания лимфомой в одной семье, однако лишь отдельные случаи фамильной лимфомы могут быть обусловлены наследственностью. В 1971 г. была выявлена зависимость между инфицированностью вирусом Эпштейна-Барр и частотой возникновения лимфомы.
В Международной морфологической классификации лимфом (ВОЗ, 2001 г.) по иммуно-морфологическим характеристикам выделено 4 гистологических варианта классической лимфомы Ходжкина:
- Богатый лимфоцитами (5-6% случаев)
- Нодулярный (узловатый) склероз (30-45%)
- Смешанно-клеточный (35-50%)
- Лимфоидное истощение – до 10%
Отдельно выделена небольшая группа больных, имеющая сходную с классической лимфомой Ходжкина морфологическую характеристику, но иную иммунологическую. Эта форма болезни получила название нодулярная с лимфоидным преобладанием лимфома Ходжкина. Течение этого варианта наиболее благоприятное.
Международная клиническая классификация делит лимфому Ходжкина на 4 стадии:
I – поражение одной группы лимфатических узлов или локализованное поражение одного экстралимфатического органа или ткани;
II – поражение двух и более групп лимфатических узлов под одну сторону диафрагмы;
III – поражение двух и более групп лимфатических узлов по обе стороны диафрагмы;
III1 – поражение отдельных лимфатических структур в верхней части брюшной полости (селезенки, лимфатических узлов ворот печени, чревных узлов);
III2 – поражение лимфатических узлов нижней половины брюшной полости (парааортальных, подвздошных и брыжеечных узлов);
IV – диффузное поражение различных внутренних органов.
Все стадии подразделяются на:
А – бессимптомное течение, нет признаков интоксикации;
В – необъяснимая потеря веса на 10%, беспричинная лихорадка свыше 38 градусов, ночные поты.
Рецидивы подразделяются на ранние (возникшие в течение первых 12 месяцев после окончания лечения) и поздние (возникшие более чем через 12 месяцев после окончания лечения). Такое разделение имеет большое значение при выборе интенсивности лечения рецидива и определении прогноза.
На ранних стадиях лимфома Ходжкина не имеет специфических признаков. Начинаясь в лимфатических узлах той или иной группы, патологический процесс может распространяться практически на все органы, сопровождаться различно выраженными симптомами интоксикации. Преимущественное поражение того или иного органа или системы и определяет клиническую картину заболевания. Первым проявлением лимфомы Ходжкина обычно становится увеличение лимфатических узлов; в 60-75% случаев процесс начинается в шейно-надключичных лимфатических узлах, несколько чаще справа. Как правило, увеличение периферических лимфатических узлов не сопровождается нарушением самочувствия больного.
Увеличенные лимфатические узлы подвижны, плотноэластичны, не спаяны с кожей, в редких случаях болезненны. Постепенно, а иногда быстро увеличиваясь, они сливаются в крупные конгломераты. У некоторых больных возникают боли в увеличенных лимфатических узлах после приема алкоголя.
У 15-20% больных лимфома Ходжкина начинается с увеличения лимфатических узлов средостения. Это увеличение может быть случайно обнаружено при флюорографии или проявиться в поздние сроки, когда размеры конгломерата значительны, кашлем, одышкой и симптомами сдавления верхней полой вены (отечность и синюшность лица, одышка), реже – болями за грудиной.
В единичных случаях лимфома Ходжкина начинается с изолированного поражения параортальных (забрюшинных, расположенных вдоль позвоночника) лимфатических узлов. Больной жалуется на боли в области поясницы, возникающие главным образом ночью. У 5-10% больных лимфома Ходжкина начинается остро с лихорадки, ночных потов, быстрого похудания. Обычно в этих случаях незначительное увеличение лимфатических узлов появляется позднее; заболевание сопровождается ранней лейкопенией и анемией (малокровием).
В период развернутых проявлений лимфомы Ходжкина возможно поражение всех лимфоидных органов и всех органов и систем организма. Селезенка поражается у 25-30% больных с первой – второй клинической стадией, диагностированной до спленэктомии. Поражение вальдейерова кольца – миндалин и лимфоидной ткани глотки – при лимфоме Ходжкина наблюдается редко.
Наиболее часто помимо лимфатических узлов лимфома Ходжкина поражает легочную ткань. В легких возможен как инфильтративный рост из лимфатических узлов средостения, так и развитие отдельных очагов или диффузных инфильтратов, иногда с распадом и образованием полостей. Поражения легких могут не сопровождаться выраженными клиническими симптомами. Довольно часто при лимфоме Ходжкина обнаруживается скопление жидкости в плевральных полостях.
Как правило, это признак специфического поражения плевры, иногда видимого при рентгенологическом исследовании. При этом в плевральной жидкости обнаруживаются лимфоидные и ретикулярные клетки, а также клетки Березовского-Штернберга. Поражение плевры встречается обычно у больных лимфогранулематозом с увеличенными лимфатическими узлами средостения или с очагами в легочной ткани. Опухоль в лимфатических узлах средостения может прорастать в перикард, миокард, пищевод, трахею.
Костная система – столь же частая, как и легочная ткань, локализация заболевания (рентгенологически приблизительно у 20% больных) при всех гистологических вариантах. Чаще поражаются позвонки, затем грудина, кости таза, ребра, реже – трубчатые кости. Вовлечение в процесс костей проявляется болями, рентгенологическая диагностика обычно запаздывает. В единичных случаях поражение кости может стать первым видимым признаком лимфогранулематоза.
Специфическое поражение костного мозга может обусловить снижение количества лейкоцитов и тромбоцитов в крови, анемию или остается бессимптомным.
Поражение печени из-за больших компенсаторных возможностей этого органа обнаруживается поздно. Печень обычно увеличивается, повышается активность щелочной фосфатазы, снижается альбумин сыворотки. Желудочно-кишечный тракт, как правило, страдает вторично в связи со сдавлением или прорастанием опухоли из пораженных лимфатических узлов. Однако в отдельных случаях встречается поражение желудка и тонкой кишки. Процесс обычно затрагивает подслизистый слой, язвы не образуется.
Иногда встречаются поражения центральной нервной системы, главным образом спинного мозга. Они локализуются в мозговых оболочках и дают серьезные неврологические расстройства вплоть до полного паралича. Весьма часты при лимфоме Ходжкина разнообразные изменения кожи: расчесы, аллергические проявления, реже бывают специфические поражения кожи опухолью. Лимфома Ходжкина может поражать почки, молочную железу, яичники, вилочковую железу, щитовидной железу, мягкие ткани.
Лихорадка при лимфоме Ходжкина многообразна. Довольно часто встречаются ежедневные кратковременные подъемы температуры. Они начинаются с озноба, заканчиваются проливным потом, но обычно легко переносятся больным. Лихорадка на первых порах купируется индометацином или бутадионом.
Большая или меньшая потливость отмечается почти всеми больными. Проливные ночные поты, заставляющие менять белье, часто сопровождают периоды лихорадки и указывают на тяжелое течение заболевания. Часто одним из симптомов заболевания является похудание.
Кожный зуд бывает приблизительно у 25-35% больных лимфомой Ходжкина. Его выраженность весьма различна: от умеренного зуда в областях увеличенных лимфатических узлов до распространенного дерматита с расчесами по всему телу. Такой зуд очень мучителен для больного лимфомой Ходжкина, лишает его сна, аппетита, приводит к психическим расстройствам.
Специфических для лимфомы изменений в клиническом анализе крови не существует. У большинства больных лимфомой Ходжкина отмечается умеренный лейкоцитоз. На поздних этапах, как правило, наблюдается снижение количества лимфоцитов в крови.
Диагноз "лимфома" устанавливается исключительно при гистологическом исследовании лимфатических узлов, полученных в результате операции, называемой биопсией пораженных лимфатических узлов или опухоли. Диагноз "лимфома" считается доказанным только в том случае, если при гистологическом исследовании найдены специфические многоядерные клетки Штернберга (синонимы – клетка Березовского-Штернберга или Штернберга-Рид). В сложных случаях необходимо иммунофенотипирование. Цитологического исследования (пункция опухоли или лимфатического узла) обычно недостаточно для установки диагноза.
- Биопсия лимфатического узла
- Общий анализ крови
- Биохимический анализ крови
- Рентгенография легких – обязательно в прямой и боковой проекциях
- Компьютерная томография средостения для исключения невидимых при обычной рентгенографии увеличенных лимфатических узлов в средостении в первом случае и поражения легочной ткани и перикарда
- Ультразвуковое исследование всех групп периферических, внутрибрюшных и забрюшинных лимфатических узлов, печени и селезенки, щитовидной железы при больших лимфатических узлах шеи
- Трепанбиопсия подвздошной кости для исключения поражения костного мозга
- Скенирование костей и при показаниях – рентгенография костей
Локальное поражение нескольких групп лимфатических узлов лимфомой Ходжкина можно излечить с применением лучевой терапии (облучения). Применение полихимиотерапии и комбинирование полихимиотерапии с лучевой терапией позволяют излечить пациентов и при генерализованном процессе (III-IV стадии заболевания).
Лучевую терапию в виде рентгенотерапии начали применять при лимфоме Ходжкина еще в 1902 году. Принципы излечивающей лучевой терапии впервые обосновал Гилберт в 1928 году. В последующем была предложена концепция радикальной лучевой терапии, при которой облучаются все лимфатические узлы. В настоящее время известны 2 модификации радикального облучения при лимфоме Ходжкина: многопольное, с последовательным облучением относительно большими полями пораженных лимфатических узлов и зон субклинического (не определяемого при обследовании) распространения, и крупнопольное, или мантиевидное, когда патологические и субклинические зоны облучаются практически одномоментно.
Лимфома Ходжкина стала одним из первых онкологических заболеваний, при котором была показана возможность излечения большой группы больных. Если в начале 40-х годов 5 лет переживало лишь 5% больных с лимфомой Ходжкина, то при использовании современных программ лечения двадцатилетняя безрецидивная выживаемость составляет 60%, а в группе больных с локальными стадиями достигает 80-90%.
Радикальная лучевая терапия длительное время была основным методом лечения I-III стадий лимфомы Ходжкина, но в настоящее время этот метод лечения успешно используется в группе больных с локальными стадиями и очень благоприятным прогнозом. Это небольшая группа больных с IA – IIА стадиями лимфомы Ходжкина, преимущественно женщины моложе 40 лет, без факторов риска. Полные ремиссии при использовании радикальной лучевой терапии индуцируются у 93-95% этих больных, 5-летнее безрецидивное течение достигает 80-82%, а 15-летняя общая выживаемость – 93-98%.
При применении только цикловой полихимиотерапии у больных с любой стадией лимфомы Ходжкина лечение следует проводить до достижения полной ремиссии, после чего необходимо провести, как минимум, два консолидирующих (закрепляющих) цикла. Полная ремиссия у больных лимфомой Ходжкина с благоприятным и промежуточным прогнозом после 3 циклов полихимиотерапии достигается не более чем у 50% больных, а у больных с распространенными стадиями заболевания этот рубеж преодолевается после 6 циклов полихимиотерапии, поэтому необходимый минимум всей программы лечения составляет не менее 6 циклов, но может достигать и 12 циклов.
При использовании только полихимиотерапии полные ремиссии достигаются у 70-85% больных лимфомой Ходжкина, а 20-летняя безрецидивная выживаемость составляет 60%. Однако у 40% больных лимфомой Ходжкина возникают рецидивы. В отличие от лучевой терапии, где рецидивы чаще возникают в новых зонах, после полихимиотерапии рецидивы чаще отмечаются в исходных зонах поражения.
Совмещение в одной программе лечения полихимиотерапии с лучевой терапией не только улучшило общую выживаемость больных лимфомой Ходжкина, но и позволило в 3-4 раза сократить число рецидивов (до 10-12%).
В процессе лечения у больных лимфомой Ходжкина могут развиваться нежелательные побочные явления как при проведении химиотерапии (общая слабость, тошнота, рвота, выпадение волос, снижение показателей крови, инфекции), так и лучевой терапии (покраснение кожи в поле облучения и другие). Правильное проведение процедур и следование рекомендациям лечащих врачей позволяют минимизировать количество осложнений от проводимого лечения лимфомы Ходжкина и не отказываться от привычного ритма жизни в ходе терапии.
Профессор А.В. Пивник, 2008 г.
Читайте также:

