Отрицательная динамика при раке молочной железы
Трижды негативный рак молочной железы является весьма враждебной злокачественной опухолью. Такой рак вступает в единичную категорию онкологических заболеваний, он наиболее враждебный по сопоставлению с иными образованиями груди. Главным показателем присутствия трижды негативного рака груди является непрерывный островоспалительный процесс.

Особенности трижды негативного рака
Онкология выражается в виде долгого воспалительного процесса. Многочисленные потомственные формы болезни причисляются к предоставленной группе. Он имеет различные подтипы и категории, что дают вероятность досконально подвергать анализу его формирование и составить результативный план лечения.
Онкологическая болезнь в груди характеризована отрицательным мониторингом. Однако, при оперативном вмешательстве без рецидивного течения на протяжении 5 лет, мониторинг выживаемости такой же, как и при иных конфигурациях злокачественного течения. В целом, трижды отрицательный рак грудных желез имеет более агрессивный курс. Часто эта болезнь проистекает быстро и статистика отечественного здравоохранения неутешительная. Выживать сложно при трижды негативном раке, смертность повышена.
Многие ученые расходятся в научных теориях и своих публикациях по тому, откуда берется рак груди. В настоящее время единогласно могут лишь подтвердить, что есть факторы, которые его вызывают. В последние годы наблюдается динамический рост знаний в науке о трижды негативном раке, развитии диагностики и новых терапевтических возможностях в отношении рака груди. По мнению экспертов специализированные центры способны обеспечить пациентам с трижды негативным раком правильный диагноз, который оптимально можно излечивать.

Причины появления болезни
Развитие карциномы сопряжено с разными преобразованиями в организме. Основной причиной бывает гормональная коррекция (производство эстрогена, прогестерона убавляется лекарствами, яичники находятся в неактивном режиме), менструации в раннем возрасте, либо нарушения цикла. Положительный фон для формирования трижды негативного рака создает излишек гормонов. Беременность, кормление грудью и аборты кроме того формируют гормональную активность, повышая риски формирования патологического состояния.
Для реальной оценки риска РМЖ предусматриваются более значимые условия:
- Запоздалая менопауза.
- Поздние роды и их отсутствие.
- Женщины старше 55 лет.
- Наследственность.
- Мутации гена.
- Иммунофенотип больной.
- Атипичная гиперплазия ткани груди.
- Долгосрочное применение оральных контрацептивов.
- Заместительная гормональная терапия.
- Различные травмы и дефекты груди.
Наличие указанных условий не является опасностью, однако повышает угрозу формирования болезни. Однако неимение данных условий не является залогом абсолютного здоровья. Стоит знать, что разные доброкачественные воспаления формируют положительный фон для течения трижды негативного рака. Конституциональное ожирение и микрооблучение груди при иных болезнях (опухоль легкого, нарушение лимфатической системы) увеличивают риск болезни.

Симптомы трижды негативного рака
Симптомы болезни в существенной степени формируются причинами его происхождения. Медицинская картина заболевания сопряжена с гистологическими чертами опухоли. Признаки болезни похожи на проявления иных видов злокачественных образований. В груди есть уплотнение, что на ранней стадии безболезненно. По мере формирования опухоли сосок убирается, кожа ухудшается, меняется форма груди, появляется красноватая жидкость из груди.
Трижды негативный рак с определенным патоморфозом зачастую встречается в 40-60 лет. Особенности болезни схожи с проявлением мастопатии. Образование в груди состоит из негативных базальных клеток, грудь подвергается повреждению близких и дальних лимфоидных участков. Заболевание тяжело поддается полному лечению, что сопряжено с невысокой восприимчивостью онкологических клеток к медицинским препаратам.
Присутствие характерных признаков трижды негативного рака дает возможность раскрыть опухоль на ранней стадии и начать терапию своевременно. Поначалу новообразование имеет незначительные объемы и повышенную подвижность. Раковые клетки стремительно возрастают в объемах и приводят к проявлению боли в груди. Наличие данных особенностей должно стать предлогом для похода к доктору, который будет правильно вылечивать трижды негативный рак.

Диагностика заболевания
Диагностировать трижды негативный рак груди трудно. Это сопряжено с тем, что его нечасто можно определить с поддержкой традиционных инструментальных способов, что применяются для контроля патологии железы.
В первый раз женщина может проконсультироваться с доктором о том, что она нашла образование в груди. Оно может быть безболезненным и может спровоцировать только некоторые неудобства. Доктор, как правило, отправляет на маммографию, однако, заключение трижды отрицательного инвазивного рака груди не базируется на информации этого исследования.
Надежная информация для диагностирования данного заболевания дается только лишь посредством иммуногистохимического и микроскопического обследования трижды негативного рака, приобретенного в результате биопсии. Такие диагностические мероприятия помогают целиком оценить негативные перемены в тканевых клетках и сформировать примерное предположение того, как трижды негативный рак будет осуществлять свое развитие далее.
В этом случае при отличительной диагностике нет потребности дисконтировать показатели традиционного анализа, а кроме того сведения методов инструментальных. Они, безусловно, не определят форму болезни, однако, покажут локализацию и объем опухоли.

Инструментальный способ диагностики онкологической болезни складывается из комплекса исследовательских процедур и ведется с соответствующими медицинскими показаниями. Наиболее современным способом диагностики трижды негативного рака груди является маммография либо ультразвук. Данные 2 этапа дают возможность определять всевозможные перемены и уплотнения в железе. Изотопное сканирование и молекулярный метод производится для раскрытия клинических метастазов на поздних стадиях онкологии.
Проводятся анализ крови для онкомаркеров — белков, что продуцируются опухолью. Для того чтобы определить тройную отрицательную форму. Определение рака ведется путем сдачи анализа на гормоны. 2-ой способ в ходе исследовательских процедур — биопсия. Этот вид исследования дает возможность установить вид образования, то есть хорошего либо злокачественного типа опухоль.
Известно, что это заболевание подобно другому раку груди. И для его диагностики применяется масса разных способов проведения исследований. Для диагностики рака ведется ультразвук, биопсия тонкой иглой.Также проводится скрининг-тест. Вероятно выявление многочисленных кистозных образований при проведении ультразвука. С целью дифференциации ведутся доктография и цитологическое обследование.

Осложнения
Описанная патология представляется одной из более негативных разновидностей злокачественных опухолей, что нередко сопутствуются осложнениями.
Более обычными из них представлены:
- метастазирование — образование второстепенных опухолевых источников
- интоксикация — отравление организма продуктами жизнедеятельности и разрушения онкологических клеток
- крайнее истощение больного
- гидроторакс — возникновение жидкости в плевральной полости, см. фото
- легочное кровоизлияние
- грубые патологии центральной нервной системы — паралич и др
- отказ печени
- слепота
Также могут появиться осложнения в результате лечения трижды негативного рака.

Лечение патологии
Этот тип опухоли трудно преодолеть, в данном случае гормональная терапия неэффективная и гистология продолжается. Следовательно первое место захватывает химиотерапия и вторжение хирурга (операция). Впоследствии удаления опухолевой части с сохранением части тела как правило прописывается курс терапии лучами и больная начинает выздоравливать.
Конкретный лечебный порядок разрабатывается персонально, принимая во внимание:
- расположение и морфология опухоли, ее объем и распространение процессов (стадии)
- уровень нетипичных клеток (фаза злокачественности)
- общее состояние женщины
Химиотерапия, когда трижды негативный рак, предоставляется пациенту циклически лечиться. Период применения лекарств заменяется периодом прерывания их использования, при котором восстанавливается количество крови.
Это заболевание чувствительно к воздействию цитостатиков и ими нужно лечить – они заболевание стремительно побеждают. Тем не менее данный вид образования склонен к ранним рецидивам, и снова образующийся центр обретает стойкость к прежде используемым химиотерапевтическим веществам. Следовательно состав и порядок химиотерапии таблетками следует поменять, однако, к сожалению, не всегда данные перемены приводят к позитивному итогу.
Цитотоксические средства допускается назначать как до процедуры (неоадъювантная химиотерапия), так и повторно впоследствии удаления негатив клеток груди (адъювантная химиотерапия). В первоначальном случае химотерапия ориентирована на снижение объема опухоли, чтобы упростить и облегчить дальнейшее вторжение, в другом — избежать образование метастазов.

В альтернативной медицине используют народные средства для лечения трижды негативного рака груди, показывающие стабильную динамику уничтожения онкологии. Получать их при раке разрешается по персональной рекомендации сертифицированного онколога, в то время как принципиально не забывать о возможных последствиях, второстепенных результатах. В собственном естественном составе могут быть токсичные растения, что, в случае если нарушаются ежедневные нормы, провоцируют интоксикацию женского организма. Народные лекарственные средства от рака могут быть полезны и могут причинить вред.
Лечение triple рака разными народными средствами отражается негативным образом, но бывает что оно содействует возобновлению организма после долгого влияния болезнетворных условий. Продуктивная терапия рака груди с поддержкой народных средств — это не только лишь применение лекарств, основанных на растительных ядах. Также разумно использовать травяные средства с мягким эффектом на очаговые воспаления. Пить подобные нетрадиционные лекарства следует около месяца и длительнее, однако персональная консультация с онкологом требуется обязательно. Врач будет обозначать курс.

Если триплнегативное новообразование было обнаружено на ранних стадиях и уровень его агрессивности небольшой, может выполняться так именуемая люмпэктомия. Это устранение фрагмента груди, имеющей поражения с захватом располагающихся рядом здоровых материй. В случае если рак обнаружили на поздней стадии, грудь целиком удаляется. В случае когда своевременно найден этот тип болезни и позитивный мониторинг, грудь может быть удаленнной не целиком. Зачастую, и в этом, и в другом случае лимфоузловые участки, расположенные рядом также вырезаются.
Прогноз заболевания может обозначаться отрицательным, даже в случае если можно было обнаружить опухоль железы своевременно. Это сопряжено с большим риском метастазов и быстрым формированием заболевания.
Выживание при тройном отрицательном раке груди низкое. У больных, получивших данный диагноз, в течение следующих 5 лет имеется большой риск не только лишь метастазов, но и преддиагностика патологии. Выживаемость увеличивается, в случае когда больной предоставляется химиотерапия и терапия лучевая, что может устранять онкологические клетки.
Профилактические меры
Предотвращение рака груди является прежде всего регулярным самоанализом. В другом случае, конечно же, нужно своевременное обращение к экспертам иначе прогноз трижды негативного рака молочной железы будет неутешительный. Обнаруженное на раннем этапе онкозаболевание молочной железы даст возможность своевременно активизировать противораковую терапию и достигнуть предельно возможных позитивных итогов лечения, не дать болезни рецидивировать.
Вылечиваться полностью может быть сложно если не вовремя обратиться к врачу. Постоянная проверка с учетом условий риска в любом отдельном случае является залогом того, что заболевание может быть диагностировано раньше, тем самым снижая негативный прогноз. Как говорят отзывы, возможно восстановление, а не смерть.
Рак молочной железы отличается высокой чувствительностью к лекарственному воздействию.
Этим объясняется применение лекарственной терапии в качестве неоадъювантной терапии перед операцией, а также как самостоятельного метода лечения.
Эффективность предоперационной терапии может служить одним из критериев прогноза при местнораспространенном раке молочной железы. Также известно, что при выраженном клиническом эффекте рецидивы и метастазы возникают реже и сроки их появления удлиняются.
Использовать предоперационную химиотерапию стали сравнительно недавно (с 1960 г.), но полученные данные о высокой 5-летней выживаемости у таких больных подтвердили правильность выбранной тактики лечения.
Причем на прогнозирование эффекта от лекарственного лечения не влияют ни степень злокачественности, нигистологическая форма рака молочной железы (РМЖ). Нечувствительность к предоперационной химиотерапии является фактором плохого прогноза при РМЖ, причем именно морфологически определяемый полный эффект лечения имеет значение для прогноза болезни.
Клинически определяемый эффект и размер остаточной опухоли существенно не влияют на прогноз безрецидивной и общей выживаемости. У больных с III стадией рака молочной железы после предоперационной химиотерапии и операции поражение регионарных лимфатических узлов имело относительное значение: безрецидивная и общая выживаемость при отсутствии метастазов и поражении 1-3 лимфатических узлов различий не имели.
Проведение предоперационной химиотерапии позволяет перевести до 95% больных РМЖ T4N1M0 в операбельное состояние. Значимость эффекта при использовании неоадъювантной химиотерапии для прогноза болезни (рак молочной железы II-III стадий): отдаленные метастазы в первые два года появились у 4% леченных с эффектом, у 38% леченных со стабилизацией и у 100% больных с прогрессированием опухоли на фоне лечения.
Эффективность лечения
Эффективность лечения принято оценивать по разработанным комитетом экспертов ВОЗ критериям:
• Полная ремиссия — полное исчезновение проявлений опухолевого заболевания при клиническом и инструментальном исследовании.
• Частичная ремиссия — уменьшение размеров опухоли не менее, чем на 50%.
• Стабилизация — уменьшение менее, чем на 50% при отсутствии новых поражений или увеличение не более, чем на 25%.
• Прогрессирование — увеличение размеров опухоли на 25% и более или появление новых очагов поражения.
Достаточно часты ошибки в клинической оценке эффекта химиотерапии. Случаи, рассматриваемые клинически как полный эффект, при морфологическом исследовании нередко оцениваются иначе.
Маммография — метод исследования, на который традиционно опираются при оценке размеров первичной опухоли, оказался не самым лучшим для определения размеров опухоли в процессе предоперационного лечения.
Клиническое измерение и ультразвуковая томография лучше оценивают динамику размеров опухоли, чем маммография, тем более, если учитывать нежелательность частой лучевой нагрузки.
С целью оптимизации трактовки данных ультразвукового исследования, выделена группа наиболее информативных признаков, которые позволяют судить об эффективности лечения.
Критериями эффективности лечения рака молочной железы, которые получены при помощи ультразвуковой томографии в В-режиме, являются: изменение размеров и интенсивности отражений от структуры опухоли, выраженность дорсального эффекта.
При положительном эффекте наблюдается уменьшение размеров (43%), а повышение интенсивности отражений ультразвуковых волн от опухоли (61%) и ослабление дорсального эффекта (47%) возникает вследствие развития фиброзных изменений (Рис.7.1 а,б,в — Рис.7.5 а,б) как проявление лечебного патоморфоза.

Рис.7.1 а,б,в. Варианты эхографического изображения рака молочной железы. Положительный эффект от лечения. В-режим.

Рис.7.2 а,б,в. Варианты эхографического изображении рака молочной железы. Положительный эффект от лечения. В-режим.

Рис. 7.3 а,б,в. Варианты эхографического изображении рака молочной железы. Положительный эффект от лечении. В-режим — а,б. Режим энергетической допплерографии (ЭД) — в1.

Рис.7.4 а,б. Варианты эхографического изображения рака молочной железы. Положительный эффект от лечения. В-режим.

Рис.7.5 а,б,в. Варианты эхографического изображения рака молочной железы: а,б — положительный эффект от лечения, В-режим; в — отрицательный эффект от лечения (в — В-режим, в1 — режим ЭД).
Отрицательный эффект от лечения отмечается при увеличении размеров опухоли (Рис.7.5 в, Рис.7.6 а,б,в, Рис.7.7 а), метастазов либо при появлении ранее не определяемых метастазов.

Рис.7.6 а,б,в. Варианты эхографического изображении рака молочной железы. Отрицательный эффект от лечении. В-режим.

Рис.7.7 а,б,в. Варианты эхографического изображения рака молочной железы в В-режиме: а — отрицательный эффект от лечения: б,в — без динамики от лечения.
Контуры, границы и структура опухолевого образования молочной железы не могут быть достоверными критериями оценки эффективности, так как они практически не изменяются в ходе лечения в большинстве случаев — 86%, 90% и 92% соответственно.
Таким образом, используя только эти признаки, нельзя достоверно судить об эффективности проводимой терапии.
При отсутствии изменений размеров опухолевого узла либо незначительном их уменьшении или увеличении (на 1-3 мм), что наблюдается обычно после первых двух курсов, состояние характеризуется как стабилизация. В ультразвуковом заключении указывается — без динамики в сравнении с предыдущим исследованием (Рис.7.7 б, в).
Для выработки ультразвуковых критериев эффективности лечения оценивается не только динамика состояния опухолевого узла в В-режиме, но и изменения васкуляризации и гемодинамических показателей внутриопухолевых сосудов.
При отсутствии какой-либо динамики изменений кровотока не наблюдается, а в случае усиления параметров кровотока, сопровождающегося увеличением количества сосудов, констатируется отрицательная динамика (Рис.7.8 а,б).

Рис.7.8 а,б. Варианты эхографического изображения рака молочной железы. Отрицательный эффект от лечения. Режим энергетической допплерографии.
Уменьшение либо отсутствие васкуляризации отмечается при положительном эффекте от лечения (Рис.7.9 а,б,в).

Рис.7.9 а,б,в. Варианты эхографического изображения раки молочной железы. Положительный эффект от лечения. Режим ЭД.
Полученные при анализе ультразвуковых томограмм данные были сопоставимы с клиническими признаками лечебного эффекта.
Таким обрати, изменение характера васкуляризации может служить надежным критерием эффективности лечении.
Спектральные характеристики
Спектральные характеристики кровотока коррелируют со степенью лечебного патоморфоза, а именно, чем выраженнее лечебный эффект, тем ниже значения всех спектральных параметров вне зависимости от морфологического варианта опухоли.
На представленных томограммах отмечено уменьшение спектральных показателей при положительном эффекте от лечения (Рис.7.10 а-г) и соответственное увеличение — при отрицательном (Рис.7.10 д).

Pиc.7.10 а,б,в,г,д. Варианты эхографического и изображения рака молочной железы в импульсно-волновом режиме. а-г — спектограмма внутриопухолевого кровотока: уменьшение спектральных показателей при положительной динамике. д — спектограмма внутриопухолевого кровотока: увеличение спектральных показателей при отрицательной динамике.
Методически исследование состояло в сравнивании средних значений спектральных параметров, но, учитывая вариабельность полученных показателей, низкую чувствительность методики, длительность в проведении исследования и анализе результатов, импульсно-волновой режим не оправдал ожидаемых результатов и совершенно спокойно может не использоваться в оценке эффективности лечения.
Показаны томограммы с равными значениями спектральных параметров (Рис.7.11 а,б) либо их увеличением (Рис.7.11 в,г,д), несмотря на уменьшение размеров опухоли.

Рис.7.11 а,б,в,г,д. Варианты эхографического изображения рака молочной железы и импульсно-волновом режиме. а,б — спектограмма внутриопухолевого кровотока: спектральные показатели не изменились при положительном эффекте от лечения. в,г,д — спектрограмма внутриопухолевого кровотока: спектральные показатели увеличились при положительном эффекте от лечения.
Полный эффект от лечения или полная ремиссия, заключается в исчезновении опухолевого узла, подтверждающегося всеми методами диагностики. При ультразвуковом исследовании узел не определяется, либо в месте ранее определяемой опухоли в редких случаях может определяться участок в виде тяжа с нечеткими контурами (Рис.7.12 а,б,в,г).

Рис.7.12 а,б,в,г. Варианты эхографического изображения рака молочной железы в В-режиме. а,б — участок с нечеткими контурами на месте определяемого узла. в,г — полная ремиссия.
На их месте может продолжать определяться образование различной эхогенности, чаще неоднородное, без гипоэхогенных включений, в структуре которого уже нет опухолевых клеток.
Г.Т. Синюкова, Г.П. Корженкова, Т.Ю. Данзанова

- Отделение анестезиологии и реанимации
- Метастазы рака
- Химиотерапия
- Хоспис для онкологических больных
- Иммунотерапия в центре платной онкологии Медицина 24/7
- КТ-исследования
- МРТ-исследования
Рак молочной железы является наиболее часто встречающимся злокачественным заболеванием у женщин и, по данным мировой статистики, достигает 22,9%. Заболеваемость РМЖ неуклонно возрастает, несмотря на снижение смертности от него благодаря внедрению скрининга и эффективной системной химиотерапии [1,2,3].
Трижды негативный РМЖ (ТНРМЖ) составляет около 8–20% всех опухолей молочной железы; встречается чаще у женщин молодого возраста (до 50 лет) до наступления менопаузы, у женщин с ранним менархе, первой беременностью в более раннем возрасте, коротким периодом грудного вскармливания, повышенным индексом массы тела [4,5,6,7].
ТНРМЖ характеризуется отсутствием экспрессии РЭ, РП и , что существенно затрудняет лечение этого типа рака. Он представляет собой подтип опухолей с высоким риском прогрессирования заболевания, а также особым характером метастазирования, что приводит к раннему поражению внутренних органов и ЦНС. По результатам крупнейшего исследования, в которое были включены 12 858 больных ТНРМЖ, наиболее частой локализацией гематогенных метастазов оказались: головной мозг и легкие (соотношение вероятностей составило 5,32 и 2,27 соответственно), а метастатическое поражение костей оказалось в конце списка с отношением вероятностей — 0,23 [8,9,10,11].
Цель исследования
Анализ непосредственных и отдаленных результатов комплексного лечения больных ТНРМЖ.
Материалы и методы
В исследование было включено 128 больных с операбельным ТНРМЖ со сроком наблюдения 5 лет, находившихся на обследовании и лечении в ГБУЗ ОКД № 1 ДЗМ в период с 2006 по 2008 г. При составлении характеристики пациенток было выявлено, что медиана возраста больных составила 57 лет (от 31 года до 83 лет).
По данным гистологического исследования, у пациенток преимущественно встречался инфильтративный протоковый рак — 107 (83,6%).
Инфильтративный дольковый рак был верифицирован — у 14 (10,9%) больных, а инфильтративный — у 7 (5,5%) пациенток.
В подавляющем количестве случаев у больных была 3 степень злокачественности опухоли — 69 (53,9%) пациенток. 2 степень злокачественности опухоли — у 56 (43,8%) больных, а 1 степень — у 3 (2,3%) пациенток.
Большинство пациентов, по данным иммуногистохимического исследования, имели высокий индекс пролиферативной активности ( > 19%) — 119 (93%). В 9 случаях (7%) индекс пролиферативной активности был меньше 19. Таким образом, пациентки, включенные в исследование, характеризовались совокупностью неблагоприятных признаков: в 93% случаев опухоли характеризовались высоким индексом пролиферативной активности и в 97,7% случаев — 2–3 степенью злокачественности (рис. 1).
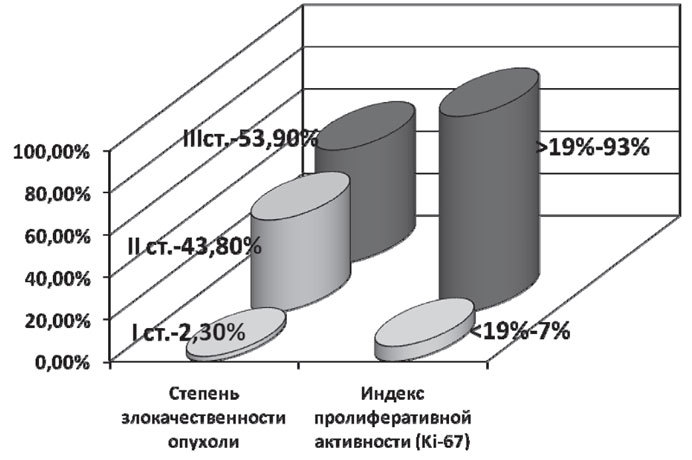
Рис. 1. Частота неблагоприятных признаков у больных с ТНРМЖ
На хирургическом этапе комплексного лечения пациенток с ТНРМЖ были выполнены четыре вида оперативных вмешательств: радикальная резекция молочной железы, радикальная мастэктомия по Мадден, радикальная мастэктомия по Пейти, радикальная мастэктомия по Холстеду.
В 97 случаях (75,8%) из 128 хирургическое лечение было проведено на первом этапе комплексного лечения. Распределение по стадиям этих пациенток представлено на рисунке 2.
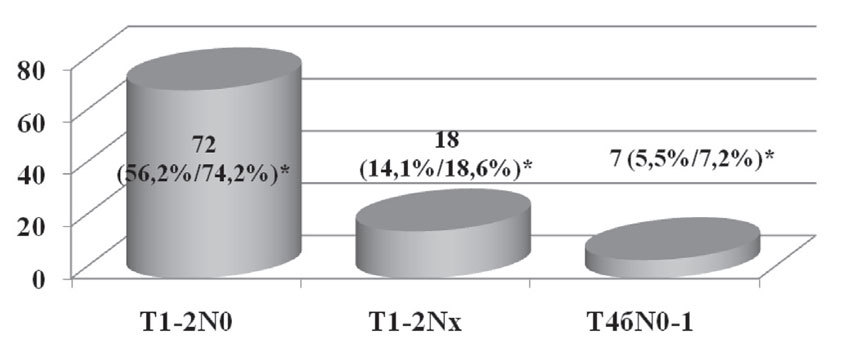
Рис. 2. Пациентки, которым хирургическое лечение было проведено на первом этапе комплексного лечения в зависимости от стадии заболевания
* % от общего числа пациенток / % от числа пациенток, которым проводилось хирургическое лечение не первом этапе
Неоадъювантная химиотерапия как составляющая комплексного лечения была проведена 31 пациентке (24,2%) по следующим показаниям: наличие верифицированных метастазов в регионарные (подмышечные и/или подключичные) лимфоузлы и/или форма рака молочной железы (рис. 3).
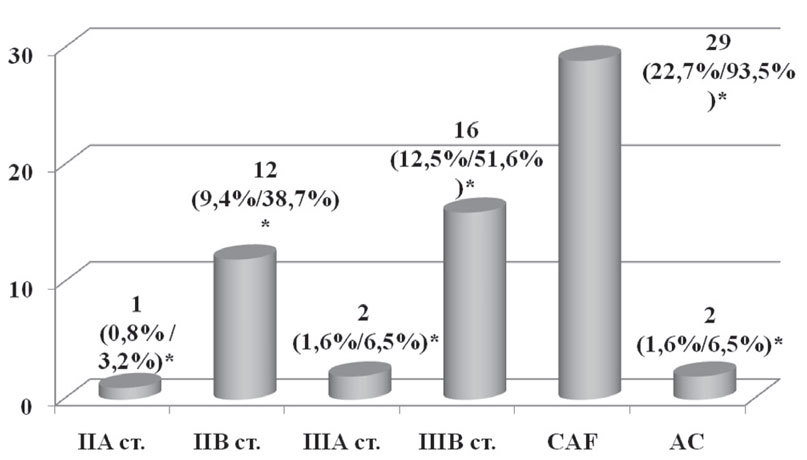
Рис. 3. Неоадъювантная химиотерапия в зависимости от стадии заболевания и схемы химиотерапии
*— % от общего числа пациенток / % от числа пациенток, которым проводилась неоадъювантная химиотерапия
Для проведения неоадъювантной химиотерапии применялись две схемы химиотерапии:
- схема — CAF (циклофосфан 600 мг/м2 + доксорубицин 50 мг/м2 + 600 мг/м2) была применена 29 пациенткам, из них в 28 случаях было проведено 2 курса и 1–3 курса химиотерапии;
- схема — AC (доксорубицин 50 мг/м2 + циклофосфан 600 мг/м2) была назначена 2 пациенткам, которым было проведено 4 курса химиотерапии.
Адъювантная химиотерапия была проведена 70 (54,7%) пациенткам при различных стадиях заболевания (рис. 4). Применялись 4 схемы адъювантной химиотерапии:
- схема — CAF (циклофосфан 600 мг/м2 + доксорубицин 50 мг/м2 + 600 мг/м2), была проведена 46 пациенткам (65,8%), из них 38 больным (54,3%) было выполнено 4 курса и 8 (11,5%) — 6 курсов химиотерапии;
- 2 схема — AC (циклофосфан 600 мг/м2 + доксорубицин 50 мг/м2), была назначена 16 пациенткам (22,8%), из них 11 (15,7%) — 4 курса и 5 (7,1%) — 6 курсов химиотерапии;
- схема — 600 мг/м2 + доксорубицин 50 мг/м2, была применена 5 пациенткам (7,1%), в количестве 4 курсов химиотерапии;
- схема — абитаксел 175 мг/м2 + доксорубицин 50 мг/м2, была проведена 3 пациенткам (4,3%), в количестве 4 курсов химиотерапии.
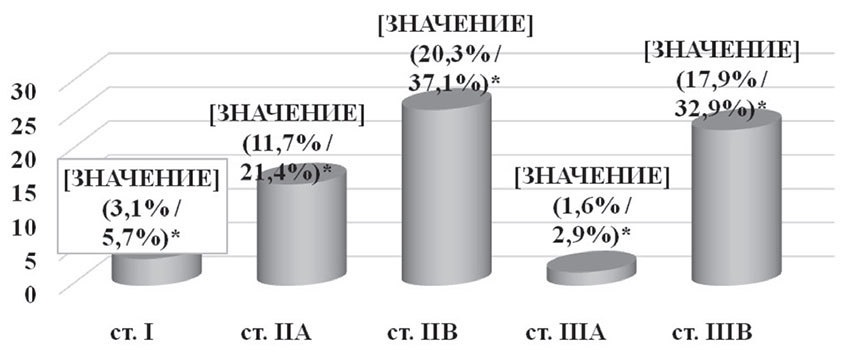
Рис. 4. Адъювантная химиотерапия в зависимости от стадии заболевания
*— % от общего числа пациенток / % от числа пациенток, которым проводилась адъювантная химиотерапия
Лучевая терапия как составляющая комплексного лечения пациенток с ТНРМЖ проводилась как в предоперационном, так и в послеоперационном периоде.
Основными показаниями к назначению лучевой терапии являлись: возможность выполнения органосохраняющего хирургического лечения (радикальная резекция молочной железы); наличие метастазов в 4 и более регионарных (подмышечных и/или подключичных) лимфоузлах, не спаянных между собой; наличие метастатического конгломерата лимфоузлов до начала лечения; форма РМЖ.
Предоперационная лучевая терапия была проведена 2 пациенткам (1,6% от общего числа).
Одной больной (0,8% от общего числа) с РМЖ стадии II В. — T2N1M0 с целью уменьшения размеров первичной опухоли в суммарной очаговой дозе (СОД) — 20 Гр.
Другой пациентке (0,8% от общего числа) — при РМЖ стадии IIIБ — T4бN2M0 с целью уменьшения отека молочной железы, по результатам проведения неоадъювантной химиотерапии была выявлена стабилизация, в СОД — 25 Гр.
Послеоперационная лучевая терапия была проведена 39 пациенткам (30,5%).
Результаты исследования
Проведение комплексного лечения пациенток с ТНРМЖ обусловило необходимость оценки его непосредственных и отдаленных результатов.
При проведении хирургического этапа лечения пациенток с ТНРМЖ нами в послеоперационном периоде был отмечен ряд осложнений, которые были обусловлены прежде всего объемом выполненных оперативных вмешательств. В основном у пациенток были зафиксированы случаи развития лимфостаза верхней конечности — 35 случаев (27,3%); длительной лимфорреи — 18 случаев (14,1%); краевого некроза лоскута (после радикальной мастэктомии), в результате которого заживление послеоперационный раны происходило частично за счет вторичного натяжения — 2 случая (1,6%) (рис. 5).
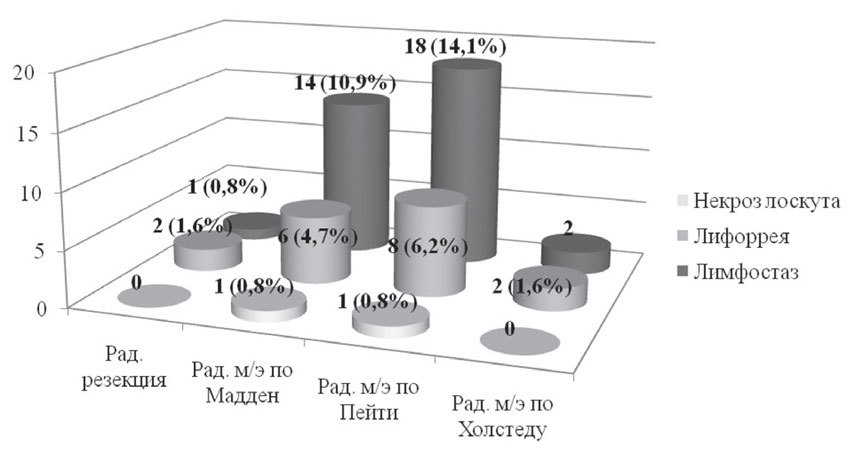
Рис. 5. Характер ранних послеоперационных осложнений в зависимости от вида хирургического вмешательства
Оценка эффективности неоадъювантной химиотерапии проводилась на основании результатов контрольного обследования (маммография и УЗИ молочных желез, подмышечных, над- и подключичных лимфоузлов) и данных о степени лечебного патоморфоза в опухоли, полученных в результате гистологического исследования операционного материала.
У 11 пациенток (35,5%) на фоне проведенной химиотерапии был достигнут полный регресс опухоли (лечебный патоморфоз степени); у 10 (32,2%) — частичная регрессия (патоморфоз степени); у 6 (19,4%) — стабилизация (патоморфоз степени); у 4 пациенток (12,9%) отмечено прогрессирование заболевания (патоморфоз степени) (рис. 6).
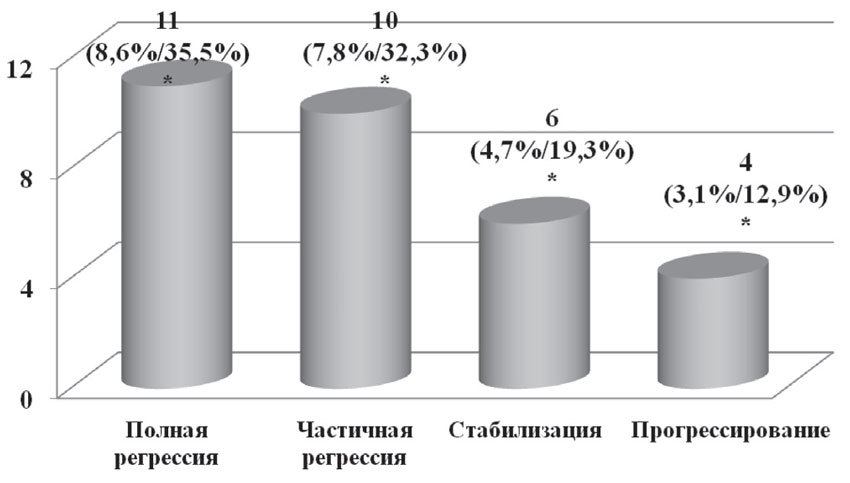
Рис. 6. Данные о лечебном эффекте неоадъювантной химиотерапии
*— % от общего числа пациенток/% от числа пациенток, у которых была выявлена данная степень лечебного патоморфоза опухоли при данной степени заболевания
Помимо оценки эффективности неоадъювантной химиотерапии были проанализированы ее побочные эффекты, которые отмечались у всех (100%) пациенток. Основными проявлениями токсичности были гематологическая токсичность (лейкопения и тромбоцитопения), тошнота, рвота, стоматит, синдром и др. Вышеуказанные побочные эффекты требовали коррегирующей симптоматической терапии, но не привели к отсрочке или отмене лечения (рис. 7).
Аналогичные результаты были получены и при оценке токсичности вышеуказанных схем адъювантной химиотерапии (рис. 7).
В двух случаях проведения предоперационной лучевой терапии был получен хороший лечебный эффект в виде частичной регрессии опухоли. Одной больной была проведена дистанционная гамматерапия в суммарной очаговой дозе 20 Гр по поводу РМЖ IIб ст., второй 25 Гр — IIIб ст.
У 39 пациенток (30,5%) на фоне проведения послеоперационной лучевой терапии отмечались следующие побочные реакции: повреждения кожи I степени были зарегистрированы у 14 больных (11,0%); cтепени — у 3 (2,4%); лучевые повреждения подкожной клетчатки I cтепени — у 34 пациенток (26,6%), а степени — у 5 (4%).
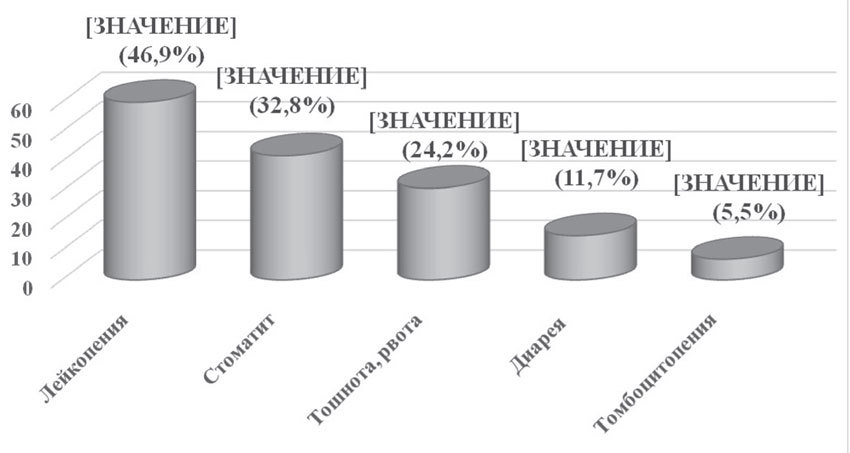
Рис. 7. Токсические реакции изученных режимов неоадъювантной и адъювантной химиотерапии
С целью оценки отдаленных результатов комплексного лечения пациенток с ТНРМЖ у 128 больных были прослежены сроки появления местных рецидивов и гематогенных метастазов в течение 5–6 лет, а также их локализация. Помимо этого была проведена оценка сроков безрецидивной и общей выживаемости (рис. 8). Все полученные данные были обработаны в программе IBM SPSS Statistics, а также при помощи расчетов по методу , что и позволило проанализировать результаты комплексного лечения пациенток с ТНРМЖ.
Из 128 пациенток у 3 (2,3%) на втором году наблюдения был выявлен локальный рецидив, медиана их появления составила 15 месяцев и 7 дней. Этим больным было проведено комплексное лечение по поводу РМЖ IIIб стадии.

Рис. 8. Отдаленные результаты комплексного лечения
В результате наблюдения в течение 5 лет у 31 пациентки (24,2%) были диагностированы гематогенные метастазы. Следует отметить, что большая их часть была выявлена на 2–3 годах наблюдения, в среднем — через 23 месяца и 6 дней от начала лечения. Локализация гематогенных метастазов была достаточно разнообразной: в 9 случаях (7,03%) гематогенные метастазы были диагностированы в костях, в 5 случаях (3,91%) — в легких, в 5 случаях (3,91%) — в надключичных лимфоузлах, в 4 случаях (3,13%) — в печени, в 3 случаях (2,34%) — в плевре, по одному случаю (0,78%) — в коже и головном мозге. У 3 пациенток (2,34%) были выявлены сочетанные метастазы: в головной мозг и кости, легкие и кости, кожу и плевру (рис. 9).
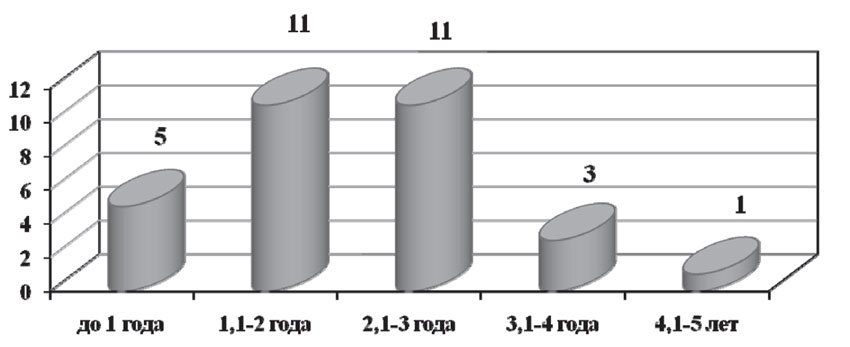
Рис. 9. Число больных с гематогенными метастазами на разных сроках наблюдения
Пятилетняя безрецидивная выживаемость у пациенток, получавших комплексное лечение по поводу ТНРМЖ, составила 75,8%: при I стадии — 28 больных (84,9%), при IIа — 34 пациентки (80,9%), при IIб — 23 случая (82,1%), при IIIа — 2 случая (100%), при IIIб — 10 больных (43,5%) (рис. 10).
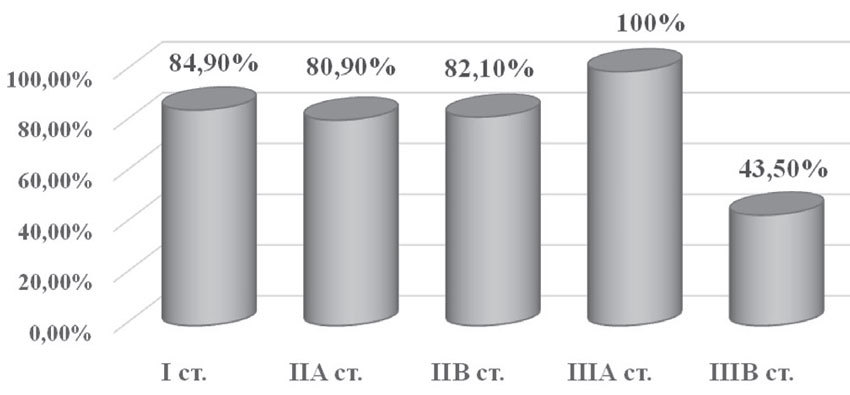
Рис. 10. Пятилетняя безрецидивная выживаемость в зависимости от стадии заболевания
Общая пятилетняя выживаемость составила 77,3%: при I стадии — 28 больных (84,9%), при IIа — 36 пациенток (90,5%), при IIб — 23 случая (82,1%), при IIIа — 2 случая (100%), при IIIб — 10 больных (43,5%). Смерть на первом году наблюдения была зафиксирована у 1 больной (0,8%) (рис. 11).
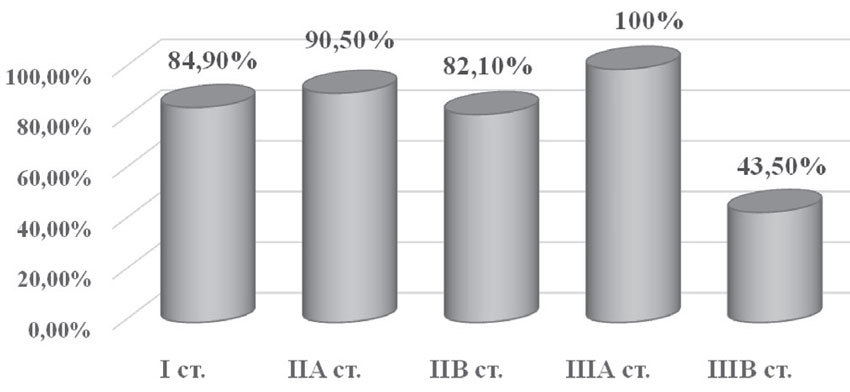
Рис. 11. Общая пятилетняя выживаемость в зависимости от стадии заболевания
Заключение
Полученные результаты свидетельствуют о высокой степени эффективности примененных нами способов диагностики и схем комплексного лечения больных с операбельной формой ТНРМЖ.
Читайте также:





