Описание клинического случая в онкологии
Аннотация научной статьи по клинической медицине, автор научной работы — Рыбакова Д.В., Давыдов М.М., Казанцев А.П., Керимов П.А., Матинян Н.В.
Похожие темы научных работ по клинической медицине , автор научной работы — Рыбакова Д.В., Давыдов М.М., Казанцев А.П., Керимов П.А., Матинян Н.В.
Д.В. Рыбакова, М.М. Давыдов, А.П. Казанцев, П.А. Керимов, Н.В. Матинян
Российский онкологический научный центр им. Н.Н. Блохина Минздрава России,
Москва, Российская Федерация
Рак желудка у пациента 16 лет: описание клинического случая
В структуре злокачественных новообразований у детей опухоли желудочно-кишечного тракта (ЖКТ), представленные в основном лимфопролифератив-ными заболеваниями или саркомами мягких тканей, составляют лишь 1,2% [1].
Рак желудка — крайне редкое заболевание у детей и составляет 0,05% всех злокачественных новообразований ЖКТ [2]. Различают 2 гисто-
логических типа рака желудка (классификация P. Lauren) — кишечный и диффузный, при этом диффузный тип чаще встречается в молодом возрасте. Согласно результатам клинических наблюдений, неблагоприятный прогноз при диффузном раке желудка связывают с низкой выявляемостью на ранних стадиях, быстрым течением, более злокачественным потенциалом опухолевых клеток и ранним метастазированием 3.
D.V. Rybakova M.M. Davydov, P.A. Kerimov, A.P. Kazantsev, N.V. Matinyan
Institute of Pediatric Oncology and Hematology N.N. Blokhin, Moscow, Russian Federation
Cancer of the Stomach in A Child of 16 Years:
A Rare Clinical Case
Key words: children oncology, stomach cancer, a gastrectomy in a child, laparoscopy. (For citation: Rybakova DV, Davydov MM, Kerimov PA, Kazantsev AP, Matinyan NV. Cancer of the Stomach in A Child of 16 Years: A Rare Clinical Case. Onkopediatria. 2017;4(2):147-151. Doi: 10.15690/onco.v4i2.1709)
Заболевание не имеет ранних специфических симптомов и может манифестировать диспепсией, болями в эпигастрии, тошнотой, анемией, потерей веса. Этиология рака желудка у взрослых связана с такими факторами жизни, как употребление алкоголя, курение, диета с очень высоким содержанием соли и нитратов, а также наличием инфекционного агента Helicobacter pylori и генетической предрасположенностью [6]. Однако роль данных факторов в развитии рака желудка у детей не доказана: в литературе описаны лишь единичные случаи 7.
Литературный материал в большинстве своем представлен описательными клиническими примерами, без приведения статистических данных. Из-за редкости заболевания и неяркой клинической картины у детей рак желудка диагностируется на поздних стадиях, характеризуется неблагоприятным прогнозом, а используемые методы лечения не отличаются от таковых у взрослых пациентов.
Пациент К., 16 лет, поступил в отделение опухолей торакоабдоминальной локализации НИИ ДОГ для продолжения лечения, начатого по месту жительства.
Из анамнеза жизни известно, что ребенок от первой беременности, протекавшей без осложнений, первых срочных родов на 38-й нед геста-ции, оценка по шкале APGAR 8/8 баллов; грудное вскармливание до 6 мес. Прививки выполнены по возрасту. Со слов мамы, у специалистов не наблюдался; хронические заболевания отрицает. Развитие соответственно возрасту. В семье у бабушки по материнской линии в пожилом возрасте выявлен рак яичников.
Пациент болен с мая 2016 г., когда при диспансеризации по месту жительства выявлена анемия (уровень гемоглобина 73 г/л); в течение 1 мес пациент принимал по рекомендации педиатра железа (III) гидроксид полимальтозат. Однако при повторном обследовании уровень гемоглобина оставался низким — 78 г/л, в связи с чем выполнена эзофагогастродуоденоскопия, по данным которой выявлен язвенный дефект по большой кривизне желудка. По данным цитологического исследования края язвенного дефекта выявлены злокачественные атипичные клетки. Пациент направлен на консультацию в НИИ ДОГ для диагностики и решения вопроса о тактике лечения.
В научно-консультативном отделении НИИ ДОГ ребенку проведено комплексное обследование:
• компьютерная томография органов грудной клетки: признаков очаговых и инфильтратив-ных изменений не выявлено;
• радиоизотопное исследование скелета: специфического поражения костей не выявлено;
• эзофагогастродуоденоскопия: пищевод не изменен на всем протяжении, розетка кардии
эластичная, смыкается не полностью. На границе верхней и средней трети тела желудка по большой кривизне, по передней и задней стенкам на фоне инфильтрированной слизистой оболочки определяется изъязвление приблизительно до 3,0 см в диаметре с приподнятыми краями. Дно язвы плотное. Отмечается умеренная кровоточивость при контакте. Выполнена биопсия краев и дна язвы. Антральный отдел и привратник свободны. Луковица двенадцатиперстной кишки правильной формы без патологии;
• магнитно-резонансная томография органов брюшной полости: на уровне верхней и средней трети желудка стенка утолщена до 2,5 см (рис. 1). Отмечаются множественные парага-стральные лимфоузлы до 1,5 см в диаметре (рис. 2). По переднему краю селезенки — добавочная долька 1,5 см, также кпереди от вышеописанного образования — два узла по брюшине размерами 0,7 и 1,5 см. Отмечаются лимфоузлы по ходу брюшной аорты и мезентериаль-ные лимфоузлы (максимально до 1,3x0,7 см). Печень без признаков поражения.
Рис. 1. МРТ органов брюшной полости: утолщенная стенка желудка (стрелка)
Рис. 2. МРТ органов брюшной полости: утолщение стенки желудка и метастаз по брюшине (стрелки)
Проведено иммуногистохимическое исследование биопсийного материала с использованием антител panCK(AE1/AE3), CK7, CK20, villin, Her2/ neu, CD56, synaptophysin, chromogranin, CD20, CD3, CD30, Ki-67. Опухолевые клетки экспресси-руют panCK(AE1/AE3), СК7(часть+), villin(часть+). При реакции с Ki-67 позитивны около 90% опухолевых клеток. На отдельных клетках отмечается экспрессия synaptophysin. Опухолевые клетки не экспрессируют CD20, CD3, CD30, CD56, chromogranin. Реакция с Her2/neu на опухолевых клетках негативна (+1). Заключение: Морфоиммуногистохимическая картина соответствует низкодифференцированной аденокарцино-ме с перстневидноклеточными элементами (poorly cohesive carcinoma).
• эзофагогастродуоденоскопия: на границе верхней и средней трети тела желудка по большой кривизне отмечается постъязвенный дефект с конвергенцией складок и небольшим сужением просвета. Инфильтрации слизистой оболочки не отмечено;
• магнитно-резонансная томография органов брюшной полости: сохраняется на уровне верхней и средней трети желудка утолщение стенки до 1,2 см (рис. 3). Также визуализируются множественные парагастральные лимфоузлы до 0,9 см в диаметре. По переднему краю селезенки — добавочная долька размером 1,5 см. Дополнительных узловых образований в брюшной полости не выявлено. Печень без признаков поражения.
На консилиуме принято решение выполнить пациенту хирургический этап лечения в следующем объеме: лапароскопия, ревизия брюшной полости; при отсутствии диссеминации по брюши-
let L«Btltti;-Q, íO
Рис. 3. МРТ органов брюшной полости: стенка желудка после полихимиотерапии по программе Хе1ох (стрелка)
не продолжить оперативное лечение в радикальном объеме — гастрэктомия, лимфодиссекция D2.
Положение больного на спине, с валиком под мечевидным отростком.
Лапароскопия. При ревизии брюшной полости диссеминации по брюшине и печени не выявлено.
Срединная лапаротомия от мечевидного отростка до лобкового симфиза.
Вскрыта малая сальниковая сумка, мобилизован желудок по малой кривизне. Выделены правая и левая желудочные артерии, перевязаны и пересечены. С помощью сшивающего аппарата выполнена резекция дистального отдела желудка, культя двенадцатиперстной кишки погружена двумя полукисетными швами. Затем вскрыта большая сальниковая сумка, выполнена мобилизация всей парагастральной клетчатки до ворот селезенки, поэтапно перевязаны и пресечены короткие вены желудка. На брюшной отдел пищевода наложен зажим Сатинского, выполнена гастрэктомия единым блоком с лимфодиссекцией. Сформированы эзофагоеюноанастомоз на отводящей петле и межкишечный анастомоз по Брауну.
Тщательный гемостаз с использованием коагуляции. Брюшная полость дренирована двумя дренажами: справа — в область гепатодоуденаль-ной связки и зону анастомоза, слева — под левый купол диафрагмы.
Послойное ушивание раны. Косметический шов на кожу.
Время операции составило 3 ч.
Больному проведена комбинированная сбалансированная многокомпонентная анестезия с эпидуральной анальгезией. Интраоперационная кровопотеря составила 150 мл, дополнительной трансфузии компонентов крови не понадобилось. По окончании операции больной экстубирован на операционном столе.
Ближайший послеоперационный период на фоне антибактериальной, сопроводительной и симптоматической терапии протекал гладко. На 3-и сут после операции ребенок переведен из реанимационного отделения в палату хирургического отделения.
На 5-е сут в послеоперационном периоде выполнено контрастное рентгеновское исследование брюшной полости: на обзорных рентгено-грам-мах без патологии. При глотании бариевой взвеси пищевод проходим, замедлена эвакуация из пищевода (супрастенотическое расширение при прохождении анастомоза 0,1-0,2 см). Заполнение бариевой взвесью тощей кишки своевременное. Четких признаков несостоятельности анастомоза не выявлено (рис. 4).
По данным гистологического заключения в задней стенке тела желудка и по большой кривизне выявлен блюдцеобразный опухолевый узел размером 2,6x2x0,4 см: представлен перстневид-ноклеточным раком и аденокарциномой (Lauren,
Рис. 4. Рентгенограмма брюшной полости: контрастирование анастомоза
тип II) с признаками лечебного патоморфоза 1-й степени (пригодно к идентификации 80% клеток опухоли). Отмечены инфильтрация слизистой, под-слизистой и внутренней половины мышечной оболочки желудка, а также периневральная инвазия в стенку желудка. В краях резекции пищевода и желудка опухолевые клетки не обнаружены.
В малом сальнике 18 лимфоузлов, в 16 из них метастазы перстневидноклеточного рака желудка, в большом сальнике 10 лимфоузлов, в 9 — метастазы перстневидноклеточного рака желудка.
При иммуногистохимическом исследовании операционного материала обнаружена экспрессия К1-67 (95% клеток), экспрессия Нег2/пеи не обнаружена (0% клеток).
Пациенту проведен также ряд молекулярно-генетических исследований с целью выявления наследственной формы рака и определения чувствительности к таргетным препаратам. Так, мутаций в генах ВЯ0А1, BRCA2, СНЕК2, ассоциированных с высоким риском развития рака желудочно-кишечного тракта, не выявлено. При исследовании ДНК, выделенной из опухолевой ткани, микросателлит-ной нестабильности не выявлено. Фенотип опухоли со стабильной системой репарации.
Пациенту было рекомендовано продолжить полихимиотерапию в адъювантном режиме по схеме Хе1ох на основании полученных морфологических, имму-ногистохимических и молекулярно-генетических данных с последующим контрольным обследованием.
На 10-е сут пациент в удовлетворительном состоянии выписан из хирургического отделения НИИ ДОГ для продолжения лечения по месту жительства.
ров жизни (употребление алкоголя, курение, диета с очень высоким содержанием нитратов и наличием Helicobacter pylori) в развитии патологии до сих пор не выявлена. У детей отмечены случаи рака желудка не только при наследственных полипозах ЖКТ, но и в виде спорадических заболеваний [2, 11].
Клинические проявления заболевания очень различны и неспецифичны. Рак желудка у детей следует дифференцировать с гастроинтестиналь-ными стромальными опухолями [12], лимфомой с поражением желудка, лейомиосаркомой, тератомой и наследственным полипозом [9]. Из-за редкости рака желудка в педиатрической популяции диагностировать патологию на ранних стадиях крайне сложно, а стратегия лечения основана на принципах лечения взрослых: рекомендовано комплексное лечение — химиотерапевтическое и радикальное хирургическое. Стандартной схемой химиотерапии на протяжении многих лет было сочетание 5-фторурацила с препаратами платины. В настоящее время активно используется капеци-табин в комбинации с оксалиплатином, при Her2-позитивном раке желудка также возможно применение трастузумаба [13]. Проведение больших мультицентровых исследований у детей невозможно в связи с малым количеством пациентов.
В доступной литературе сообщается о 21 случае рака желудка в возрастной группе младше 21 года, где только 1 пациент (жив на момент анализа литературных источников) прослежен более 2 лет [14]. Приведены клинический случай рака желудка у 12-летней девочки, а также обзор литературы, где описаны еще 15 случаев данного заболевания у детей в возрасте от 2,5 до 17 лет: прослежена судьба 9 из 15 пациентов, 8 из них умерли в первый год заболевания, 1 ребенок был жив в течение 102 мес [7]. В 2011 г. опубликовано описание 5 случаев рака желудка у детей за 20-летний период: жив только 1 пациент [15]. Эти данные демонстрируют, что рак желудка в детском возрасте характеризуется крайне плохим прогнозом заболевания. Возможно, это связано с редкостью заболевания и диагностикой на поздних стадиях болезни.
Необходимо помнить, что и в детском возрасте встречается рак желудка. При подозрении на данное заболевание обязательно проведение полноценного гистологического и молекулярно-генетиче-ского исследования, а при подтверждении данного диагноза у ребенка необходимо применение протоколов лечения, принятых у взрослых больных.
Авторы данной статьи подтвердили отсутствие конфликта интересов, о котором необходимо сообщить.
1. Brecht IB, GrafN, Schweinitz DV, Fruhwald MC, Bielack SS, Schneider DT. Networking for children and adolescents with very rare tumors: foundation of the gpoh pediatric rare tumor group. Klinische Padiatrie. 2009;221(3):181-185. doi.org/10.1155/2014/527471.
2. Goldthorn JF, Canizaro PC. Gastrointestinal malignancies in infancy, childhood, and adolescence. Surgical Clinics of North America. 1986;66(4):845-861. doi. org/10.1155/2014/527471.
3. Аруин Л.И. Рак желудка // Рос. журн. гастроэнтерол., гепатол., колопроктол. — 1999. — №1. — С. 72-78. [Aruin LI. Rak zheludka // Ros. zhurn. gastrojenterol., gepatol., koloproktol. 1999;1:72-78. (In Russ).]
4. Никулин М.П., Любченко Л.Н., Сельчук В.Ю., Стили-ди И.С. Наследственный рак желудка: молекулярно-генетические и клинические аспекты // Современная онкология. — 2006. — Т.8. — №2 — С. 22-26. [Nikulin MP, Ljubchenko LN, Sel'chuk VJu, Stilidi IS. Nasledstvennyj rak zheludka: molekuljarno-genet-icheskie i klinicheskie aspekty // Sovremennaja onkol-ogija. 2006;8(2):22-26. (In Russ).]
5. Wang CS, Hsueh S, Chao TC, et al. Рrognostic study of gastric cancer without serosal invasion: reevaluation of the definition of early gastric cancer. J Amer Coll Surg. 1997;185:476-480. Doi: 10.1016/j.jamcoll-surg.2015.04.024.
6. Milne AN, Carneiro F, O'Morain C, Offerhaus GJ. Nature meets nurture: molecular genetics of gastric cancer. Hum Genet. 2009;126:615-628. Doi: 10.1007/ s00439-009-0722-х.
7. Lu J, Huang CM, Zheng CH, Li P, Xie JW, Wang JB, Lin JX. Gastric carcinoma in a 12-year-old girl: a case report and literature review. Zhonghua Weichang
Waike Zazhi. 2012;15:967-970 Doi: 10.3748/wjg. v21.i11.3409.
8. Aydogan A, Corapcioglu F, Elemen EL, Tugay M, Gürbüz Y, Oncel S. A case report: gastric adenocarcinoma in childhood. Turk J Pediatr. 2009;51:489-492. Doi: 10.3748/ wjg.v21.i11.3409.
9. Michalek J, Kopecna L, Tuma J, et al. Gastric carcinoma in a 9-year-old boy. Pediatr Hematol Oncol. 2000;17:511-515.
10. Давыдов М.И. Современная стратегия хирургического лечения рака желудка. Текст / М.И. Давыдов, М.Д. Тер-Ованесов // Современная онкология. — 2000. — Т.2. — №1 — С. 4-10. [Davydov MI. Sovremennaja strategija hirurgicheskogo lechenija raka zheludka. Tekst / MI. Davydov, MD. Ter-Ovanesov // Sovremennaja onkologija. 2000;2(1):4-10. (In Russ).]
11. Harting MT, Blakely ML, Herzog CE, et al. Treatment issues in pediatric gastric adenocarcinoma. J Pediatr Surg. 2004;39:e8-e10.
12. Kaemmer DA, Otto J, Lassay L, et al. The Gist of literature on pediatric GIST: Review of clinical presentation. J Pediatr Hematol Oncol. 2009;31:108-112. Doi: 10,1097/MPH.0b013e3181923cd8.
13. Kang Y, Ohtsu A, Van Cutsem E, et al. AVAGAST: A randomized, double-blind, placebo-controlled, phase III study of first-line capecitabine and cisplatin plus bevacizumab or placebo in patients with advanced gastric cancer (AGC). J Clin Oncol (Meeting Abstr). 2010;28:LBA4007.
14. Sasaki H, Sasano H, Ohi R, et al. Adenocarcinoma at the esophageal gastric junction arising in an 11-year-old girl. Pathol Int. 1999;49:1109-1113.
15. Subbiah V, Varadhachary G, Herzog CE, et al. Gastric adenocarcinoma in children and adolescents. Pediatr Blood Cancer. 2011;57:524-7. Doi: 10.1002/pbc.23051.
Давыдов Михаил Михайлович, доктор медицинских наук, директор НИИ клинической онкологии
Казанцев Анатолий Петрович, доктор медицинских наук, заведующий хирургическим отделением № 2
опухолей торакоабдоминальной локализации отдела общей онкологии НИИ детской онкологии и гематологии

Перенесенные заболевания - корь в детстве.
Оперативные вмешательства: 1995 год-фиброма левой молочной железы.
Гинекологический анамнез- климакс 2 года, 1 беременность, 1 роды.
В анамнезе- варикозное расширение вен н/к,, остеохондроз шейного отдела позвоночника.
Аллергологический анамнез не отягощен.
Наследственность- мать - рак желудка, отец - ОНМК.
Обратилась к гинекологу с жалобами на чувство дискомфорта внизу живота, бели, так же обращалась к урологу с жалобами на учащенное мочеиспускание с резью.
УЗИ органов малого таза: эхографическая картина объемного образования правого яичника, миом тела матки, признаки полипов цервикального канала.
Общий анализ крови: Гемоглобин 129.10 г/лЭритроциты 4.30 10^12 / л Гематокрит 36.41
Общий анализ мочи: Эритроциты неизмененные 1,2.
Выходной отдел желудка выраженно деформирован за счет опухолевидного образования до 3-4 см, осмотр несколько затруднен вследствие локализации и деформации просвета, определяется язвенный дефект в центре до 10 мм с прикрытым фибрином дном.
Выполнена биопсия для гистологического исследования, слизистая при биопсии ригидная, хрящевидной плотности, фрагментируется, выраженно кровоточит.
Заключение: Опухолевидное образование антрального отдела желудка с переходом на привратник с деформацией и незначительным сужением просвета, биопсия
При гистологическом исследовании из образования толстой кишки: фрагменты тубуло-ворсинчатой аденомы с фокусами тяжелой дисплазии.
Онкомаркеры:
РЭА 160.6
СА 19.9 884.7
Гиперметаболический процесс в утолщенных стенках ободочной кишки и окружающей клетчатке – может соответствовать опухолевому процессу. Гиперметаболические образования по брюшине – вероятнее всего метастатического характера.
В связи с результатами гистологического исследования, было принято решение о повторных исследованиях с биопсией, выполнены через 3 дня.
Гистологическое исследование образования желудка: В пределах доставленного на исследование материала морфологическая картина умеренного хронического гастрита с гиперплазией покровно-ямочного эпителия, участками значительного отека, фокусами фиброза стромы собственной пластинки слизистой. Опухолевого роста в пределах данного материала не обнаружено.
Данный результат гистологического исследования был ожидаем вследствие того, что данная опухоль является прорастанием опухоли поперечноободочной кишки, что видно по снимкам, и, вероятнее всего, на момент осмотра нет прорастания в слизистую оболочку желудка.
Гистологическое исследование образования толстой кишки: в одном из представленных фрагментов - фиброзная ткань с комплексами аденокарциномы.
Данный клинический случай интересен тем, что, несмотря на количество биопсийных фрагментов (в общей сложности взято более 14 фрагментов за два исследования), прицельную биопсию из очагов наиболее измененной бесструктурной слизистой с участками депрессии и нарушением сосудистого рисунка, а так же использование биопсийных щипцов с объемными браншами для множественной биопсии с накопителем, существуют трудности диагностики образований вследствие мозаичности гистологического строения опухоли даже крупных образований органов желудочно-кишечного тракта, иногда требующие повторных эндоскопических исследований.
Рак толстой кишки является одним из наиболее распространенных злокачественных новообразований. Согласно статистическим данным последнего десятилетия, показатели заболеваемости и смертности больных РТК неуклонно растут в России и экономически развитых странах. Так, с 2003 по 2013 г. прирост злокачественных новообразований ободочной кишки составил 23,43 %, прямой кишки, ректосигмоидного отдела, ануса – 17,90 %.
Частота метастатических опухолей яичников (метастаз Крукенберга), по данным различных авторов, колеблется от 4,18 до 63 % всех злокачественных опухолей этого органа. Наиболее часто в яичники метастазируют опухоли женской репродуктивной системы, молочной железы и опухоли органов желудочно-кишечного тракта.
Метастазы в яичники при опухолях толстой кишки составляют по данным различных авторов от 1,7 до 12 % случаев. Частота первично-множественных злокачественных новообразований (ПМЗН) яичников и толстой кишки колеблется от 0,8 до 12,6 %.
Клиническая картина РТК с метастазами в яичники отличается малой выраженностью. При распространенном процессе отмечается нарушение функции яичников, болевые ощущения внизу живота и увеличение его объема, расстройства функции смежных органов (нарушение мочеиспускания), общие нарушения. Для ранней диагностики поражения яичников в диагностический алгоритм необходимо включение определение уровня опухолевых маркеров РЭА, СА 19–9, СА 125, УЗИ органов малого таза и брюшной полости.
1.Казакевич В.И., Митина Л.А., Востров А.Н., Гуц О.В. Ультразвуковая диагностика метастатического поражения яичников при раке желудочно-кишечного тракта. Ультразвуковая и функциональная диагностика 2009;5:14. [Kazakevitch V.I., Mitina L.A., Vostrov A.N. Guts O.V. Ultrasound diagnosis of metastatic disorder of ovarian in cancer of the gastrointestinal tract. Ultrazvukovaya i funktsionalnaya diagnostika = Ultrasound and functional diagnostics 2009;5:14 (In Russ.)].
2.Казаков М.П., Поддубная И.В., Любченко Л.Н., Харитонова Т.В. Наслед- ственный рак яичника (литературный обзор). Современная онкология 2012;1(14):47–54. [Kazakov M.P., Poddubnaya I.V., Lubchenco L.N., Kharitonova T.V. Hereditary ovarian cancer (literature review). Sovremennaya onkologiya =Modern oncology 2012;1(14):47–54 (In Russ.)].
3.Паяниди Ю.Г., Сельчук В.Ю., Жордания К.И. и др. Полинеоплазии женского генитального тракта: первичномножественные новообразования или метаста- зы? Архив патологии 2006;4:16–20. [Payanidi Y.G., Selchuk V.Y., Jordania K.I. et al. Polyneoplasia of female genital tract: multiple primary tumors or metastases? Arkhiv patologii = Archives of pathology 2006;4: 16–20 (In Russ.)].
4.Паяниди Ю.Г., Сельчук В.Ю., Жордания К.И. и др. Первично-множественные злокачественные новообразования половых органов у женщин: пути профи- лактики. Опухоли женской репродуктив- ной системы 2010;1:51–4. [ Payanidi Y.G., Selchuk V.Y., Jordania K.I. et al. Multiple primary malignant neoplasms of genital organs in women: the way of prevention. Opukholi zhenskoy reproduktivnoy sistemy = Tumors of the female reproductive system 2010;1: 51–4 (In Russ.)].
5.Попова Т.Н. Диагностика и лечебная тактика у больных с первично-множественными синхронными злокачественными опухолями. Дис. … д-ра мед. наук. М., 2002. [Popova T.N. Diagnosis and treatment strategy in patients with multiple primary synchronous malignant tumors. Thesis . Dr. sci. med. M., 2002 (In Russ.)].
6.Kim D.D., Park I.J., Kim H.C. et al. Ovarian metastases from colorectal cancer: a clinicopathological analysis of 103 patients. Colorectal Dis 2009 Jan;11(1):32–8.
7.Omranipour R., Abasahl A. Ovarian metastases in colorectal cancer. Int J Gynecol Cancer 2009 Dec;19(9):1524–8.
8.Simon M.S., Petrucelli N. Hereditary breast and ovarian cancer syndrome: the impact of race on uptake of genetic counseling and testing. Methods Mol Biol 2009;471:487–500.
La Vecchia C. Epidemiology of ovarian cancer: a summary review. Eur J Cancer Prev 2001;10:125–9.
В стационар поступила пожилая женщина с симптомами тревоги
Nicola Carlomagno, Fabrizio Schonauer, Vincenzo Tammaro, Annalena Di Martino, Carmen Criscitiello, Michele L. Santangelo
Journal of Medical Case Reports 2015, 9:13
81‑летняя женщина поступила в терапевтическое отделение с жалобами на общую слабость, потерю веса, рвоту и боли в животе. В анамнезе: гипертоническая болезнь и холецистэктомия по поводу острого холецистита. При осмотре обнаружена припухлость на передней брюшной стенке, высказано предположение о послеоперационной грыже. Однако при эндоскопическом исследовании выявлена опухоль антрального отдела желудка. В следующие несколько дней над описанной припухлостью образовалась сначала небольшая кожная язва, а затем сформировался свищ. Пациентка была переведена в хирургическое отделение.
Пан-цитокератин (общий цитокератин, цитокератин АЕ1/АЕ3) — смесь моноклональных антител к различным цитокератинам, белкам цитоскелета эпителиальных клеток. Используется для дифференциальной диагностики рака и неэпителиальных опухолей.
Хромогранин А содержится в гранулах большинства нейроэндокринных клеток. Специфичный маркер нейроэндокринных опухолей разного происхождения.
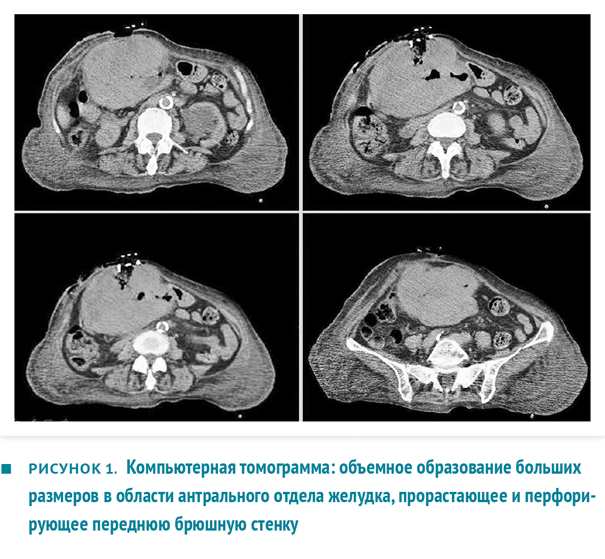
При лабораторном исследовании выявлены гипопротеинемия 46 г/л, гипоальбуминемия 20 г/л и анемия (гемоглобин 83 г/л). При выполнении компьютерной томографии (КТ) описано массивное образование 10×14×15 см в области антрума с центральным некрозом и кровоизлияниями, со слабой васкуляризацией, без четкой границы с левой долей печени (рис. 1). Опухолевая масса врастала в поперечную ободочную кишку и прямую мышцу живота, занимала значительную часть верхнего этажа брюшной полости и формировала наружный свищ. При КТ-исследовании не обнаружено метастазов.
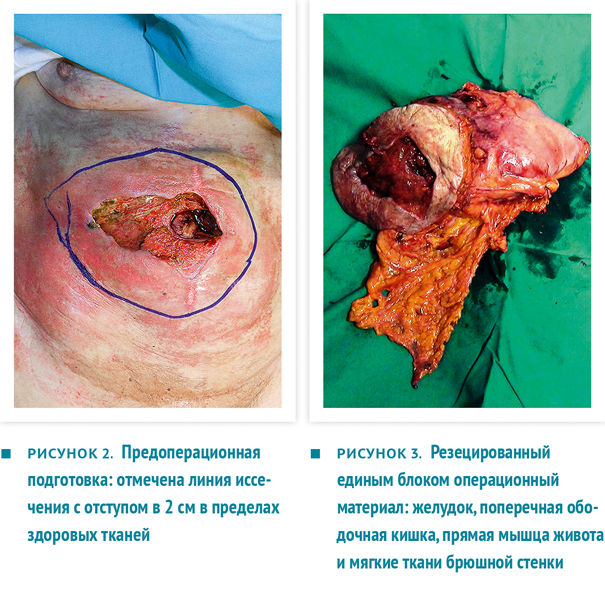
Проведено хирургическое лечение. Вокруг неопластического поражения выполнен эллиптический разрез в пределах 2 см здоровых тканей (рис. 2). Боковые края расширены линейными разрезами.
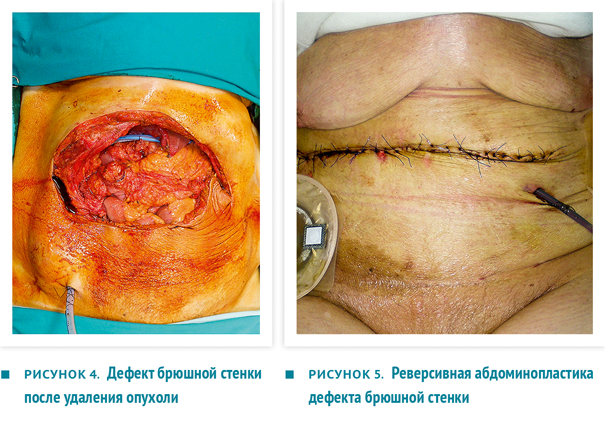
Единым блоком резецированы участок передней брюшной стенки, часть желудка и часть ободочной кишки (рис. 3), проведена систематическая лимфодиссекция, после чего наложен аппаратный гастроеюноанастомоз и ручной тонко-толстокишечный анастомоз. Установлены 2 внутрибрюшных дренажа (рис. 4).
Дефект передней брюшной стенки протезирован сетчатым трансплантатом, рана закрыта методом реверсивной абдоминопластики (рис. 5). Внутрибрюшное давление в ходе оперативного вмешательства и в послеоперационном периоде было
ниже 10 мм. рт. ст.
CD56 — молекула клеточной адгезии, в норме экспрессируется на поверхности натуральных киллеров, нейронов, клеток глии, скелетных мышц. Определяется на клетках многих солидных и гематологических опухолей.
Виментин — белок цитоскелета клеток мезодермального происхождения, в частности соединительной ткани. Обнаруживают при фиброзных опухолях, саркомах, мезотелиоме.
Синаптофизин участвует в формировании синаптических пузырьков в нервных клетках. Маркер нейроэндокринных опухолей.
Белок S-100 — семейство кальций-связывающих белков, повышение концентрации наблюдается при прогрессии меланомы.
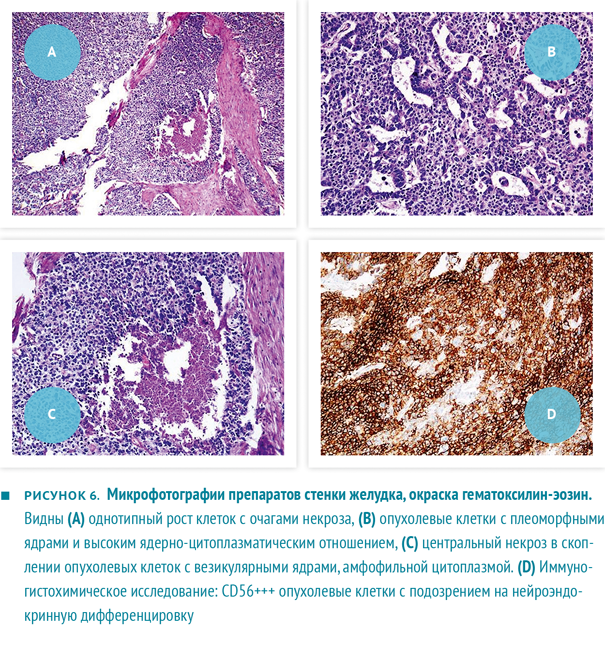
По данным гистологического исследования, удаленная опухоль соответствовала малодифференцированной аденокарциноме с чертами нейроэндокринной дифференцировки с прорастанием до слизистой оболочки поперечной ободочной кишки и мягких тканей до кожи (рис. 6а‑с). При иммуногистохимическом исследовании выявлено позитивное окрашивание к пан-цитокератину, хромогранину и CD56 (рис. 6d), негативное — к виментину, синаптофизину и S-100.
Состояние пациентки в раннем послеоперационном периоде было удовлетворительным. По поводу анемии легкой степени проведены гемотрансфузии в первые 3 дня. Активная перистальтика отмечена с 3‑го дня. С 6-го дня, после контрастного рентгенологического исследования верхних отделов ЖКТ, пациентка начала самостоятельно принимать пищу.
К сожалению, с 10‑го дня у пациентки на фоне пневмонии развился тяжелый респираторный дистресс-синдром. Несмотря на проводимую антибактериальную терапию и перевод в отделение интенсивной терапии, она умерла на 20‑й день после операции.
Обсуждение
Несмотря на то что рак желудка часто обнаруживают только на поздних стадиях [1, 2], прорастание опухолью брюшной стенки с ее деструкцией и формированием наружного желудочного свища встречается редко. Обычно поражение опухолевыми клетками ограничивается серозными оболочками и прилежащими тканями смежных органов [3]. В литературе описаны единичные случаи серьезного поражения кишечника при раке желудка и манифестации болезни с кишечной непроходимости [4–7], прямокишечного кровотечения, запоров и тенезмов [8]. Еще более редки случаи доминирования симптомов массивного прорастания брюшной стенки. Описан 62‑летний пациент с диффузной инвазией опухолевых клеток в переднюю брюшную стенку при раке желудка, однако без ее полного разрушения [9].
В запущенных случаях рака желудка возможности терапии обычно ограничены неоадъювантной химиотерапией с гастростомией или еюностомией. В описанном случае подобная тактика была неприменима из‑за обширного дефекта брюшной стенки и вовлечения поперечной ободочной кишки. Было принято решение о резекции всех пораженных органов единым блоком.
При онкологических операциях во избежание контаминации опухолевыми клетками распространено широкое иссечение больших участков мягких тканей. Устранение кожного дефекта после оперативных вмешательств возможно пластикой на питающей ножке местными и отдаленными тканями, либо с переносом свободного кожного лоскута [1]. Для реконструкции дефекта верхней части передней брюшной стенки могут быть использованы кожно-мышечные лоскуты на основе прямой мышцы живота или широчайшей мышцы спины. При значительном поражении местных тканей может потребоваться свободная кожная пластика. Ее преимущество — лучший косметический эффект, а недостатки — более длительное время операции, возможность отторжения трансплантированного лоскута и большие повреждения донорского участка.
Альтернативой перечисленным методам может быть использованная в описанном случае реверсивная абдоминопластика [12]. Кожу нижнего края операционной раны вместе с поверхностной фасцией отделяют от мышечного футляра. Разрез продолжают до лобковой области, полученный лоскут подтягивают кверху для закрытия дефекта брюшной стенки. Реверсивная абдоминопластика чаще используется в пластической хирургии для коррекции формы живота после значительной потери веса [13, 14] и редко — для реконструктивных операций после резекции опухоли [15–17]. Она может быть использована в комбинации с другими типами лоскутов, а также для покрытия сетчатого эндопротеза.
Стоит отметить особо, что смерть пациентки наступила не из‑за хирургических осложнений. Внутрипузырное измерение внутрибрюшного давления рутинно проводили на всех этапах терапии, наиболее угрожаемых по развитию внутрибрюшной гипертензии и абдоминального компартмент-синдрома. Оперативное вмешательство проведено усилиями хирурга-онколога и пластического хирурга с применением адекватной техники. Авторы статьи убеждены в пользе и важности индивидуального подхода и нестандартных решений в сложных случаях хирургического вмешательства при онкологических заболеваниях.
- Santangelo M, et al. Extended total gastrectomy: indications in the 3rd millennium. Minerva Chir. 2001;56 (1):1–6.
- Tammaro V, et al. Prognostic value of splenectomy and lymph-node dissection during gastric cancer resection. Chir Ital. 2006;58 (2):163–70.
- Feczko PJ, et al. Metastatic disease involving the gastrointestinal tract. Radiol Clin North Am. 1993;31:1359–73.
- Tomikashi K, et al. Gastric cancer metastatic to the colon. Gastrointest Endosc. 2002;55:561.
- Kumagai K, et al. Octreotide acetate successfully treated a bowel obstruction caused by peritoneally disseminated gastric cancer, thereby enabling the subsequent use of oral S-1 chemotherapy. Int J Clin Oncol. 2009;14:372–5.
- Fukuda Y, et al. A case of advanced gastric cancer with direct invasion of the transverse colon responding to paclitaxel/5'-DFUR combined therapy. Gan To Kagaku Ryoho. 2005;32:1945–8.
- Yu X, Zhang J. Gastric cancer with large bowel obstruction as the first presentation: a case report. Oncol Lett. 2013;6:1377–9.
- Alegre R, et al. Gastric cancer: an unusual presentation. Acta Gastroenterol Latinoam. 2003;33 (1):29–32.
- Waguri N, et al. A case of gastric cancer with abdominal wall invasion treated by weekly low-dose paclitaxel therapy. Gan To Kagaku Ryoho. 2006;33 (8):1151–4.
- Aomatsu N, et al. A case of emergency resection of a giant gastrointestinal stromal tumor of the stomach associated with hemorrhagic shock. Gan To Kagaku Ryoho. 2013;40 (12):2185–7.
- Okada K, et al. A case of gastrointestinal stromal tumor of the stomach with rapid growth in a short term. Gan To Kagaku Ryoho. 2008;35 (12):2080–2.
- Halbesma GJ, van der Lei B. The reverse abdominoplasty: a report of seven cases and a review of English-language literature. Ann Plast Surg. 2008;61:133–7.
- Akbas H, et al. The combined use of classic and reverse abdominoplasty on the same patient. Plast Reconstr Surg. 2002;109:2595–6.
- Hurwitz DJ. Single-staged total body lift after massive weight loss. Ann Plast Surg. 2004;52:435–41.
- Pantelides NM, et al. Reverse abdominoplasty: a practical option for oncological trunk reconstruction. Eplasty. 2013;13: e2.
- Bury TF, et al. Closure of massive chest wall defects after full-thickness chest wall resection. Ann Plast Surg. 1995;34:409–14.
- Dagregorio G, Darsonval V. Aesthetic surgery techniques after excision of dermatofibrosarcoma protuberans: a case report. Br J Plast Surg. 2005;58:556–60.
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.
Читайте также:

