Оксид серы 6 реагирует с нитратом натрия хлором
![]()
![]()
реагирует с Оксидом алюминия, тк оксид серы-это кислотный оксид, а по их хим свойствам подходит только оксид ал
Другие вопросы из категории
металлами 3 Взаимодействие с оксидами а) основными б) амфотерными 4 взаимодействие с основаниями 5 взаимодействие с солями
предварительно составив формулы оксида и гидроксида:
Zn → оксид →
гидроксид → Me2Zn О2.
Читайте также
(III) - 8) угольной кислоты - 9) бромида натрия - 10) серной кислоты - 1) карбонат калия - 2) гидроксид меди - 3) сульфат лития - 4) кремниевой кислоты - 5) оксид серы (IV) - 6) гидроксид - 7) нитрат цинка - 8) оксид метия - 9) карбонат магния - 10) азотистой кислоты
гидроксид калия, оксид серы(₆)?
Напишите молекулярные и ионные уравнения возможных реакций.
1) 2, 6 2) 2,8,6 3) 2,8,4 4) 2, 8,3
2. Углерод и кремний находятся в одной группе и подгруппе,
т.к. у их атомов:
1) одинаковое число энергетических уровней
2) одинаковые радиусы атомов
3) одинаковое строение внешних электронных уровней
4) одинаковое число электронов
3. Ковалентная полярная связь в обоих веществах:
1) HCl; HBr 2) HCl; H2 3) KCl; KBr 4) HBr;Br2
4. Степень окисления хлора в соединении NaClO3
1) -1 2) +1 3) +5 4) +7
5. Названия оксид серы (IV), сульфит кальция, сульфид кальция,
сернистая кислота соответственно имеют:
1) SO2; CaSO3; CaS; H2SO3 2) SO2; CaSO3;CaS;H2SO4
3) SO2; CaS; CaSO3; H2SO3 4) SO3; CaSO3; CaS; H2SO3
6.В уравнении реакции взаимодействия Аl и H2SO4 коэффициенты
перед формулами этих веществ соответственно равны:
1) 2 и 3 2) 3 и 2 3) 2 и 1 4) 1 и 3
7. Реакцией замещения является:
1) 2Na + 2H2O = 2NaOH + H2 2) SO3 + H2O = H2SO4
3) CaO + 2HCl = CaCl2 + H2O 4) Cu(OH)2 = CuO + H2O
8. К сильным электролитам относятся вещества:
1) HNO3 ; Cu(OH)2 ; KOH 2) NaCl; H2SO4 ; CaCO3
3) H2S ;BaSO4 ;Fe(NO3)2 4) HCl; Ca(NO3)2 ; NaOH
9. Наибольшее число ионов образуется при диссоциации:
1) Na2S 2) K2SO3 3) Al2(SO4)3 4) Al(NO3)3
10. Сокращенное ионное уравнение Al 3+ + 3OH- →Al(OH)3 соответствует взаимодействию
1) хлорида алюминия с водой 2) оксида алюминия с водой
3) хлорида алюминия со щелочью 4) алюминия со щелочью
11. Химическая реакция возможна
1) H2O и Cu 2) H2SO4 (p-p) и Ag
3) MgSO4 и Zn 4) Zn и CuSO4
12. Оксид углерода (IV) реагирует с обоими веществами группы:
1) водой и оксидом кальция
2) кислородом и оксидом серы (IV)
3) сульфатом калия и гидроксидом натрия
4) фосфорной кислотой и водородом
13. Раствор гидроксида натрия реагирует с каждым
из веществ, указанных в паре
1) оксид железа (II) и соляная кислота
2) нитрат железа (III) и углекислый газ
3) серная кислота и оксид азота (II)
4) оксид цинка и хлорид калия
14. Соляная кислота будет взаимодействовать с:
1) Na2CO3 2) SO3 3) Ba(NO3)2 4) Cu
15. Сульфат меди (II) реагирует по отдельности в растворе
с веществами:
1) Fe; Na2S ; KOH 2) Zn; HNO3 ;CaCO3
3) Ag; K2CO3; BaCl 2 4) Al; KCl; KOH
16. К непредельным относятся оба вещества в паре:
1) этан, этанол 2) этен, этин
3) глицерин, пропен 4) уксусная кислота, этен
17. В перевернутый вверх дном сосуд можно собрать:
1) NH3 2) O2 3) CO2 4) SO2
18. Метилоранж не меняет цвет в растворе
1) H2SO4 2) NaOH 3) Na2SO4 4) SO2
19. Массовая доля кислорода в карбонате кальция равна:
1) 48% 2) 16% 3) 32% 4) 40%
ЧАСТЬ 2
1. Для галогенов с возрастанием порядкового номера:
1) усиливаются неметаллические свойства
2) повышается электроотрицательность
3) уменьшается температура кипения
4) ослабевает окислительная способность
5) увеличивается радиус атома
2. С медью могут взаимодействовать:
1) HCl 2) HNO3 (P-P) 3) Cl2 4) FeSO4 5) ZnO
3. Растворы азотной кислоты и гидроксида кальция способны реагировать с :
1) гидроксидом натрия 2) гидроксидом цинка
3) оксидом магния 4) оксидом серы (VI)
5) карбонатом натрия
4. В уравнении реакции
Cu + HNO3 → Cu(NO3)2 + NO2 + H2O
Коэффициент перед окислителем равен
ЧАСТЬ 3
2. Какой объём газа выделится при взаимодействии 6,5 г цинка с раствором соляной кислоты.
Играй и зарабатывай! кликни!
Сера --> Сероводород --> Сернистый газ --> Серный ангидрид --> Серная кислота
Дисульфид железа (II) --> Оксид серы (IV) --> Оксид серы (VI) --> Серная кислота
Сероводород --> Сера --> Сернистый газ --> Гидросульфит натрия --> Сульфит натрия

Определения и формулы основных, амфотерных и кислотных оксидов были приведены ранее в уроке 6.
Характерные химические свойства основных оксидов: реакции с кислотными оксидами с образованием солей и с кислотами с образованием солей и воды, например:
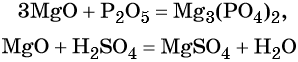
Некоторые основные оксиды реагируют с водой с образованием оснований. Эта реакция проходит в том случае, если продукт реакции растворим в воде:
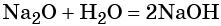
В аналогичных условиях, например, оксид железа (II) с водой реагировать не будет, так как гидроксид железа (II) в воде нерастворим.
Амфотерные оксиды взаимодействуют как с кислотами, так и с основаниями с образованием солей и воды или комплексных соединений:
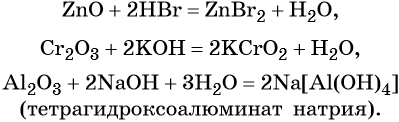
Кроме того, амфотерные оксиды могут взаимодействовать как с кислотными, так и с основными оксидами, например:
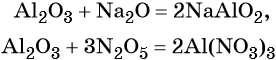
С водой амфотерные оксиды не взаимодействуют.
Кислотные оксиды реагируют с основными оксидами с образованием солей; с основаниями, с образованием солей и воды или кислых солей, а также с водой, в том случае если образующаяся в ходе такой реакции кислота растворима в воде:
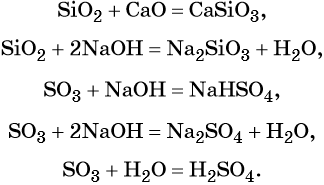
Кроме того, кислотные оксиды вступают в окислительно-восстановительные и обменные реакции:
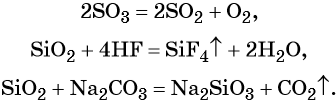
Тренировочные задания
1. Оксид натрия взаимодействует с каждым из двух веществ:
1) серная кислота и вода
2) уксусная кислота и азот
3) оксид лития и фосфор
4) оксид бария и серная кислота
2. Оксид калия взаимодействует с
1) азотом и фосфором
2) водой и сульфатом натрия
3) серной кислотой и оксидом фосфора (V)
4) литием и хлоридом натрия
3. Оксид кальция взаимодействует с
1) оксидом кремния
2) оксидом углерода (II)
3) оксидом азота (II)
4) оксидом азота (I)
4. Оксид бария взаимодействует с каждым из двух веществ:
1) азотной кислотой и водой
2) уксусной кислотой и хлором
3) оксидом натрия и азотом
4) оксидом серы (IV) и кремнием
5. Оксид магния не взаимодействует с
1) соляной кислотой
2) серной кислотой
3) оксидом лития
4) оксидом кремния
6. Оксид кальция взаимодействует с каждым из двух веществ:
1) оксидом фосфора (V), водой
2) оксидом углерода (IV) и сульфидом натрия
3) оксидом магния и азот
4) кислородом и сульфатом натрия
7. Оксид кальция реагирует с
1) медью
2) фосфором
3) оксидом углерода (IV)
4) оксидом магния
8. Оксид натрия реагирует с
1) водой
2) сульфатом калия
3) нитратом железа (II)
4) оксидом азота (II)
9. Оксид бария реагирует с каждым из двух веществ:
1) оксидом азота (II) и хлором
2) азотной кислотой и водой
3) оксидом углерода (II) и железом
4) серой и хлоридом кальция
10. Оксид магния реагирует с каждым из двух веществ:
1) оксидом кальция и оксидом железа (II)
2) оксидом алюминия и оксидом хрома (II)
3) соляной кислотой и оксидом кремния (VI)
4) оксидом фосфора (V) и цинком
11. Оксид цинка
1) растворяется в кислотах, но не реагирует с основаниями
2) растворяется в щелочах, но не реагирует с кислотами
3) реагирует с оксидом натрия, но не реагирует с водой
4) реагирует с оксидом калия и водой
12. Оксид хрома (III) реагирует с
1) оксидом калия
2) водой
3) оксидом серы (VI)
4) оксидом азота (I)
13. Оксид алюминия амфотерен, поскольку он способен взаимодействовать
1) как с азотной, так и серной кислотой
2) с водой и кислотами
3) с водой и щелочами
4) как с кислотами, так и со щелочами
14. Оксид алюминия реагирует с
1) сульфатом калия
2) оксидом калия
3) оксидом азота (II)
4) оксидом углерода (IV)
15. Оксид серы (VI) взаимодействует с каждым из двух веществ:
1) оксидом лития и углекислым газом
2) водой и углекислым газом
3) водой и гидроксидом калия
4) кислородом и натрием
16. Оксид фосфора (V) взаимодействует с каждым из двух веществ:
1) кислородом и водородом
2) водой и углекислым газом
3) водой и гидроксидом натрия
4) водой и оксидом углерода (II)
17. Оксид серы (VI) не взаимодействует с
1) водой
2) хлоридом калия
3) гидроксидом натрия
4) оксидом бария
18. Оксид серы (IV) взаимодействует с
1) оксидом углерода (IV) и водой
2) оксидом фосфора (V) и водой
3) сульфатом калия и водой
4) оксидом кальция и гидроксидом натрия
19. Оксид серы (IV) не взаимодействует с
1) водой
2) фосфатом кальция
3) раствором гидроксида натрия
4) гидроксидом кальция
20. Оксид хлора (VII) взаимодействует с каждым из двух веществ:
1) кальцием и углекислым газом
2) водой и углеродом
3) водой и оксидом калия
4) кислородом и азотом
21. Установите соответствие между реагирующими веществами и продуктами реакций.
22. Установите соответствие между реагирующими веществами и продуктами реакций.
23. Установите соответствие между реагирующими веществами и продуктами реакций.
24. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) CaO + SiO2 →
Б) CaO + H3PO4 (разб.) →
В) CaO + HCl →
25. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) ZnO + HCl →
Б) ZnO + NaOH ⎯⎯ H2O →
В) ZnO + Na2O ⎯⎯ сплавление →
26. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) ZnO + H3PO4 →
Б) ZnO + NaOH + H2O →
В) ZnO + C →
27. Установите соответствие между реагирующими веществами и продуктами реакций.
28. Установите соответствие между реагирующими веществами и продуктами реакций.
29. Установите соответствие между реагирующими веществами и продуктами реакций.
30. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) SO2 + H2S →
Б) SO2 (изб.) + NaOH →
В) SO2 + NaOH (изб.) →
31. Дана схема превращений:
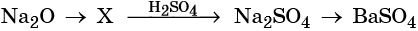
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
32. Дана схема превращений:
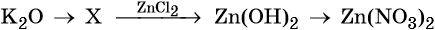
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
33. Дана схема превращений:
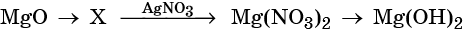
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
34. Дана схема превращений:
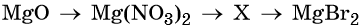
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
35. Дана схема превращений:
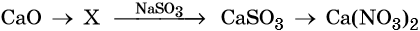
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
36. Дана схема превращений:
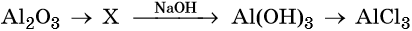
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
37. Дана схема превращений:
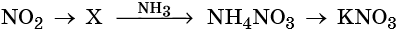
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
38. Дана схема превращений:
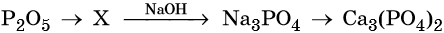
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
39. Дана схема превращений:
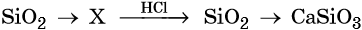
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
40. Дана схема превращений:
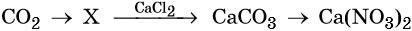
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
41. Дана схема превращений:
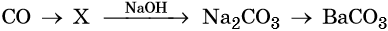
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
42. Дана схема превращений:
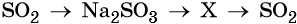
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
43. Дана схема превращений:
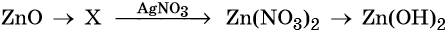
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
44. Дана схема превращений:
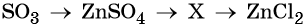
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
45. Дана схема превращений:
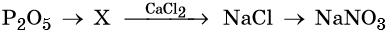
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
46. Дана схема превращений:
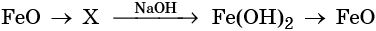
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
47. Дана схема превращений:
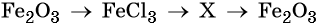
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
48. Дана схема превращений:
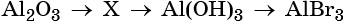
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
49. Дана схема превращений:
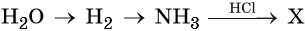
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
50. Дана схема превращений:
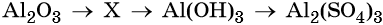
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.

Надеюсь, что вы уже выучили свойства серы (Сера. Общая характеристика, получение, химические свойства) и готовы решать задания ЕГЭ.
Задание 1:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать; к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Решение:
Первая в списке сера, с нее и начнем: как ты знаешь, S реагирует с
- металлами (Al, Na, остальные, кроме золота, платины, иридия),
- кислотами (H2SO4, да, да, с серной кислотой сера реагирует с образованием сернистого газа и воды; HNO3, HI),
По данным задания, нам подходит вариант 3 - водород, гидроксид натрия, азотная кислота.
Идем далее, диоксид кремния, SiO2 - это кислотный оксид, который НЕ взаимодействует с водой, но ему соответствует метакремниевая кислота H2SiO3;
- хорошо реагирует с плавиковой кислотой (HF) (к слову, это та кислота, которая "плавит стекло", а ты знаешь, что главная составляющая стекла - это песок, а в песке содержится более 80% диоксида кремния);
- с углеродом (C) - в результате этой реакции образуется карбид кремния (карборунд) и угарный газ;
Здесь подходит вариант 4.
Следующее вещество в списке - бромид железа (II).
Это средняя бескислородная соль, которая реагирует с
- с кислотами (в случае образования осадка, газа или воды);
- с основаниями, которые дают осадок или воду,
- с хлором (Cl2) - в результате реакции замещения хлор замещает бром, и выделяется Br2.
Исходя из вариантов, верный ответ 2.
И, последнее вещество в этом задании - дихромат калия, или хромпик (K2Cr2O7).
Это кислородсодержащая, средняя соль; широко используется в различных областях, например, в пиротехнике, химии, фотографии.
Его химические свойства обусловлены тем, что он является сильным окислителем, соответственно, он хорошо вступает в химические реакции
- с щелочами (KOH) - образуется хромат калия (окраска раствора изменяется с оранжевой на желтую):
- с галогеноводородами (HCl, HI)
Итак, самый подходящий вариант - 1.
Задание 2:
Установите соответствие между изменением степени окисления серы и формулами веществ, при взаимодействии которых это изменение происходит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Решение:
В этом задании представлены изменения степеней окисления серы и варианты, при которых могут возникать эти изменения.
Первый случай - сера была со степенью окисления 0, а стала +4; это говорит о том, что исходным веществом является простая сера, то есть в виде простого вещества, соответственно, подходит вариант 3, а вот и реакция:
Второй случай - сера была в составе соединения со степенью +4, а стала +6; здесь остановимся на варианте ответа номер 4:
Третья позиция - сера была в составе соединения со степенью -2, а стала простым веществом - это возможно только в пункте номер 2:
Задание 3:
Установите соответствие между названием вещества и возможным электролитическим способом получения этого вещества; к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой:
1) водного раствора CuSO4,
2) водного раствора K2S ,
3) водного раствора HgBr2 ,
5) водного раствора CuCl2 .
Решение:
Для выполнения этого задания необходимо вспомнить тему "Электролиз":
- кислород выделяется на аноде при электролизе водного раствора CuSO4,
- сера выделяется при электролизе водного раствора K2S,
- водород выделяется на катоде при электролизе водного раствора K2S ,
- калий выделяется ТОЛЬКО при электролизе РАСПЛАВОВ, то есть в данном случае KF.
Задание 4:
Даны две пробирки с раствором бромида меди (II). В первую пробирку добавили металл X, в результате наблюдали образование красноватого налета на его поверхности. Во вторую пробирку добавили раствор вещества Y. В этой пробирке произошла реакция, которую описывает сокращенное ионное уравнение
Из предложенного перечня выберите вещества X и Y, которые участвовали в описанных реакциях
1) сульфид натрия;
5) гидросульфид натрия.
Решение:
Данное задание не является сложным, но ученики часто допускают ошибку именно здесь.
Самая распространенная проблема в этом задании заключается в том, что здесь нужно подобрать вещества так, чтобы образовался только тот осадок или газ, которые указаны в уравнении, и ничего лишнего.
Например, в нашем задании даны две пробирки, в каждой из которых есть бромид меди (II).
- В первую добавили металл, и образование красноватого налета, а это и есть медь)
Значит, нужен металл, который стоит в ряду активности ДО водорода; в нашем случае это железо, ответ 2.
- Далее - во вторую пробирку с бромидом меди (II) добавили вещество, с помощью которого в результате обмена получился сульфид меди (II).
Соответственно, второе вещество должно быть растворимым.
Мы можем взять либо сульфид натрия, либо гидросульфид калия, или сероводород.
Самый приемлемый вариант из всех перечисленных - это сульфид натрия.
Значит, ответ 31.
Задание 5
Для выполнения заданий 30 используйте следующий перечень веществ:
сера, азотная кислота, гидроксид натрия, фосфин, фторид серебра, ацетат кальция.
Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, между которыми может протекать окислительно - восстановительная реакция. В этой реакции одна молекула восстановителя отдает шесть электронов. В ответе запишите уравнение окислительно - восстановительной реакции с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение:
ОВР - это всегда не просто, но если мыслить системно, то даже это задание становится легким.
Итак, у нас есть одно простое вещество, одна кислота, одна щелочь, один газ, две средних соли.
- Как правило, в таких заданиях мы ищем окислитель, среду и вещество, в котором ионы могут увеличить свою степень окисления.
Для этих целей нужно проанализировать все возможные реакции; ты можешь начать с того вещества, которое лучше всего знаешь.
Я выбрала азотную кислоту, так как она одна из моих любимых) и, является одним из наиболее часто встречающихся реагентов в этом задании:
- азотная кислота реагирует с гидроксидом натрия с образованием соли и воды - это не ОВР,
- азотная кислота реагирует с фосфином, и это ОВР:
Однако, в условии сказано, что одна молекула восстановителя отдает шесть электронов, и вроде нам подходит, так как у фосфора степень окисления была -3, а стала +5, но есть проблема - фосфор здесь представлен в виде иона, а не молекулы, поэтому данный вариант мы не рассматриваем.
- азотная кислота и фторид серебра - эта реакция не идет, так как все продукты реакции растворимые;
- азотная кислота и ацетат кальция - также не идет, продукты реакции растворимые;
- азотная кислота и сера - здесь происходит изменение степеней окисления:
Эта химическая реакция нам подходит)
Составляем электронный баланс:
Теперь уравниваем эту реакцию в соответствии с электронным балансом:
Азот в степени окисления +5 (или азотная кислота) является окислителем.


Оксид серы (4)реагирует с 3. оксидом алюминия






























В окружности с радиусом 7.5 см проведены диаметр АС и хорда АК ,равная 9 см.Найдите длину хорды СК.Если можно решение с рисунком.Спасибо
существует несколько трактовок понятия экономика,что ее иллюстрирует как хоз-во1 открытие сети продовльственных товаров2 объяснение причин роста инфляции3 расчет показателей гос-го бюджета4 прогнозирование спроса на товары
Лодка прошла путь по течению реки за 5 часов , а обратно - за 7 часов. За сколько времени это же расстояние пройдёт плот пущенный по течению реки?
Решите неравенство: 1) 5x^-17x-12>0 2) x^-121 4,7x 4) x(x-7)-18>7(9-x) Решите неравенство методом интервалов: 1) (x 9) (x-3) 8 1
У человека ген нормального слуха (B) доминирует над геном глухоты и находится в аутосоме. Ген цветовой слепоты (дальтонизм -d) рецессивный и сцеплен с X-хромосомой. В семье, где мать старадала глухотой, но имела нормальное цветовое зрение, а отец - с нормальным слухом (гомозиготен), дальтоник, роди.
Читайте также:

