Образования ионной связи между магнием и хлором
Помогите со схеми образования ионной связи между атомами химических элементов:
а) калия и кислорода; б) лития и хлора; в) магния и фтора.
Помощь уже в пути, держи.
а) Рассмотрим схему образования ионной связи между натрием и
кислородом.
1. Натрий — элемент главной подгруппы I группы, металл. Его атому легче отдать I внешний электрон, чем принять недостающие 7: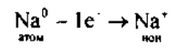
1. Кислород— элемент главной подгруппы VI группы, неметалл.
Его атому легче принять 2 электрона, которых не хватает до завершения внешнего уровня, чем отдать 6 электронов с внешнего уровня.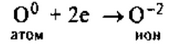
1. Сначала найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2(2∙1). Чтобы атомы Naотдали 2 электрона, их надо взять 2(2:1), чтобы атомы кислорода смогли принять 2 электрона, их нужно взять 1.
2. Схематично образование ионной связи между атомами натрия и кислорода можно записать так: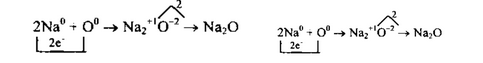
б) Рассмотрим схему образования ионной связи между атомами лития и фосфора.
I. Литий — элемент I группы главной подгруппы, металл. Его атому легче отдать 1 внешний электрон, чем принять недостающие 7: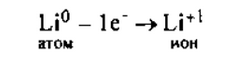
2. Хлор— элемент главной подгруппы VII группы, неметалл. Его
атому легче принять 1 электрон, чем отдать 7 электронов: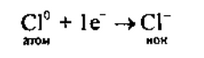
2. Наименьшее общее кратное 1, т.е. чтобы 1 атом лития отдал, а атом хлора принял 1 электрон, надо взять их по одному.
3. Схематично образование ионной связи между атомами лития и хлора можно записать так: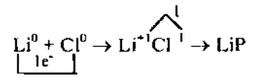
в) Рассмотрим схему образования ионной связи между атомами
магния и фтора.
1. Магний— элемент II группы главной подгруппы, металл. Его
атому легче отдать 2 внешних электрона, чем принять недостающие 6: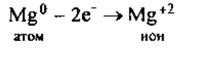
2. Фтор — элемент главной подгруппы VII группы, неметалл. Его
атому легче принять 1 электрон, которого не хватает до завершения вешнего уровня, чем отдать 7 электронов: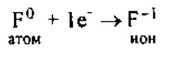
2. Найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2(2∙1). Чтобы атомы магния отдали 2 электрона, нужен только один атом, чтобы атомы фтора смогли принять 2 электрона, их нужно взять 2(2:1).
3. Схематично образование ионной связи между атомами лития и фосфора можно записать так: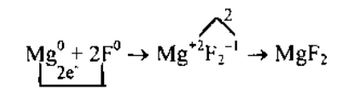
Ионная связь – химическая связь, образованная электростатическим притяжением между катионами и анионами.
Катионы – положительно заряженные ионы, образующийся в результате отдачи атомом электрона (например, K 
(ион калия), Fe 2 
(ион железа), NH4 
(ион аммония), [Cu(NH3)4] 2 
(ион тетраамминмеди).
Анион – отрицательно заряженный ион, образующийся в результате приобретения атомом электрона (Cl 
(хлорид-ион), N 3 
(нитрид-ион), PO4 3 
(фосфат-ион), [Fe(CN)6] 4 
(гексацианоферрат-ион).
По значению заряда ионы подразделяются на:
- однозарядные (K
![]()
, Cl![]()
, NH4![]()
, NO3![]()
и т. п.); - двухзарядные (Са 2
![]()
, O 2![]()
, SО4 2![]()
и т. д.); - трёхзарядные (Аl 3
![]()
, РО4 3![]()
и т. п.).
В образовании ионной связи участвуют атомы металлов и неметаллов. Образование таких соединений получается из атомов, резко отличающихся по значению электроотрицательности в результате перехода электронов от атомов одних элементов, к другим.
При образовании ионной связи атом неметалла принимает электроны на внешний энергетический уровень и достраивает его до устойчивой конфигурации с восьмью электронами (правило октета).
Рассмотрим механизм образования ионной связи на примере. Реакция образования хлорида натрия: атом щелочного металла теряет электрон (образуется катион натрия), а атом галогена – приобретает (образуется хлорид-ион). Ионы образуют соединение за счет электростатического притяжения между ними.

Для ионной связи характерно:
- ненаправленность – электростатическое взаимодействие может осуществляться в любом направлении;
- ненасыщаемость – одна заряженная частица может взаимодействовать с любым число других заряженных частиц.
Пример. Схема образования ионного соединения:

,

,

,

Общая характеристика ионной химической связи
Ионы – это частицы, имеющие заряд, в которые превращаются атомы в процессе отдачи или принятия электронов. Притягиваются они друг к другу довольно сильно, именно по этой причине у веществ с таким типом связи высокие температуры кипения и плавления.

Ионная связь – химическая связь между разноименными ионами, обусловленная их электростатическим притяжением. Ее можно считать предельным случаем ковалентной связи, когда разность электроотрицательностей связанных атомов так велика, что происходит полное разделение зарядов.

Рис. 2. Ионная химическая связь.
Обычно считается, что связь приобретает электронный характер, если ЭО >1,7.
Различие в значении электроотрицательности тем больше, чем дальше элементы расположены друг от друга в периодической системе по периоду. Эта связь характерна для металлов и неметаллов, особенно расположенных в наиболее удаленных группах, например, I и VII.
Пример: поваренная соль, хлорид натрия NaCl:

Рис. 3. Схема ионной химической связи хлорида натрия.
Ионная связь существует в кристаллах, она обладает прочностью, длиной, но не насыщена и не направлена. Ионная связь характерна только для сложных веществ, таких как соли, щелочи, некоторые оксиды металлов. В газообразном состоянии такие вещества существуют в виде ионных молекул.
Ионная химическая связь образуется между типичными металлами и неметаллами. Электроны в обязательном порядке от металла переходят к неметаллу, образуя ионы. В результате образуется электростатическое притяжение, которое называют ионной связью.
На самом деле полностью ионной связи не встречается. Так называемая ионная связь носит частично ионный, частично ковалентный характер. Однако связь сложных молекулярных ионов может считаться ионной.
Примеры образования ионной связи
Можно привести несколько примеров образования ионной связи:
- взаимодействие кальция и фтора
– кальцию легче отдать два электрона, чем получить недостающие.
– фтору, наоборот, легче принять один электрон, чем отдать семь электронов.
Найдём наименьшее общее кратное между зарядами образующихся ионов. Оно равно 2. Определим число атомов фтора, которые примут два электрона от атома кальция: 2 : 1 = 2. 4.
Составим формулу ионной химической связи:
- взаимодействие натрия и кислорода
– натрий находится в главной подгруппе первой группы. Он с легкостью может отдавать один электрон.
– кислород находится в главной подгруппе шестой группы. Естественно, что ему легче получить два электрона, чем отдать шесть.
Найдём наименьшее общее кратное между зарядами образующихся ионов. Оно равно 2 : 1 = 2. Определим число атомов натрия, которые отдадут два электрона атому кислорода: 2. 4.
Составим схему образования ионной связи:
Что мы узнали?
Ионная связь и ионы изучаются в 11 классе. Ионная химическая связь – связь между положительными и отрицательными ионами, осуществляемая между металлами и неметаллами.
Образовательный журнал для школьников, воспитателей и учителей
Ионная химическая связь – это связь, которая образуется между атомами химических элементов (положительно или отрицательно заряженные ионы). Так что же такое ионная связь, и как происходит ее образование?
Общая характеристика ионной химической связи
Ионы – это частицы, имеющие заряд, в которые превращаются атомы в процессе отдачи или принятия электронов. Притягиваются они друг к другу довольно сильно, именно по этой причине у веществ с таким типом связи высокие температуры кипения и плавления.

Ионная связь – химическая связь между разноименными ионами, обусловленная их электростатическим притяжением. Ее можно считать предельным случаем ковалентной связи, когда разность электроотрицательностей связанных атомов так велика, что происходит полное разделение зарядов.

Рис. 2. Ионная химическая связь.
Обычно считается, что связь приобретает электронный характер, если ЭО >1,7.
Различие в значении электроотрицательности тем больше, чем дальше элементы расположены друг от друга в периодической системе по периоду. Эта связь характерна для металлов и неметаллов, особенно расположенных в наиболее удаленных группах, например, I и VII.
Пример: поваренная соль, хлорид натрия NaCl:

Рис. 3. Схема ионной химической связи хлорида натрия.
Ионная связь существует в кристаллах, она обладает прочностью, длиной, но не насыщена и не направлена. Ионная связь характерна только для сложных веществ, таких как соли, щелочи, некоторые оксиды металлов. В газообразном состоянии такие вещества существуют в виде ионных молекул.
Ионная химическая связь образуется между типичными металлами и неметаллами. Электроны в обязательном порядке от металла переходят к неметаллу, образуя ионы. В результате образуется электростатическое притяжение, которое называют ионной связью.
На самом деле полностью ионной связи не встречается. Так называемая ионная связь носит частично ионный, частично ковалентный характер. Однако связь сложных молекулярных ионов может считаться ионной.
Примеры образования ионной связи
Можно привести несколько примеров образования ионной связи:
- взаимодействие кальция и фтора
Ca 0 (атом) -2e=Ca 2 + (ион)
– кальцию легче отдать два электрона, чем получить недостающие.
F 0 (атом)+1е= F- (ион)
– фтору, наоборот, легче принять один электрон, чем отдать семь электронов.
Найдём наименьшее общее кратное между зарядами образующихся ионов. Оно равно 2. Определим число атомов фтора, которые примут два электрона от атома кальция: 2: 1 = 2. 4.
Составим формулу ионной химической связи:
Ca 0 +2F 0 →Ca 2 +F−2.
- взаимодействие натрия и кислорода
Данный урок посвящен обобщению и систематизации знаний о видах химической связи. В процессе урока будут рассмотрены схемы образования химической связи в различных веществах. Урок поможет закрепить умение определять вид химической связи в веществе по его химической формуле.
Тема: Химическая связь. Электролитическая диссоциация
Урок: Схемы образования веществ с различным типом связи
Рис. 1. Схема образования связи в молекуле фтора
Молекула фтора состоит из двух атомов одного химического элемента-неметалла с одинаковой электроотрицательностью, следовательно, в этом веществе реализуется ковалентная неполярная связь. Изобразим схему образования связи в молекуле фтора. Рис. 1.
Вокруг каждого атома фтора с помощью точек нарисуем семь валентных, то есть внешних, электронов. До устойчивого состояния каждому атому необходим еще один электрон. Таким образом, образуется одна общая электронная пара. Заменив ее черточкой, изобразим графическую формулу молекула фтора F-F.
Вывод: ковалентная неполярная связь образуется между молекулами одного химического элемента-неметалла. При таком типе химической связи образуются общие электронные пары, которые в равной степени принадлежат обоим атомам, то есть не происходит смещения электронной плотности ни к одному из атомов химического элемента

Рис. 2. Схема образования связи в молекуле воды
Молекула воды состоит из атомов водорода и кислорода - двух элементов-неметаллов с разными значениями относительной электроотрицательности, следовательно, в этом веществе - ковалентная полярная связь.
Так как кислород - более электроотрицательный элемент, чем водород, общие электронные пары смещаются в сторону кислорода. На атомах водорода возникает частичный заряд, а на атоме кислорода - частичный отрицательный. Заменив обе общие электронные пары черточками, а точнее стрелками, показывающими смещение электронной плотности, запишем графическую формулу воды Рис. 2.
Вывод: ковалентная полярная связь возникает между атомами разных элементов-неметаллов, то есть с разными значениями относительной электроотрицательности. При этом типе связи образуются общие электронные пары, которые смещаются в сторону более электроотрицательного элемента .
1. №№ 5,6,7 (с.145) Рудзитис Г.Е. Неорганическая и органическая химия. 8 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. М.: Просвещение. 2011 г.176с.:ил.
2. Укажите частицу с наибольшим и наименьшим радиусом: атом Ar, ионы: K + , Ca 2+ , Cl - .Ответ обоснуйте.
3. Назовите три катиона два аниона, которые имеют такую же электронную оболочку, что и ион F - .
Данный урок посвящен обобщению и систематизации знаний о видах химической связи. В процессе урока будут рассмотрены схемы образования химической связи в различных веществах. Урок поможет закрепить умение определять вид химической связи в веществе по его химической формуле.
Тема: Химическая связь. Электролитическая диссоциация
Урок: Схемы образования веществ с различным типом связи
Рис. 1. Схема образования связи в молекуле фтора
Молекула фтора состоит из двух атомов одного химического элемента-неметалла с одинаковой электроотрицательностью, следовательно, в этом веществе реализуется ковалентная неполярная связь. Изобразим схему образования связи в молекуле фтора. Рис. 1.
Вокруг каждого атома фтора с помощью точек нарисуем семь валентных, то есть внешних, электронов. До устойчивого состояния каждому атому необходим еще один электрон. Таким образом, образуется одна общая электронная пара. Заменив ее черточкой, изобразим графическую формулу молекула фтора F-F.
Вывод: ковалентная неполярная связь образуется между молекулами одного химического элемента-неметалла. При таком типе химической связи образуются общие электронные пары, которые в равной степени принадлежат обоим атомам, то есть не происходит смещения электронной плотности ни к одному из атомов химического элемента

Рис. 2. Схема образования связи в молекуле воды
Молекула воды состоит из атомов водорода и кислорода - двух элементов-неметаллов с разными значениями относительной электроотрицательности, следовательно, в этом веществе - ковалентная полярная связь.
Так как кислород - более электроотрицательный элемент, чем водород, общие электронные пары смещаются в сторону кислорода. На атомах водорода возникает частичный заряд, а на атоме кислорода - частичный отрицательный. Заменив обе общие электронные пары черточками, а точнее стрелками, показывающими смещение электронной плотности, запишем графическую формулу воды Рис. 2.
Вывод: ковалентная полярная связь возникает между атомами разных элементов-неметаллов, то есть с разными значениями относительной электроотрицательности. При этом типе связи образуются общие электронные пары, которые смещаются в сторону более электроотрицательного элемента .
1. №№ 5,6,7 (с.145) Рудзитис Г.Е. Неорганическая и органическая химия. 8 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. М.: Просвещение. 2011 г.176с.:ил.
2. Укажите частицу с наибольшим и наименьшим радиусом: атом Ar, ионы: K + , Ca 2+ , Cl - .Ответ обоснуйте.
3. Назовите три катиона два аниона, которые имеют такую же электронную оболочку, что и ион F - .
1. Атомы металлов, отдавая внешние электроны, превращаются в положительные ионы:
где n — число электронов внешнего слоя атома, соответствующее номеру группы химического элемента.
2. Атомы неметаллов, принимая электроны, недостающие до завершения внешнего электронного слоя, превращаются в отрицательные ионы:

3. Между разноимённо заряженными ионами возникает связь, которая называется ионной.

1. Дополните схемы образования положительно заряженных ионов. Из букв, соответствующих правильным ответам, вы составите название одного из древнейших природных красителей: индиго.


3. Верны ли следующие утверждения?
3) верно только Б
4. Подчеркните пары химических элементов, между которыми образуется ионная химическая связь.
1) калий и кислород
2) водород и фосфор
3) алюминий и фтор
4) водород и азот
Составьте схемы образования химической связи между выбранными элементами.

5. Придумайте рисунок в стиле комиксов, отражающий процесс образования ионной химической связи.
6. Составьте схему образования двух химических соединений с ионной связью по условной записи:

Подходят для данной схемы кальций и хлор, магний и хлор, кальций и бром, магний и бром.

7. Напишите небольшое литературное произведение (эссе, новеллу или стихотворение) об одном из веществ с ионной связью, которое человек применяет в быту или на производстве. Для выполнения задания используйте возможности Интернета.
Хлорид натрия - вещество с ионной связью, без него нет жизни, хотя, когда его много - это тоже нехорошо. Даже есть такая народная сказка, где рассказывается о том, что принцесса любила своего отца короля так сильно, как соль, за что была изгнана из королевства. Но, когда король однажды попробовал еду без соли и понял, что есть невозможно, он тогда понял, что дочь его очень сильно любила. Значит, соль - есть жизнь, но её потребление должно быть в меру. Потому что чрезмерное потребление соли сильно вредит здоровью. Избыток соли в организме приводит к заболеванию почек, меняет цвет кожи, задерживает излишнюю жидкость в организме, что приводит к отёкам и нагрузке на сердце. Поэтому, надо контролировать потребление соли. 0,9% раствор хлорида натрия - это физиологический раствор, используется для вливания лекарств в организм. Поэтому, очень трудно ответить на вопрос: полезна или вредна соль? Она нам нужна в меру.

Прежде, чем узнать, что такое ионная связь и как она образуется, побываем в одной удивительной стране.
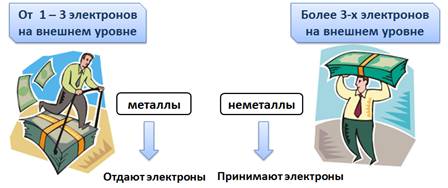
Речь в истории шла об элементах металлах и неметаллах. Разберёмся почему.
У атомов металлов на внешнем уровне всегда мало электронов (от одного до трех), естественно, что им легче отдать электроны для завершения энергетического уровня, а для неметаллов, у которых более трех электронов, легче присоединить электроны для завершения энергетического уровня.
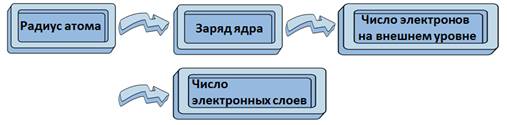
Главной характеристикой атома является заряд его ядра, от которого зависит и радиус атома. Чтобы определить число электронов на внешнем уровне достаточно знать номер группы.
Теперь, составим логическую цепочку: радиус атома зависит от заряда ядра, числа электронов на внешнем уровне, числа электронных слоев.
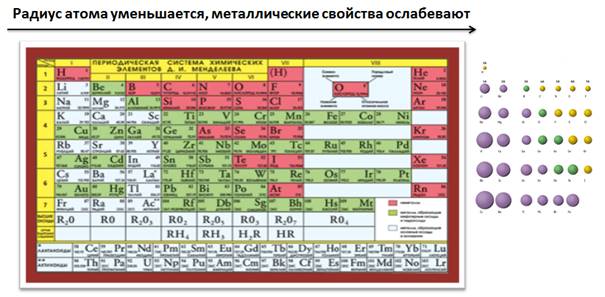
Рассмотрим, как изменяются металлические и неметаллические свойства по периодам и группам периодической системы.
В периодах слева направо увеличивается заряд ядра, радиус атома постепенно уменьшается, увеличивается число электронов на внешнем уровне, которые сильнее притягиваются к положительно заряженному ядру, и атомам становится легче присоединить электроны до завершения уровня, чем отдать их, поэтому металлические свойства ослабевают, а увеличиваются неметаллические.
В Периодической таблице каждый период начинается металлом IA группы (это типичные металлы) и заканчивается неметаллом, в VIIA группе уже находятся типичные неметаллы.
В пределах одной группы главной подгруппы, сверху вниз увеличивается заряд ядра атома, увеличиваются радиусы атомов, число электронов на внешнем уровне остается постоянным, но увеличивается число энергетических уровней, и электроны будут удаляться от ядра, поэтому атомам их легче отдать, чем присоединить до завершения внешнего уровня, следовательно, металлические свойства будут увеличиваться, а неметаллические ослабевать. Поэтому атомы элементов, расположенные внизу в пределах одной группы, будут проявлять более металлические свойства, нежели которые находятся вверху.

Элементы VIIIА группы называют благородными или инертными газами. У всех этих атомов завершен энергетический уровень, для любого атома – это устойчивое состояние. Поэтому они не отдают и не присоединяют электроны. Они практически не соединяются с другими атомами и друг с другом, т.е. они инертны.
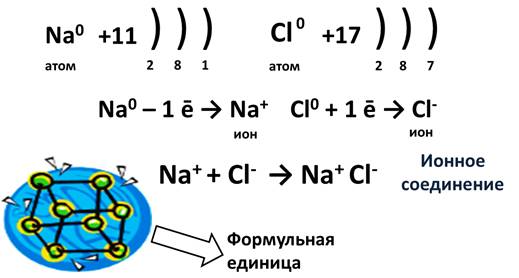
Представьте себе, встречается элемент IA группы, у которого 1 электрон, и элемент VIIA группы, у которого 7 электронов. Пусть это будут Na и Cl. У натрия один единственный электрон, а хлору как раз не хватает одного электрона для завершения внешнего уровня. Если натрий отдаст свой электрон, то он приобретет положительный заряд, а когда атом хлора заберет этот электрон, он превратится в отрицательно заряженную частицу. Эти заряженные частицы, называются ионами. Из курса физики известно, что разноименные заряды притягиваются, поэтому ион натрия и хлора соединятся и между ними возникнет химическая связь. Эта связь и будет называться ионной. В результате этого взаимодействия образуется ионное соединение. Для выражения этих ионных соединений пользуются формульными единицами, т.е. говорят не молекула NaCl, а формульная единица NaCl.
Ионная связь образуется между типичным металлом и типичным неметаллом.
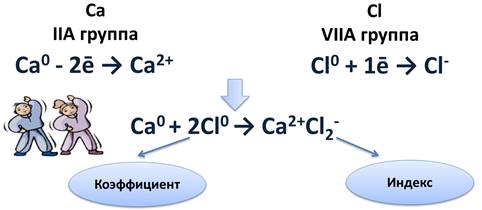
Схема образования ионной связи между атомами кальция и хлора
Кальций расположен во IIA группе, значит, на внешнем энергетическом уровне у него два электрона, которые легче отдать, чем присоединить шесть до завершения энергетического уровня. После чего он становится положительным ионом.
Са 0 - 2ē → Са 2+
Атому хлора, у которого на внешнем уровне 7 электронов, легче присоединить 1 электрон до завершения уровня, чем отдать 7 электронов. После присоединения 1 электрона, атом хлора становится отрицательным ионом.
Cl 0 + 1ē → Cl -
Найдём наименьшее общее кратное между образовавшимися ионами. Оно равно двум. Следовательно, нужно взять 1 атом кальция и 2 атома хлора. Это схематично можно показать так:
Ca 0 + 2Cl 0 → Ca 2+ Cl2 - .
Цифра 2, стоящая перед атомом хлора, называется коэффициентом. Коэффициент обычно показывает число атомов, молекул или формульных единиц, а цифра 2 после иона хлора, называется индексом. Индекс показывает число атомов в молекуле или ионов в формульной единице.
Читайте также:










