Нуклеиновые кислоты в онкологии
Не вызывает сомнения, что обмен нуклеиновых кислот тесно связан с обменом белков. Обнаружены многочисленные корреляции между содержанием тех и других во время роста, эмбрионального развития и при возникновении опухоли (Шмидт, 1953).
Однако эти наблюдения в общем не дали особенно ценных результатов, поскольку наличие корреляции само по себе еще не доказывает существования причинной взаимосвязи и не позволяет вскрыть механизм взаимодействия белков и нуклеиновых кислот.
В опытах с бактериофагами и вирусами растений показано, что в клетку, имеющую соответствующие наследственные и физиологические свойства, проникает чужеродный нуклеопротеидный комплекс; он изменяет внутриклеточную среду таким образом, что биохимический аппарат клетки начинает репродуцировать только компоненты вируса (Коэн, 1952).
Примеры изменения обмена под влиянием нуклеиновых кислот дают опыты по трансформирующему действию на бактерий дезоксирибонуклеиновой кислоты.
Недавно опубликованы интересные исследования Херши и Чейза (1952), показавшие, что при заражении Escerichia coli бактериофагом Т2 большая часть серусодержащего белка фага остается на поверхности клетки, тогда как большая часть дезоксирибонуклеиновой кислоты проникает в клетку.
Механизм действия этих нуклеиновых кислот пока остается тайной, но эти вопросы интенсивно разрабатываются, и можно надеяться, что в дальнейших исследованиях будут получены данные, представляющие большой интерес для всех изучающих проблему рака.
Каким должно быть питание при онкологических заболеваниях? Какие продукты абсолютно противопоказаны при той или иной форме рака?
Фитотерапия способна оказать существенную помощь не только в лечении онкологических заболеваний, но также и в их профилактике.
Многих людей, имеющих у себя или у родственников онкологическое заболевание, интересует вопрос: передается ли рак по наследству?
Лечение рака во время беременности является довольно сложным, ведь большинство лекарственных средств обладает токсичностью.
Какие перспективы у беременности после перенесенного онкологического заболевания? Следует ли выдерживать срок после лечения рака?
Профилактика является важной частью общей борьбы с онкологическими заболеваниями. Как же уменьшить вероятность возникновения рака?
Что представляет из себя паллиативное лечение рака? Как оно может повлиять на качество жизни онкологического больного и изменить ее к лучшему?
Учеными разработано достаточно много перспективных методов лечения рака, пока еще не признанных официальной медициной. Но все может измениться!
Как найти силы для борьбы с раком? Как не впасть в отчаяние от возможной инвалидности? Что может послужить надеждой и смыслом жизни?
Бытует такое мнение, что постоянные стрессовые ситуации способны привести к развитию онкологических заболеваний. Так ли это?
Многие онкологические больные часто страдают от резкой потери веса. Чем это вызвано и можно ли как-то справиться с этой проблемой?
Правила ухода за больными, вынужденными постоянно находиться в кровати, имеют свои особенности и их нужно обязательно знать.

С момента открытия присутствия в крови и других биологических жидкостях (ликворе, лимфе, моче и т.д.) человека внеклеточных или циркулирующих нуклеиновых кислот (вкНК) проводятся исследования не только их биологической роли, но и возможности использования в качестве диагностических показателей при различных патологических состояниях. вкНК рассматриваются как потенциальные диагностические, прогностические и предиктивные биомаркеры рака [1; 2]. Leon S.A. и соавт. [3] установили увеличение концентрации вкДНК в крови больных со злокачественными новообразованиями с различной локализацией опухоли (колоректальный рак, рак легких, молочной железы, желудка и пищевода и др.) по сравнению со здоровыми лицами. Было показано, что в сыворотке крови у больных с онкологическими заболеваниями концентрация внДНК варьировала в пределах от 50 до 5000 нг/мл, тогда как у лиц контрольной группы – не превышала 50 нг/мл [4].
Поскольку вкДНК имеют достаточно короткий период полувыведения из организма, то, по мнению Leon S.A. и соавт. [3], её можно рассматривать как маркер опухолевой нагрузки.
Abo-El-Eneen M.S. и соавт. [5] показали, что концентрация вкДНК в крови больных со злокачественными новообразованиями превышала не только аналогичный показатель здоровых лиц, но и больных с доброкачественными опухолями. После лучевой терапии уровень вкДНК снижался у больных раком легких, яичников, матки, молочной железы и др., но степень снижения существенно варьировала. У больных, у которых отсутствовал ответ на противоопухолевую терапию, содержание вкДНК в сыворотке крови сохранялось на высоком уровне или продолжало возрастать. Показано, что больные, у которых после лечения сохранялся высокий уровень вкДНК, имели более плохой прогноз [4; 6; 7]. Проведен анализ содержания вкДНК в крови больных после хирургического лечения опухолей. У больных без рецидивов после хирургического лечения содержание вкДНК снижалось. У больных, у которых заболевание прогрессировало, уровень вкДНК оставался высоким [8].
До сих пор нет единого мнения по вопросу, что лучше использовать для определения вкНК – плазму или сыворотку крови. Содержание вкДНК в сыворотке крови существенно превышает таковое в плазме за счет выхода вкДНК из погибающих в процессе свертывания крови лейкоцитов [4].
Было предложено использовать определение концентрации вкНК в плазме/сыворотке крови больных для скрининга некоторых видов рака (рак легких, рак молочной железы и колоректальный рак). В качестве аргумента приводили результаты, полученные Frattini M. et al., которые показали, что количественное определение вкДНК в плазме крови больных с колоректальным раком является более чувствительным методом, чем раково-эмбриональный антиген [9; 10].
Hashad D. et al. выявили взаимосвязь между стадией, размером опухоли и увеличением вкДНК в крови больных раком молочной железы [11]. Вместе с тем опубликованы и другие данные, которые не выявили взаимосвязи между уровнем вкДНК, размером и локализацией опухоли. Кроме того, был установлен существенный рост концентрации вкНК в крови при других патологических состояниях (воспаление, сепсис), после тяжелой физической нагрузки, а также у пожилых людей. Другим фактором, ограничивающим внедрение количественного определения вкДНК в клинике, является проблема стандартизации методов. В связи с этим применение количественной оценки вкДНК как маркера онкопатологии на сегодняшний день не рекомендовано к использованию в клинике [12].
Развитие методов генетических исследований позволило вывести анализ вкНК на новый уровень. Достигнуты определенные успехи в идентификации типов вкНК в биологических жидкостях больных различными видами раков. Stroun и соавторы [13] высказали предположение, что часть вкДНК, которая определяется в плазме крови больных, имеет опухолевое происхождение. Friel A.M. et al. [14] сообщили о появлении в крови больных специфических mRNA, ассоциированных с наличием рака молочной железы. Fleischhacker M. и Schmidt B. [15] показали, что циркулирующие нуклеиновые кислоты в крови онкологических больных имеют опухолевое происхождение, причем опухоль-ассоциированные изменения определяются как в вкДНК, так и в вкРНК. При этом фракция циркулирующей опухолевой ДНК часто может составлять менее 1% от общей вкДНК [16]. Установлено, что во вкДНК обнаруживаются нарушения, идентичные таковым как в первичной опухоли, так и в метастазах. В вкДНК обнаружены точечные мутации, микросателлитные повторы, инверсии и делеции. Микросателлитные повторы состоят из коротких ди-, три-, тетра-, пента- или гексануклеотидов, продублированных от нескольких до сотен раз. Увеличение количества микросателлитных повторов выше определенного порогового значения и их расположение в геноме приводит к развитию генетических дефектов. Кроме того, в вкДНК обнаружено гиперметилирование промотерных последовательностей. В плазме крови вкДНК также могут присутствовать в комплексе с нуклеосомами, митохондриальные ДНК [17]. Обсуждается их возможный прогностический и предиктивный потенциал, а также использование как инструмента для мониторинга последующей терапии.
Была сформулирована гипотеза генометастазов [18], согласно которой ДНК из опухолевых клеток способна проникать в здоровые клетки и индуцировать злокачественную трансформацию последних, что в конечном итоге приводит к образованию метастазов.
Помимо внеклеточных ДНК, проводится изучение внеклеточных РНК, главным образом microRNA. microRNA – это маленькие некодирующие одноцепочечные молекулы РНК. microRNA вовлечены в разнообразные процессы, включая иммунный ответ, репарацию ДНК, апоптоз, реакции окислительного стресса. Достаточно большое количество microRNA найдено в биологических жидкостях. Основная функция циркулирующих microRNA – обеспечение внеклеточной коммуникации, что играет важную роль в дифференциации и пролиферации. Высказано предположение о существовании активного механизма высвобождения внеклеточных microRNA, в частности посредством церамид-зависимого секреторного механизма. miRNA циркулирует в плазме крови в комплексе с липопротеинами, апоптотическими тельцами, микровезикулами или экзосомами, что делает их достаточно стабильными [19].
Дизрегуляция microRNA играет важную роль в инициации, развитии и прогрессировании некоторых видов рака у человека. Исследование microRNA является перспективным для ранней диагностики, прогноза и лечения злокачественных новообразований. На сегодняшний день предложено определение в сыворотке или плазме по меньшей мере 79 microRNA в качестве биомаркеров солидных или гематологических опухолей [19]. Получены предварительные данные о том, что циркулирующие microRNA могут быть маркерами предрасположенности к онкопатологии. Вполне вероятно, что сами циркулирующие microRNA могут быть потенциальными мишенями для лечения отдельных видов рака.
Обсуждается гипотеза о механизме передачи опухолевых сигнальных молекул при участии экзосом, в составе которых выявлены мРНК и микроРНК. При этом микроРНК подавляют иммунный ответ [20]. Бондарь Г.В. и соавт. (2013) высказали мнение, что внеклеточные нуклеиновые кислоты могут оказывать как стимулирующее, так и ингибирующее воздействие на иммунную систему. Эффект определяется нуклеотидной последовательностью вкНК, метилированием, а также зависит от того, находится ли вкНК в составе белкового комплекса [21].
Исследованиями Е.Ю. Рыковой и соавт. (2008) показано, что у 13% женщин с фиброаденомой и у 60% больных раком молочной железы в вкДНК плазмы крови встречается метилированная форма одного из трех генов опухолевой супрессии RASSF1A, Cyclin D2, RARb2. Если для исследования методом метил-специфичной полимеразной цепной реакции использовали суммарную вкДНК (вкДНК плазмы крови и из элюатов с форменных элементов клеток крови) метилированные формы этих генов выявляются у 95% женщин с раком молочной железы и у 87% с фиброаденомой молочной железы. Эти же авторы, используя метод количественной полимеразной цепной реакции с обратной транскрипцией, установили достоверное увеличение количества копий 18S рРНК и мРНК генов RASSF8 и Ki-67 в крови больных раком молочной железы по сравнению с аналогичными параметрами группы контроля и с фиброаденомой. Чувствительность метода анализ 18S рРНК в плазме крови составила 82%, специфичность 92% [22].
У 83% больных колоректальным раком мутации гена KRAS обнаружены не только в тканях, но и в циркулирующей вкДНК. Помимо этого, у 27% здоровых доноров также обнаружены мутантные гены KRAS в циркулирующей вкДНК, хотя онкологического процесса выявлено не было. Авторы исследования высказали предположение, что это может быть связано с более высоким риском развития колоректального рака [23]. Было показано, что совместное определение наличия мутантных генов KRAS в циркулирующей вкДНК и увеличение опухолевого маркера СА 19-9 в крови позволяют повысить чувствительность прогностического теста до 90% [24].
Получены интересные результаты о формах существования вкНК в крови онкобольных. Под действием экзонуклеаз вкДНК распадается на короткие олигомерные последовательности, которые связываются с эритроцитами. Связывание с эритроцитами олигонуклеотидов предотвращает появление в крови больных мононуклеотидов и продуктов их катаболизма, которые выполняют функцию аларминов. вкНК могут образовывать комплексы с лейкоцитами, что объясняет возможный механизм переноса ДНК опухолевых клеток в ткани, учитывая способность лейкоцитов к миграции [25].
Г.В. Бондарь и соавт. (2013) также показали более высокий уровень внНК опухолевого генеза в эритроцитарной фракции онкобольных. Кроме того, этими авторами установлено присутствие в эритроцитарной фракции высокомолекулярных последовательностей L1, продукты которой обладают эндонуклеазной активностью и участвуют в деградации внеклеточных нуклеиновых кислот опухолевого происхождения [21].
По данным С.Н. Тамкович и соавт. (2005) [26], в крови больных раком молочной железы не обнаружены вкНК, связанные с поверхностью клеток. У больных раком толстой кишки и раком желудка происходит снижение внРНК, связанных с клетками крови, по сравнению с группой контроля. Не было обнаружено зависимости степени увеличения вкНК от стадии заболевания и размера опухоли. В то же время опубликованы данные о снижении внНК, связанных с эритроцитами, в крови женщин с раком молочной железы относительно контроля [27].
Показано, что вкДНК – олигомеры могут связываться с белками, в частности с альбумином, фибронектином, лактоферрином и др. Приблизительно 1.5% белков плазмы крови обладают способностью связывать вкНК. Химическая модификация вкДНК оказывает безусловное влияние на их свойства. С клетками крови (эритроцитами и лейкоцитами) вкНК могут связываться как с помощью ионных взаимодействий, так и с белками клеточной мембраны [25].
Остается открытым вопрос о происхождении внНК в крови онкологических больных. Причинами увеличения вкНК в крови являются апоптоз/некроз клеток опухоли [2; 25; 28]. Кроме того, высказано предположение о существовании механизма активного высвобождения вкНК опухолевыми клетками (активная метаболическая секреция) [28]. Согласно этому механизму вкДНК секретируется в комплексе с РНК и гликопротеинами. Наконец, определенный вклад в общий пул вкНК могут вносить и нейтрофильные внеклеточные ловушки, при образовании во внеклеточное пространство которых секретируется ДНК в комплексе с гистонами и ферментами, высвобождаемыми из гранул нейтрофилов [28]. М.Л. Филипенко (2017) считает, что механизмы высвобождения нуклеиновых кислот из клетки могут различаться для разных типов рака [28].
Следовательно, в настоящее время можно выделить следующие направления исследования вкНК. Одно направление связано с изучением количества циркулирующих нуклеиновых кислот в крови больных с различными видами опухолей. Причем проводится определение вкДНК или РНК не только в плазме или сыворотке крови, но и связанные с клетками крови. Большой интерес представляет исследование динамики изменения концентрации вкНК в процессе лечения, особенно при применении различных видов терапии и их комбинации.
Другое важное направление связано с использованием циркулирующих ДНК для жидкостной биопсии, что представляется весьма перспективным для ранней диагностики опухолевого процесса. Перспективность исследования связана с тем, что в отличие от ДНК, полученной из биоптата пораженного органа, исследование вкДНК дает информацию не только о генетическом профиле первичной опухоли, но и метастазов. В этом плане представляются перспективными исследования последних лет, посвященных исследованию эпигенетических модификаций циркулирующей ДНК, важность которых подчеркнута в работе М.Л. Филипенко (2017) [28]. Речь идет о программном разделении метилированной вкДНК по фракциям, которые соответствуют специализированным клеткам организма человека, что дает возможность определять патологически измененные клетки органа, которые избыточно синтезируют и секретируют специфичную вкДНК [28].
Наряду с изучением вкДНК проводятся интенсивные исследования циркулирующих microRNA. Учитывая то, что microRNA в биологических жидкостях являются достаточно стабильными, ведется разработка определения множественного профиля циркулирующих в крови microRNA в качестве диагностического инструмента. Весомым аргументом являются результаты Bertoli G. et al. [31], показавших информативность определения профилей циркулирующих microRNA для ранней диагностики (miR-9, miR-10b и miR-17-5p), прогноза (miR-148a и miR-335), а также прогнозирования результатов лечения (miR-30c, miR-187 и miR-339-5p) рака молочной железы. Не менее перспективным направлением является разработка новых лекарственных препаратов, основанных на microRNA.
Третье направление связано с исследованием молекулярных механизмов высвобождения вкНК, форм их существования и путей утилизации вкНК из крови онкологических больных, что обеспечит безусловный прогресс в изучении роли вкНК в патогенезе опухолевого процесса.
Нуклеиновые кислоты, ДНК и РНК, несут информацию о строении, развитии и размножении всех клеток живого организма, поэтому неудивительно, что клетки тщательно оберегают эти структуры от действия потенциально опасных внешних факторов. Так, у бактерий геномные ДНК компактно упакованы с помощью специальных белков и защищены от окружающей среды прочной клеточной стенкой; в клетках высших организмов ДНК хранится в клеточном ядре в составе сложных структур – хромосом.
Нуклеиновые кислоты – довольно стабильные полимерные молекулы, поэтому они могут сохраняться в естественной среде длительное время после гибели организма. Так, в костной ткани относительно длинные фрагменты ДНК остаются практически неизменными в течение десятков тысяч лет (!), что делает возможным проведение палеогенетических исследований, таких как расшифровка генома мамонта или неандертальца.
Но иногда горизонтальный перенос ДНК становится реальным источником проблем. Речь идет о бактериальных пленках (так называемых биофильмах), которые образуются на твердых поверхностях, в том числе на поверхности эндопротезов, зубов (вызывая кариес), а также на стенках бронхов при бронхитах и пневмониях.
Что касается потребления ГМО человеком, то в наш организм ежедневно с пищей попадает значительное количество чужеродных ДНК различного происхождения. Известно, что у людей, потребляющих в пищу генно-модифицированную сою – самый распространенный трансгенный продукт, специфичный трансген успешно переваривается в желудочно-кишечном тракте (Netherwood et al., 2004).
Таким образом, непосредственной опасности, связанной с употреблением трансгенных продуктов, на сегодняшний день не выявлено. Безусловно, в процессе эволюции должны были появиться механизмы, защищающие клетки от вторжения чужеродной ДНК, столь широко распространенной в окружающей среде.
Тем не менее отношения между нами и тем, что мы едим, не так просты. Судя по результатам последних исследований, в организмах животных РНК растительного происхождения могут сохранять свою биологическую активность! Так, китайским исследователям удалось обнаружить в клетках желудочно-кишечного тракта и затем в крови лабораторной мыши и человека микроРНК из пищи (риса и растений семейства крестоцветных), причем в значительных концентрациях. Эта чужеродная микроРНК оказалась способна подавлять экспрессию одного из генов, кодирующего белок рецептора липопротеина низкой плотности (Zhang et al., 2012).
На пути агрессоров
Живые клетки не только заботливо охраняют свои генетические программы, но и активно борются с чужими. При заражении вирусами или бактериями первая реакция клетки-хозяина состоит в распознавании и уничтожении чужих нуклеиновых кислот; либо зараженная клетка включает механизмы самоликвидации, чтобы не допустить размножения инфекционных агентов в целом организме.
Узнавание двуцепочечной РНК как сигнала опасности опосредуется поверхностным фагоцитарным рецептором TRL3, который и запускает сигнальный каскад, активирующий усиленный синтез противоспалительных белков-интерферонов (Yu et al., 2011). Последние, специфически связываясь с клеточными рецепторами, активируют работу определенных генов, ответственных за противовирусный ответ. Например, ген, кодирующий фермент РНК-зависимую протеинкиназу (PKR), который индуцирует апоптоз (клеточное самоубийство), либо белковый комплекс OAS/RNAseL, который угнетает процессы репликации и трансляции вирусной РНК и т. д.
В конечном итоге зараженная вирусом клетка обычно теряет способность к делению и синтезу белков, а зачастую и вовсе элиминируется из организма.
Другой типичной реакцией зараженной клетки, которая активируется проникновением вирусной двуцепочечной РНК, является РНК-интерференция – лавинообразный процесс, приводящий к расщеплению чужеродной РНК и выключению вирусных генов.
Своя рубашка ближе к телу
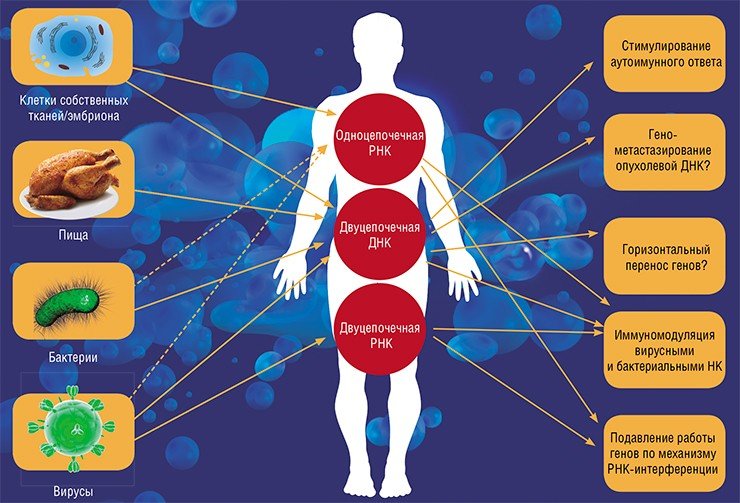
Все вышесказанное относилось к так называемым экзогенным нуклеиновым кислотам, чужеродным по отношению к организму. Однако достаточно давно было обнаружено присутствие в крови животных и человека, а также в тканях растений, эндогенных, т.е. собственных внеклеточных ДНК и РНК.
У высших растений внеклеточные РНК могут перемещаться между соседними клетками и транспортироваться до отдаленных органов и тканей через флоэму – проводящую сосудистую ткань, которая обеспечивает нисходящий транспорт органических веществ (продуктов фотосинтеза) из листьев к другим органам. Это было доказано в экспериментах по пересадке частей растений; был также обнаружен особый белок флоэмы, связывающий одноцепочечные РНК и способствующий их переносу как между соседними клетками, так и через фильтрующие структуры флоэмы.
В циркулирующем токе флоэмы были обнаружены матричные РНК собственных генов растения, микроРНК, малые интерферирующие РНК, а также несколько классов малых РНК с неизвестными функциями (кроме того, там присутствует большое количество экзогенной РНК - патогены, например вирусы растений, способны использовать этот путь для распространения своей генетической информации) (Lough, Lucas, 2012).
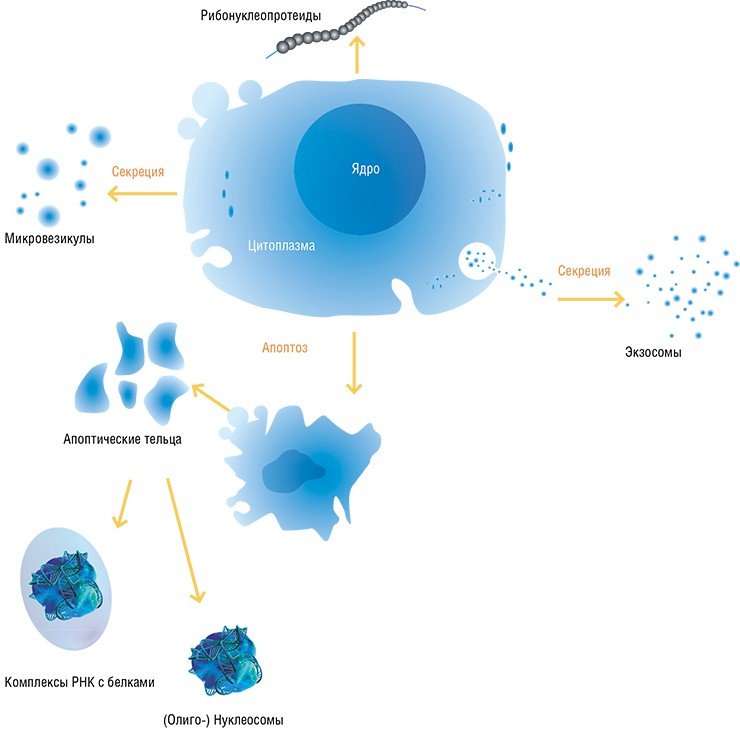
У млекопитающих внеклеточные ДНК представляют собой популяцию молекул размером от 180 до 3500 пар нуклеотидов. Один из источников их появления – клетки, разрушающиеся по механизму апоптоза или некроза (Jahr et al., 2001). Так погибают клетки опухолей, а также пострадавшие в результате травм, инфаркта миокарда, интенсивного воспалительного процесса и даже в результате интенсивной физической нагрузки.
На концентрацию внеклеточных ДНК и РНК влияет работа специальных расщепляющих ферментов, которых в крови предостаточно, и ДНК спасает лишь то, что вне клеток она появляется в комплексах с белками (например, с гистонами в виде нуклеосом) либо заключенная в мембранные структуры (экзосомы, микрочастицы и апоптотические тельца) (Stroun, 2000).
На благо.
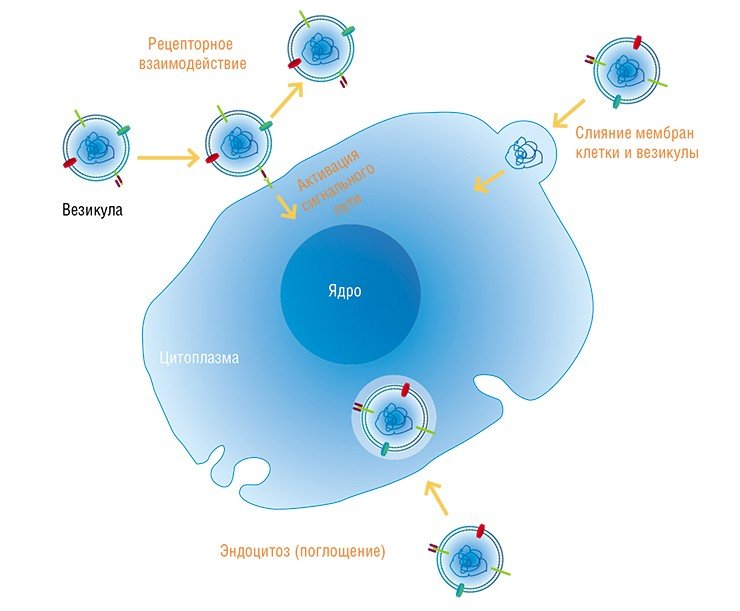
Внеклеточные нуклеиновые кислоты, синтезируемые в организме и участвующие в общей циркуляции (особенно это относится к РНК), играют важнейшую сигнальную роль в локальной и отдаленной регуляции развития органов и тканей, обеспечивая слаженную работу клеток в многоклеточных организмах.
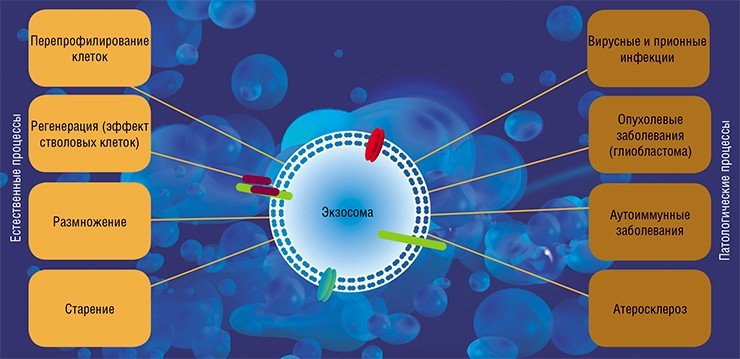
Так, в экспериментах по выявлению факторов, регулирующих клеточную дифференцировку и тканевый морфогенез, были открыты РНК-белковые комплексы, названные ангиотропинами. РНК этих комплексов представляют собой высокомодифицированные короткие (длиной до 200 нуклеотидов) последовательности. Взаимодействие таких молекул с белками в присутствии ионов металлов (Cu, Ca, Na, K) приводит к образованию комплексов, которые выступают в роли противоспалительных факторов (цитокинов) и как регуляторы дифференцировки клеток, выстилающих капилляры, при формировании этих структур (Wissler, 2004).
Перенос микроРНК между клетками может способствовать формированию самых разных физиологических эффектов, от регуляции иммунного ответа до миграции клеток. У беременной женщины микроРНК, секретируемые тканями эмбриона (правда, это фактически чужеродная для организма РНК), могут участвовать в адаптации материнского организма к беременности (Mincheva-Nilsson et al., 2010), а микроРНК материнского молока, в свою очередь, – в развитии иммунной системы ребенка (Kosaka et al., 2010).
Транспортируемые в экзосомах матричные и микроРНК могут защищать клетки от апоптоза и стимулировать их деление. Как оказалось, именно этот факт объясняет благотворные эффекты инъекций стволовых клеток в поврежденные органы. Ранее считалось, что стволовые клетки дают в поврежденных органах начало новой ткани, а оказалось, что все дело в продуцируемых ими экзосомах, которые помогают выживать и размножаться собственным клеткам поврежденной ткани (Biancone et al., 2012).
. и во вред
Однако способ межклеточных взаимодействий путем обмена нуклеиновыми кислотами может быть использован и во вред организму. Так, клетки опухолей (например, глиобластом) активно секретируют экзосомы, содержащие микроРНК, которые влияют на клетки стенок кровеносных сосудов и способствуют успешному распространению метастазов (Skog et al., 2008). (Кстати сказать, аналогичным образом может действовать и экзогенная микроРНК: в геноме вируса Эпштейна-Барра закодированы микроРНК, которые, будучи секретируемыми в составе экзосом зараженной клеткой, проникают в окружающие клетки и нарушают экспрессию цитокина, ответственного за активацию клеточного иммунного ответа (Pegtel et al., 2010)).
И это далеко не единственный пример негативного воздействия внеклеточных нуклеиновых кислот. Так, в ряде случаев в развитии патологических процессов непосредственно участвует внеклеточная ДНК. Наиболее известная болезнь такого типа – системная красная волчанка. При этом аутоиммунном заболевании в организме появляются патогенные антитела против собственной ДНК (Rumore et al., 1990). Эти антитела образуют с внеклеточными ДНК комплексы, которые способствуют развитию воспалительных реакций. Считается, что толчком к развитию болезни могут быть нарушения механизмов, регулирующих уровень циркулирующих ДНК, поскольку у многих больных отмечено снижение активности фермента, разрушающего ДНК, и фагоцитов, ее утилизирующих (Napirei et al., 2006).
Поскольку клетки способны захватывать продукты клеточного распада, была выдвинута гипотеза о возможности ракового перерождения клеток вследствие переноса генов из опухолевых клеток, погибших в результате апоптоза. По такому механизму рак мог бы, как инфекционное заболевание, передаваться через кровь от клетки к клетке пораженного организма, формируя отдаленные и соседние метастазы.
Все имеющиеся на сегодня данные однозначно свидетельствуют об огромной биологической значимости внеклеточных нуклеиновых кислот. Согласно самым смелым представлениям они являются не просто сигнальными молекулами, а важным действующим звеном механизмов, работающих как на организменном, так и на популяционном и, в конечном итоге, эволюционном уровне.
Черноловская Е. Л. РНК-интерференция: клин клином… // НАУКА из первых рук. 2008. № 1 (19). С. 54—59.
Rykova E. Y. et al. Cell-free and cell-bound circulating nucleic acid complexes: mechanisms of generation, concentration and content // Expert Opin Biol Ther. 2012 Suppl 1. P. 141—153.
Vlassov V. V., Pyshnyi D. V., Vorobjev P. E. Nucleic acids: structures, functions, and applications. In Handbook of nucleic acids purification, Ed. D. Liu, Boca Raton, CRC Press, 2009.

Александр Олегович Иванцов, доктор медицинских наук
— Чтобы ответить на этот вопрос, стоит разобраться как развивается опухоль. Она имеет автономный характер роста. Что это значит? В норме количество клеток в организме человека регулируется балансировкой двух противоположных процессов – клеточного деления и клеточной гибели. При росте опухоли прибавление клеточной массы опережает клеточную гибель. Это возможно по двум причинам – либо активируются процессы пролиферации, т.е. деления клетки, либо угнетается апоптоз, т.е. запрограммированная клеточная гибель. Автономность опухоли состоит в том, что ее клетки не способны реагировать на внешние сигналы организма, и, как следствие, она продолжает рост.
Если изменения нуклеотидной последовательности ДНК происходят в значащих фрагментах ДНК (прим. – экзонах), то они могут привести к развитию опухоли. К развитию рака приводят в основном мутации, нарушающие баланс деления и гибели клеток, то есть мутации в генах, контролирующих именно эти процессы. Мутации могут возникать случайно, например, в процессе удвоения ДНК в результате деления клетки. А могут возникать под влиянием мутагенов: например, воздействия ультрафиолетового или рентгеновского излучения, высокой температуры, некоторых химических веществ. На последний вопрос, можно ответить, что патогенность мутации можно предположить в первую очередь по функции гена, который она затрагивает, по её структурным характеристикам (насколько сильно она нарушает или изменяет работу этого гена), и подтвердить путем функциональных исследований (например, на клеточных культурах).
— Что такое онкогены?
— Онкогеном называется ген, который в норме не оказывает влияние на процессы деления и гибели клеток, а в опухоли активизируется, вследствие чего раковые клетки приобретают способность к неконтролируемому размножению. Кроме того, в настоящее время известно о роли антионкогенов. В норме они подавляют процесс деления клеток или способствуют их гибели, а в опухоли этот сдерживающий эффект подобных генов отсутствует, тем самым провоцируется рост опухолевых масс. Современная наука полагает, что для возникновения трансформированного клеточного клона необходимо как минимум пять-девять мутаций в разных онкогенах и антионкогенах.
— Эти мутации можно выявить с помощью генетического исследования?

— Кому и чем могут помочь генетические исследования? Верно ли, что от генетического исследования может зависеть успех лечения? Кому стоит пройти генетическое исследование на мутации?
— Сфера медицинского применения ДНК- и РНК-тестов в современной онкологии постоянно расширяется. Сейчас это тестирование позволяет диагностировать наследственные опухолевые синдромы, выявить предиктивные мутации, осуществить анализ экспрессионных характеристик опухоли. Также совершенствуются технологии, которые позволяют уточнять диагноз опухолей с невыявленным первичным очагом, эффективно контролировать течение заболевания и изменения свойств опухоли (жидкостная биопсия), выполнять различные биологические тесты с опухолевыми клетками.
Индивидуализация лечения онкологического пациента во многих случаях напрямую зависит от результатов генетического тестирования. Эмпирический подход, сопряжённый со случайным перебором биологически активных химикатов, постепенно замещается научно-обоснованным, молекулярно-направленным поиском специфических противоопухолевых средств, направленных на активацию или инактивацию ключевых биохимических компонентов опухолевой трансформации.
Например, еще недавно клиническое деление всех первичных опухолей легкого на мелкоклеточный и немелкоклеточный рак было достаточным для определения стратегии лечения. Ситуация изменилась с открытием активирующих мутаций в гене, который кодирует рецептор эпидермального фактора роста — EGFR, сделавших этот онкогенный белок избирательной мишенью для воздействия препаратов ингибиторов EGFR. Мутации EGFR, как правило, встречаются у пациентов с аденокарциномой легкого. Тест на мутацию EGFR позволяет практически со 100%-й достоверностью отобрать тех больных, у которых гарантирован положительный результат применения гефитиниба, эрлотиниба или афатиниба.
— Может ли генетическое исследование помочь здоровому человеку предупредить рак или выявить его на ранней стадии?
Генетическое исследование при подозрении на наследственный раковый синдром носит комплексный характер. Оно начинается со сбора онкологического анамнеза ‒ уделяется внимание случаям злокачественных заболеваний у кровных родственников. В результате составляются родословные, позволяющие заподозрить наследственную патологию. На заключительном этапе проводится анализ ДНК, что позволяет установить наличие в генотипе больного, а также членов его семьи, подозреваемые мутации.
— Какие виды мутаций ученые уже выявили? Существует ли для каждого вида таргетный препарат? Как именно работает таргетный препарат?
— Много разных видов мутаций при разных опухолях известны, но наибольший интерес представляют мутации в онкогенах, в частности, в рецепторных протеинкиназах, для блокировки которых разрабатываются специфические препараты. Мутации в протеинкиназах изменяют конформацию белковых молекул и, таким образом, формируют идеальное терапевтическое окно. Таргетный препарат избирательно воздействует на клетки опухоли, содержащие молекулярную мишень, и этим выгодно отличается от химиотерапии. Известно об успешном использовании ингибитора тирозинкиназы ALK – кризотиниба – у больных с ALK-транслоцированными карциномами легкого. Успешным оказалось и применение специфических ингибиторов мутированного белка BRAF – вемурафениба и дабрафениба для лечения больных меланомой. Другой пример: ген BRCA1 кодирует фермент репарации ДНК. BRCA1-дефицитные клетки демонстрируют неспособность эффективно удалять сшивки ДНК, индуцированные препаратами платины. В наследственных BRCA1-ассоциированных раках отмечается наибольшая эффективность цисплатина, т.к. в опухолевых клетках наблюдается соматическая утрата оставшегося BRCA1-аллеля, в то время как нормальные клетки носительниц мутаций BRCA1 сохраняют интактную копию данного гена. Этим обусловлено уникальное терапевтическое окно и это объясняет высокую эффективность цисплатина при лечении BRCA1-ассоциировнного рака молочной железы, яичника. Конечно, по разным причинам, не для всех мутаций есть такие препараты, но их спектр и количество неуклонно возрастает.
— В настоящее время проводятся исследования в двух направлениях: диагностика наследственных раковых синдромов и индивидуализация подбора лекарственных препаратов на основе молекулярных характеристик опухоли. Тем самым повышается клиническая эффективность применения дорогостоящих лекарственных препаратов, снижается частота и тяжесть побочных эффектов, и в некоторых случаях предотвращается неблагоприятный исход заболевания.
— В настоящее время проводятся исследования в двух направлениях – диагностика наследственных раковых синдромов и индивидуализация подбора лекарственных препаратов на основе молекулярных характеристик опухоли. Тем самым повышается клиническая эффективность применения дорогостоящих лекарственных препаратов, снижается частота и тяжесть побочных эффектов, и, в некоторых случаях, предотвращается неблагоприятный исход заболевания.
Читайте также:

