Нейроэндокринная карцинома мочевого пузыря
- Причины развития
- Особенности нейроэндокринных опухолей
- Классификация нейроэндокринных опухолей
- Виды нейроэндокринных опухолей и их симптоматика
- Диагностика заболевания
- Лечение
- Прогноз выживаемости
Нейроэндокринные опухоли (НЭО) образуются из апудоцитов, или APUD-клеток. Эти клетки разбросаны по всему организму и составляют самую древнюю часть эндокринной системы. Они одновременно похожи на нервные клетки и клетки желез внутренней секреции, так как могут реагировать на сигналы извне или изменения состояния организма, способны производить гормоны, выполняющие разные функции.
Опухоли APUD-системы встречаются редко, и их бывает сложно диагностировать. Чаще всего они возникают в желудочно-кишечном тракте, но могут поражать и другие органы. Особенность нейроэндокринных новообразований в том, что опухолевые клетки производят повышенное количество гормонов, и из-за этого могут возникать определенные симптомы.
Согласно данным американского реестра SEER, в 2004 году заболеваемость нейроэндокринными опухолями в США составила 5 случаев на 100 тысяч населения. В России статистика, к сожалению, отсутствует, но, вероятно, заболеваемость находится на аналогичном уровне.
По данным американских экспертов, распространенность нейроэндокринных опухолей ежегодно растет. В первую очередь это связывают с изменениями в характере питания, неблагоприятной экологической обстановкой.
По данным все того же реестра SEER, новообразования APUD-системы часто диагностируются на поздних стадиях: в 50% случаев опухоль успевает распространиться на окружающие ткани, в регионарные лимфоузлы, дать отдаленные метастазы.
Причины развития
У некоторых людей нейроэндокринные опухоли возникают в результате генетических заболеваний:
- Множественная эндокринная неоплазия (МЭН, MEN) вызвана мутацией в гене MEN, RET или CDKN1B. У больных может развиваться множество нейроэндокринных новообразований и опухолей в железах внутренней секреции. Некоторые из этих опухолей доброкачественные, некоторые — злокачественные. Выделяют четыре типа множественной эндокринной неоплазии: MEN1, MEN2A, MEN2B и MEN4. При MEN1 чаще всего возникают нейроэндокринные опухоли в паращитовидных железах, поджелудочной железе, гипофизе, иногда в пищеварительном тракте и легких. У большинства пациентов с MEN2A и MEN2B обнаруживают медуллярные карциномы (разновидность опухоли щитовидной железы), в некоторых случаях — аденомы паращитовидных желез, феохромоцитому. При MEN4 чаще всего встречаются аденомы гипофиза и паращитовидных желез.
- Болезнь Гиппеля-Линдау возникает при мутации в гене VHL. У больных в разных частях тела развиваются кисты и опухоли. Среди этих опухолей встречаются нейроэндокринные, в том числе НЭО поджелудочной железы, феохромоцитома.
- Нейрофиброматоз I типа вызван мутацией в гене NF1. Некоторые люди получают эту мутацию от родителей, у других она возникает спонтанно. Основное проявление заболевания — множество доброкачественных новообразований нервов и кожи. Повышен риск развития опухолей APUD-системы в желудочно-кишечном тракте, поджелудочной железе, феохромоцитомы.
- Туберозный склероз приводит к возникновению доброкачественных новообразований в разных органах, включая кожу, глаза, головной мозг, сердце, легкие, почки. Повышен риск развития НЭО.
У людей, которые не являются носителями этих мутаций, нейроэндокринные новообразования тоже могут возникать. Причины до конца не известны. Многие исследования показали, что одним из важнейших факторов риска является наследственность. Если в семье есть люди, у которых была обнаружена нейроэндокринная опухоль, то у остальных членов риски тоже повышены, особенно у ближайших родственников больных (родителей, детей, сестер и братьев). Кроме того, риск опухолей APUD-системы повышен в семьях с отягощенным анамнезом по раку толстой кишки, молочной железы, легкого.
Известны и другие факторы риска, но их роль нельзя считать полностью доказанной:
- Курение может способствовать развитию нейроэндокринных опухолей в легких, желудке, тонкой кишке и поджелудочной железе.
- Хронический атрофический гастрит, как показали некоторые исследования, способствует развитию НЕО в желудке.
- Сахарный диабет связывают с возникновением новообразований APUD-системы в поджелудочной железе, желудке.
Ученые пока не могут сказать, повышаются ли риски при частом употреблении алкоголя, нездоровом питании (много животных жиров), у людей с лишним весом. Нужны дополнительные исследования.
Особенности нейроэндокринных опухолей
Нейроэндокринные клетки не привязаны к какому-либо конкретному органу. Они разбросаны по всему организму. Хотя опухоли чаще всего и возникают в пищеварительном тракте, в более редких случаях они обнаруживаются и в других местах. В 15% случаев найти первичную опухоль не удается.
Нейроэндокринные опухоли могут производить гормоны, которые вызывают в органах определенные эффекты, и из-за этого пациент испытывает те или иные симптомы. Такие новообразования называют функционирующими. Если гормоны не вырабатываются — это нефункционирующая опухоль.
Классификация нейроэндокринных опухолей
Существуют разные классификации нейроэндокринных опухолей. Ниже в таблице представлены основные группы:
Стадию нейроэндокринных опухолей определяют в соответствии с общепринятой системой TNM:
- T — размер первичной опухоли, ее прорастание в окружающие ткани.
- N — поражение регионарных (близлежащих по отношению к опухоли) лимфатических узлов.
- M — наличие отдаленных метастазов.
Классификация по стадиям различается в зависимости от того, в каком органе находится нейроэндокринное новообразование. Например, стадию опухоли APUD-системы в легком определяют так же, как для немелкоклеточного рака легкого. Для нейроэндокринных новообразований в желудке, тонкой кишке, червеобразном отростке, ободочной, прямой кишке и поджелудочной железе разработаны собственные системы классификации по стадиям.
Виды нейроэндокринных опухолей и их симптоматика
Так как существуют разные типы нейроэндокринных опухолей, и они могут находиться в разных органах, то и симптомы различаются. Можно выделить три основные группы проявлений. Первая — это общие симптомы, характерные для любого типа рака: слабость, повышенная утомляемость, снижение аппетита, потеря веса без видимой причины.

Вторая группа симптомов связана с локализацией опухоли и ее размерами, сдавлением анатомических структур и нарушением функции пораженного органа. Беспокоят боли в определенной части тела, тошнота, упорный хронический кашель, расстройства стула, мочеиспусканий, кровотечения, необычные выделения. При поражении печени, желчных протоков, поджелудочной железы развивается механическая желтуха.
Третья группа симптомов вызвана гормонами, которые продуцируют нейроэндокринные клетки:
- диарея — жидкий стул более трех раз в сутки;
- постоянная жажда, голод, частые мочеиспускания, — признаки повышения уровня глюкозы в крови;
- повышенная утомляемость, раздражительность, дрожь, головокружение, судороги, потери сознания — признаки снижения уровня глюкозы в крови;
- язвенная болезнь, которая не поддается лечению;
- тревожность;
- сыпь на коже.
Желудочно-кишечный тракт — наиболее распространенное место локализации нейроэндокринных опухолей. Такие новообразования часто называют карциноидными опухолями. Частота поражения разных отделов пищеварительного тракта:
- тонкая кишка — 39%;
- прямая кишка — 15%;
- червеобразный отросток (аппендикс) — 7%;
- толстая кишка — 5–7%;
- желудок — 2–4%.
Опухоли в пищеварительном тракте вызывают классический карциноидный синдром. Он проявляется в виде покраснения и ощущения тепла в области лица, диареей, одышкой, симптомами, напоминающими бронхиальную астму, слабостью, учащенным сердцебиением, увеличением веса без видимой причины, высоким артериальным давлением, его частыми колебаниями.
Вторым по частоте местом локализации опухолей APUD-системы после НЭО ЖКТ являются легкие. Примерно в 30% случаев нейроэндокринное новообразование возникает в бронхиальной системе.
Феохромоцитома — опухоль надпочечников (иногда в других частях тела), которая вырабатывает гормоны стресса: адреналин и норадреналин. В результате избыточного уровня гормонов возникают приступы (кризы), во время которых человек испытывает беспокойство, страх, озноб, дрожь, головную боль и боль в грудной клетке, его кожа становится бледной, учащается сердцебиение, возникают экстрасистолы, тошнота, рвота.
Рак из клеток Меркеля — злокачественная опухоль кожи. Она встречается очень редко, но отличается высокой агрессивностью, рано распространяется в лимфатические узлы, метастазирует. Патология проявляется в виде одного или нескольких узелков на коже красного и синюшного цвета. Они могут изъязвляться. Рак из клеток Меркеля сложно диагностировать, зачастую его выявляют уже на поздних стадиях.
Диагностика заболевания
В большинстве случаев нейроэндокринные новообразования обнаруживаются случайно, когда человек проходит обследование по другому поводу. Опухоль можно обнаружить с помощью таких методов диагностики, как:
- Ультразвуковое исследование.
- Эндоскопические исследования: гастроскопия, колоноскопия, бронхоскопия.
- Рентгенография с контрастным усилением. Перед исследованием пациенту дают выпить раствор, который помогает четко увидеть контуры желудка, кишечника.
Диагноз подтверждается с помощью биопсии. Обнаружив патологическое образование, врач удаляет из него фрагмент ткани и отправляет в лабораторию для исследования под микроскопом. Если опухоль предположительно является феохромоцитомой, к биопсии прибегают только в крайних случаях, так как она сопряжена с серьезными рисками.
Компьютерная томография и МРТ помогают обнаружить опухоль, оценить ее размеры, локализацию, степень распространения в организме, обнаружить метастатические очаги. Для поиска метастазов применяют ПЭТ-сканирование. Врач может назначить анализы, которые помогают обнаружить гормоны, вырабатываемые опухолью, например, исследование мочи на 5-HIAA — продукт обмена серотонина. Определение уровня хромогранина А в крови помогает контролировать эффективность лечения.
Лечение
Выбор лечения зависит от типа опухоли, ее локализации, степени злокачественности, стадии. В некоторых случаях, если нейроэндокринное новообразование является высокодифференцированным и практически не растет, врач назначает активное наблюдение. Нужно периодически являться на осмотры, проходить КТ, МРТ, сдавать анализы крови. Как только появляются признаки роста или распространения в организме, начинают активное лечение.
В большинстве случаев нейроэндокринные новообразования успешно лечатся хирургическим путем. Во время операции удаляют саму опухоль и некоторое количество окружающих тканей. Затем удаленный материал изучают в лаборатории. Если получен негативный край резекции, это означает, что опухолевая ткань удалена полностью.
Если радикальное вмешательство невозможно, может быть выполнена циторедуктивная операция, во время которой стараются удалить как можно большее количество опухолевой ткани.
Если у пациента имеются признаки карциноидного синдрома, есть риск, что его состояние во время операции может сильно ухудшиться. Врач-анестезиолог должен быть осведомлен о такой возможности и принять необходимые меры.
При неоперабельных опухолях назначают медикаментозное лечение, лучевую терапию. Применяют различные виды химиопрепаратов, таргетные препараты, иммунотерапию. Терапия аналогами соматостатина помогает справиться с симптомами и замедлить рост опухоли.
Если нейроэндокринные опухолевые очаги имеются в печени, может быть проведена радиочастотная аблация, эмболизация артерии, питающей опухоль. Врачи Европейской клиники обладают большим опытом в проведении таких вмешательств.
Прогноз выживаемости
Прогноз зависит от того, какой вид опухоли был диагностирован, насколько она агрессивна, на какой стадии находится. Лечение преследует одну из двух целей:
- Полностью удалить опухолевые очаги. Если по результатам обследований не выявляются признаки присутствия опухоли в организме, констатируют ремиссию.
- Избавить пациента от симптомов и сдержать рост новообразования. При этом больной может прожить довольно долго.
Стоит поговорить с врачом перед началом лечения, спросить, какой будет цель, какого результата можно ожидать, и что планируется делать в случае, если ситуация ухудшится, опухоль рецидивирует.
Карцинома мочевого пузыря – что это такое и сколько проживёт человек? Карцинома является разновидностью рака мочевого пузыря. У мужчин рак злокачественная опухоль возникает чаще, чем у женщин. Преимущественно карцинома встречается в возрасте от 40 до 60 лет. Для лечения больных карциномой созданы все условия в Юсуповской больнице:
- Палаты любого типа и степени комфортности;
- Диагностическая аппаратура ведущих фирм США и западноевропейских стран;
- Высокая квалификация врачей;
- Профессионализм и внимательное отношение персонала к пожеланиям пациентов;
- Диетическое питание, которое по качеству не отличается от домашней кухни.
Пациенты Юсуповской больницы имеют возможность проходить сложные диагностические и лечебные процедуры в клиниках-партнёрах и на кафедрах медицинских институтов. Благодаря программам исследований, которые проводятся на базе Юсуповской больницы, пациенты могут получать лекарственные препараты, которые отсутствуют в других онкологических клиниках.
Прогноз пятилетней выживаемости улучшается при ранней диагностике заболевания. К неблагоприятным факторам прогноза инвазивных карцином относят множественность поражения, размеры опухоли более трёх сантиметров, наличие фоновых изменений в виде карциномы ин ситу мочевого пузыря, что повышает риск развития рецидива. Урогенитальный рак мочевого пузыря характеризуется инфильтративным ростом уже на стадии выявления заболевания. В таком случае прогноз особенно неблагоприятный.

Причины
Карцинома мочевого пузыря возникает под воздействием следующих повреждающих факторов:
- Канцерогенов (никотина, бензола или анилиновых красителей);
- Отягощённой наследственностью;
- Онкогенными вирусами.
У женщин происходит инфицирование мочевого пузыря вследствие короткой уретры, вследствие чего развивается урогенитальная карцинома мочевого пузыря.
Стадии и виды
Различают 4 стадии карциномы мочевого пузыря. О нулевой стадии онкологи говорят в том случае, когда в мочевом пузыре обнаруживаются раковые клетки, которые не фиксировались в слизистой оболочке органа. На первой стадии опухоль проникает в глубину слоёв стенки органа, но не затрагивает мышечный слой. При второй стадии новообразование поражает мышечный слой, но не прорастает в него. Третья стадия заболевания характеризуется прорастанием стенки мочевого пузыря. На четвёртой стадии карциномы опухоль прорастает все слои стенки мочевого пузыря, распространяется в окружающую орган жировую клетчатку, метастазирует в лимфатические узлы и внутренние органы.
Различают 3 степени карциномы мочевого пузыря:
- Уротелиальная карцинома мочевого пузыря g1 (прогноз оптимистичный) характеризируется тем, что клетки опухоли почти ничем не отличаются от здоровых. клеток, и именно поэтому она является уротелиальной карциномой мочевого пузыря. Опухоль низкой степени злокачественности. Она обладает небольшим уровнем роста и не имеет тенденции к распространению;
- Инвазивная уротелиальная карцинома мочевого пузыря g2 – клетки опухоли отличаются от здоровых, опухоль быстро растёт и распространяется по организму;
- Уротелиальная карцинома мочевого пузыря g3 является наиболее опасным видом злокачественной опухоли, быстро прогрессирует и даёт метастазы.
Папиллярная уротелиальная карцинома мочевого пузыря образуется из доброкачественных опухолей с высоким потенциалом малигнизации. Плоскоклеточная метаплазия часто встречается в карциномах высокой степени анаплазии. При веретеноклеточном варианте онкологи нередко выявляют регионарные и отдаленные метастазы. В случае превалирования лимфоэпителиомоподобного варианта прогноз относительно благоприятен. Такие варианты уротелиальной карциномы, как микропапиллярная, саркомоподобная, с железистой дифференцировкой, имеют худший прогноз.
Переходно-клеточная карцинома – наиболее часто встречающийся вид рака мочевого пузыря. Опухоль развивается из клеток переходного эпителия. Агрессивным клиническим течением отличаются мелкоклеточная, перстневидноклеточная, плоскоклеточная карциномы. Инвазивная уротелиальная карцинома мочевого пузыря буквально прорастает стенку органа.
Оценку степени распространённости опухоли онкологи Юсуповской больницы проводят в соответствии с классификацией по системе TNM. Чаще всего предварительную клиническую стадию устанавливают по данным цистоскопии, ультразвукового и гистологического исследования биопсийного материала.
При неинвазивных поражениях слизистой мочевого пузыря базальный слой уротелия сохраняет ровный чёткий контур. Под ним находится непрерывная базальная мембрана. В участках инвазии контур утрачивается. В области последней отмечаются явления фиброза и воспалительная инфильтрация.
- Микропапиллярный;
- Микрокистозный;
- Гнёздный.
Уротелиальная карцинома мочевого пузыря принципиально отличается от прогрессирующих поверхностных карцином по своим молекулярно-патогенетическим механизмам развития.
Симптомы и диагностика
Длительное время карцинома мочевого пузыря протекает бессимптомно. Типичными признаками рака мочевого пузыря являются появление крови в моче и боль при мочеиспускании. Если опухоль препятствует прохождению мочи из почек в мочевой пузырь, развивается дисфункция почек. Она выражается болью в поясничной области. Если новообразование блокирует уретру, процесс мочеиспускания становится весьма затруднительным.
Гематурия (появление крови в моче) бывает первой жалобой у 90% пациентов. Гематурия характеризуется наличием эритроцитов в моче. Микрогематурию обнаруживают только при проведении микроскопического исследования. Макрогематурию можно увидеть, поскольку моча приобретает красный или ржавый цвет.
Учащённое, болезненное мочеиспускание, затруднённое начало, неприятные ощущения после мочеиспускания встречаются у 25% пациентов. Отёк наружных половых органов, ног возникает при сдавливании вен лимфатических сосудов. Боль в тазу и животе наблюдается при запущенной опухоли.
Симптомы карциномы мочевого пузыря неспецифичные и встречаются при других болезнях мочевыводящих путей. Только опытный специалист определит настоящую причину присутствия крови в моче и назначит адекватное лечение. Юсуповская больница оснащена современной аппаратурой для проведения качественной диагностики. Чем раньше обнаружена болезнь, тем эффективнее будет лечение карциномы мочевого пузыря и тем лучше прогноз.
При подозрении на карциному мочевого пузыря онкологи проводят комплексное обследование пациента с помощью следующих методов:
- Цитологического исследования мочи;
- Компьютерной томографии брюшной полости;
- Ультразвукового исследования.
Для оценки распространения заболевания проводят дополнительные диагностические процедуры: остеосцинтиграфию, рентгенологическое исследование органов грудной клетки. В Юсуповской больнице существует возможность проведения всех диагностических исследований для достоверного выявления патологии мочевого пузыря с помощью новейшей аппаратуры с высокой разрешающей способностью.
Лечение
Онкологи Юсуповской больницы проводят комплексное лечение карциномы мочевого пузыря. Оно включает хирургические, медикаментозные и лучевые методы. Лечебную тактику определяют на заседании Экспертного Совета с участием профессоров и врачей высшей категории. Основным оперативным вмешательством является трансуретральная резекция мочевого пузыря. Его выполняют на ранней стадии заболевания. В последующем проводят иммунотерапию или лучевое лечение.
Если опухоль прорастает в большую часть стенки мочевого пузыря, хирурги выполняют радикальную цистэктомию (удаление мочевого пузыря) с последующей пластикой (формированием искусственного мочевого пузыря из толстой или тонкой кишки). Пластическая операция позволяет восстановить мочеиспускание естественным путем. Лучевое и химиотерапевтическое лечение используют дополнительно к оперативному вмешательству для предотвращения возврата заболевания.
Внутрипузырная химиотерапия снижает риск возникновения местных рецидивов. Химиотерапевты назначают пациентам цитостатические препараты до и после оперативного вмешательства, что увеличивает безрецидивный период и является наиболее эффективным методом лечения распространённой карциномы мочевого пузыря. Стандартный индукционный курс БЦЖ состоит из 6 еженедельных инстилляций. У 40-60 % больных возникает необходимость в проведении повторного курса
Лучевая терапия помогает уменьшить размеры опухоли. Это облегчает оперативное вмешательство. Облучение опухоли выполняют при кровотечении. Радиотерапия заметно снижает боль при метастазах в костях.
По окончании лечения пациенты находятся под наблюдением онколога Юсуповской больницы. Это позволяет своевременного выявить возможный рецидив заболевания. После осмотра пациента онколог назначает общий анализ и цитологическое исследование мочи, анализ крови. При наличии показаний выполняет цистоскопию и применяет рентгенологические методы диагностики.
Профилактика
Профилактика рака мочевого пузыря включает:
- Устранение профессиональных вредностей;
- Защиту от промышленных канцерогенов (ношение защитной одежды, исключение непосредственного контакта с химикатами);
- Радикальное лечение всех доброкачественных папиллом мочевого пузыря;
- Адекватная терапия цистита;
- Отказ от курения;
- Употребление достаточного количества жидкости;
Получить ответы на вопросы, касающиеся диагностики и лечения карциномы мочевого пузыря, уточнить стоимость операции вы можете по телефону. Контакт центр Юсуповской больницы работает круглосуточно 7 дней в неделю.
Первичный рак уретры признан редкой злокачественной опухолью, составляющей менее 1% всех опухолевых заболеваний [1]. В 2008 году в 28 странах Евросоюза зарегистрировано 4292 случая этого заболевания с предполагаемой частотой 655 новых случаев в год. Стандартизованное по возрасту соотношение составило 1,1 на миллион жителей (1,6 млн у мужчин и 0,6/млн у женщин) [2]. Пик возникновения рака уретры отмечен у группы больных в возрасте более 75 лет [3].
Предрасполагающими факторами для развития первичного рака уретры у мужчин являются: стриктуры уретры [4, 5], хроническое раздражение уретры вследствие длительной катетеризации/уретропластики 7, дистанционная лучевая терапия [9], брахитерапия [10], хроническое воспаление уретры вследствие заболеваний, передающихся половым путем [11,12]. У женщин развитие первичного рака уретры связывают с дивертикулами уретры 14 и рецидивирующими инфекциями уротелиального тракта [16]. Аденокарцинома также может иметь врожденную этиологию [17,18].
Преобладающим гистологическим типом первичного рака уретры является уротелиальная карцинома (54-65%), следующими по частоте встречаемости являются плоскоклеточная карцинома (16-22%) и аденокарцинома (10-16%) [2,3]. В недавнем отчете Голландского Национального реестра злокачественных опухолей сообщается, что у женщин, больных первичным раком уретры, гистологически в 45% случаев выявлен уротелиальный рак, в 29% случаев – аденокарцинома, в 19% случаев – плоскоклеточный рак и в 6% – другие гистологические типы опухолей [19].
ОПИСАНИЕ СЛУЧАЯ
Больная N. в сентябре 2017 г. отметила появление кровянистых выделений из половых путей, по поводу которых обратилась к гинекологу по месту жительства, где был выявлен полип эндометрия, выполнено раздельное диагностическое выскабливание полости матки и цервикального канала, гистологически: фиброзно-железистый полип. Однако пациентку продолжали беспокоить вышеуказанные жалобы. При дальнейшем обследовании выявлена опухоль уретры, выполнена биопсия опухоли, пациентка направлена в НМИЦ онкологии им. Н.Н.Блохина. Объективно: опухоль, исходящая из уретры с инфильтрацией нижней трети передней стенки влагалища, синюшнобагрового цвета, контактно кровоточит, размерами 8х5 см.
При магнитно-резонансной томографии (МРТ) выявлено: на уровне нижней трети влагалища отмечается опухолевое образование с нечеткими контурами, вовлекающее переднюю стенку влагалища и уретру, заднюю стенку влагалища поверхностно, общими размерами не менее 2,8х3,0х4,8 см. Достоверных МР-признаков распространения процесса на стенки мочевого пузыря и прямой кишки, на правый леватор, прямую кишку, мезоректальную клетчатку, ножки клитора не выявлено. Отмечена кистозная трансформация одного из передних наружных подвздошных узлов справа размерами 1,0х0,7 см. В правой паховой области определяется уплотненный лимфатический узел 1,2х1,0 см. Паховые лимфатические уз-лы слева – без выраженных особенностей (рис. 1).
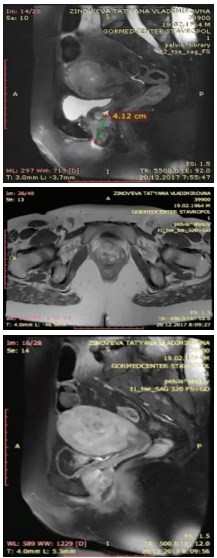
Рис. 1. МРТ органов малого таза
При компьютерной томографии (КТ): по органам брюшной и грудной полости – без патологии. В малом тазу отмечается неравномерное утолщение стенки влагалища по передне-правой полуокружности до 2,8 см, наружные контуры стенки нечеткие. Инфильтрат распространяется на правую ножку клитора и правый леватор. В центральных отделах образования (в проекции уретры) отмечается участок сравнительно пониженной плотности с четкими контурами 2,6х2,2 см. Мочевой пузырь заполнен однородным содержимым, его стенка не утолщена. Прямая кишка – без выраженных патологических изменений. Паховые и тазовые лимфатические узлы не увеличены.
При гистологическое исследование (биопсия опухоли уретры по месту жительства – пересмотр препаратов в НМИЦ онкологии им. Н.Н. Блохина): некротические массы, среди которых определяются небольшие комплексы низкодифференцированного рака солидного строения, вероятнее всего, аденогенной природы. Заключение: Низкодифференцированная аденокарцинома уретры.
19.01.2018 г. больной выполнена резекция уретры и передней стенки влагалища (рис. 2).
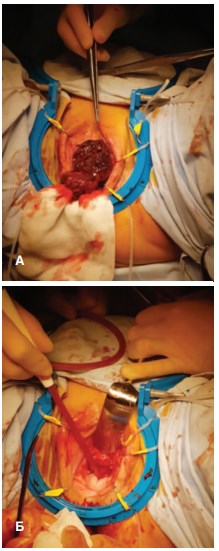
Рис. 2. Интраоперационно: А – опухоль; Б – вид после удаления опухоли
По данным гистологического исследования операционного материала опухоль представлена недифференцированной карциномой уретрыс фокусом высокодифференцированной аденокарциномы. Учитывая нестандартность случая, принято решение о проведении иммуногистохимического исследования (ИГХ).
ИГХ-исследование: В низкодифференцированном участке опухоли определяется экспрессия маркеров: CK18, chromogranin, synaptophysin, p53; индекс пролиферации (индекс мечения ki67)- 80%. В высокодифференцированном участке опухоли определяется экспрессия маркеров CK18, CK20, cdx2, p53; индекс пролиферации ( индекс мечения ki67)- 65%. В опухолевых клетках не определяется экспрессия маркеров: СK7, GATA3, HMWCK, CK5/6, p63. Заключение: с учетом морфологической картины и результатов ИГХ-исследования в уретре имеет место комбинированная карцинома, представленная преимущественно участками крупноклеточного нейроэндокринного рака (85%) и очагами высокодифференцированной аденокарциномы с кишечным иммунофенотипом (15%).
С целью определения лекарственной чувствительности опухоли проведено ИГХ исследование с антителами к рецепторам соматостатина 2 типа: SSTR-2A (клон UMB-1). Результаты: в нейроэндокринном компоненте опухоли определяется экспрессия SSTR-2A в виде мембранного окрашивания части клеток: имеются участки опухоли с окрашиванием отдельных, разрозненных клеток (2+, 30% клеток) и фокусы с диффузным сильным окрашиванием клеток (3+, 15% клеток). В участках высокодифференцированной аденокарциномы экспрессия рецепторов полностью отсутствует (0). Заключение: морфологическая картина опухоли уретры соответствует диагнозу комбинированного крупноклеточного нейроэндокринного рака с позитивным ИГХ статусом рецепторов соматостатина 2А типа. В участках высокодифференцированной аденокарциномы ИГХ статус рецепторов соматостатина 2А типа негативный.
Пациентке в послеоперационном периоде в связи с жалобами на пальпируемое образование в паховой области справа, выполнена пункция под ультразвуковым контролем (лимфатический узел, наибольший размер по данным УЗИ – 3,1 см). За период наблюдения размеры описанного лимфатического Рис. 1. МРТ органов малого таза узла увеличились (по сравнению с МРТ от 26.12.2017 г. размер лимфатического узла – 1,2 см). По результатам цитологического исследования пунктата – метастатическое поражение пахового лимфоузла справа.
В период с 01.02.2018 г. по 17.04.2018 г. больной проведено 3 курса полихимиотерапии по схеме Цисплатин 75 мг/м2 1 день; Паклитаксел 80 мг/м2 1-й, 8-й, 15-й дни.
24.05.2018 г. выполнено хирургическое лечение в объеме двусторонней пахово-бедренной лимфаденэктомии. Гистологически: в 9 лимфатических узлах слева элементов опухоли не выявлено; справа фрагмент жировой клетчатки размерами 12х7х4 см, в котором обнаружена инкапсулированная опухоль размерами 6х4х4см, имеющая строение комбинированного крупноклеточного нейроэндокринного рака с участками аденокарциномы с минимальными дистрофическими изменениями опухолевых клеток в фокусах аденокарциномы, очаги некрозов, кровоизлияний и некробиоза опухоли; в 15 лимфатических узлах – без признаков метастатического поражения.
С 06.2018 г. по 10.2018 г. проведено 4 курса адъювантной полихимиотерапии по схеме "EC": Этопозид 100 мг/м2 1-й, 2-й, 3-й день; Карбоплатин AUC 5 1-й день, на фоне которой пациентке проводилась терапия Соматостатином: ОктреотидЛонг 30 мг 1 раз в 28 дней.
При контрольном обследовании в декабре 2018 г. признаков прогрессирования заболевания не выявлено.
ОБСУЖДЕНИЕ
Мультимодальный подход к лечению первичного рака уретры включает радикальную операцию и химиотерапию с возможностью проведения дополнительной лучевой терапии [20,21].
Недавние ретроспективные исследования показали, что современные полихимиотерапевтические режимы на основе платины эффективны для распространенного первичного рака уретры, обеспечивая высокую общую выживаемость (ОВ) даже при наличии метастазов в регионарных лимфатических узлах. Более того, авторы подчеркнули важную роль хирургического лечения после химиотерапии для достижения долговременной выживаемости у пациентов с местно-распространенным раком уретры [22].
В многоцентровом исследовании 124 пациентов с распространенным первичным раком уретры, которым была проведена периоперационная химиотерапия на основе платины, были отмечены лучшие показатели безрецидивной и общей выживаемости в группе из 39 пациентов, которым проводилась неоадъювантная химиотерапия [22]. В другом исследовании было сообщено о результатах лечения 44 пациентов с распространенным первичным раком уретры, которым проводилась химиотерапия на основе Цисплатина. Общий коэффициент ответа для различных схем составил 72%, а медиана общей выживаемости – 32 месяца. Пациенты, которым было проведено хирургическое вмешательство после химиотерапии, имели значительно лучшую ОВ по сравнению с теми, кто подвергся только химиотерапии [23].
В Европе медиана пятилетней ОВ существенно не различается между полами [2,24]. Согласно RARECARE (проект наблюдения редких опухолей), медиана одногодичной и 5-летней ОВ пациентов с первичным раком уретры составляет 71% и 54%, соответственно [2]. При более длительном наблюдении SEER (программа Национального Онкологического Центра – источник информации об эпидемиологии, встречаемости и выживаемости онкологических заболеваний в США), изучившей 1615 случаев заболеваний первичным раком уретры, было доложено о медиане пятии десятилетней ОВ – 46% и 29% соответственно. Раково-специфическая выживаемость в течение 5 и 10 лет была 68% и 60%, соответственно [3].
Предикторами снижения выживаемости пациентов с первичным раком уретры являются: преклонный возраст (>65 лет) и принадлежность к черной расе [2,24,25]; стадия заболевания, степень злокачественности опухоли, вовлеченность лимфатических узлов [26] и наличие метастазов [27]; размер очага и расположение проксимального края опухоли [27]; объем хирургического вмешательства и возможность мультимодального подхода к лечению [25,27]; гистологический тип опухоли [2,19,25]; наличие сопутствующего рака мочевого пузыря [28]; локализация рецидива (уретральная/неуретральная) [29].
При интерпретации этих результатов необходимо учитывать некоторые ограничения. К примеру, в Голландском исследовании число больных было небольшим (n=91) [30]. В обширной базе данных SEER (n=2046) не указана связь проведенного лечения с выживаемостью [19]. Наконец, в отличие от проекта RARECARE [2], в базе данных SEER сообщалось о противоположных результатах относительно роли гистологического строения опухоли в выживаемости у мужчин [25].
ЗАКЛЮЧЕНИЕ
Первичный рак уретры является редким заболеванием. Мультимодальный подход к лечению больных с данной патологией позволяет достигнуть удовлетворительных показателей отдаленной выживаемости. Учитывая возможность сочетания различных гистологических вариантов рака уретры необходимо проведение полноценного гистологического исследования с применением всех методов морфологической диагностики для выбора правильного алгоритма лечения.
ЛИТЕРАТУРА
- Gatta G, van der Zwan JM, Casali PG, Siesling S, Dei Tos AP, Kunkler I, et al. Rare cancers are not so rare: the rare cancer burden in Europe. Eur J Cancer 2011;47(17):2493-511. doi: 10.1016/j.ejca.2011.08.008.
- Visser O, Adolfsson J, Rossi S, Verne J, Gatta G, Maffezzini M, et al. Incidence and survival ofrare urogenital cancers in Europe. Eur J Cancer 2012;48(4):456-64. doi: 10.1016/j.ejca.2011.10.031
- Swartz MA, Porter MP, Lin DW, Weiss NS. Incidence of primary carcinoma in the United States. Urology, 2006. 68(6):1164-8. doi: 10.1016/ j.urology.2006.08.1057
- Medina Pérez M, Valero Puerta J, Sánchez González M, Valpuesta Fernández I, Marín Martín J. [Squamosus carcinoma of the male urethra, its presentation as a scrotal abscess]. Arch Esp Urol 1999;52(7): 792-4.
- Van de Voorde W, Meertens B, Baert L, Lauweryns J. Urethral squamosus cell carcinoma associated with urethral stricture and urethroplasty. Eur J Surg Oncol 1994; 20(4): 478-83.
- Colapinto V, Evans DH. Primary carcinoma if the male urethra developing after utethroplasty for stricture. J Urol 1977;118(4):581-4.
- Mohanty NK, Jolly BB, Saxena S, Dawson L. Squamosus cell carcinoma of perineal urethrostomy. Urol Int 1995;55(2):118-9.
- Sawczuk I, Acosta R, Grant D, White RD. Post urethroplasty squamosus cell carcinoma. NY State J Med 1986;86(5):261-3.
- Mohan H, Bal A, Punia RP, Bawa AS. Squamous cell carcinoma of the prostate. Int J Urol 2003;10(20:114-6.
- Arva NC1, Das K. Diagnostic dilemmas of squamous differentiation in prostate carcinoma case report and review of the literature. Diagn Pathol 2011;6:46. doi: 10.1186/1746-1596-6-46.
- Cupp MR, Malek RS, Goellner JR, Espy MJ, Smith TF. Detection of human papillomavirus DNA in primary squamous cell carcinoma of the male urethra. Urology 1996;48(4):551-5. doi: 10.1016/S0090-4295(96)00246-4
- Wiener JS, Liu ET, Walther PJ. Oncogenic human papillomavirus type 16 is associated with squamous cell cancer of the male urethra. Cancer Res 1992;52(18):5018-23.
- Ahmed K, Dasgupta R, Vats A, Nagpal K, Ashrafian H, Kaj B, et al. Urethral diverticular carcinoma: an overview of current trends in diagnosis and management. Int Urol Nephrol 2010;42(2):331-41. doi: 10.1007/ s11255-009-9618-x
- Chung DE, Purohit RS, Girshman J, Blaivas JG. Urethral diverticula in women: discrepancies between magnetic resonance imaging and surgical findings. J Urol 2010;183(6):2265-9. doi: 10.1016/j.juro.2010.02.016.
- Thomas AA, Rackley RR, Lee U, Goldman HB, Vasavada SP, Hansel DE. Urethral diverticula in 90 female patients: a study with emphasis on neoplastic alterations. J Urol 2008;180(6):2463-7. doi: 10.1016/ j.juro.2008.08.040
- Libby B, Chao D, Schneider BF.Non-surgical treatment of primary female urethral cancer. Rare Tumors 2010;2(3):e55. doi: 10.4081/rt.2010.e55.
- Gandhi JS, Khurana A, Tewari A, Mehta A. Clear cell adenocarcinoma of the male urethral tract. Indian J Pathol Microbiol 2012;55(2):245-7. doi: 10.4103/0377-4929.97895
- Mehra R, Vats P, Kalyana-Sundaram S, Udager AM, Roh M, Alva A, et al., et al. Primary urethral clear-cell adenocarcinoma: comprehensive analysis by surgical pathology, cytopathology, and next-generation sequencing. Am J Pathol 2014;184(3):584-91. doi: 10.1016/j.ajpath.2013.11.023 184: 584.
- Derksen JW, Visser O, de la Rivière GB, Meuleman EJ, Heldeweg EA, Lagerveld BW. Primary urethral carcinoma in females: an epidemiologic study on demographical factors, histological types, tumourstage and survival. World J Urol 2013;31(1):147-53. doi: 10.1007/s00345-012-0882-5.31: 147.
- Cahn DB, Handorf E, Ristau BT, Geynisman DM, Simhan J, Kutikov A, et al. Contemporary practice patterns and survival outcomes for locally advanced urethral malignancies: A National Cancer Database Analyses. Urol Oncol 2017;35(12):670.e15-670.e21. doi: 10.1016/j.urolonc.2017.07.026
- Dayyani F1, Hoffman K, Eifel P, Guo C, Vikram R, Pagliaro LC, et al. Management of advanced primary urethral carcinomas. BJU Int 2014;114(1):25-31. doi: 10.1111/bju.12630
- Gakis G, Morgan TM, Daneshmand S, Keegan KA, Todenhöfer T, Mischinger J, et al. Impact of perioperative chemotherapy on survival in patients with advanced primary urethral cancer: results of the international collaboration on primary urethral carcinoma. Ann Oncol 2015;26(8):1754- 9. doi: 10.1093/annonc/mdv230.
- Dayyani F, Pettaway CA, Kamat AM, Munsell MF, Sircar K, Pagliaro LC. Retrospective analysis of survival outcomes and the role of cisplatin-based chemotherapy in patients with urethral carcinomas referred to medical oncologists. Urol Oncol 2013;31(7):1171-7. doi: 10.1016/j.urolonc.2012.01.011
- Sui W, RoyChoudhury A, Wenske S, Decastro GJ, McKiernan JM, Anderson CB. Outcomes and prognostic factors of primary urethral cancer. Urology 2017;100:180-186. doi: 10.1016/j.urology.2016.09.042..
- Champ CE, Hegarty SE, Shen X, Mishra MV, Dicker AP, Trabulsi EJ, et al. Prognostic factors and outcomes after definitive treatment of female urethral cancer: a population-based analysis. Urology 2012;80(2):374-81. doi: 10.1016/j.urology.2012.02.058 80: 374.
- Gakis G, Morgan TM, Efstathiou JA, Keegan KA, Mischinger J, Todenhoefer T , et al. Prognostic factors and outcomes in primary urethral cancer: results from the international collaboration on primary urethral carcinoma. World J Urol 2016;34(1):97-103. doi: 10.1007/ s00345-015-1583-734: 97.
- Rabbani F. Prognostic factors in male urethral cancer. Cancer 2011;1;117(11):2426-34. doi: 10.1002/cncr.25787
- Gakis G, Efstathiou JA, Daneshmand S, Keegan KA, Clayman RH, Hrbacek J, et al. Oncological outcomes of patients with concomitant bladder and urethral carcinoma. Urol Int 2016;97(2):134-41. doi: 10.1159/000448335
- Gakis G, Morgan TM , Daneshmand S , Keegan KA , Clayman RH, Mischinger J. Impact of salvage surgery and radiotherapy on overall survival in patients with recurrent primary urethral cancer. J Clin Oncol (Meeting Abstracts), 2015; 33:4568.
- Golijanin D, Yossepowitch O, Beck SD, Sogani P, Dalbagni G. Carcinoma in a bladder diverticulum: presentation and treatment outcome. J Urol 2003;170(5):1761-4. doi: 10.1097/01.ju.0000091800.15071.52
Статья опубликована в журнале "Экспериментальная и клиническая урология" №2 2019 г., стр. 38-43
Читайте также:

