Миелодиспластический синдром рефрактерная анемия отзывы
Миелодиспластическим синдромом называют группу гетерогенных клональных заболеваний крови, объединенных следующими признаками: неэффективный гемопоэз, периферическая цитопения, дисплазия в одном или более ростке кроветворения с высоким потенциалом трансформации в острый миелоидный лейкоз.
Недостаточное кроветворение проявляется анемией, повышенной кровоточивостью и подверженностью инфекциям. Миелодиспластический синдром (МДС) встречается у людей любого возраста, в том числе и детского, но в большей степени ему подвержены люди после 60 лет.
По МКБ-10 миелодиспластическим синдромам присваивается код D46.
Причины
Клетки крови синтезируются и созревают главным образом в костном мозге (этот процесс называется миелопоэзом, а ткань, в которой он происходит, называется миелоидной), затем, выполнив свою функцию и состарившись, уничтожаются селезенкой, а на их место приходят новые. При миелодиспластическом синдроме костный мозг теряет способность к воспроизводству клеток крови (всех – эритроцитов, лейкоцитов, тромбоцитов или только некоторых) в необходимом организму количестве, в кровь попадают незрелые клетки (бласты), в результате чего она хуже выполняет свои функции. Это проявляется характерной для МДС симптоматикой. Примерно в 30% случаев процесс миелопоэза становится со временем полностью бесконтрольным, количество бластных форм кровяных клеток увеличивается, вытесняя нормальные, зрелые клетки. Когда количество бластов в крови превышает 20% (ранее пороговым значением было 30%), ставится диагноз острого миелоидного лейкоза.
В зависимости от того, известна ли причина нарушения функции костного мозга, или нет, МДС делится на первичный, или идиопатический, и вторичный. Вторичный возникает в результате угнетения костномозговой функции после химиотерапевтического или лучевого воздействия. Такое воздействие обычно является частью противоопухолевой терапии, т. е. проводится по поводу какого-либо вида рака. В этом случае МДС можно рассматривать как осложнение.
Первичный, или идиопатический МДС возникает спонтанно, без какой-либо предшествующей патологии и по неизвестной причине. Возможно, предрасполагающим фактором является генетический, поскольку при некоторых видах синдрома обнаруживаются хромосомные изменения.
Факторами, способствующими развитию МДС, являются:
- курение;
- контакт с канцерогенными химическими веществами (пестициды, гербициды, бензол);
- воздействие ионизирующей радиации;
- пожилой возраст.
Формы заболевания
Как уже указывалось выше, МДС делится на два вида, первичный и вторичный.
Чаще встречается первичный МДС (около 80% всех случаев), большинство заболевших – пожилые люди (65-75 лет). Вторичным МДС также в основном страдают пожилые люди, по той причине, что и злокачественные опухоли, а значит, и их осложнения, у них встречаются чаще. Вторичный МДС хуже поддается терапии и связан с худшим прогнозом.
Кроме того, МДС делится на клинические типы в зависимости от типа бластных клеток, их количества и наличия хромосомных изменений, эта классификация предложена Всемирной Организацией Здравоохранения (ВОЗ). Согласно классификации ВОЗ, выделяют следующие формы МДС:
- рефрактерная (т. е. устойчивая к классической терапии) анемия;
- рефрактерная цитопения с мультилинейной дисплазией;
- МДС с изолированной делецией 5q;
- МДС неклассифицируемый;
- рефрактерная анемия с кольцевидными сидеробластами;
- Рефрактерная цитопения с мультилинейной дисплазией и кольцевыми сидеробластами;
- рефрактерная анемия с избытком бластов-1;
- рефрактерная анемия с избытком бластов-2.
Стадии заболевания
В протекании МДС выделяют три стадии, которые, однако, не всегда клинически четко отличаются между собой, различия определяются лабораторно. Это стадия анемии, стадия трансформации (промежуточная между анемией и острым лейкозом), и острый миелоидный лейкоз. Не все исследователи согласны с определением острого миелоидного лейкоза как стадии миелодиспластического синдрома, поскольку он относится к миелопролиферативным нарушениям (т. е. тем, которые характеризуются бесконтрольным клеточным ростом), тем самым не полностью соответствуя характеристикам МДС.
Симптомы
Основные симптомы МДС связаны с проявлениями анемии. Пациенты предъявляют жалобы на повышенную утомляемость, приступы головокружения, одышку при физической нагрузке, которая ранее переносилась легко. Анемия связана с нарушением продукции эритроцитов, следствием чего является низкий уровень гемоглобина в крови.
В некоторых случаях развивается геморрагический синдром, который характеризуется повышенной кровоточивостью. Пациент начинает замечать, что даже незначительные поверхностные повреждения вызывают длительно не останавливающееся кровотечение, может появиться кровоточивость десен, частые и спонтанные носовые кровотечения, петехии на коже и слизистых оболочках, а также множественные гематомы (синяки) либо без связи с какой-либо запоминающейся пациенту травмы, либо после незначительного ушиба или даже надавливания. Геморрагический синдром связан с нарушениями тромбоцитопоэза.
У больных с МДС также обнаруживается подверженность инфекционным болезням. Они часто болеют простудными заболеваниями, кожными бактериальными и грибковыми инфекциями. Такое состояние обусловлено нейтропенией (недостаточностью нейтрофилов).
Кроме того, признаками МДС могут быть:
- беспричинное повышение температуры, часто до высоких значений (38 °С и выше);
- снижение веса, уменьшение аппетита;
- гепатомегалия;
- спленомегалия;
- болевой синдром.
В ряде случаев МДС ничем себя не проявляет и обнаруживается случайно во время лабораторного исследования крови по другому поводу.
Диагностика
Основной метод диагностики МДС – лабораторный. При подозрении на миелодисплазию проводятся:
- Клинический анализ крови. При этом обнаруживается анемия (макроцитарная), ретикулоцитопения, лейкопения, нейтропения, при синдроме 5q – тромбоцитоз. Примерно у половины пациентов выявляется панцитопения.
- Биопсия костного мозга. Цитоз обычно в норме или увеличен, но примерно у 10% пациентов он снижен (гипопластический вариант МДС), есть признаки нарушенного гемопоэза одного или нескольких ростков кроветворения, может обнаруживаться повышенное содержание бластных форм, патологических сидеробластов (эритроциты, содержащие отложения железа). Для идентификации аномальных фенотипов проводят исследование иммунофенотипа костномозговых клеток, это позволяет проводить дифференциальную диагностику МДС и неклональных цитопений, что важно для прогноза.
- Цитогенетический анализ. У 40–70 % пациентов обнаруживаются клональные цитогенетические аномалии, особенно часто наблюдается делеция (моносомия) 7 хромосомы (7q), которая является прогностически неблагоприятной.
- Определение уровня железа и феритина в сыворотке. Уровни повышены.
- Определение эндогенного эриропоэтина (при Диагностика МДС проводится лабораторными методами
Для определения МДС разработаны специальные критерии, т. е. условия, при соблюдении которых ставится данный диагноз. Диагностические критерии следующие:
- 1-, 2- или 3-ростковыя периферическая (т. е. обнаруживаемая в периферической крови) цитопения;
- дисплазия: признаки нарушения гемопоэза не менее 10% клеток не менее одного кроветворного ростка;
- характерные цитогенетические изменения (наличие патологического клона).
Цитопения должна быть стабильной и наблюдаться в течение не менее шести месяцев, однако если обнаруживается специфический кариотип, или ей сопутствует дисплазия не менее двух ростков кроветворения, достаточно двух месяцев.
Для постановки диагноза должны быть исключены другие заболевания, сопровождающиеся клеточной дисплазией и цитопенией.
При выявлении цитопении без других признаков МДС диагностируют идиопатическую цитопению, значение которой не установлено; при выявлении дисплазии без цитопении – идиопатическую дисплазию, значение которой не установлено. При этом требуется постоянное наблюдение пациента с повторным исследованием костного мозга через 6 месяцев, поскольку оба этих диагноза способны прогрессировать до МДС и острого миелоидного лейкоза (или другого миелопролиферативного заболевания).
МДС дифференцируется со следующими заболеваниями:
- анемии (прежде всего, мегалобластическая, сидеробластическая и апластическая);
- острый миелоидный лейкоз;
- лейкопения с нейтропенией;
- первичная иммунная тромбоцитопения;
- клональный гемопоэз с неопределенным потенциалом;
- первичный миелофиброз;
- ВИЧ;
- тяжелая интоксикация различной этиологии.
Лечение
В 1997 году была разработана специальная шкала, называемая шкалой IPSS (International Scoring Prognostic System, Международная шкала оценки прогноза), разделяющая пациентов на группы риска. В соответствии с определенной группой риска выбирается лечебная тактика, и, что следует из названия, оценивается прогноз.
Баллы присваиваются с учетом трех факторов:
- количество бластных форм;
- количество пораженных кроветворных ростков;
- цитогенетическая категория.
![]()
Добрый день! Узнал на вашем сайте, что в Израиле занимаются лечением (а не просто симптоматической помощью) миелодиспластического синдрома. Причем, в старшем возрасте. Мой папа живет в Киеве, но я понял, что на Украине МДС не лечат. Диагноз поставили месяц назад, после взятия пробы костного мозга. Прикрепляю файл с результатами обследования. Папе 87 лет, но он в хорошей форме, давно занимается активно ЗОЖ, йогой, бегает, моржует. Сейчас, правда, уже немного с меньшим ритмом и нагрузкой. Динамика показания гемоглобина: 111 (7.12.18г),110 (21.2.19), 106 (16.03.19), 97 (31.05.19), 87 (10.06.19), 88 (20.06.19). В начале июля немного поднялся - до 96, пока неделю держится. Хотел бы узнать возможности по лечению папы и предварительную смету, чтобы оценить наши возможности. Спасибо заранее
Добрый день, Борис! В Израиле действительно занимаются лечением (а не просто симптоматической помощью) миелодиспластического синдрома. Как правило, лечение заключается в трансплантации костного мозга от родственного донора (аллогенная трансплантация). В зависимости от различных показателей крови, перед ТКМ может требоваться соответствующая терапия, направленная на стабилизацию показателей. С учетом сложности данного вида лечения и возраста пациента, ТКМ ему не показан. Вместо этого могут быть предложены другие виды эффективного, но в то же время щадящего лечения.
Для того, чтобы ответить, Вам нужно войти или зарегистрироваться
![]()
Здравствуйте. Моей маме поставили миелодиспластический синдром (в анализах у неё низкий гемоглобин и тромбоциты, а моноцитов больше нормы). В выписке написали, что у неё рефрактерная анемия с избыточным количеством бластных клеток. Мы из Украины, поэтому наверное вы захотите сделать перепроверку анализов. Поэтому интересует стоимость диагностики и лечения в вашей клинике.
Полина, добрый вечер. Начну с хороших новостей. Данная болезнь излечима. Лечение - cтволовые клетки, пересадка костного мозга. Выбор методов лечения определяется тяжестью клинической картины. Сколько лет маме? Хотелось бы получить последний анализ крови и данные по биопсии костного мозга.
![]()
Юлия, про трансплантацию костного мозга я у наших спрашивала, они откзалали из-за маминого возраста, ей 75 лет. Является ди этот возраст допустимым для израильских врачей?
Да, возраст допустим, я консультировалась с врачами, есть специальные препараты, вводятся подкожно. Результаты хорошие.
Для того, чтобы ответить, Вам нужно войти или зарегистрироваться
![]()
Отцу четыре назад поставили диагноз миелодиспластический синдром. неделю назад делали анализ крови и получили результат: лейкоциты от 2 000 -2 500, нейтрофилов 0.5-1,1, НВ 12 - 13 ед. Последняя аспирация костного мозга, по результатам: угнетён только росток гранулоцитов.
В лечении нам отказывают, за исключением симптоматической помощи, то есть просто облегчают состояние отца. По слова лечащего врача, если бы отец был положе, то ему бы помогла пересадка костного мозга, а так, как он говорит "своё ваш отец уже прожил".
Скажите, лечат ли в Израиле миелодиспластический синдром пациентам в таком возрасте, как мой отец и возможна (нужна ли) моему отцу пересадка костного мозга?
- миелодиспластический синдром
Глеб, здравствуйте! Миелодисплатический синдром в Израиле лечат, но программа очень сложная, необходимо продвигаться соответственно находкам. Чтобы Вы сориентировались. привожу стандартную программу обследования:
• Мазок крови и общий анализ, биохимия - $520;
• Ревизия предыдущей биопсии костного мозга с иммуногистохимией, как референс (точка отсчета) - $1,320;
• Новая биопсия костного мозга с цитогенетическим анализом - $4,070;
• ПЭТ КТ организма для выявления участков лимфаденопатии - $1,850;
• УЗИ органов брюшной полости для оценки гепатоспленомегалии - $490;
• Две консультации гемато-онколога - $900.
В Израиле, Ваш отец, можно сказать только бы жить начал 2 года назад (пенсионный возраст мужчин 67 лет). Средняя продолжительность Жизни в Израиле более 80 лет. Так что по местным меркам он еще достаточно молод.
В больнице Хадаса профессор Шапиро сможет Ему помочь!
Он занимается пересадкой костного мозга даже у гериатрических пациентов - с большим букетом "возрастных" заболеваний.
2 Консультации профессора Шапиро будет стоить 720$
Генотипирование 1450$
Биопсия костного мозга 3950$. Ревизия стекол которые которые Вы привезли с собой - еще 850$.
Мы работаем по прейскуранту клиники Хадасса.
Обследование займет около 2-3 дней. Результаты биопсии - через неделю.
Кроме того, хотелось бы получить дополнительную информацию - что случилось 4 года назад? есть ли раковое заболевание сейчас? Как лечили в течении этих 4 лет?
![]()
Здравствуйте, доктора и благодарю за внимание к моему отцу.
Скажите, обязательно ли повторно делать у вас биопсию, если у нас есть свои стёкла? И другие анализы?
Отец себя почувствовал плохо где-то лет пять назад, начались внезапные частые простуды, потом увеличение лимфатических узлов то там, то сям. Ему ставили много разных диагнозов, много от чего лечили, конечно безуспешно, и только 4 года назад после тысячи всяких обследований, анализов крови и биопсии КМ, поставили диагноз МДС. Из лечения делали переливание плазмы и эритроцитарной массы, также курсом назначили Леналидомид, переносился отцом оооочень тяжело. Ну облегчающее лечение назнали типа анальгина, аспирина и тому подобного.
Сейчас есть анализ крови, стёкла КМ и увеличение шейных лимфаузлов, плюс общее состояние: слабость, утомляемость, иногда незначительное повышение температуры, но без инфекций.
Глеб, можно взять с собой все анализы, которые у Вас есть. Вы можете прислать нам все результаты, врач тогда точно сможет сказать, что мы примем.
Для того, чтобы ответить, Вам нужно войти или зарегистрироваться
В основе МДС лежат различные генетические аномалии, а также аномальное метилирование ДНК, приводящее к торможению экспрессии генов-онкосупрессоров, что в свою очередь приводит к множественным нарушениям клеточного цикла и дифференцировки клеток [1; 2].
К наиболее характерным изменениям хромосом при МДС относятся: делеция длинного плеча del 5(5q-) - у 27-30%, del 7(7q-) - у 4-10%, моносомия 7(-7) - у 15-25%, трисомия 8(+8) - выявляется у 20% пациентов, моносомия 5(-5) - у 5-10%, del 11(11q) - у 7-11%, делеция Y-хромосомы - у 5-10%, а также транслокации t(1; 3), t(1; 7), t(5; 7), t(2; 11), t(6; 9), t(11; 27), инверсия 3 хромосомы.
Заболевание характеризуется низкой продолжительностью жизни пациентов и быстрой трансформацией в острый миелобластный лейкоз, что определяет его высокую социальную значимость. При отсутствии лечения общий срок выживаемости составляет в среднем 0,4 года для больных с высоким риском прогрессирования и 5,7 года при низком риске прогрессирования. Срок до перехода в ОМЛ у 25% больных этих групп составляет соответственно 0,2 и 9,4 года [9]. Причинами смерти больных с МДС являются последствия цитопенических нарушений - в частности инфекции, тяжелые кровотечения, а также трансформация в ОМЛ [4; 12].
С совершенствованием методов диагностики МДС становится все более актуальным заболеванием в онко-гематологической практике. По данным западных авторов, заболеваемость МДС составляет 5 случаев на 100 000 населения в год [7]. По оценкам ведущих специалистов в России, в настоящее время в РФ насчитывается около 2,5 тысяч пациентов с МДС, средний возраст которых приближается к 40 годам. Однако централизованного учета больных МДС не ведется, а выявляемость заболевания остается на низком уровне. Трудности выявления МДС связаны с отсутствием типичной клинической картины и со сложной диагностикой заболевания, которая, помимо обычного клинического обследования, проводящегося при подозрении на любое онкогематологическое заболевание, включает обязательный морфологический анализ и цитогенетическое исследование костного мозга [2; 4; 8].
По данным нашего гематологического отделения, наблюдается рост пролеченных больных с МДС, так, если за три года с 2005 по 2007 год было пролечено 19 больных, то уже в 2008-2010 гг. лечилось 42 человека.
Основными целями лечения МДС являются купирование симптоматики, снижение зависимости от гемотрансфузий, отсрочка прогрессирования до ОМЛ, увеличение выживаемости, улучшение клеточного состава крови, улучшение качества жизни [3; 5]. До последнего времени основные способы терапии МДС включали постоянные гемотрансфузии, применение препаратов эритропоэтина, колониестимулирующие факторы, антибактериальные препараты, курсы интенсивной химиотерапии, трансплантацию костного мозга. К сожалению, все перечисленные методы являются малоэффективными или эффективны только у определенной группы пациентов, а также сопряжены с повышенным риском прогрессирования заболевания и смерти [10]. В этой связи особую важность приобретают препараты с принципиально новыми, более целенаправленными механизмами противоопухолевого действия. Таким препаратом является Дакоген (децитабин) - гипометилирующий агент, оказывающий противоопухолевое действие за счет торможения метилирования ДНК и индукции дифференцировки или апоптоза клеток [6; 13]. В мае 2006 года дакоген был зарегистрирован как средство для специфического лечения МДС. С 2007 года дакоген доступен в России.
По данным североамериканского исследования III Фазы медиана выживаемости и отсутствия прогрессии в ОМЛ среди ответивших на терапию дакогеном составила 17,5 месяцев против 9,8 месяцев в контрольной группе, получавшей поддерживающую терапию (трансфузии эритроцитарной массы, тромбоконцентрата, рекомбинантный эритропоэтин) [11].
Приводим собственный опыт лечения больной с миелодиспластическим синдромом препаратом, ингибирующим метилирование ДНК, - децитабином( Дакоген).
Пациентка Л., 58 лет, наблюдалась в поликлинике у гематолога в течение 6 лет (2002-2008 гг.). В 2002 году во время медосмотра выявлены низкие цифры гемоглобина (в пределах 100-90г/л. В течение 5 лет периодически назначались препараты железа, витамин В12. С 2005 года гемоглобин снизился до 70-80 г/л, на лечении цифры не корригировались. В стернальном пунктате выявлены умеренные изменения - пунктат гиперклеточный, за счет равномерного увеличения всех ростков миелопоеза с нарушением вызревания. Красный росток с выраженным мегалобластоидным компонентом, бластов 1,6%. Проводился поиск причины анемического синдрома (онкопоиск, аутоиммунный процесс и т.д.), но патологии, которая могла бы привести к упорной, рефрактерной анемии, не выявлено.
В апреле 2008 года для уточнения диагноза и лечения больная была госпитализирована в гематологическое отделение ГКБ № 7, где при повторном исследовании костного мозга на фоне сужения красного ростка найдено 30% сидеробластов, кольцевидные формы 18%. Проведена трепанобиопсия - жировая ткань и костномозговые элементы в соотношении 2:1, 3:1, т.е. отмечается уменьшение кроветворных элементов. Данных за миело- и лимфопролиферацию нет. У больной диагностирован миелодиспластический синдром по типу рефрактерной анемии с кольцевидными сидеробластами, промежуточная группа риска 1. Проведено лечение: переливание эритроцитарной взвеси № 2. Выписана с клинико-гематологическим улучшеним - анемический синдром купирован, гемоглобин повысился до 120г/л. Повторные госпитализации в июне, сентябре 2008 г., апреле, июле 2009 года - поступала с выраженным анемическим синдромом (гемоглобин снижался до 60г/л, эритроциты 1,81*109). В стационаре проводились переливания эритроцитарной взвеси, получала эпоэтин альфа по 10 000 млн. МЕ 3 раза в неделю. Амбулаторно периодически получала лечение рекомбинантными эритропоэтинами.
В сентябре 2009 г. впервые проведено цитогенетическое исследование костного мозга, выявлено: кариотип женщины, мозаичный вариант со структурными перестройками по типу делеции 5 q -del(5)(q31;q35). В миелограмме препарат умеренноклеточный, тип кроветворения преимущественно нормобластный с небольшим процентом мегалобластов. Белый росток несколько угнетен. Созревание гранулоцитов без особенностей, бластов 4,1%. Красный росток умеренно раздражен - представлен нормобластами 30,2%; мегалобластами 1%; соотношение белого и красного ростков 2,2:1; индекс созревания эритробластов 0,93; полихромазия. Мегакариоцитов 8/на100полей зрения.
Был диагностирован миелодиспластический синдром по типу рефрактерной анемии с изолированной делецией 5q, промежуточная группа риска - 1 (по IPSS), тяжёлое течение.
Учитывая отсутствие эффекта от паллиативной терапии, потребность в частых гемотрансфузиях, наличие делеции q 5 хромосомы, больной было решено провести лечение новым высокотехнологичным препаратом для эпигенетической терапии МДС - децитабином.
С 6.10. 2009 г. в гематологическом отделении ГКБ № 7 проведен первый курс лечения децитабином 50 мг № 5 в/в. После курса развилась глубокая панцитопения с присоединением фебрильной нейтропении, агранулоцитоз продолжался 12 дней. Проводилась терапия выхаживания в полном объеме: Г-КСФ Грасальва 30 млн. МЕ п/к № 18, переливание эритровзвеси № 5, тромбоконцентрат 27 доз, комбинированная антибактериальная терапия , противогрибковые препараты, ацикловир. В дальнейшем проведено ещё четыре пятидневных курса лечения дакогеном со снижением дозы до 35 мг. После курсов развивалась умеренная тромбоцитопения без геморрагического синдрома, получала переливание тромбоконцетрата. Последний курс лечения дакогеном проведен в марте 2010 года.
На фоне проведенных 5 курсов лечения высокотехнологичным препаратом, восстанавливающим баланс генов, дакогеном, получен клинико-гематологический эффект: исчезла потребность в гемотрансфузиях, нормализовались показатели гемограммы. Диагностирована гематологическая ремиссия МДС. Длительность ответа составляет 14 месяцев. Всё это время больная наблюдается у гематолога в поликлинике, лечения не получает.
Выводы:
- Ведение больных с миелодиспластическим синдромом всё ещё является нерешённой задачей.
- Диагноз МДС ставится всегда с осторожностью, путем исключения других заболеваний, которые могли бы привести к развитию цитопений.
- Для постановки диагноза МДС необходимы не только рутинные гематологические методы обследования, но и обязательное проведение цитогенетического исследования костного мозга.
- Подход к лечению МДС должен быть индивидуальным и основываться на группе риска больного, возрасте, соматическом статусе.
- При выявлении цитогенетических поломок, как в нашем случае, при выборе тактики лечения преимущество в отношении качества жизни даёт эпигенетическая терапия децитабином.
- Лечение дакогеном действительно обладает клинической эффективностью, вызывая высокий уровень общего ответа на терапию у больной миелодиспластическим синдромом, так как позволяет исключить потребность в гемотрансфузиях, снизить количество осложнений, связанных с переливанием донорской крови, оптимизировать использование препаратов крови, сократить потребность в химиотерапии и поддерживающей терапии, повысить выживаемость больной, в данном случае на 14 месяцев, и тем самым увеличить время до прогрессирования заболевания.
Рецензенты:
- Винник С.Ю., д.м.н., профессор, зав. кафедрой О.Х. КрасГМУ, г. Красноярск.
- Никулина С.Ю., д.м.н., профессор, зав. кафедрой внутренних болезней № 1 КрасГМУ, г. Красноярск.
Работа получена 11.08.2011
Заболевания крови составляют многочисленную и разнообразную группу синдромов, формирующихся при нарушениях качественного и количественного состава крови. Все они систематизируются, исходя из поражения какого-либо компонента крови. Гематологические заболевания делят на три основные группы:
- патологии, характеризующиеся снижением уровня гемоглобина;
- гемобластозы;
- гемостазиопатии.
Рефрактерная анемия – одна из разновидностей малокровия, отличающаяся нарушением созревания клеток красного ростка.
Миелодиспластический синдром – это что?
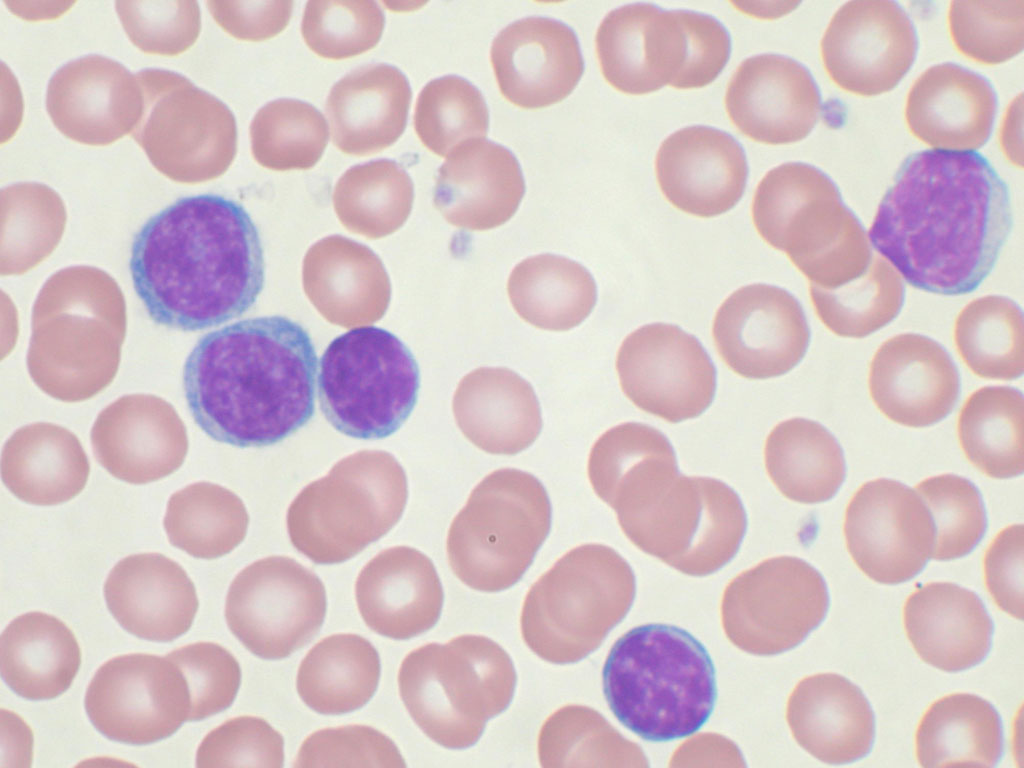
Группу заболеваний и состояний с нарушением процесса образования эритроцитов, моноцитов, тромбоцитов, гранулоцитов в миелоидной ткани (миелоидное кроветворение) с высокой вероятностью развития опухолевого поражения кроветворной системы в медицине именуют миелодиспластическим синдромом (МДС).
Одно из заболеваний группы миелодиспластического синдрома – рефракторная анемия. Данная патология, как и все остальные, объединенные МДС, относится к гематологическим заболеваниям, характеризующимися цитопенией (снижением уровня определенного вида клеток в крови) и патологическими изменениями костного мозга.
Классификация миелодиспластического синдрома
В международную классификацию болезней были внесены некоторые изменения, которые коснулись и гематологических заболеваний. Систематизация схожа с предложенной ранее ВОЗ, но отличается от FAB количеством вариантов определения заболеваний:
- D46.0 - рефрактерная анемия без сидеробластов.
- D46.1 - РА с кольцевыми сидеробластами. Незрелые кровяные клетки в крови не обнаруживаются.
- D46.2 - рефракторная анемия с избытком бластов 1. В анализе крови цитопения, превышение уровня моноцитов, тельца Ауэра отсутствуют.
- D46.3 - рефракторная анемия (РА) со множеством бластов с трансформацией.
- D46.4 - РА неуточненная.
- D46.5 - рефракторная цитопения со многолинейной дисплазией.
- D46.6 - миелодиспластический синдром, ассоциированный с делецией 5q.
- D46.7 - другие миелодиспластические синдромы.
- D46.9 - миелодиспластический синдром неуточненный.
Особенности рефрактерной анемии
Refractorius в переводе с латыни означает "невосприимчивый", "трудноизлечимый". Заболевание относится к гематологическим и характеризуется нарушением развития эритроцитного ростка в крови, продуцируемого костным мозгом. При синдроме рефрактерной анемии сначала снижается содержание эритроцитов в крови, а потом и остальных клеток, поражается орган кроветворной системы, отвечающий за гемопоэз.
Основная опасность патологии заключается в том, что она не поддается лечению, основанному на применении железосодержащих препаратов. Данный вид анемии часто протекает практически бессимптомно и выявляется при диагностике других патологий. Болезнь быстро прогрессирует и ведет к развитию острого лейкоза.
Рефракторная анемия с избытком бластов
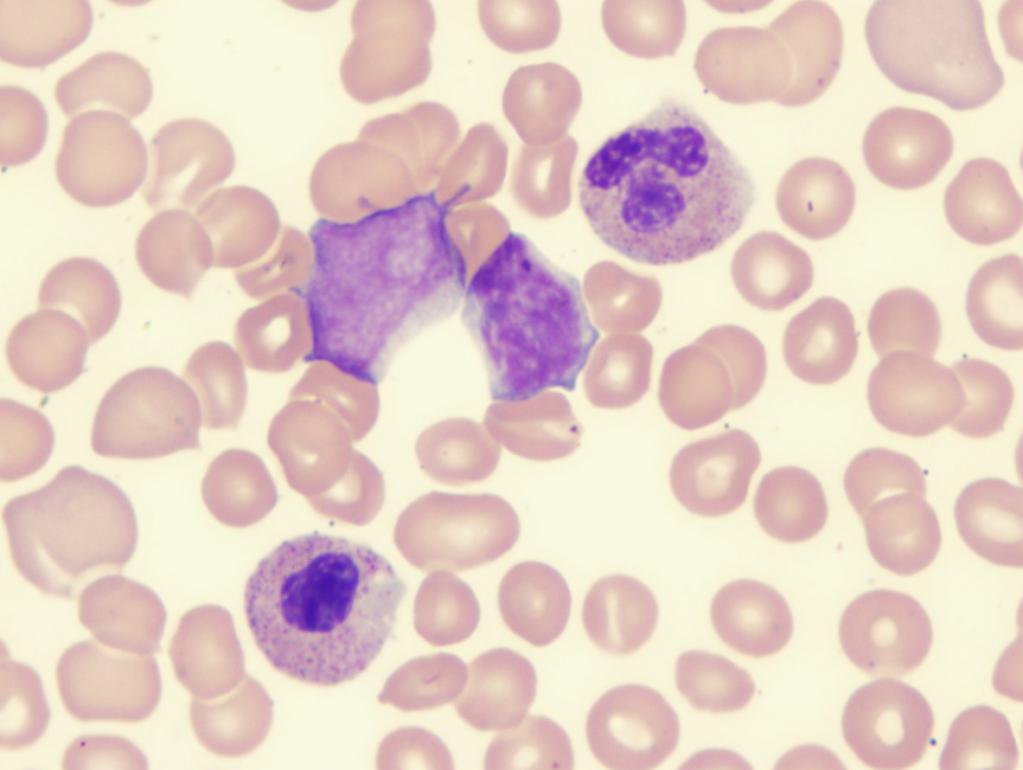
Исходя из статистических данных, людей с подобным диагнозом около 1 015 000. Заболевание чаще всего встречается у мужчин 75-80 лет, а у женщин в возрасте 73-79 лет. Патологию делят на два типа:
- РАИБ-1 – характеризуется цитопенией, увеличением числа моноцитов в крови. Палочковидные красные белковые включения в цитоплазме моноцитов (тельца Ауэра) не обнаруживаются. В костном мозге наблюдается дисплазия одной клеточной линии, бластов (незрелые кровяные клетки) около 5-19 %.
- РАИБ с трансформацией – анализ крови показывает повышенное содержание моноцитов, выявляются тельца Ауэра. Содержание бластов около 30 %. В костном мозге обнаруживаются дисплазии сразу нескольких клеточных линий. Подобная картина способствует развитию острого миелолейкоза.
Смертность от данной патологии составляет около 11 %.
Причины возникновения патологии
Точные причины развития заболевания до сих пор не выявлены. Разделяют два типа синдрома, и по каждому из них установлены факторы риска.
Первичный (идеопатический) выявляется в почти 90 % случаев. Факторы риска:
- Курение.
- Превышенный уровень радиации.
- Проживание в неблагоприятной экологической зоне.
- Регулярное вдыхание паров бензина, органических растворителей, пестицидов.
- Врожденный нейрофиброматоз Реклингхаузена (развитие опухолей из нервной ткани).
- Наследственная анемия Фанкони.
- Синдром Дауна.
Вторичный тип рефрактерной анемии (МДС) наблюдается в 20 % случаев, может развиваться в любом возрасте. Основные причины развития:
- Химиотерапия или радиотерапия.
- Долговременное применение некоторых групп лекарственных средств: циклофосфаты, антрациклины, ингибиторы топоизомеразы, подофиллотоксины.
Вторичный вариант отличается высокой резистентностью к терапии и большой вероятностью формирования острого лейкоза и, как следствие, неблагоприятным прогнозом.
По каким признакам определить заболевание?

Часто патология развивается без каких-либо симптомов, что мешает начать лечение на ранних этапах и в мягких формах. Как правило, диагностируется рефрактерная анемия в тяжелой степени при плановом обследовании пациента.
Но выявить заболевание на ранних этапах все же можно. Первые его признаки имеют много общего с проявлениями, возникающими при патологиях печени, аутоиммунных заболеваниях и любой другой анемии. К ним относятся:
- Бледность, прозрачность кожи, в особенности на лице.
- Чрезмерное утолщение рогового слоя эпидермиса на локтях и коленях.
- Образование гематом, которые долго проходят.
- Постоянные трещины на слизистой рта.
- Ломкость ногтей.
- Изменение обоняния и вкуса: пристрастие к резким запахам, желание есть землю, мел.
- Быстрая утомляемость.
- Частые ОРВИ с тяжелым течением.
При обнаружении подобных симптомов следует обратиться к врачу.
Клинические проявления тяжелой степени патологии

Клиническая картина анемии состоит из двух фаз: хроническая гемодепрессия и тяжелая (финальная) стадия.
При гемодепрессии наблюдаются следующие проявления:
- Значительное повышение температуры, лихорадка.
- Резкий упадок сил.
- Общее плохое самочувствие.
- Снижение веса.
- Увеличение внутренних органов: селезенки, печени.
- Увеличение и болезненность лимфатических узлов.
Подобные состояния затяжные, с периодами ремиссии.
Симптомы тяжелой степени рефрактерной анемии (миелодиспластический синдром) такие же, как при остром лейкозе. Болезнь развивается стремительно. Одной из ее особенностей является обнаружение бластов в анализе крови. Заболевание сопровождается следующими симптомами:
- Гематомы, даже при незначительных ушибах.
- Кровоточивость десен.
- Гингивит.
- Бинокулярное смещение глазного яблока.
- Упорные повторные воспалительные процессы в носоглотке.
- Нагноение царапин, небольших ран.
- Боли в области позвоночника.
У пациентов пожилого возраста возникают вторичные заболевания, чаще поражается сердечно-сосудистая система. Пациенты испытывают боли при ходьбе в нижних конечностях.
Диагностические мероприятия
При первых подозрительных симптомах необходимо обратиться к доктору. Диагноз "миелодиспластический синдром" или "рефрактерная анемия с избытком бластов" ставится только после прохождения ряда лабораторных исследований. Они включают:
- Клинический анализ периферической крови.
- Цитологические исследования аспирата костного мозга.
- Трепанобиопсия заключается во взятии биоматериала из костного мозга путем прокола большеберцовой кости.
- Цитогенетический тест. Анализ выявляет хромосомные нарушения, является обязательным.
В зависимости от клинической картины заболевания могут быть назначены дополнительные диагностические мероприятия:
- УЗИ брюшной полости.
- Эзофагогастродуоденоскопия желудочно-кишечного тракта.
- Анализ на специфические онкомаркеры.
Методы терапии
Выбор способа лечения рефрактерной анемии обусловлен выраженностью клинических проявлений и результатами лабораторных исследований. Схемы терапии довольно сложны и определяются врачом. Пациенты с небольшим количеством бластов находятся в группе низкого риска. Они получают заместительное и поддерживающее лечение и могут вести практически обычный образ жизни. Приблизительная схема лечения такова:
Прогнозирование
Прогноз рефрактерной анемии (миелодиспластический синдром) зависит от клинической картины, ответной реакции организма на терапию, своевременности обращения за медицинской помощью. Исход заболевания обусловлен выраженностью дефицита определенных клеток, наличие и профиль хромосомных отклонений, количество бластов и их тенденцию к развитию в крови и костном мозге.
Профилактика

Ввиду того что сущность, обстоятельства и механизмы развития патологии до конца еще не исследованы, то и действенные профилактические методы назвать практически невозможно. Врачи советуют придерживаться следующих рекомендаций по сохранению здоровья:
- Правильно сбалансировано питаться.
- Включать в рацион продукты с высоким содержанием железа.
- Чаще совершать прогулки на свежем воздухе.
- Отказаться от вредных привычек, в частности курения.
- При работе с пестицидами или органическими растворителями применять средства защиты.
Рефракторная анемия – опасное гематологическое заболевание, переходящее в онкологию. Чтобы избежать тяжелых стадий заболевания и серьезных последствий, необходимо регулярно проводить плановый осмотр. При обнаружении патологии необходимо полностью пройти курс терапии, многим пациентам это помогло не только улучшить, но и продлить жизнь.
Читайте также:

