Механизмы бессмертия раковых клеток
• Раковые клетки избегают старения за счет инактивации генов-супрессоров опухоли
• Раковые клетки достигают критической точки, в которой многие из них погибают
• Клетки, прошедшие критическую точку, становятся бессмертными
• С каждым поколением клеток, если не активируется теломераза, то теломеры укорачиваются
• Когда теломеры становятся слишком короткими и не защищают хромосомы, последние сливаются концами, что приводит к кризису
• В большинстве раковых клеток транскрипция теломеразы активирована; тем самым они избегают гибели
Существованием онкогенов и генов-супрессоров опухоли объясняются многие аспекты нарушения регуляции роста раковых клеток, исключая один критический аспект. Раковые клетки обладают неограниченным пролиферативным потенциалом, в то время как здоровые клетки в культуре до прекращения роста способны лишь к ограниченному количеству удвоений. После этого они вступают в фазу покоя, или старения.
В клетках человека вступление в фазу старения можно предотвратить при инактивации генов-супрессоров опухоли р53 и Rb. Если произошла инактивация, клетки растут в течение следующего периода времени до наступления кризиса, после чего в основном начинают погибать. В редких случаях клону клеток удается избежать гибели, и они начинают интенсивно расти; такие клетки приобрели неограниченную способность к репликации, т. е. стали иммортализованными. Вероятно, многие из этих этапов также предшествуют иммортализации раковых клеток, которая происходит при развитии опухоли у человека.
Способность клеточных линий учитывать количество репликативных удвоений, через которые она проходит, трудно совместить с функционированием онкогенов и генов-супрессоров опухоли. Эти гены участвуют в приеме и обработке сигналов, которые клетки постоянно получают из окружающей среды. Однако способность клетки контролировать число удвоений подразумевает наличие неких клеточных часов, которые функционируют независимо от клеточного окружения.
Эти автономные клеточные часы находятся в теломерах на концах хромосом. Теломеры включают гексануклеотидные последовательности, которые в каждой теломере повторяются несколько тысяч раз. Функционируя совместно со специфическими белками, теломерная ДНК служит для защиты концов хромосом от слияния с другими хромосомами.
Однако главная машина репликации ДНК не способна точно копировать самые концы теломерной ДНК. Поэтому всякий раз, когда клетка проходит через S-фазу, теломерная ДНК становится короче на 100-150 нуклеотидов. В конце концов, в результате многих циклов деления в потомстве клеток остаются такие короткие теломеры, что они более не в состоянии эффективно защищать концы хромосомальной ДНК. Слияние концов хромосом представляет собой катастрофическое молекулярное событие, которое переводит клетки в кризисное состояние.
Для того чтобы обеспечить свою дальнейшую экспансию, популяция раковых клеток должна преодолеть эти высокоэффективные барьеры. Клетки достигают этого, блокируя экспрессию фермента теломеразы. Обычно этот фермент находится в значительных количествах только в ранних эмбриональных клетках и в сперматозоидах. В этих клетках фермент необходим для поддержания существования и элонгации теломерной ДНК. Однако 90% раковых клеток человека обладают значительным уровнем теломеразной активности.
Это объясняется депрессией соответствующего гена в некоторые моменты роста опухоли. Очевидно, что постоянное функционирование фермента необходимо для пролиферации этих клеток. Если в раковых клетках отсутствует теломеразная активность, они вступают в кризисное состояние и в большом количестве погибают. Это делает понятным, что пролиферативная активность раковых клеток в такой же степени зависит от теломеразы, как и от гиперактивации онкогенов и инактивации генов-супрессоров опухоли.
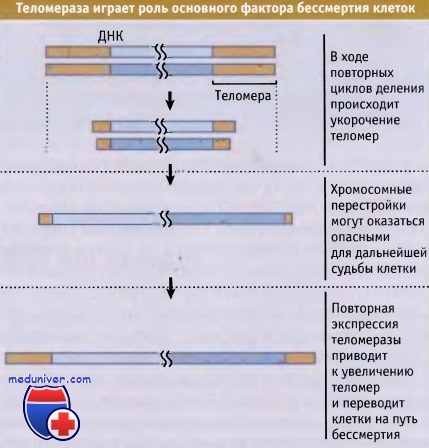
Укорачивание теломер, которое происходит после многих циклов деления, приводит к их дестабилизации.
Хромосомы с укороченными теломерами склонны к перестройкам, могущим иметь для клетки опасные последствия.
В раковых клетках повторная экспрессия теломеразы приводит к восстановлению длины хромосом и позволяет клеткам продолжать деление.
Будущее приближается, и от него никуда не деться: если еще 100 лет назад средняя продолжительность жизни была 40–46 лет, то сегодня, если верить статистике, в развитых странах она составляет около 80 лет. Универсального рецепта долгой жизни сегодня нет ни у кого, но вполне вероятно, что современные технологии смогут нам его подсказать. И случиться это может даже раньше, чем вы думаете.
Первая технология, открывающая дверь в бессмертие, уже стала притчей во языцех. Где только ее ни эксплуатировали и как только ни издевались над ней, особенно после появления овечки Долли. Вы уже, наверное, догадались, о чем пойдет речь.
Клонирование
Само по себе клонирование не предполагает продление жизни отдельно взятой особи.

Вот только выращивать такие тела запрещено с 1998 года. И этот запрет будет сохраняться до тех пор, пока мы сами для себя не решим этическую дилемму: считать ли убийством пересадку своей личности в другое тело? Ведь мы должны будем удалить у клона мозг и заменить его своим.
Отрасль создания искусственных органов сегодня переживает свой расцвет: ученые научились выращивать не только кожу, но и внутренние органы (печень и сердце), работают над созданием искусственного пениса и мозговой ткани.
Да, из вашей печени можно взять клетки и вырастить новую практически такую же (хотя, подозреваем, что делать этого не стоит). Можно даже пересадить вам эту печень, если родная откажет.
Но когда дело доходит до объединения искусственных органов в систему, возникают серьезные проблемы. Ведь для этого нужно учесть целую кучу факторов: особенности биохимических процессов, биосовместимость клеток, стабильность нового организма во времени. Это не просто пересадка одного органа взамен другого, это создание всей системы с чистого листа — каждого сосуда и нерва, каждой складки кожи и волоска на голове. Кроме того, очень сложно создать какую-то конкретную искусственную часть тела и поддерживать ее существование для остальных систем организма. Например, сердце не сможет работать, если к его тканям не будут поступать кровь и электрические сигналы по нервным окончаниям.
Следующая технология, о которой пойдет речь, существует уже сегодня и даже применяется несколькими компаниями, хотя ученые и сомневаются в том, что она может обеспечить бессмертие.
Крионирование
Технология крионирования, впервые описанная в научно-фантастических романах, плавно перешла в реальный мир благодаря трансгуманистам и ученым. Тело человека или только его мозг замораживают, чтобы сохранить до момента, когда наука научится лечить все болезни на свете, пересаживать людей в новые тела или загружать сознание в компьютер.

Чтобы такой способ продления жизни был законным с точки зрения юристов, тело нужно замораживать сразу после зафиксированной биологической смерти, иначе это будет считаться убийством. То есть, по сути, крионирование — это что-то вроде бальзамирования на современный лад.
Почему же заморозка считается вариантом утилизации трупа, а не способом продлить нашу жизнь на тысячу лет? Одна из сложностей, как ни странно, состоит в том, что человеческие клетки содержат в себе много воды. Охлаждаясь до температуры замерзания (для содержимого клеток она немного ниже −40 °C), цитоплазма клеток превращается в кристаллики льда. Но этот лед занимает бóльший объем, чем вода, из которой он образовался, и, расширяясь, повреждает стенки клеток. Если в дальнейшем эти клетки разморозить, они уже не смогут функционировать: их мембрана будет необратимо разрушена.
От столь холодной материи мы переходим к, пожалуй, самому желаемому многими способу продления жизни.
Перенос сознания в компьютер
Информация переносится по проводам в компьютере намного быстрее, чем по нервной системе в человеческом теле. Но у компьютеров, как мы знаем, есть один недостаток: они не умеют мыслить, как люди. Научившись перемещать сознание человека в электронные устройства, мы создадим симбиоз с огромным потенциалом.
Этап моделирования и составления карт мозга уже идет вовсю. В 2005 году был запущен проект Blue Brain Project, цель которого — создать полную карту человеческого мозга к 2023 году. В 2011-му его участники смогли полностью картографировать мозг крысы (это около 100 млн нейронов). По словам ученых, мозг человека по объему равен примерно 1000 крысиным мозгам, поэтому для его картографирования потребуется не 6, а 12 лет. Учтем, однако, что данные этих экспериментов обрабатывал суперкомпьютер Blue Gene, скорость вычислений которого в 6 раз меньше скорости лучших современных машин, поэтому процесс в перспективе можно значительно ускорить.
Второй проект — Human Brain Project, основанный в 2013 году в Швейцарии и в значительной мере финансируемый Европейским союзом, — можно считать прямым продолжением Blue Brain (у них одни и те же создатели). Однако цели у них всё же немного различаются. Если Blue Brain хочет лишь картографировать человеческий мозг и приблизиться к пониманию того, что такое память и сознание, то Human Brain планирует полностью смоделировать работу мозга в компьютере. Вместе оба этих проекта открывают путь к созданию цифрового аналога человеческого разума.
К сожалению, и тут не всё так радужно и хорошо. Если картографировать мозг и заставить его работать в виртуальном мире еще потенциально возможно, то когда дело доходит до загрузки сознания, всё становится ой как непонятно. Ведь мы даже не знаем, что такое сознание и чем оно определяется. Хотя взглядов на этот счет столько же, сколько ученых на планете, ни одна из теорий сознания не подкреплена экспериментальными фактами, а значит — это всего лишь гипотезы.
Соединить себя с компьютером — это, конечно, круто, но не все готовы сделать такой шаг. Не каждый готов и клонировать себя или заморозить в криокамере. Поэтому сейчас мы расскажем о тех способах достижения вечной жизни, которые никак не отразятся на вашем внешнем виде, не потребуют сложного морального выбора и не будут столь неопределенными.

Рак
Да-да, вы не ослышались. Рак — это не просто болезнь, это изменения клеток, которые мы не можем контролировать.
Но если это станет возможным, мы убьем двух зайцев: избавимся от страшных болезней и сможем продлить жизнь многих людей на годы, а то и десятилетия. Кроме того, научившись программировать рост раковых клеток, мы откроем новый способ выращивания биологических тканей для пересадки больным.
Как сделать раковые клетки нашими союзниками? Для этого надо понять, почему они вообще могут бесконечно делиться. Мы уже выяснили, что они избегают апоптоза — ну а кто умирать-то хочет?
Научившись контролировать процессы внутри раковых клеток, мы сможем управлять ими по своему желанию и жить столько, сколько нам вздумается.
Но тут возникает немало проблем. Во-первых, раковые клетки перестали умирать не от хорошей жизни. Они похожи на обреченных на смерть людей, которые готовы продать душу дьяволу, лишь бы остаться в живых.
Исследований по этому вопросу пока мало, но внушают надежду HeLa — культура раковых клеток, извлеченная в 1951 году из опухоли шейки матки женщины по имени Генриетта Лакс (Henrietta Lacks). С тех пор получены триллионы этих клеток, и они по-настоящему бессмертны.
Да, с раковыми клетками не всё так просто, но согласитесь — способ очень соблазнительный. От превращения болезни в лекарство вечной жизни мы переходим к еще одной безумной идее, которая тем не менее в перспективе может обеспечить нам вечную жизнь без потери личности и тела.
Симбиоз
Внутри человека живет масса разных видов бактерий. Каждая из них эгоистична и действует только в своих интересах. Интересы ряда бактерий совпадают с нашими, поэтому они нам помогают — например, перерабатывают в кишечнике непереваренные остатки еды. Другие бактерии, которые мы называем вредными, тоже питаются веществами в нашем организме, но при этом выделяют в него токсины. С первыми видами у нас завязываются взаимовыгодные отношения — симбиоз: мы даем им пищу для жизни, а они избавляют нас от непереваренных остатков еды, которые иначе гниют и приносят вред.
Идея использования бактерий для лечения возникла относительно недавно.
Так, вирус гриппа постоянно мутирует, приспосабливаясь к лекарствам, которые его убивают. Производство каждого нового средства требует всё больше ресурсов и денег, и в конце концов зайдет в тупик, чего не скажешь о бактериях. Их геном легко изменить и настроить на уничтожение конкретного типа вируса, к тому же бактерии при необходимости могут сами мутировать.

Если рассматривать наш симбиоз с бактериями в качестве средства для бессмертия, тут тоже возникают некоторые проблемы с реализацией. Использование модифицированной микрофлоры может не дать возникнуть некоторым болезням и излечивать существующие, но исключить запрограммированную смерть клеток оно не способно. Однако эти бактериальные помощники позволят продлить нашу жизнь не на один десяток лет, и, согласитесь, это уже немаловажный шаг на пути к истинному бессмертию.
Интерес к этой теме подогревают результаты исследований, опубликованные российскими учеными в 2015 году: обнаруженная ими в Мамонтовой пещере бактерия Bacillus F оказалась способна продлевать жизнь подопытных мышей на 20–30 %. Возможно, когда наука изучит механизмы, дающие такой эффект, мы сможем модифицировать этот вид бактерий и увеличить этот процент до 100–150.
Мы рассмотрели пять перспективных методов увеличения продолжительности жизни до бесконечности, но так и не разобрались, что значит эта бесконечность. В научном понимании это то время, которое осталось нашей Вселенной до ее смерти, если она вообще возможна. Но на практике сможем ли мы жить так долго?
Информация, которая накапливается в нашем мозге, может в конце концов повредить его: есть риск просто сойти с ума — хотя пока что встречаются менее страшные симптомы переизбытка информации. Они входят в так называемый синдром информационной усталости — психологическую болезнь XXI века, проявление которой в обществе будет от года к году только возрастать, если мы не научимся эффективно распределять информационные потоки и выносить из каждого прочитанного материала пользу.
К тому же, по теории вероятности, с каждым годом нашей жизни растет вероятность несчастного случая: сегодня человек может доехать до работы спокойно, а завтра в него влетит фура. Если вы летаете самолетом, есть небольшой шанс, что он упадет и вы погибнете. Это очень маленькие риски, но чем дольше вы живете, тем больше они начинают сказываться на вашей жизни.
Вы возразите, что уже, может быть, через 50 лет все автомобили будут оснащены автопилотом или мы будем летать на аэротакси, и тогда жить станет менее рискованно. Но это не так.
Взамен устраненных нами рисков приходят другие, и каждый невозможно предсказать. Поэтому бессмертие — это, скорее, состояние возможности выбора между жизнью и смертью. Если вы вольны выбирать, когда хотите уйти из жизни без принуждения, можно считать, что цель науки достигнута.
Раковые клетки не бессмертны , как и все остальные. Образование обычной клетки в раковую происходит на самых ранних этапах развития этой клетки , когда способность к размножению превышает таковую у других клеток в сотни раз. Это по сути те же стволовые клетки. Отсюда такая " живучесть" , но не бессмертность. Клетки иммунной системы не сразу могут распознать онкологическую клетку , потому что генетически она "родная" для организма. И к тому моменту , когда клетки - киллеры начинают уничтожать раковые клетки , их становится слишком много - останется хоть одна и процесс начнется заново. Кроме того, новые технологии лечения онкологических заболеваний связаны с фактором некроза опухоли , который синтезируется организмом постоянно . Поэтому бессмертия им точно не видать. А вот омоложение с помощью стволовых клеток давно используется . Но это очень противоречивая тема.
Хороший пример бессмертия раковых клеток — это клетки HeLa, изначально полученные из опухоли шейки матки Генриетты Лекс в 1951 г. Эта культура по сей день используется в лабораторных исследованиях. Клетки Hela в самом деле бессмертны: по оценкам, ежедневно производится несколько тонн этих клеток, причём все они являются потомками нескольких клеток, извлечённых из опухоли Г. Лекс.
Чтобы клетка стала раковой (запустив механизм своего размножения и деления в организме человека), она проходит несколько этапов мутаций (трансформируется). Не любых мутаций, а именно критичных для превращения в канцерогенную клетку. Их должно быть не менее пяти (8-10), их комбинации - самые разные. Нет абсолютно одинаковых опухолей, как и одинаковых причин их возникновения.
У каждой нашей клетки (их около 100 триллионов) - своя продолжительность жизни, у каждого органа - свои клетки. И программа клеточной гибели срабатывает только после многократного "сигнала смерти". Сигнал может прийти из окружающей клетку среды или собственных внутриклеточных "датчиков неблагополучия".
В здоровом и нормально функционирующем организме ежесекундно(!) погибает огромное количество клеток и столько же образуется вновь. Опухоль возникает, когда этот процесс иногда выходит из-под контроля. И появляются мутантные клетки, которых ежедневно(!) в организме возникает до сотни тысяч. Их постоянно отслеживают и уничтожают две системы контроля нашего организма: система клеточного генетического самоконтроля и система противоопухолевого иммунитета.
Сложность в том, что если клетка в результате мутации не поддастся действию одной из этих двух систем контроля, то она будет неуязвима и для другой. И потомки этой клетки положат начало формированию мутантного клона - они приобретают способность ускользать от системы генетического самоконтроля и в дальнейшем избегать гибели при тиражировании вновь появившихся мутаций.
Таким образом, опухолевая клетка постоянно эволюционирует, порождая новые клеточные клоны, наиболее злокачественные из которых начинают вытеснять менее злокачественные. Остановить это возможно, лишь удалив опухоль, ограничивая их рост.
Сейчас ученые работают над тем, чтобы раковая клетка совершила самоубийство, поедая саму себя.
Мастерок.жж.рф
Когда мне было лет 10 все вокруг практически уверенно говорили, что пройдет буквально 50 лет и люди будут жить не менее 200 лет. Наука и медицина несомненно должна была шагать семимильными шагами и мы точно должны были увидеть прорыв. Но сейчас понятно, что на это надо наверное еще лет 200. Однако, смотрите про что я узнал .
Оказывается существуют теломеры - это концевые участки линейной молекулы ДНК, которые состоят из повторяющейся последовательности нуклеотидов. У человека и других позвоночных повторяющееся звено имеет формулу TTAGGG (буквы обозначают нуклеиновые основания). В отличие от других участков ДНК теломеры не кодируют белковые молекулы, в некотором роде это "бессмысленные" участки генома.
В 1971 году российский ученый Алексей Матвеевич Оловников впервые предположил, что при каждом делении клеток эти концевые участки хромосом укорачиваются. То есть длина теломерных участков определяет "возраст" клетки - чем короче теломерный "хвост", тем она "старше".
Через 15 лет это предположение экспериментально подтвердил английский ученый Говард Кук. Правда, нервные и мышечные клетки взрослого организма не делятся, теломерные участки в них не укорачиваются, а между тем они "стареют" и умирают. Поэтому вопрос о том, как "возраст" клетки связан с длиной теломер, остается по сей день открытым. Одно несомненно - теломеры служат своего рода счетчиком клеточных делений: чем они короче, тем большее число делений прошло с момента рождения клетки-предшественницы.

Сколько отведено человеку для жизни, мало кто может сказать, почему человек стареет. Ученые уже давно задаются вопросом: что происходит в организме и запускает процесс старения? Клетки могут делиться, и казалось бы, организм будет вечно молодым, здоровым и жить вечно, но оказывается наши клетки могут обновляться до определенного количества раз, а потом наступает время болезней и процесса старения, что приводит к смерти, невозможности клеток возобновляться. Существует много теорий, рассматривающие разные аспекты, как первопричину старения, но сегодня известная настоящая причина, с которой справиться никто не может.
Одни ученые говорят, что старение начинается с процессом повреждения и распада белка. А белок, как мы уже знаем, является строительным материалом нашего тела, в частности костей. Другие исследователи видят гены смерти, которые начинают активизироваться в старости. Еще одно мнение: организм накапливает загрязнения, если доза мусора в организме превышает допустимую, то запускается очередность заболеваний, организм истощается и умирает. Также существует иммунологическая теория. В какую из них верить, дело каждого. Истинная причина, почему человек стареет и начинается отмирание клеток находится в нашем генетическом коде.
Старение начинается из-за укорачивания длины теломер – это конечный участок генетического кода (ДНК). Теломеры направлены защищать хромосомы от прилипания друг к другу, что может повлечь потерю информации. Такие выводы сделали ученные в процессе наблюдения за жизнью клеток молодых и в процессе их старения. Длина теломер в генах молодых клеток отличается от состарившихся. Теломеры ДНК в молодых клетках длиннее, чем концы в старых клетках. Когда теломера разрушается, погибает клетка. Клетка имеет способность делиться до тех пор, пока ее теломера не разрушиться.
Такая теория должна была найти объяснения и доводы. Были проведены опыты над мышами. Специалисты в области генетики искусственным образом укорачивали теломеры клетки ДНК у здоровой молодой мыши. Чем короче становилась теломера, тем больше появлялось заболеваний, характеризующих процесс старения. Полученные результаты послужили доказательством теории зависимости молодости и старения от длины теломер в клетках. При укорачивании длины теломер возникают такие заболевания: артрит, артроз, дегенеративный и дистрофические процессы, заболевания, связанные с сердечно-сосудистой системой, нарушения нервной системы, остеопороз, изменения в кожном покрове.

Теломераза - это фермент-"удлинитель", его функция - достраивать концевые участки линейных молекул ДНК, "пришивая" к ним повторяющиеся нуклеотидные последовательности - теломеры. Клетки, в которых функционирует теломераза (половые, раковые), бессмертны. В обычных (соматических) клетках, из которых в основном и состоит организм, теломераза "не работает", поэтому теломеры при каждом делении клетки укорачиваются, что в конечном итоге приводит к ее гибели.
В 1997 году американские ученые из университета Колорадо получили ген теломеразы. Затем в 1998-м исследователи из Юго-Западного медицинского центра Техасского университета в Далласе встроили ген теломеразы в клетки кожи, зрительного и сосудистого эпителия человека, где фермент в обычных условиях "не работает". В таких генетически модифицированных клетках теломераза находилась "в рабочем состоянии" - пришивала к концевым участкам ДНК нуклеотидные последовательности, поэтому длина теломер от деления к делению не менялась. Таким способом ученым удалось увеличить жизнь обычных клеток человека в полтора раза. Не исключено, что этот метод поможет найти ключ к продлению жизни.
Итак, теломераза остается главным кандидатом на звание эликсира бессмертия. И в то же время этот фермент - один из главных факторов злокачественного перерождения клеток. Раковые клетки бессмертны благодаря тому, что в них "работает" теломераза. Вот почему бессмертие и рак в природе как бы уравновешивают друг друга: бессмертный организм теоретически может жить вечно, но он неминуемо погибнет от рака.
И вот в прошлом году был найден способ удлинения теломер для продления жизни. Ученые из Стэнфордского университета разработали метод стимуляции концевых участков хромосом, которые отвечают за старение человека.

Таким образом удалось удлинить теломеры более чем на 1000 нуклеотидов, что эквивалентно нескольким годам человеческой жизни. Что важно, процесс совершенно безопасен для здоровья и не приводит к неконтролируемому делению клеток: иммунная система просто не успевает отреагировать на введенную в организм РНК, которая бесследно распадается. Открытие поможет увеличить количество клеток для исследований медицинских препаратов и моделирования заболеваний, а в перспективе и для продления жизни.
И еще немного интересного по медицинской тематики: вот например Профессор Преображенский в реальности, а вот как вам Робот из крысиных сердец. Давайте вспомним, что такое Эффект плацебо и узнаем, как Микробы заставляют нас пить пиво

Следует отметить, что долгое время в научном мире существовала гипотеза противоположная теории предельного деления клеток, согласно которой считалось, что сама клетка бессмертна.
Все зависит от жидкой среды, в которой клетка находится и функционирует. Если найти механизм периодического обновления этой среды, то биение жизни может быть значительно продлено.
Найти такой механизм пытался известный французский хирург, биолог, патофизиолог, евгенист Алексис Каррель (1873–1944), лауреат Нобелевской премии по физиологии и медицины (1912).
Большую часть своих экспериментов ученый выполнил для клеток сердца эмбрионов курицы возрастом от 7 до 15 дней.
Культивирование кусочков тканей проводили не в чистом экстракте, а с гипотонической сывороткой в соотношении 1:2 соответственно.
Ученому и его коллегам удалось поддерживать клетки жизнеспособными и размножающимися при последующих переносах в свежую питательную среду.
Культивирование клеток привлекло всеобщий интерес, и линия клеток фибробластов соединительной ткани поддерживалась в течение 34 года, пережив самого ученого.
Таким образом, гипотетически удалось увеличить продолжительность жизни птицы, как биологического вида фактически в 3,5 раза. В пересчете на жизнь человека это примерно 265–270 лет.
Старение и смерть клеток наступает в результате их взаимодействия в составе единой ткани, а не за счет процессов, происходящих внутри индивидуальной клетки, таков был основной вывод Алексиса Карреля по результатам эксперимента.
Благодаря этому выводу долгое время в среде ученых господствовала точка зрения, что клетки бессмертны, а старение и смерть — это свойство организма в целом.
Добавление экстрактов эмбрионов обновляло регулярно клеточную популяцию и это создавало видимость, что на чашке растут одни и те же клетки, а не появляются новые.
И еще один любопытный факт, подтверждающий гипотезу о возможном бессмертии живой клетки. В современных биомедицинских исследованиях и при разработке новых видов лечения часто используют выращенные в лаборатории культуры человеческих клеток.
На протяжении многих лет клетки были анонимными, ученые не знали, кому именно они принадлежали. Однако, совершенно неожиданно, этот биологический материал получили широкую известность.
Оказалось, что клетки были взяты у красивой чернокожей американки по имени Генриетта Лакс (Henrietta Lacks, 1920–1951). Она жила в небольшом городке Тернер в Южной Вирджинии вместе с мужем и пятью детьми.
В феврале 1951 г. она обратилась в госпиталь Джонса Хопкинса, где ей поставили диагноз рак шейки матки. Несмотря на хирургическую операцию и радиационное облучение, через восемь месяцев она скончалась. Было ей 31 год.
Размножались они вдвое быстрее клеток из нормальных тканей. Эти клетки пролиферируют необычайно быстро даже в сравнении с другими раковыми клетками.
В то время культивирование клеток вне организма было только на стадии становления, и главной проблемой была предопределённая гибель клеток. Как правило, после определенного количества делений вся клеточная линия погибала.
Эти клетки стали незаменимым инструментом для медицинских исследований. Миллиарды этих клеток покупались и продавались, при этом приносили значительные доходы медицинским фирмам.
Все это время семья Генриетты Лакс не подозревала об экспериментах с биологическим материалом их матери.
В начале этого века американская журналистка Ребекка Склут, бакалавр биологии и магистр изящных искусств в области творческой документалистики, преподаватель университета г. Мемфис, провела собственное расследование этого удивительного случая.
Период расследования начинается с 1950-х годов, когда Генриетта Лакс проходила лечение от рака, и продолжается до сегодняшних дней, когда дети и внуки Генриетты борются за наследственные права на биоматериал, взятый много лет назад у их матери без ее согласия.
В 2010 г. книга в категории нон-фикшн стала бестселлером и побила все мыслимые рекорды продаж во многих странах мира.
Генриетта Лакс была занесена в Книгу рекордов Гиннесса, как человек, чьи клетки через 60 лет после смерти все еще остаются живыми.
А как же предел деления клетки, о котором мы говорили выше? Вероятно, клетка действительно может делиться строго определенное количество раз, но если ученые смогут найти механизм обновления жизненной среды клетки и механизм удлинения теломер, то появится гипотетическая возможность увеличения количества их деления до бесконечности, как у опухолевых клеток или плоских червей планарий.
Взаимосвязь процесса старения и развитие раковых клеток
Еще одно доказательство связи процесса старения и развития раковых клеток нашли американские ученые. В 2012 г. исследователи из Онкологического центра Киммела в Джефферсоне выявили, что раковые клетки индуцируют окислительный стресс (аутофагию) в близлежащих клетках опухолевого микроокружения, в частности, в фибробластах, за счет чего питаются и растут.
Таким образом, старение клетки и аутофагия метаболически поддерживают рост раковой опухоли и метастазирование.
Поскольку клеточное старение отражает биологическое старение, это исследование может объяснить, почему заболеваемость раком экспоненциально возрастает по мере старения организма.
Метастазирование может, в конечном счете, определяться старыми клетками в опухолевой микросреде, а не самими раковыми клетками.
Это открытие полностью может изменить взгляды на рак, как на болезнь и ставит под сомнение устоявшееся мнение, что рак является клеточно-автономным генетическим заболеванием.
Напротив, из этого следует, что рак, фактически, представляет собой болезнь старения организма-хозяина, подпитывающую рост опухоли и образование метастазов и определяющую, таким образом, клинический исход.
Поэтому нормально стареющие клетки организма-хозяина могут стать ключом к эффективной противораковой терапии.
По мнению исследователей, это открытие означают смену парадигмы и вступление в совершенно новую эру разработки лекарственных средств для борьбы с раком.
Кроме того, открытие теломеразы, о котором мы говорили в предыдущих разделах, стимулировало новое направление исследований в онкологии и геронтологии. Учеными было доказано, что примерно 80–90% всех раковых клеток имеют аномально высокую активность теломеразы.
Это сохраняет их от потери теломер, не смотря на многие циклы репликации.
Теория апоптоза
Он заметил, что если надломить ветку, с которой уже начала опадать листва, то листопад прекращается и листья, хотя и меняют цвет, засыхают, но все же остаются на ветке.
То есть опадание листьев, в отличие от их омертвления на сломанной ветке, – физиологический процесс, преднамеренное самоубийство листьев.
Впервые мысль о том, что процесс старения как завершающий этап индивидуального развития организма может быть запрограммирован, высказал немецкий зоолог и теоретик эволюционного учения Август Вейсман (1834–1914).
Один из известных современных биохимиков, наш соотечественник академик Владимир Петрович Скулачев (1935 г. рождения), развивая научные идеи Августа Вейсмана о запрограммированной смерти, выдвинул свою гипотезу старения.
Ученый считает, что старение — это не столько накопление поломок в организме, ведущих к смерти, сколько запускаемая на генном уровне программа апоптоза.
Клетка самоубийца отмирает безболезненно, она как бы сама себя разбирает на части, которые соседние клетки впоследствии используют в качестве строительного материала.
Этим апоптоз отличается от травматической гибели клеток – некроза, когда разрывается клеточная мембрана и содержимое клетки вытекает наружу.
С помощью апоптоза природа выбраковывает в биологических системах больные, мутированные и прочие поврежденные клетки.
Андрианов Владимир
Профессор МГУ, д.э.н., академик РАЕН, бывший Помощник Председателя Правительства РФ
Читайте также:

