Механизмы апоптоза при опухолях
В последнее десятилетие в самостоятельную форму гибели клеток выделен апоптоз. Его находят в опухоли как до, так н после лечения. Для апоптоза характерно поражение отдельных клеток, отсутствие воспалительной реакции в тканях, быстрый фагоцитоз и переваривание погибших клеток.). Изменения клеток при апоптозе заключаются в маргииации хроматина и его распаде на фрагменты, конденсации цитоплазмы, разделении клетки на части с отделением последних в виде апоптотических тел. Считают, что при апоптозе происходит активация механизмов саморазрушения вместо процессов дегенерации, как это происходит при некрозе. Факторы, вызывающие апоптоз клеток, и его механизмы исследуются, но установлено, что радиация, гипертермия и химиотерапия опухолей ускоряют процесс.
Лечебные воздействия меняют гистофизиологию опухоли, пролиферацию (деление), дифференцировку и рост клеток, их соединение и перемещение, интенсивность специфического функционирования (если оно сохранилось), способность к клеточной и тканевой регенерации, чувствительность к влияниям внешней среды и др.
Пролиферативная способность клеток опухоли не только мишень для изыскания новых лекарственных химиотерапевтических средств и совершенствования известных методов лечения злокачественных новообразований, но и достоверный непосредственный морфологический критерий эффективности терапии, а также один из ведущих показателей степени патоморфоза.
Как известно, с точки зрения пролифератнвной способности опухолевая и нормальная ткань состоят из двух субпопуляций клеток пролиферируюшей (фракция роста, пролиферативный пул) и покоящейся. Последнюю образуют клетки, временно выходящие из клеточного цикла и сохраняющие способность делиться (фаза G0), а также непролиферирующие клетки. Ионизирующее излучение, особенно лекарственные химиотерапевтические средства, действует в основном на фракцию роста, т. е. на все быстрорастущие опухоли, в которых большая часть клеток находится в состоянии пролиферации (например, лейкозы, лнмфосаркомы, хорионэпителиома матки, саркома Юинга), являются высокочувствительными к хнмиотераневтическим воздействиям и облучению.
Стадия инициации апоптоза
Кроме того, современные технические возможности ограничивают использование метода в клинике из-за его длительности, необходимости повторных биопсий и возможности вредной действия иютопа на больного. Несмотря на ограничения метода, удалось получить данные о длительности разных фаз клеточного цикла в некоторых опухолях человека. Большую практическую значимость приобрел метод инкубации биопсийного и операционного материала в среде с Н-тимидином in vitro, с помощью которого определяют индекс метки. равный отиош(нию меченых клеток к общему количеству клеток, умноженному на 100. Данные разных авторов для различных опухолей и даже для различных участков одною и того же новообразования часто значительно расходятся, что связывают во многом с погрешностями метода. Поэтому для получения достоверных результатов, приходится исследовать несколько кусочков ткани. Метод радиоавтографии in vitro успешно используется для контроля лечения опухолей. Приведем 2 примера.
Митотический режим аденокарцином прямой кишки при различных методах предоперационного облучения изменяется следующим образом. В необлученной высокодифференцированной аденокарциноме митотический индекс составил 25,6%, в умереннодифференцированной — 35,2%. Определялось преобладание метафаз (78,9% — в высокодифференцированной и 70,2% — в умеренно дифференцированной аденокарциноме) над другими фазами мнтоза, что является характерным для опухолей человека.
Патологические митозы составили 29,3% в высокодифференцированной и 23,2% в умеренно дифференцированной аденокарциноме (отставание хромосом в метафазе, рассеивание хромосом, трехгрупповая метафаза и др. ).
После облучения происходит достоверное уменьшение уровня митотической активности и увеличение числа патологических митозов. В высокодифференцированной аденокарциноме после облучения дозой 20 Гр митотический индекс снижен до 15%, а процент патологических митозов увеличен до 86,7, в умеренно дифференцированной аденокарциноме — до 29,4% и 61,2% соответственно. При дозе 40 Гр митотическая активность в высокодифференцированной аденокарциноме равна 46% в умеренно дифференцированной — 7,2%0, а процент патологических митозов увеличился соответственно до 91,3 и 100. Особенно резкие изменения пролиферативиой способности клеток наблюдали при комбинации лучевой и химиотерапии.
Исследован митотический режим рака гортани при лучевом лечении с применением радносенсибилизатора метроиидазола. Лучевые изменения характеризовались уменьшением численности клеточной популяции за счет некроза и апоптоза, снижением пролиферативного пула клеток, патологическими митозами и угнетением синтеза ДНК. Так, до лечения индекс метки составлял 6,05 ±0,40 (неороговевающнй рак 7,33 ±0,74, ороговевающий рак 5,0±0,44), после лечения — 2,50±0,46 (Р>0,001) (неороговевающнй рак 3,24±0,69, Р>0,01; ороговевающий рак — 1,60 ±0,06; Р>0,001). При сравнении разных суммарных очаговых доз достоверных отличий величии индекса метки ие отмечено (20 Гр — 2,70±0,70; 32 Гр — 2,35 ±0,66).
Необходимо заметить, что достоверность результатов измерений у одного больного (разные участки центра и периферии опухоли до и после лучевой терапии) и группы больных совпадали не всегда Например, низкий индекс метки можно было встретить в ороговевающем раке до лечения и в обоих гистологических типах рака после лечения. Поэтому вопрос о значимости параметров пролиферации для оценки радиочувствительности опухоли нельзя отнести к окончательно решенному.
Следует хотя бы в краткой форме упомянуть об эффекте синхронизации митотической активности опухолевых клеток, который был использован в практике лучевой и химиотерапии. Сущность эффекта заключается в том, что с помощью лекарственного средства (например, 5-фторурацила) клетки блокируют на определенной фазе клеточного цикла, а после отмены препарата все они синхронно переходят в следующую фазу цикла. Зная время прохождения клетками данного интервала, можно подвергнуть опухоль облучению или полихимиотерапии в одной из наиболее чувствительных фаз цикла .Так, при комплексном лечении больных раком прямой кишки с использованием 5-фторурацила в опухоли находили глубокие и распространенные повреждения раковых клеток и опухолевых структур, вплоть до их полного разрушения. Широкое практическое использование эффекта синхронизации митотической активности опухолевых клеток затруднено из-за необходимости длительного (15-20 ч) введения больном) 5-фторурацила, токсичности препарата, отсутствия надежного контроля изменений временных параметров клеточного цикла и наличия в опухоли покоящихся клеток.
Различное по степени и длительности угнетение процесса апоптоза сопровождается развитием различных солидных и особенно гематогенных злокачественных опухолей. Особо важная роль в их развитии принадлежит соматическим мутациям или дефициту гена р53. В клетках с нерепарированными разрывами цепей ДНК при участии нормального гена р53 формируется сигнал к развитию апоптоза. В большинстве злокачественно трансформированных клеток образуется мутантная (аномальная) форма гена р53, неспособная индуцировать апоптоз. Такие клетки утрачивают нормальные связи с межклеточным матриксом и другими клетками микроокружения, не подвергаются апоптозу, а продолжают интенсивно делиться и метастазировать.
В основе развития некоторых типов лимфом лежат транслокации гена bcl-2, когда он перемещается из хромосомы 18 к гену IgH хромосомы 14. Следствие этих хромосмных транслокаций — гиперэкспрессия гена bcl-2 и повышение резистентности генетически измененных клеток к индукции апоптоза.
Показано, что под влиянием различных онкогенов (особенно bcl-2) опухолевые клетки становятся резистентными к действию различных физических и химических (в том числе химиотерапевтических) веществ, которые в нормальных клетках всегда индуцируют апоптоз. То есть, в опухолевых клетках процессы апоптоза обычно подавляются благодаря антиапоптозному действию некоторых генов (bcl-2, c-fos и др.). В то же время известно, что гиперэкспрессия онкогенов (например, с-тус) в зависимости от условий, приводит к активизации либо пролиферации, либо апоптозной гибели клеток. Последняя обусловлена действием различных физиологически активных компонентов цитотоксических гранул, особенно, перфоринов и гранзимов, которые при совместном действии способны активировать продукцию серинэстеразы, ответственной за индукцию фрагментации ДНК клеток-мишений и в целом за индукцию процесса их апоптоза. В гиперплазированнои (опухолевой) ткани возможен и прямой, независимый от действия цитотоксических гранул, механизм развития апоптоза клеток и регрессии опухоли через молекулы рецептора Fas, расположенные на поверхности клеток.
Апоптоз в опухолевых клетках может активироваться под действием у-излучения, УФО, гипертермии, гипотермии, под влиянием цитокинов ИЛ-4, ИЛ-10, а-ФНО и др., a также под действием ряда химиотерапевтических препаратов (цисплатин, этопозид, тенипозид и др.). Однако способность опухолевых клеток к апоптозу под влиянием указанных выше средств неустойчива и ограниченна.
В настоящее время считают доказанным, что и трансформация, и прогрессирующий рост клеточного клона зависят не только от онкогенных сигналов, но и от дополнительных антиапоптозных сигналов, обусловленных активностью внутриклеточных ингибиторов апоптоза. То есть апоптоз играет определённую контролирующую роль в противоопухолевой защите.
Важную роль в угнетении апоптоза в опухолевых клетках играют (кроме отмеченных выше) следующие патогенетические факторы:
• снижение содержания НАД+ и АТФ;
• повышение образования активных форм кислорода (Н202, 02 и др.);
• увеличение продукции N0 (в результате резкой активации iNOS);
• уменьшение активности антиоксидантных ферментов и количества антиоксидантных витаминов и микроэлементов.
Чем выраженнее эти, главным образом, внутриклеточные сдвиги, тем более прогрессивно развивается опухоль.
Одновременно отмечено, что усиленно образующиеся в опухоли Н202, 02, ОН и N0 существенно ослабляют противоопухолевый эффект цитостатиков и способствуют развитию некроза опухолевых клеток.
Н202 угнетает апоптоз, препятствуя захвату макрофагами апоптотически изменённых клеток. Избыток свободных радикалов, угнетая продукцию АТФ в клетке, также сопровождается блокадой различных звеньев апоптоза (выхода на поверхность клетки молекул фосфатидилсерина, активации каспаз).
Антиоксиданты не только уменьшают количество свободных радикалов, но и способны даже в присутствии Н202 поддерживать необходимый для жизнедеятельности клеток уровень АТФ. Более того, на фоне введенных в организм антиоксидантов усиливается противоопухолевый эффект цитостатиков, главным образом, за счёт активизации процесса апоптоза. Показано, что в отсутствие Н202 цитостатики проявляют максимальный противоопухолевый эффект, усиливая гибель опухолевых клеток путём активации апоптоза.
Избыточно образующийся при опухолевом (оксидативном) стрессе N0 приводит у онкологических больных к выраженным как цитотоксическим, так и гипотензивным эффектам. Эти нежелательные клинические эффекты N0 можно существенно ослабить путём применения ряда препаратов:
• цианкобаламина в больших дозах (10 мг/кг);
• глюкокортикоидов, способных ингибировать iNOS;
• аргиназы, способной разрушать предшественник N0 — L-аргинин.
В заключение следует отметить, что нарушение или блокада механизмов апоптоза способствуют развитию и ускорению роста злокачественных опухолей.
Лечение: рак простаты, рак груди, рак матки, рак ЖКТ, рак легких, рак кожи, базалиома, меланома, рак шеи гортани ротоглотки, носа, головы, мозга, рак крови, лимфолейкоз, лейкоз… Реактив универсальный практически для большинства видов опухолей, а также предраковых состояний как лейкоплакия, гиперплазия…
Что такое АПОПТОЗ
Это спуск механизма самоотмирания больных и мутированных клеток. Так задумано природой, чтобы все клетки у которых произошел сбой программы существования и то, что мешает существованию здоровых клеток, должно элиминироваться, исключаться. Для этого в каждой клетке встроен такой механизм естественного, физиологичного, запрограммированного отмирания патологических или ненужных организму клеток. Причем, апоптоз абсолютно безвредный путь элиминации ненужных клеток, в отличие от некроза, то есть патологического пути отмирания. Единственно этому правилу не подчиняются онкологические клетки. Они вышли из-под контроля, стали автономными и живут по своим примитивным программам прото-клеток.
Причины онкологического перерождения клеток – слом механизмов регулировки особенностей энергетики клетки.
Почему организм не может бороться с онкоклетками?
По антигенным характеристикам такие онкоклетки полностью аналогичны здоровым, поэтому для иммунитета они совершенно не видимы, а вернее их иммунитет расценивает как свои нормальные. Ведь это те же самые клетки, что и здоровые, только у них сломан механизм сохранения энергетики клетки. Вернее, сломаны гомеостазные программы и механизмы ответственные за вывод клеток из гликолизного типа энергетики обратно в аэробную. В организме часто бывает, что при какой-то запредельной нагрузке на ткань её клетки вынуждены переходить на гликолиз. Например, мышцы у спортсменов-марафонцев часто переходят на режим гликолиза, это нормально. Марафоновая нагрузка закончилась и тут же включаются автоматически механизмы по возвращению к требуемым нормо-константам гомеостаза, которые выводят клетки из этого запредельного режима работы. Точно также нагрузкой для ткани может быть затянувшийся воспалительный процесс при травме кости с последующим продолжением её длительного раздражения. Также хроническое, то есть устойчивое воспаление может происходить из-за длительных солнечных ожогов. Такой же результат с исходом в хроническое провоспаление могут дать и гормональные перегрузки ткани и многое другое. Во всех этих случаях в итоге ткани могут зайти в гликолиз. Это симптом каких-то перегрузок для какой-то части клеток. То есть во всех случаях ткань должна быть предварительно заведена в гликолиз. В случае если одновременно к этому присоединяется слом операторной системы, ответственной за вывод клеток из гликолиза и процесс затягивается, то клетки навсегда застревают в этом гликолизе. Это и является по сути механизмом провоспаления, предрака, а затем перерождения в рак. Во всех случаях этот процесс сопровождается предварительным хроническим провоспалением.
В случаях повреждения специфической системы регулировки на мембранах клеток, процесс идет в сторону дегенеративных перерождений тканей и утрате ею своих специфических особенностей и функций. Если процесс идет по направлению повреждения неспецифических операторных систем регулировки, ответственных за тип энергетики клетки, то происходит онкологическое перерождение клеток. Как на онкологические, так и на дегенеративные клетки иммунитет не обращает внимания, они свои. Это объясняет почему, научное направление иммунотерапии онкологии неперспективно.
Итак, возлагать надежды на иммунитет, иммунотерапию при онкологии не следует, он просто здесь не дееспособен, зря искать препараты для противоопухолевого иммунитета. Но есть еще и другой эшелон обороны, должны подключиться механизмы самозащиты клеток изнутри: апоптоз.
Каждая клетка способна анализировать себя и свой обмен с нормой и при необходимости его корректировать. Если клетка не соответствует требуемым правилам и не может себя откорректировать – она должна самоликвидироваться. Для этого включены в клетки специальные программы на самоликвидацию. Это основное правило и требование здорового организма как системы. Программы апоптоза расположены в кольцевом геноме митохондрий. Это сделано специально. Митохондрии обеспечивают аэробизм. Здоровая клетка не может и не должна находиться долго вне аэробизма. Ведь аэробизм – это важнейшее условие существования высших или метаклеток. Вне аэробизма они должны потерять свою специализацию. Этого клетка не может допустить. На пути этому она ставит заградительный механизм в виде апоптоза. Поэтому программа на самоликвидацию заложена в митохондриях. Особенность онкоклеток в том, что они программы апоптоза не могут запустить, ведь для этого должны быть готовы воспринять такой сигнал, быть чувствительными к нему, то есть быть в рабочем состоянии митохондрии. В общем разорвана цепочка автоматической электрорегулировки и самонастройки клетки.
В наборе рабочих программ онкоклеток в качестве прото-клеток нет программ на апоптоз. Онкоклетки свободны от всех программ как апоптоза, так и высших программ. Все эти программы у онкоклеток имеются, они никуда не исчезли, но они зависли. Это тот случай, когда высшая клетка не может сама себе помочь и включить апоптоз на устранение таких аберрантных клеток.
Причины почему организм не может бороться с онкоклетками.
По антигенным характеристикам такие онкоклетки практически аналогичны здоровым, поэтому для иммунитета они практически не видимы. Но должен подключиться еще второй механизм обороны – самозащиты: апоптоз. Каждая клетка способна анализировать себя и свой обмен с нормой. Если клетка не соответствует требуемым правилам – она должна самоликвидироваться. Программы апоптоза расположены в кольцевом геноме митохондрий, а они у онкоклеток не работают и поэтому не запускается апоптоз. Онкоклетки свободны от всех программ как апоптоза, так и высших программ. Все эти программы у онкоклеток имеются, они никуда не исчезли, но они зависли. Это тот случай, когда высшая клетка не может сама себе помочь и включить апоптоз на устранение таких аберративных клеток.
Механизмы апоптоза.
В клетке встроены механизмы анализа ситуации. Это так называемая система ГЛОНАСК (глобальная навигационная система клетки): самоориентации и саморегулировки как по электромагнитным параметрам, так и по химическим. Если клетка зашла слишком далеко в глубокий гликолиз, то должны запуститься механизмы на вывод ее из этого состояния. В случае если одновременно сломана операторная система, и сопряженные с ней системы интегральных и информационных белков, обеспечивающих такой вывод, то такая система не может замкнуть свой контур из разорванных звеньев в единой цепи и удержания гомеостата и не может даже запустить механизмы апоптоза. Открыта дорога для процветания онкоклеток.
Симптоматика апоптоза и некроза
В первом случае происходит сморщивание и усыхание клеток. Не отмечается провоспалительный процесс. Во втором случае некроза отмечается мощный провоспалительный процесс, набухание клеток и отекание ткани с последующей интоксикацией как локального типа, так и всего организма, когда страдают многие органы и ткани. Поэтому-то все современные методы медицины, которые приводят к некрозу опухоли, не приемлемы.
Апоптанты и апоптогены
В первом случае апоптантами являются вещества готовые произвести спуск механизма апоптоза. Во втором случае это вещества способные запустить механизмы апоптоза. Апоптантами, например, являются вещества участвующие в процессе метаморфоза, то есть превращения головастика в лягушку или гусеницы в бабочку. Это механизм четкой регулировки, задуманный природой и не наносящий ущерб или побочки особи. Апоптогенами не всегда являются вещества естественные для организма, они могут быть и искусственного происхождения и при своём воздействии проявлять даже определенную побочку на организм в целом. Например, есть ретиноиды которые способны вызывать апоптоз в онкоклетках, но при этом имеют и выраженные негативные последствия на печень или сухость кожи.
Каротиноиды (ретиноиды) участвуют в механизмах апоптоза.
Из биологии известно, что ряд ретиноидов (подобных витамину А) в качестве многочисленных представителей каротиноидов отвечают, как за механизмы дифференциации клеток, регулировки темпов роста клетки, так и за проявление избирательного апоптоза в онкоклетках. Доказано противоопухолевое действие каротиноида Ликопин при лечении рака простаты. Давно обсуждаются возможности широкого применения каротиноидов при гормонозависимых опухолях груди и т.п. Но практическая сторона этого дела не могла долго использоваться из-за не выраженности процесса, противоречивости полученных научных данных и необъяснимости процесса. Существуют цис- и транс-формы каротиноидов, которые оказывают противоположное действие.
Тем не менее в России тоже проведены минимальные исследования и уже проведены первичные испытания на мышах с привитыми опухолями, которые показывают максимально возможную эффективность и высшую перспективность из всего, что известно на сегодняшний день в лечении онкологии.
Наружные опухоли при этом как базалиома или меланома, начинают засыхать, сморщиваться, отшелушиваться или постепенно исчезать без гноя. Внутренние опухоли лизируют, но без жуткой интоксикации, которая сопровождает некрозы опухолей, и без провоспалительного процесса. Именно провоспалительный процесс разжигает пожар саморазгорающегося онкопроцесса: промоуцию, то есть бурный рост онколеток, и их метастазирование.
Ретиноиды Российского производства.
Практика показывает, что чтобы новый препарат был внедрен в медицине нужны многие годы. Заинтересовать Минздрав России профинансировать такие исследования и довести их до выпуска препарата тоже не представляется возможным. Очевидно нужен бум общественного мнения и широкие наработки инициатив волонтеров. Но больным сегодняшнего дня не дождаться таких препаратов.
Тем не менее, учитывая первичные положительные опыты на животных и достаточно глубокие исследования по ретиноидам за рубежом, в т. ч. и на людях, предлагаю воспользоваться таким ретиноидным веществом.
Опыт лечебного применения ретиноида CD437 на примере раковых клетках простаты.
Статьи по результатам экспериментального применения его при различном типе опухолей имеются в интернете. Инкубация клеточных линий рака простаты в культуре ткани показало заметное ингибирование пролиферации и появление в популяции клеток апоптирующих клеток. Вывод: CD437 представляет собой уникальный ретиноид, который индуцирует арест митозов (остановку делений) в s-фазе и апоптоз в андроген-зависимых и независимых человеческих раковых клеток простаты. Это указывает на высокую потенциальную роль CD437 в лечении человека от рака простаты. Такие же исследования проведены и на многочисленных других группах опухолей, в том числе рак груди, рак легких, рак кишечника…
Конечно, пациенты должны понимать, что на данном этапе им предлагают не лекарство, а определенную химическую субстанцию, которая обладает известными физиологическими свойствами, способными вызвать апоптоз в больных клетках. Решение по применению такого вещества необходимо принимать самим. Важно то, что предлагаемое вещество безвредно для организма, но способно делать то, что не способно делать ни одно лекарство.
Мне известна формула этого ретиноидного вещества. Поэтому принято решение заказать это вещество через одну из Российских лабораторий. Соответствие требуемой химической формуле гарантировано и подтверждено аналитически. Цена к сожалению, пока на сегодняшний день достаточно высокая. Одна ампула отпускается по 800 руб. По этой же цене могу отпустить и всем клиентам без всякой накидки. На курс надо минимум 20 ампул – 16 тыс. рублей и почтовые 500 р. Эффект проявляется через 1-2 или более месяцев. Принимают по 1 ампуле наружно или в виде свечей через анальное отверстие (ректально). Это необходимо, чтобы оно попало в кровь минуя ЖКТ. В лабораториях его применяют в виде уколов в опухоль или вокруг, или внутривенно капельницами.
Применение ретиноида CD437 на кожной опухоли базалиома и меланома
1 апреля поменяли тактику лечения на применение наружно в виде компресса ретиноида СД. Какого же было удивление, когда опухоль впервые за много лет перестала болеть и сочиться. Довольно быстро ушло нагноение опухоли и за две недели опухоль начала не только подсыхать, но и уменьшаться в своих размерах, сморщиваться. Явно здесь запустился механизм апоптоза, опухоль начала давать обратный ход развития, а роль апоптанта сыграл ретиноид.
К сожалению, пока на сегодняшний день достаточно высокая. Одна ампула отпускается по 800 руб. По этой же цене могу отпустить и всем клиентам без всякой накидки. На курс надо минимум 20 ампул – 16 тыс. рублей и почтовые 500 р.
Эффект начинает проявлятся через 1-2 или более месяцев.
Каждая ампула является аликвотой, то есть по сути, разовой дозой препарата. Это аналогично тому как таблетка содержит разовую требуемую дозу действующего вещества.
Действуют ли ретиноиды и другие индукторы апоптоза на здоровые ткани?
Оказывается, нет. Они в принципе не могут этого делать, так как работают адресно (таргетно) только на те группы клеток, на которые они нацелены, то есть на клетки, которые готовы их воспринять, услышать. Следовательно, побочка, в том числе боли, интоксикации и воспаления исключены. Опасения, что будут рассасываться и некоторые здоровые ткани тоже напрасны. Дело в том, что рассасывание здоровых тканей, например, хвосты у головастиков, когда они осуществляют метаморфозный переход в лягушек, возможен только в случае гормональной подготовки этого этапа.
При наружных опухолях как рак кожи, включая и рак меланома, базалиома, язвящий открытый рак груди применяют в виде компресса. В этом случае непосредственно над областью болезни на кожу намазывают 1 ампулу препарата, а сверху накрывают пленкой или вощенной бумагой и затем всё закрепляют бинтом или пластырем. Применяют обычно по 1 ампуле на 1 болячку через 1 день. Если площадь опухоли обширная или они разбросаны в разных местах по телу, то применяют 2 ампулы. Через месяц-два необходимо написать отчет о динамике в результате применения препарата. Возможно надо будет усиливать его путем приема внутрь, но не через рот, а путем применения в виде свечей через анальное отверстие (ректально). Это необходимо, чтобы оно попало в кровь минуя ЖКТ. В лабораториях его применяют в виде уколов в опухоль или вокруг, или внутривенно капельницами.

ЧЁРНЫЙ ОРЕХ "ЮГЛОН" В настоящее время достаточно большое количество информации по поводу лечения и применения настоек, экстрактов из черного ореха - я бы хотел обобщить многолетние труды и .

ФИТОТЕРАПИЙНЫЙ НАБОР ДЛЯ КОМПЛЕКСНОГО СИСТЕМНОГО ЛЕЧЕНИЯ РАКОВЫХ ЗАБОЛЕВАНИЙ (ОНКОЛОГИИ) по методу ГарбузоваОнконабор 1ОСНОВНОЙ ФИТОТЕРАПИЙНЫЙ набор для лечения рака (онкологии):ЮГЛОН Черный Орех 350 .

Противоопухолевая диета Моэрмана.В принципе лечение добро — и зокачественных заболеваний диетой, как показывает практика целительства, сходны. Одним из первых, кто подошел нау.
Сценарий самопожертвования клеток для развития организма. Морфологические изменения в клетках. Реализация стадий программирования апоптоза. Клеточный гомеостаз. Механизм зарождения злокачественных опухолей. Роль апоптоза в противоопухолевой защите.
| Рубрика | Медицина |
| Вид | контрольная работа |
| Язык | русский |
| Дата добавления | 14.05.2015 |
| Размер файла | 415,9 K |
- посмотреть текст работы
- скачать работу можно здесь
- полная информация о работе
- весь список подобных работ
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Кафедра патологической физиологии им. В.В. Корпачева
на тему: "Роль нарушений механизмов апоптоза в развитии злокачественных опухолей"
Выполнил: Исин Э., 241 ОМ
Проверила: Сайфулина Е.А.
1. Понятие апоптоза
2. Механизм апоптоза
3. Нарушения механизмов апоптоза в развитии злокачественных опухолей
Список использованной литературы
Организмы разных людей имеют более или менее одинаковое число клеток. Как поддерживается такое постоянство? Одна группа механизмов достаточно очевидна. Клетка может разделиться на две дочерние, а может и не делиться. Какая из этих возможностей реализуется, зависит как от генетической программы, так и от внешних сигналов, которые клетка получает от своих соседей или из окружающей среды. Но существует и другой механизм, привлекший внимание ученых лишь в последние годы. Оказывается, есть особая генетическая программа, реализация которой при определенных условиях приводит клетку к гибели. Гибнет клетка не от руки какого-нибудь постороннего убийцы, она сама приносит себя в жертву во имя блага организма.
При формировании некоторых органов человека и животных первоначально возникает намного больше клеток, чем потом потребуется. Например, так бывает при развитии нервной системы. Лишние клетки в свое время мирно гибнут. Мирно - значит, без воспаления. Клетка сморщивается и постепенно распадается на обломки, которые обычно поедаются макрофагами, у которых хороший аппетит. Но как узнать, какая клетка лишняя, а какая нет?
Самопожертвование осуществляется при участии ряда факторов, многие из которых еще не известны. Схематически смертоносный сценарий можно разбить на несколько этапов. На первом этапе клетка получает "послание" о том, что она должна пожертвовать своей жизнью для благополучия организма. Это известие приходит либо от соседних клеток, либо от межклеточных веществ. Чтобы воспринять такое "послание", клетки имеют специальные рецепторы (от латинского recipere - получать). Сигнальные молекулы и рецепторы подходят друг к другу, как ключ к замку.
Во втором действии драмы внутриклеточные регуляторы - посланники, получив важные инструкции, вносят поправки в работу отдельных генов. В конечном счете появляются или активируются ферменты, способные разрушать клеточные белки и нуклеиновые кислоты. В заключительном акте клетка теряет свою целостность и становится пищей для макрофагов. Морфологические и биохимические изменения в клетках - самоубийцах весьма схожи в разных органах и у разных организмов.
Этот комплекс изменений, характерный для программируемой гибели клеток, часто обозначают термином апоптоз, что в переводе с греческого означает "опадание листьев". Нарушение данного механизма, приводит к различным последствиям, в том числе и к зарождению злокачественных опухолей, механизм которых будет рассмотрен ниже.
1. Понятие апоптоза
В организме здорового человека клеточный гомеостаз определяется балансом между гибелью и пролиферацией клеток. Апоптоз - программированная клеточная гибель, энергетически зависимый, генетически контролируемый процесс, который запускается специфическими сигналами и избавляет организм от ослабленных, ненужных или повреждённых клеток. Ежедневно, примерно около 5 % клеток организма подвергаются апоптозу, а их место занимают новые клетки. В процессе апоптоза клетка исчезает бесследно в течение 15-120 минут.
Апоптоз - это биохимически специфический тип гибели клетки, который характеризуется активацией нелизосомных эндогенных эндонуклеаз, которые расщепляют ядерную ДНК на маленькие фрагменты. Морфологически апоптоз проявляется гибелью единичных, беспорядочно расположенных клеток, что сопровождается формированием округлых, окруженных мембраной телец ("апоптотические тельца"), которые тут же фагоцитируются окружающими клетками.
Это энергозависимый процесс, посредством которого удаляются нежелательные и дефектные клетки организма. Он играет большую роль в морфогенезе и является механизмом постоянного контроля размеров органов. При снижении апоптоза происходит накопление клеток, пример - опухолевый рост. При увеличении апоптоза наблюдается прогрессивное уменьшение количества клеток в ткани, пример - атрофия.
2. Механизм апоптоза
При реализации апоптоза условно можно выделить четыре стадии. Инициация -> Программирование -> Реализация программы -> Удаление погибшей клетки.
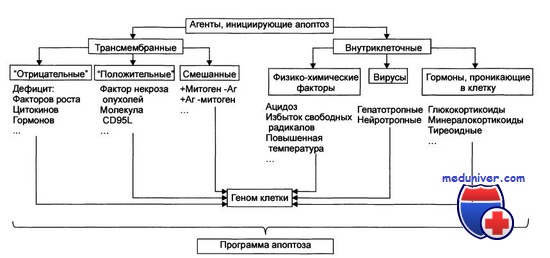
Стадия инициации. На этой стадии информационные сигналы рецептируются клеткой. Патогенный агент либо сам является сигналом, либо обусловливает генерацию сигнала в клетке и его проведение к внутриклеточным регуляторным структурам и молекулам. Инициирующие апоптоз стимулы могут быть трансмембранными или внутриклеточными.
Трансмембранные сигналы подразделяют на отрицательные, положительные и смешанные. апоптоз опухоль гомеостаз защита
Отрицательные сигналы: отсутствие или прекращение воздействия на клетку факторов роста, цитокинов, регулирующих деление и созревание клетки, а также гормонов, контролирующих развитие клеток. В норме действие названных выше групп БАВ на мембранные рецепторы обеспечивает подавление программы гибели клеток и нормальную их жизнедеятельность. Напротив, их отсутствие или снижение эффектов "освобождает" программу апоптоза. Так, для нормальной жизнедеятельности ряда нейронов необходимо постоянное наличие нейротрофических факторов. Их устранение или снижение эффектов на нервные клетки может привести к включению программы смерти нейрона.
Положительные сигналы в итоге генерируют запуск программы апоптоза. Так, связывание ФИО (FasL) с его мембранным рецептором CD95 (Fas) активирует программу смерти клетки. - Смешанные сигналы являются комбинацией воздействий сигналов первой и второй групп. Так, апоптозу подвергаются лимфоциты, простимулированные митогеном, но не проконтактировавшие с чужеродным Аг. Погибают и те лимфоциты, на которые воздействовал Аг, но не получившие других сигналов, например, митогенного или от HLA.
Среди внутриклеточных стимулов апоптоза зарегистрированы избыток Н+, свободные радикалы липидов и других веществ, повышенная температура, внутриклеточные вирусы и гормоны, реализующие свой эффект через ядерные рецепторы (например, глюкокортикоиды).
Стадия программирования. На этой стадии специализированные белки либо реализуют сигнал к апоптозу путём активации исполнительной программы (её эффекторами являются цистеиновые протеазы - каспазы и эндонуклеазы), либо блокируют потенциально летальный сигнал.
Выделяют два (не исключающих друг друга) варианта реализации стадий программирования:
1) путём прямой активации эффекторных каспаз и эндонуклеаз (минуя геном клетки);
2) опосредованной через геном передачи сигнала на эффекторные каспазы и эндонуклеазы. Прямая передача сигнала осуществляется через адапторные белки, гранзимы и цитохром С.
* Адапторные белки. В качестве адапторного белка выступает, например, каспаза-8. Так реализуют своё действие цитокины Т-лимфоцитов-киллеров в отношении чужеродных клеток, ФНО и другие лиганды CD95.
* Цитохром С. Выделяясь из митохондрий, цитохром С вместе с белком Apaf-1 и каспазой-9 формирует комплекс активации (апоптосому) эффекторных каспаз. Каспаза-8 и каспаза-9 активируют эффекторные каспазы (например, каспазу-3), которые участвуют в протеолизе белков.
* Гранзимы. Эти протеазы выделяют цитотоксические Т-лимфоциты, протеазы проникают в клетки-мишени через цитоплазматические поры, предварительно сформированные перфоринами. Гранзимы активируют аспартатспецифические цистеиновые протеазы клетки-мишени, подвергающейся апоптозу. Прямая передача сигнала наблюдается обычно в безъядерных клетках, например, в эритроцитах.
Опосредованная передача сигнала подразумевает репрессию генов, кодирующих ингибиторы апоптоза, и активацию генов, кодирующих промоторы апоптоза. Белки-ингибиторы апоптоза (например, продукты экспрессии антиапоптозных генов Bcl-2, Bcl-XL) блокируют апоптоз (например, путём уменьшения проницаемости мембран митохондрий, тем самым уменьшая вероятность выхода в цитозоль одного из пусковых факторов апоптоза - цитохрома С). Белки-промоторы апоптоза (например, белки, синтез которых контролируется генами Bad, Box, антионкогенами Rb или /т 53) активируют эффекторные кас-пазы и эндонуклеазы.
Стадия реализации программы апоптоза (исполнительная, эффекторная) состоит в собственно гибели клетки, осуществляемой посредством активации протеолитического и нуклеолитического каскадов.
Непосредственными исполнителями процесса "омертвления" клетки являются Ca2+, Mg2+ -зависимые эндонуклеазы (катализируют распад нуклеиновых кислот) и эффекторные каспазы (подвергают протеолитическому расщеплению различные белки, в том числе белки цитоскелета, ядра, регуляторные белки и ферменты). В результате разрушения белков и хроматина в процессе апоптоза клетка подвергается деструкции. В ней формируются и от неё отпочковываются фрагменты, содержащие остатки органелл, цитоплазмы, хроматина и цитолеммы - апоптозные тельца.
Стадия удаления фрагментов погибших клеток. На поверхности апоптозных телец экспрессируются лиганды, с которыми взаимодействуют рецепторы фагоцитирующих клеток. Фагоциты быстро обнаруживают, поглощают и разрушают апоптозные тельца. Благодаря этому содержимое разрушенной клетки не попадает в межклеточное пространство, а при апоптозе отсутствует воспалительная реакция. Этот признак отличает апоптоз от некроза, который сопровождается развитием перинекротического воспаления.
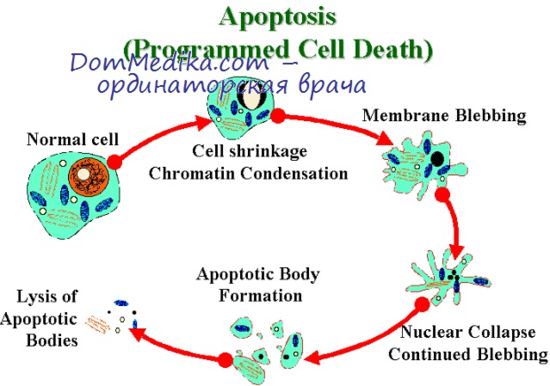
Последовательность ультраструктурных изменений при апоптозе (справа) и некрозе (слева): 1 - нормальная клетка; 2 - начало апоптоза; 3 - фрагментация апоптотической клетки; 4 - фагоцитоз апоптотических телец окружающими клетками; 5 - гибель внутриклеточных структур при некрозе; 6 - разрушение клеточной мембраны.
3. Нарушения механизмов апоптоза в развитии злокачественных опухолей
Различное по степени и длительности угнетение процесса апоптоза сопровождается развитием различных солидных и особенно гематогенных злокачественных опухолей. Особо важная роль в их развитии принадлежит соматическим мутациям или дефициту гена р 53. В клетках с нерепарированными разрывами цепей ДНК при участии нормального гена р 53 формируется сигнал к развитию апоптоза. В большинстве злокачественно трансформированных клеток образуется мутантная (аномальная) форма гена р 53, неспособная индуцировать апоптоз. Такие клетки утрачивают нормальные связи с межклеточным матриксом и другими клетками микроокружения, не подвергаются апоптозу, а продолжают интенсивно делиться и метастазировать. В основе развития некоторых типов лимфом лежат транслокации гена bcl-2, когда он перемещается из хромосомы 18 к гену IgH хромосомы 14. Следствие этих хромосмных транслокаций - гиперэкспрессия гена bcl-2 и повышение резистентности генетически измененных клеток к индукции апоптоза. Показано, что под влиянием различных онкогенов (особенно bcl-2) опухолевые клетки становятся резистентными к действию различных физических и химических (в том числе химиотерапевтических) веществ, которые в нормальных клетках всегда индуцируют апоптоз. То есть, в опухолевых клетках процессы апоптоза обычно подавляются благодаря антиапоптозному действию некоторых генов (bcl-2, c-fos и др.). В то же время известно, что гиперэкспрессия онкогенов (например, с-тус) в зависимости от условий, приводит к активизации либо пролиферации, либо апоптозной гибели клеток. Последняя обусловлена действием различных физиологически активных компонентов цитотоксических гранул, особенно, перфоринов и гранзимов, которые при совместном действии способны активировать продукцию серинэстеразы, ответственной за индукцию фрагментации ДНК клеток-мишений и в целом за индукцию процесса их апоптоза. В гиперплазированнои (опухолевой) ткани возможен и прямой, независимый от действия цитотоксических гранул, механизм развития апоптоза клеток и регрессии опухоли через молекулы рецептора Fas, расположенные на поверхности клеток. Апоптоз в опухолевых клетках может активироваться под действием у-излучения, УФО, гипертермии, гипотермии, под влиянием цитокинов ИЛ-4, ИЛ-10, а-ФНО и др., a также под действием ряда химиотерапевтических препаратов (цисплатин, этопозид, тенипозид и др.). Однако способность опухолевых клеток к апоптозу под влиянием указанных выше средств неустойчива и ограниченна. В настоящее время считают доказанным, что и трансформация, и прогрессирующий рост клеточного клона зависят не только от онкогенных сигналов, но и от дополнительных антиапоптозных сигналов, обусловленных активностью внутриклеточных ингибиторов апоптоза. То есть апоптоз играет определённую контролирующую роль в противоопухолевой защите. Важную роль в угнетении апоптоза в опухолевых клетках играют (кроме отмеченных выше) следующие патогенетические факторы:
* снижение содержания НАД+ и АТФ;
* повышение образования активных форм кислорода (Н 202, 02 и др.);
* увеличение продукции N0 (в результате резкой активации iNOS);
* уменьшение активности антиоксидантных ферментов и количества антиоксидантных витаминов и микроэлементов.
Чем выраженные эти, главным образом, внутриклеточные сдвиги, тем более прогрессивно развивается опухоль. Одновременно отмечено, что усиленно образующиеся в опухоли Н 202, 02, ОН и N0 существенно ослабляют противоопухолевый эффект цитостатиков и способствуют развитию некроза опухолевых клеток. Н 202 угнетает апоптоз, препятствуя захвату макрофагами апоптотически изменённых клеток. Избыток свободных радикалов, угнетая продукцию АТФ в клетке, также сопровождается блокадой различных звеньев апоптоза (выхода на поверхность клетки молекул фосфатидилсерина, активации каспаз). Антиоксиданты не только уменьшают количество свободных радикалов, но и способны даже в присутствии Н 202 поддерживать необходимый для жизнедеятельности клеток уровень АТФ. Более того, на фоне введенных в организм антиоксидантов усиливается противоопухолевый эффект цитостатиков, главным образом, за счёт активизации процесса апоптоза. Показано, что в отсутствие Н 202 цитостатики проявляют максимальный противоопухолевый эффект, усиливая гибель опухолевых клеток путём активации апоптоза. Избыточно образующийся при опухолевом (оксидативном) стрессе N0 приводит у онкологических больных к выраженным как цитотоксическим, так и гипотензивным эффектам. Эти нежелательные клинические эффекты N0 можно существенно ослабить путём применения ряда препаратов:
* цианкобаламина в больших дозах (10 мг/кг);
* глюкокортикоидов, способных ингибировать iNOS;
* аргиназы, способной разрушать предшественник N0 - L-аргинин.
Апоптоз играет жизненно важную роль в процессе эмбрионального и онтогенетического развития. Контролируя различные процессы, он препятствует развитию мутированных клеток, в определенное генами время уничтожает ненужные для организма клетки и ткани, затрагивая при этом одиночные клетки, не распространяясь на целые, неизмененные участки ткани. Нарушения системы программируемой гибели клетки - причина серьезной патологии. Ослабление способности к апоптозу может вести к развитию злокачественных опухолей. Некоторые заболевания, в частности дегенеративные повреждения нервной системы, - результат избыточного апоптоза.
Список использованной литературы
1. Патофизиология. Литвицкий П.Ф., 2009 г.
2. Патофизиология. Зайко Н. Н, Быць Ю.В.,2007 г.
Читайте также:

