Маркеры раковых стволовых клеток
Вне зависимости от того, что заболеваемость раком желудка в России не находится на высоком уровне, в структуре смертности от злокачественных новообразований он занимает 2 место. Это свидетельствует о поздней диагностике рака желудка и агрессивном течении заболевания [1]. Процессы прогрессирования заболевания, вероятность метастазирования и развитие устойчивости к применяемой терапии определяются особенностями экспрессии определенных генов, изменением фенотипа опухолевых клеток, что сопровождается закономерными метаболическими, морфологическими и иммунологическими их изменениями [2; 3]. Кроме того, указанные свойства опухолей определяются наличием особой субпопуляции клеток – опухолевыми, раковыми стволовыми клетками (ОСК, РСК). Показано, что маркеры, выявленные на раковых стволовых клетках, представлены и на определенных типах соматических клеток организма человека, на эмбриональных и мезенхимальных стволовых клетках [4]. Несмотря на то что данные клетки достаточно трудно идентифицировать, число работ, посвященных изучению биологических и клинических особенностей ОСК при различных формах онкологических заболеваний, неуклонно растет [5].
В разных опухолях ОСК экспрессируют различные маркеры и их комбинации, которые выявляются также на нормальных стволовых клетках или клетках-предшественницах, элементах стромы опухоли или опухолевых клетках, не имеющих свойств стволовых, поэтому, возможно, только часть клеток, выбранных по их экспрессии, является ОСК. К настоящему моменту окончательно не решен вопрос о стабильности фенотипа ОСК в процессе прогрессии опухоли или при переходе из систем in vivo к in vitro. Кроме того, разные подтипы опухолей одного органа могут иметь ОСК, экспрессирующие разные маркеры [6].
Одним из маркеров раковых стволовых клеток является CD44 - это адгезивный белок, который участвует во взаимодействиях клетка–клетка и клетка–межклеточный матрикс посредством своего лиганда – гиалуроновой кислоты, а также коллагена, ламинина, фибронектина, остеопонтина и некоторых гликозаминогликанов. У CD44+ опухолевых клеток описана более высокая туморогенность (пролиферативный потенциал, способность к формированию колоний), резистентность к лекарственному воздействию, меньшая склонность к апоптозу по сравнению с CD44- клетками [7].
CD44 изолированно или в комбинации с другими маркерами выявляется на ОСК в раке молочной, предстательной и поджелудочной желез, печени, колоректальном раке, опухолях головы и шеи, желудка [8].
CD133 (АС133, проминин-1) впервые был обнаружен Х. Yin и соавт. в 1997 г. на гемопоэтических стволовых клетках [9]. Это гликопротеин с пятью трансмембранными доменами молекулярной массой 120 кД, взаимодействующий с холестеролом [10], принадлежит к семейству промининов, имеет 3 изоформы: CD133-1, CD133-2, CD133-3. Ген (PROM1) картирован на 4р15.32. Ассоциирован с мембранными выпячиваниями, но функция его точно не известна. Было также показано, что экспрессия антигена CD133 коррелирует с выживаемостью пациентов с аденокарциномой желудка [11]. Кроме того, у пациентов с колоректальной карциномой комбинация CD133, CD44 и CD166 может успешно идентифицировать пациентов при рецидиве и метастазировании с низким, средним и высоким риском [12].
Для идентификации ОСК при раке желудка чаще всего используют фенотипический маркёр CD44+, наличие которого с высокой вероятностью может указывать на данный тип клеток. Использование же CD133 при обнаружении РСК при раке желудка отмечается не так часто, и его информативность при данной форме опухолей обсуждается.
Цель работы: исследование CD44 + , CD133 + - ОСК в различных тканях при не метастатической и метастатической форме рака желудка с использованием метода проточной цитофлюориметрии.
Материалы и методы
В исследование включено 18 больных раком желудка в возрасте от 30 до 80 лет. Больные давали письменное информированное согласие на проведение исследований, подвергались стандартному в данном случае объему обследований. Пациенты были разделены на две группы:
1 группа – М0, рак желудка без метастазов, 11 человек, степень дифференцировки опухоли – G2, средний возраст 58,9±9,7.
2 группа – М1, рак желудка с выявленными метастазами в брюшину и большой сальник, 7 человек, степень дифференцировки опухоли– G2, средний возраст 53,4±11,9.
Непосредственно после оперативного вмешательства осуществляли забор следующих образцов: опухоль (ОП), перифокальная зона (ПЗ), сальник (СА), брюшина (БР), которые ex temporae помещались в раствор CellWash и подвергались дезинтеграции с использованием BD Medimachine в течение 30–60 сек. Полученную клеточную взвесь после фильтрования центрифугировали в течение 4 мин. при 1500 об/мин. в центрифуге Еppendorf 5702 R. Осажденные клетки ресуспендировали раствором CellWash.
Фенотипирование клеток осуществляли на проточном цитометре FACSCantoII (BD, USA) после их обработки панелью антител (CD45, CD44, CD133). Аналитические процедуры осуществляли в соответствии с указаниями фирмы - производителя наборов. Результаты определения клеток, имеющих маркеры ОСК (CD44 + , CD133 + ), выражали в процентах от общего количества лимфоцитов CD45 + -клеток либо от общего числа CD45--клеток.
Статистическая обработка полученных результатов предполагала расчет средних значений и стандартных отклонений. После проверки характера распределения проводили оценку статистической значимости различий между группами. В случае нормального распределения использовали параметрический критерий Стьюдента, в противном случае – непараметрический критерий Манна-Уитни. Различия считали статистически значимыми при р≤0,05.
Выявлены следующие особенности процентного содержания клеток с маркёрами опухолевых стволовых клеток в группе пациентов с раком желудка без метастатических поражений (М0), представленные на рисунке 1.
В группе М0 при степени дифференцировки опухоли G2 процентное содержание клеток с фенотипом CD45+CD44+ в ткани опухоли и брюшины статистически не отличалось и составило 3,4±1,4 и 3,8±1,6 соответственно. При этом отмечено увеличение клеток с данным фенотипом в сальнике - 8,4±4,5, что больше количества этих клеток в ткани опухоли на 147% (в 2,4 раза), р=0,002. В случае ПЗ не удалось определить клетки с данным фенотипом.
Определение клеток с фенотипом CD45-CD44+ позволило выявить следующие закономерности. Наибольшее количество клеток данного фенотипа выявлено в ткани БР – 1,1±0,5, что выше значений данного показателя в ОП (0,65±0,3) и СА (0,3±0,1) на 69% (в 1,7 раза) и 267% (3,7 раза) соответственно, р=0,001.
Другим маркёром опухолевых стволовых клеток является CD133+. Определение клеток, имеющих фенотип CD45+CD133+, выявило большее процентное число данных клеток в ткани ОП – 2,75±0,9. В БР и СА количество данных клеток было ниже значений в ОП соответственно на 60% (2,5 раза) – 1,1±0,4, и 93% (13,8 раз) – 0,2±0,05, р=0,02. В ПЗ клетки с данным фенотипом не определялись (рис. 1).
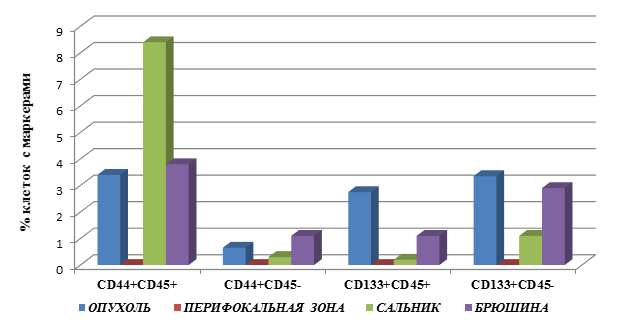
Рис. 1. Процентное содержание клеток с маркерами ОСК в тканях больных раком желудка, группа 1 (М0) – без метастатических поражений
Следует отметить, что определение процентного содержания клеток с фенотипом CD45-CD133+ имело аналогичные закономерности распределения, однако число данных клеток во всех тканях было выше, чем клеток с фенотипом CD45+CD133+. Максимальное число данных клеток выявлено в ОП – 3,35±2,7, затем в БР – 2,9±1,1 и в СА – 1,1±0,4. Полученные результаты меньше значений в ОП соответственно на 13% (в 1,2 раза) для БР и на 67% (в 3 раза) для СА, р=0,02. В ПЗ клеток с данным фенотипом не выявлено.
Таким образом, при раке желудка у пациентов без выявленных метастатических поражений в опухоли наблюдается накопление клеток с фенотипом CD45+CD133+ и CD45-CD133+, превышающее таковое в брюшине и сальнике. Кроме того, процентное содержание клеток с фенотипом CD45+CD44+ было выше в сальнике, а с фенотипом - CD45-CD44+ - в опухоли (рис. 1).
Выявлены следующие особенности процентного содержания клеток с маркёрами опухолевых стволовых клеток в группе пациентов с раком желудка, стадия дифференцировки опухоли G2 с метастатическими поражениями (М1), которые представлены на рисунке 2.
Наибольшее процентное содержание клеток с фенотипом CD45+CD44+ у больных раком желудка с метастатическими поражениями выявлено в ткани ОП – 19,8±4,5, в то время как в БР – 9,7±1,5, с практически одинаковым количеством данных клеток в ПЗ, СА – соответственно 4,4±1,5 и 4,2±1,2. Полученные значения ниже данного показателя в ОП на 79% (в 4,7 раза), 78% (4,5 раза) и 51% (в 2 раза) для СА, ПЗ и БР соответственно (для всех результатов р=0,03).
Обращает внимание тот факт, что у больных с метастатическими поражениями при РЖ по сравнению с данным показателем у пациентов без метастазов количество клеток с фенотипом CD45+CD44+ в ОП было выше на 482% (в 5,8 раза), в БР – на 155% (в 2,6 раза), а в СА – ниже на 50% (в 2 раза), р=0,03. Кроме того, данный тип клеток появляется в ПЗ пациентов группы М1, в то время как у больных М0 они не определялись (рис. 2).
Наибольшее количество клеток с фенотипом CD45-CD44+ у больных с метастазами отмечается в СА и ПЗ, соответственно 3,3±1,4 и 0,9±0,05, что превышает в 11 раз показатель у пациентов без метастазов (для СА). В ОП и БР данный тип клеток не выявлен при наличии метастазов, в то время как без них они определялись.
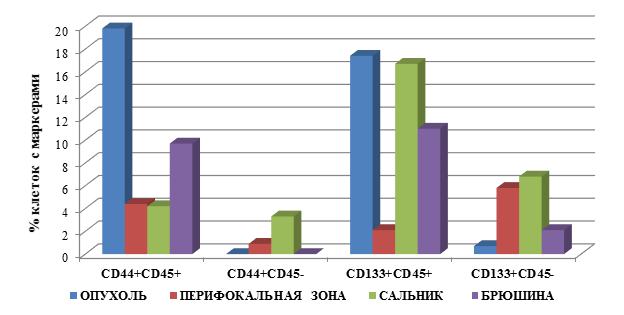
Рис. 2. Процентное содержание клеток с маркерами ОСК в тканях больных раком желудка, группа 2 (М1) – с метастатическими поражениями
При определении другого, менее часто используемого для идентификации ОСК РЖ маркера CD133, выявлены следующие особенности при наличии метастатических поражений.
Количество клеток с фенотипом CD45+CD133+ было максимальным в ОП и СА, соответственно 17,4±2,5 и 16,7±2,1, что выше значений у пациентов группы М0 в 6,3 и в 84 раза, т.е. максимальный прирост данных клеток выявлен в СА. В ПЗ у больных М1 группы количество было ниже на 37% (в 1,6 раза) по сравнению с значениями в ОП, но превышало значения данного показателя у пациентов без метастатических поражений в 10 раз. Следует отметить, что на фоне метастатических поражений данные клетки обнаруживаются и в ПЗ, чего не наблюдалось у больных РЖ без метастазов. Однако значение данного показателя было ниже на 88% (в 8,3 раза) количества данных клеток в ОП.
У больных группы М1 клетки фенотипом CD45-CD133+ в максимальном количестве определялись в СА, ПЗ и БР, соответственно 6,8±1,5, 5,8±1,8 и 2,1±0,3, в то время как в ОП их число было относительно невелико – 0,7±0,05. При этом, как правило, количество данных клеток существенно превышало данный показатель у больных без метастатических поражений в случае СА – в 6 раз (выше на 518%), в ПЗ эти клетки обнаруживались у пациентов с поражениями, в то время как без метастазов они не выявлялись. Однако количество клеток с фенотипом CD45-CD133+ снижалось у пациентов с метастазами в ОП и БР – отмечено снижение данного показателя на 79% (4,8 раза) и 28% (1,4 раза) соответственно, р=0,02.
Таким образом, у больных РЖ с метастатическими поражениями по сравнению с пациентами без метастазов (рис. 2):
- в ОП – увеличивается количество клеток фенотипа CD45+CD44+ и CD45+CD133+ и уменьшается число клеток CD45-CD44+ и CD45-CD133+;
- в ПЗ – отмечается рост числа клеток всех определяемых фенотипов CD45+CD44+ и CD45+CD133+, CD45-CD44+ и CD45-CD133+;
- в СА – снижается число клеток с фенотипом CD45+CD44+ и увеличивается число клеток остальных типов: CD45+CD133+, CD45-CD44+ и CD45-CD133+;
- в БР – увеличивается число клеток с фенотипом CD45+CD44+ и CD45+CD133+, а количество клеток CD45-CD44+ и CD45-CD133+, напротив, снижается.
Проведенное исследование позволило выявить некоторые особенности распределения клеток, имеющих маркёры ОСК в различных тканях у больных раком желудка, что может в дальнейшем быть использовано при оценке особенностей развития и прогрессирования заболевания, эффективности проводимой терапии. Полученные результаты являются основой для дальнейшего научного поиска в отношении наиболее полной характеристики гетерогенной опухолевой популяции при раке желудка, роли отдельных клеток в росте, прогрессии и метастазировании опухоли.

Группа исследователей из новосибирского Института цитологии и генетики СО РАН создала универсальный маркер для стволовых раковых клеток. С его помощью стало возможным помечать и отслеживать вредоносные и наиболее опасные клетки, предположительно в любой раковой опухоли. Прежние, не универсальные препараты, предназначавшиеся только для какого-то конкретного вида рака, часто бывали бессильны перед другими его видами.
— Они вырабатываются самим организмом. Стволовая раковая клетка — это клетка, которая возникла в результате повреждения, мутации ДНК и приобрела все свойства злокачественных раковых клеток. При этом она обладает и свойствами стволовых клеток — неограниченным числом делений, поэтому ее и называют стволовой.
Вообще что такое стволовая клетка? Это клетка, которая потенциально может делиться неограниченное число раз и создавать какую-либо новую ткань. К примеру, из стволовой клетки крови можно получить и лимфоциты, и тромбоциты, и любые клетки крови. А в случае с раковой стволовой клеткой, если ее пересадить какому-то другому организму, она и там тоже даст новый рост опухоли. Именно этими свойствами бесконечно делиться и давать прирост для новых клеток, они и похожи.
— Чем раковые стволовые клетки отличаются от прочих раковых, помимо склонности к бесконечному делению?
— В последнее время, буквально в течение нескольких лет, в мировой науке получила широкое распространение теория о том, что опухоль состоит не только из основной массы раковых клеток, но и из стволовых раковых клеток. Причем именно последние считаются ответственными за метастазы, возникновение рецидивов и вообще за общий агрессивный рост опухоли. При удалении этих стволовых раковых клеток опухоль перестает расти, организм уже сам способен с ней справиться. Но всё не так просто.
— В чем же сложность?
— В чем именно заключается открытие вашей лаборатории?
— Изначально мы начали работать с мышами, а именно с клетками костного мозга грызунов. И в какой-то момент было обнаружено, что часть стволовых клеток костного мозга мышей, которые мы называем низкодифференцированными, обладают свойством поглощать экзогенную, то есть внеклеточную, привнесенную извне, ДНК. Тогда мы придумали пометить эти фрагменты ДНК с помощью специального флуорохромного красителя — маркера, окрашивающего эти клетки в определенный цвет. Сначала такая работа велась со стволовыми клетками крови, после чего мы переключились и на раковые стволовые клетки, которые, как выяснилось, обладают теми же свойствами. Было проверено порядка 10–15 различных типов раковых клеток, как человеческих, так и, например, несколько видов мышиного рака. С помощью универсального маркера мы отследили и увидели, что во всех рассмотренных видах рака действительно существует особая популяция клеток, представленная в количестве от 1 до 10%, которые способны поглощать чужеродную ДНК. Это и были стволовые раковые клетки.
— Евгения, если по-простому, в чем важность нынешнего открытия?
Второе — с помощью маркера можно мониторить количество стволовых раковых клеток в организме того или иного пациента и благодаря этому понимать, какая методика его лечения эффективна, а какая нет. Если количество таких клеток в результате прошедших медицинских процедур не изменилось, значит, данная терапия больному не подходит. Если количество клеток уменьшается, значит, лечение подобрано правильно.
— Пока эксперименты проводились только на мышах? И, я так понимаю, выжили всё равно не все?
— Да, пока мы работали только с мышами. Нам удалось вылечить от рака 50% подопытных грызунов. Но это уже очень хороший результат. По второй половине получилось так, что 25% животных погибли от системного воспаления. Представьте, если средний вес одной мышки составляет где-то 20–30 г, то опухоль составляет порядка 5 г. Разрушение такого большого объема опухолевых клеток при введении химиотерапевтического препарата и экзогенной ДНК, безусловно, является стрессовой ситуацией для организма, в результате чего он может погибнуть. Хотя в принципе и с этим можно бороться. Существует целый ряд веществ, например, ряд антибиотиков, которые можно вводить в организм, и это поможет ему выжить. На следующих этапах исследований мы будем с этим работать. У оставшихся 25% мышей возник рецидив. Мы связываем его с тем, что в каждом организме клетки опухоли индивидуальны, поэтому подобрать универсальный режим терапии, направленной на удаление стволовых раковых клеток, сложно. С этим нам также предстоит работать.
— Когда ваш метод может быть испытан на человеке?
— Чтобы применить наши наработки на человеке, нужно провести еще большой комплекс испытаний. Сначала — доклинические, как раз на мышах. Одна из следующих фаз — проверка препарата на токсичность. Если говорить о том, чтобы наши разработки были использованы в конкретных препаратах на фармацевтическом рынке, то мы находится только в самом начале пути к этому.
— Сколько времени может пройти?
— В нашей стране внедрение нового препарата, нового метода лечения, сопровождается множеством сложностей. Я бы сказала, что должно пройти минимум пять лет.
— Существуют ли уже похожие средства для лечения рака?
— Если говорить про терапию для поддержания жизни онкобольного, то уже существуют некоторые препараты на основе ДНК. А мы предложили с помощью универсального цветного маркера проследить, когда во время или после проведения химиотерапии стволовые раковые клетки разрушаются, а когда нет, мы показываем, когда их нужно атаковать. Именно уклон на молекулярную основу в лечении онкологии является сейчас наиболее актуальным и перспективным, и мы работаем в этом русле.
— В чем недостаток уже существующих препаратов?
— Чаще всего они подбираются для конкретной опухоли, например, для опухоли молочной железы или чего-то еще. И они могут не работать на других опухолях. Мы же разрабатываем более-менее универсальный тип лечения, который подходил бы для широкого спектра опухолей, но при этом относился к таргетным, то есть целевым препаратам, убивающим не все клетки в организме, а только злокачественные, раковые.
- 1149
- 0,9
- 0
- 5
Выделить все важное и отличить от других — вот задача клеточных мáркеров.
![]()
Анна Петренко![]()
Андрей Панов




Естественные клеточные маркеры и способы их рассмотреть
В многоклеточных организмах существует клеточная специализация. Несмотря на то, что клетки содержат одинаковую ДНК, они отличаются друг от друга: клетки мышц умеют сокращаться, нейроны — проводить нервные импульсы, и так далее. Это происходит из-за того, что в каждом виде клеток работает только определенный набор генов из всего их разнообразия, содержащегося в ДНК. Именно поэтому маркером клеток может служить любой ген, который экспрессируется избирательно — только в каком-нибудь конкретном виде клеток. Особенно удобно, когда такой отличительный ген кодирует белок, располагающийся на поверхности клетки.
Антитела — специальные белки, которые могут распознавать молекулы за счет пространственного взаимодействия. Именно антитела играют важную роль в нашем иммунитете — они связываются с белками или другими молекулами на поверхности бактерий и вирусов, что и запускает иммунную реакцию. Современная наука научилась делать антитела против практически любых белков — в том числе и против поверхностных клеточных маркеров. Чтобы использовать антитела для определения маркеров, ученые прибегают к еще одной хитрости. Они присоединяют к антителу еще один белок: или фермент, или флуоресцирующий (светящийся) белок. Тогда, если к исследуемым клеткам добавить антитела против поверхностного маркера, связанные с ферментом, потом отмыть лишние антитела и добавить субстрат для фермента, который при расщеплении приобретает какой-нибудь цвет, то клетки, несущие на своей поверхности нужный маркер, окажутся окрашенными, а остальные клетки — останутся бесцветными (рис. 1).
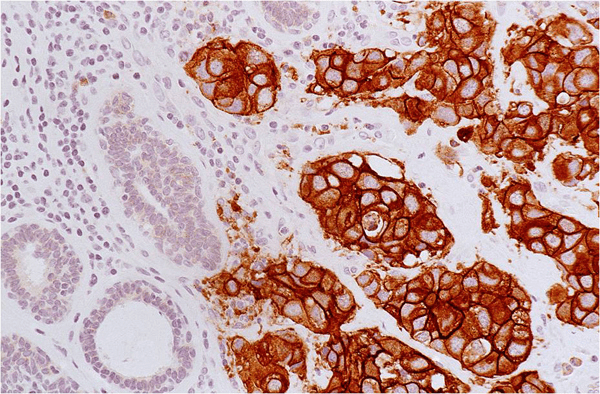
Рисунок 1. Пример выявления онкомаркера HER2 с помощью антител (иммуногистохимия). Коричневые клетки несут на своей поверхности HER2.
Другой метод, позволяющий выявлять поверхностные маркеры, называется проточной цитофлуориметрией (fluorescence-activated cell sorting, FACS) [3]. Здесь исследуемые клетки (в виде одноклеточной взвеси) смешивают с антителами, к которым присоединены флуоресцирующие белки. Антитела связываются со своими маркерами-мишенями, a не связавшиеся антитела удаляют. Далее клетки загружают в прибор. Он создает тонкую струю из клеточной суспензии, проходящую через свет лазера буквально по одной клетке. Если на поверхности клетки есть искомые маркеры, то вместе с клеткой в луч лазера попадают и антитела, связавшиеся с маркерами. Происходит возбуждение флуорофора на антителе, и он испускает на своей длине волны свет, который и регистрируется детектором (рис. 2).
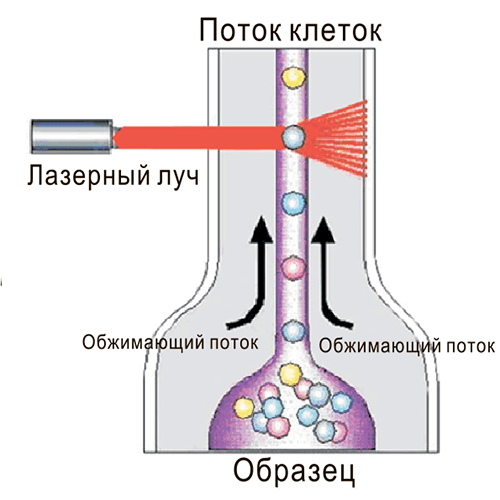
Рисунок 2. Общий принцип проточной цитофлуориметрии.
Описанные способы позволяют выявлять естественные маркеры — молекулы, которые и до начала исследования присутствовали на поверхности или внутри клеток. Эти методы сильно помогли ученым разобраться в том, чем опухолевые клетки отличаются от нормальных, стволовые клетки — от более зрелых и дифференцированных, и разные ткани — друг от друга.
Искусственные маркеры: внедрить и распознать
У описанных выше методов есть один существенный недостаток: они не позволяют установить родственные связи между клетками. Вот, предположим, у нас есть 100 клеток, и у 12 из них есть маркер А на поверхности. Все эти клетки А для нас будут на одно лицо, как близнецы (рис. 3).

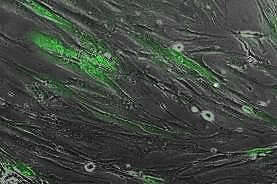
Рисунок 4. Мультипотентные мезенхимальные стромальные клетки (ММСК) человека, маркированные лентивирусом с зеленым флуоресцентным белком GFP.
собственные данные автора статьи, [4]
Современная генная инженерия достигла таких невиданных высот, что специалисты научились конструировать вирусы с заранее известными, тщательно отобранными для целей исследователей свойствами. Например, можно создать вирус, который способен заражать клетку — проникать через ее оболочку в ядро, — встраиваться в ДНК зараженной клетки, и больше ничего не делать: не создавать новые вирусные частицы, не копировать себя в геноме зараженной клетки, не экспрессировать ни один из вирусных генов. Вместо этого ученые смогли заставить вирус, который встроился в ДНК клетки, экспрессировать нужные белки (например, на этом принципе основана генотерапия). В частности, можно сделать так, что с ДНК вируса экспрессируется флуоресцентный белок [5], и зараженная клетка начинает светиться во флуоресцентном микроскопе (рис. 4).
Вирусы, которые способны направленно доставлять гены в ДНК клетки, стали называть вирусными векторами.
Не все вирусы способны встраиваться в ДНК клетки-хозяина. Такой способностью обладают вирусы семейства Retroviridae, или ретровирусы. Представители этого семейства — РНК-содержащие вирусы, которые после проникновения в клетку используют ее транскрипционный аппарат и собственную обратную транскриптазу, чтобы получить вирусную ДНК, которая затем встраивается в ДНК клетки-хозяина. Семейство Retroviridae среди прочих содержит два рода, которых чаще всего используют в качестве векторов, — это Gammaretrovirus (гаммаретровирусы) и Lentivirus (лентивирусы). Преимущество последних заключается в том, что помимо делящихся клеток (когда отсутствует ядерная мембрана), они способны заражать и клетки, находящиеся в состоянии покоя!
На заметку: именно к этому семейству принадлежит вирус иммунодефицита человека (ВИЧ). На его основе придуманы многие генетические векторы. Так что, в руках ученых ВИЧ из возбудителя страшной болезни превратился в послушный инструмент исследования.
Разберем эти возможности по порядку. Итак, наш вирус проник в клетку, сумел добраться до ядра, с боем прорвался через ядерную мембрану и встроился в ДНК клетки-хозяина. Но вот вопрос: в какое именно место он встроился? Вы когда-нибудь видели, как выглядит ДНК в клетке? Ну, вот примерно так, как на рисунке 5 .
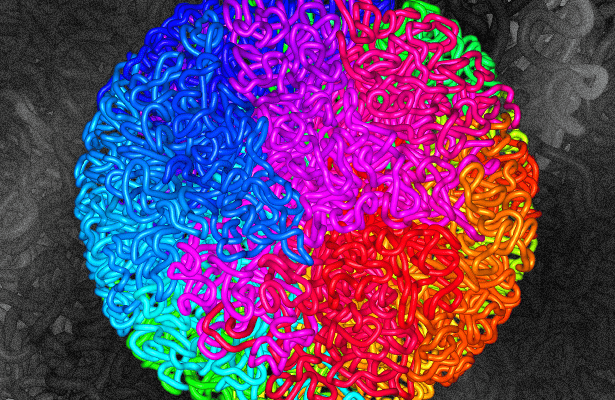
Рисунок 5. Модель фрактально-глобулярной структуры ДНК. Цветом здесь условно обозначены разные хромосомы.
Соответственно, у одного маленького вируса много возможностей, куда встроиться. В идеале — их бесконечно много, и поэтому найти две клетки, в которых бы вирусы встроились в абсолютно одинаковом месте, — довольно сложно. Еще один важный момент заключается в том, что если зараженная клетка решит поделиться, то обе ее дочерние клетки будут содержать провирус (так называется вирус, который встроился в геномную ДНК) в одном и том же месте генома! Другими словами, генетический маркер — наследуемый признак. Если научиться определять, в какое же именно место генома попал вирус в разных клетках, то можно было бы отличать потомство одной зараженной клетки от другой! И ученые умеют это! Существует несколько методов, позволяющих это сделать, главные из которых — метод саузерн-блоттинга и полимеразная цепная реакция, опосредованная лигированием [7], [8].
Оба метода основаны на том, что вследствие случайного характера интеграции вируса в геномную ДНК расстояние от провируса до ближайшего сайта рестрикции будет разным в двух независимо зараженных клетках. Соответственно, если из зараженных клеток выделить ДНК и разрезать ее одной из рестриктаз, то длина фрагмента, содержащего провирус, будет разной у потомства двух разных зараженных клеток, и будет одинаковой у всех клеток, которые произошли в результате деления одной зараженной клетки. Если после рестрикции разделить фрагменты гель-электрофорезом [11], перенести на нитроцеллюлозную мембрану и гибридизовать с короткой последовательностью дезоксирибонуклотидов, комплементарной провирусу (такие олигонуклеотиды принято называть зондами), то на фотобумаге проявится набор полос, который будет одинаковым для клеточного потомства одной клетки и разным — для клеточного потомства нескольких зараженных клеток (рис. 6).
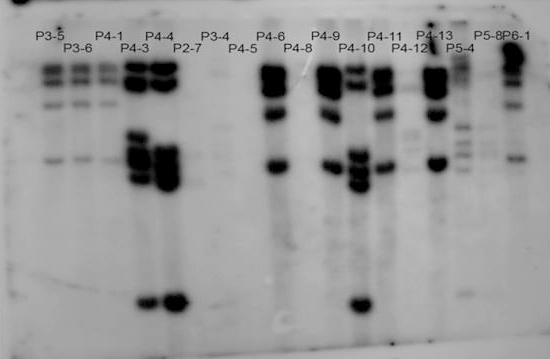
Рисунок 6. Саузерн-блот клеточных клонов, полученных из популяции, зараженной лентивирусным вектором. Каждая дорожка — результат саузерн-блоттинга ДНК из клеточного клона (клеточного потомства одной зараженной клетки). Набор полос в каждой дорожке соответствует продукту гибридизации зонда, комплементарного провирусу, с фрагментами расщепленной ДНК, содержащими провирус. Фрагменты разделены по длине с помощью гель-электрофореза.
собственные данные автора статьи, [4]
Из картинки видно, что на первых трех (и некоторых других дорожках — предлагаю читателю размяться и подсчитать их!) паттерн полос идентичен. Это говорит о том, что ДНК, проанализированная в этих образцах, получена из клеток, произошедших от одной исходно зараженной материнской клетки. Легко также заметить, что дорожка с таинственным названием Р5-4 содержит совершенно другой набор полос. Это означает, что ДНК, использованная здесь, принадлежала другой зараженной клетке. Недостаток такого метода в том, что он не позволяет в явном виде идентифицировать сайт интеграции провируса. Метод позволяет только сравнивать между собой клеточные клоны и судить об их родстве.
Другой метод, который позволяет анализировать сайты интеграции провирусов, — полимеразная цепная реакция, опосредованная лигированием [8]. Это достаточно сложный и многостадийный метод, который включает в себя рестрикцию ДНК, присоединение (лигирование) адаптеров, использование магнитных микрочастиц, ПЦР, электрофорез и секвенирование и заслуживает отдельной статьи. Прошу тебя, мой читатель, поверить мне на слово — этот метод позволяет с точностью до нуклеотида определить место в ДНК, в которое произошла интеграция провируса. С помощью этой методики можно не только различить потомство зараженных клеток между собой, но также судить о том, сколько вирусов проникло в ДНК зараженной клетки, в какие гены произошла интеграция, и не произошло ли изменение их экспрессии в результате внедрения вируса [12], [13].
Ранее я упомянул о том, что в качестве маркера, кроме места интеграции, можно использовать и саму ДНК провируса. Давайте рассмотрим подробнее, как это можно сделать. Здесь нам поможет химический синтез олигонуклеотидов! Дело в том, что в ДНК вируса можно вводить любую информацию: например, ген, кодирующий флуоресцирующий белок или фермент. Правда, тогда все вирусные частицы ничем не будут отличаться одна от другой и приобретут смысл маркеров только тогда, когда попадут в клетку. А почему бы не сделать сами вирусные частицы уникальными? Для этого ученые конструируют лентивирусные векторы, несущие так называемые генетические штрих-коды [14]. Суть заключается в том, что с помощью химического синтеза получают смесь олигонуклеотидов, где в некоторых позициях случайным образом содержится любой из четырех известных дезоксирибонуклеотидов. Дизайн штрих-кода может быть, например, таким:
ATC NNN GGA NNN TAT NNN CGA NNN ATT NNN GTG NNN
Здесь символы N обозначают любой из известных нуклеотидов (А, Т, C или G). Такой штрих-код ничего не кодирует, но он представляет собой смесь нуклеотидов с разными последовательностями. Приведенный штрих-код — на самом деле смесь из 4 18 (или приблизительно 10 11 после несложных, но утомительных математических преобразований) различных олигонуклеотидов! Такая смесь используется для сборки вирусов. На выходе получаются уже не обезличенные вирусы, похожие друг на друга как две капли воды, но целая библиотека вирусов, где каждая вирусная частица несет какой-то из возможных олигонуклеотидов-штрих-кодов. Клетки заражают такой вирусной библиотекой, и каждая зараженная клетка получает в свою ДНК уникальный стабильный наследуемый маркер в виде генетического штрих-кода. Все дочерние клетки будут нести тот же штрих-код (или набор штрих-кодов), который приобрела материнская клетка при заражении. Клеточное потомство двух разных зараженных материнских клеток будет иметь различные штрих-коды. Подобно тому, как штрих-коды на товарах в обычном продуктовом магазине позволяют однозначно идентифицировать и отличить один товар от другого, так генетические штрих-коды позволяют отличить потомство одной зараженной клетки от другой. Если затем из зараженной популяции клеток выделить ДНК и определить все присутствующие в ней штрих-коды с помощью новых методов секвенирования, то можно однозначно установить клональный состав клеточной популяции, проследить за динамикой клонов и выявить те клоны, которые преобладают над другими. После заражения библиотекой лентивирусов со штрих-кодами клеточная популяция становится как будто раскрашенной маркерами с очень-очень-очень разнообразной палитрой [15], примерно вот так (рис. 7):
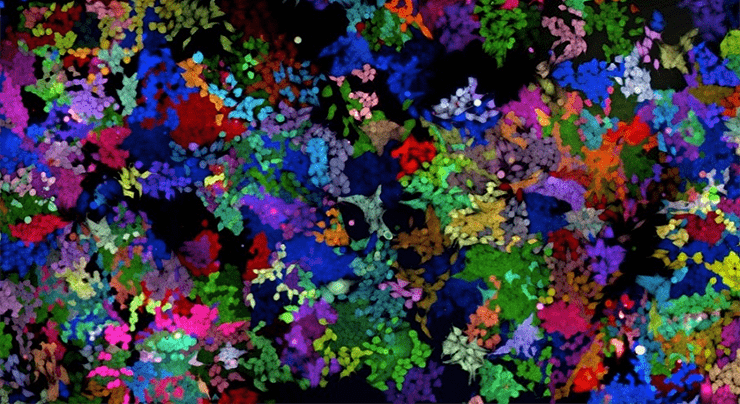
Рисунок 7. Как выглядела бы клеточная популяция, если бы каждый генетический штрих-код имел свой цвет.

Рисунок 8. Канцелярские принадлежности.
Читайте также:



