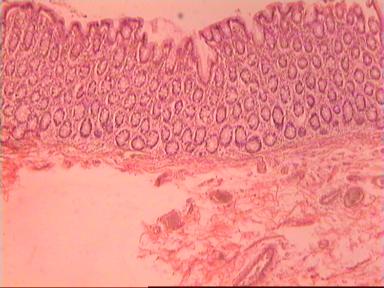
Инвазия опухоли в прямую кишку
Начавшийся рост. Рак прямой кишки 2 стадии – это прогрессирование начальной формы карциномы: опухоль прорастает через все слои кишечной стенки и становится реальной угрозой для жизни пациента.
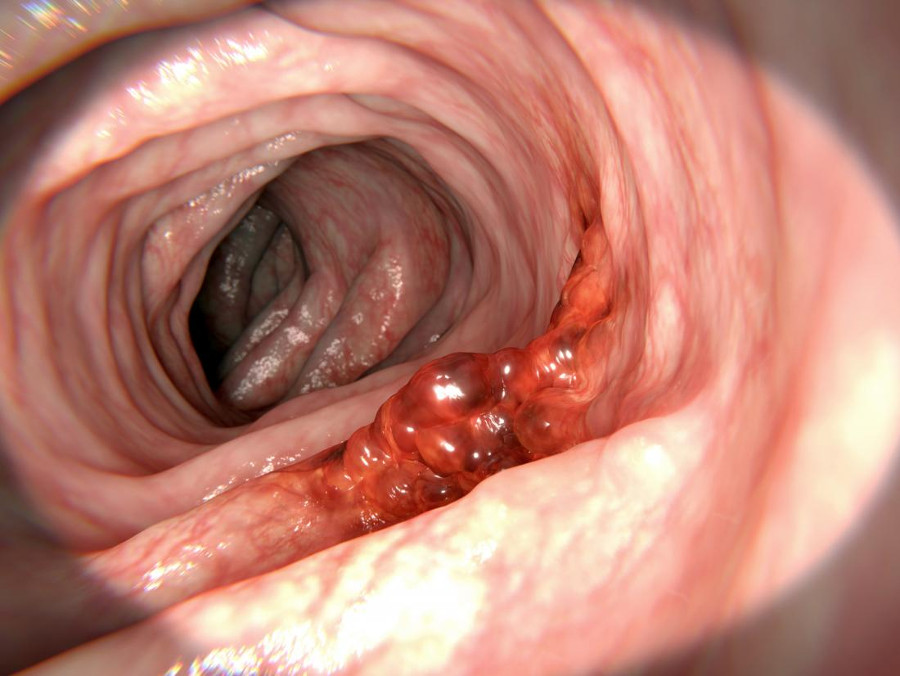
Опухоль начинает прорастать через всю стенку кишки
Рак прямой кишки 2 стадии
Хоть и небольшая по размерам карцинома, но риск для здоровья и жизни резко возрастает. Рак прямой кишки 2 стадии относится к сравнительно благоприятным формам онкологии, но важно понимать – после выхода опухоли за пределы слизистой оболочки кишечника вероятность быстрого роста и метастатического распространения увеличивается. В процессе диагностики всегда проводится стадирование, при котором выделяют 2 подстадии:
- T3aN0Mo – прорастание в подсерозный слой кишки на глубину менее 1 мм;
- T3bN0M0 – инвазия до 5 мм;
- T3cN0M0 – проникновение в серозную оболочку прямокишечного канала на глубину до 15 мм;
- T3dN0M0 – рост более 15 мм.
- T4N0M0 – инвазивное прорастание в соседние ткани и органы.
Самое главное – рак прямой кишки 2 стадии пока не распространяется в отдаленные ткани, ограничиваясь стенкой анального канала. Но это временно: если карциноме дать шанс, то переход в 3-4 стадию будет очень быстрым.
Как выявить опухоль
У большинства пациентов анальную карциному можно обнаружить при стандартном пальцевом исследовании: у 70% больных опухоль располагается на расстоянии не более 9-10 см от прямокишечного сфинктера. Но рак прямой кишки 2 стадии может быть небольшого размера, поэтому важен опыт врача – неопытный специалист может не заметить при ректальной пальпации наличие новообразования. Обязательными исследованиями при подозрении на опасное заболевание являются:
- Анализ каловых масс на скрытую кровь (гемокульт-тест);
- Эндоскопические исследования (аноскопия, ректороманоскопия, колоноскопия);
- Рентген кишечника (ирригоскопия);
- Ультразвуковое сканирование с применением трансректального датчика;
- Оценка уровня опухолевых онкомаркеров (РЭА, CA 19-9).
Важный элемент диагностических исследований – взятие биопсии из опухолевого очага. От гистологического типа зависит прогноз и выбор метода лечения.
Лечебная тактика и прогноз
Хирургическое вмешательство – это основа успешной терапии. Опухоль прямой кишки 2 стадии предполагает наличие реальной опасности рецидива при попытке выполнить органосохраняющую методику операции, поэтому врач предложит радикальное удаление анального канала (критерий радикальности – резекция кишки на расстоянии 12-15 см выше опухоли, на 2-5 см – ниже). Выбор хирургической методики зависит от следующих факторов:
- Возраст и общего состояния пациента;
- Месторасположения первичного очага злокачественного новообразования;
- Вида опухолевого роста;
- Степени прорастания в ткани (стадии).
Комбинированная методика лечения (лучевая терапия и химиотерапия) после операции при 2 стадии не используется. Облучение и лекарственная терапия применяется, если обнаружены очаги опухоли в лимфатических узлах или раковые клетки в крае удаленных при операции прямокишечных тканях. Прогноз 5-летней выживаемости не более 70%. Эта цифра указывает на то, что анальная карцинома на 2 стадии является опасной разновидностью злокачественного новообразования.
Городская больница № 40
СПбГУ, медицинский факультет, кафедра хирургии
Клинические наблюдения о несомненной важности бережного отношения к дистальной части сигмовидной кишки при передних резекциях прямой кишки (ПК), побудили нас изучить распространенность ракового поля в проксимальном направлении от верхнего края раковой опухоли. Знания эти должны лечь в основу рекомендаций, насколько минимально допустимо отступать от верхнего края опухоли при резекции сигмовидной кишки, не нарушая онкологических принципов оперирования. Такая озабоченность связана с тем, что у больных, у которых при резекции ПК для анастомоза использовалась самая дистальная часть низводимой сигмовидной кишки, резервуарно-накопительная и эвакуаторная функции оказывались заметно лучше. Вместе с тем, заботясь об улучшении функциональных результатов операций, мы постоянно имели в виду важность соблюдения онкологических принципов оперирования, поскольку главным при лечении онкологических больных является, конечно, улучшение пятилетней выживаемости.
Распространение ракового процесса внутристеночно от края видимой опухоли ПК в дистальном направлении привлекало внимание ряда авторов. Такие исследования имеют чрезвычайно важное значение при оперативном лечении больных с низкой раковой опухолью ПК. При этой локализации злокачественной опухоли, с позиций функциональных результатов, важен каждый сантиметр сохраненной дистальной части кишки. Использование сшивающих аппаратов при резекции ПК позволяет в техническом плане проводить максимально низкие резекции кишки.
Распространенность инвазии в дистальном направлении при раке прямой кишки.
Распространенность опухолевой инвазии в проксимальном направлении в меньшей мере привлекала внимание специалистов. При пересечении кишки выше опухоли не возникает необходимости в строгой экономичности сохранения кишки, примыкающей к опухоли, так как всегда имеется достаточная часть остающегося участка левого фланга ободочной кишки. Вместе с тем наши специальные исследования с анализом длины сигмовидной кишки по дооперационным ирригограммам и размера резецированной части ее после передней резекции ПК показали несомненную важность максимально возможного сохранения для анастомоза дистальной части сигмовидной кишки. К подобному заключению нас подвело изучение функциональных результатов сфинктеросохраняющих резекций ПК. Все это побудило специально изучить распространенность ракового поля в проксимальном направлении от верхнего края видимой опухоли. Результаты таких исследований были нужны для определения минимального расстояния, которое необходимо отступать от верхнего края раковой опухоли при пересечении кишки для соблюдения онкологических принципов оперирования.
Методы исследования. Исследовано 17 макропрепаратов ПК, удаленных при операциях, производившихся по поводу раковой опухоли. Макропрепараты фиксировались в 10%-ном растворе формалина и через 24 ч. проводилось микроскопическое исследование. Окраска препаратов - гематоксилин-эозин, увеличение 10 х 20.
В 15 случаях раковая опухоль располагалась в нижнеампулярном отделе ПК, в одном - в среднеампулярном и еще в одном - в верхнеампулярном отделе ПК. Раковые опухоли по наибольшему диаметру были различны: от 3 см в диаметре (3) до 5−6 см (7) и даже до 10 см (1). Резецированные участки кишки вместе с опухолью были различной длины: 20−30 см - 4, 30−40 см - 5, 40−50 см - 5, 50−60 см - 3.
При гистологическом исследовании в 12 случаях выявлена аденокарцинома разной степени дифференцирования, в двух - слизеобразующая аденокарцинома и в трех случаях - плоскоклеточный рак. В 15 из 17 препаратах установлено прорастание всех слоев стенки ПК. В шести случаях были выявлены метастазы опухоли в регионарных лимфатических узлах. Исследования проводились в Петроградском централизованном патологоанатомическом отделении городского патологоанатомического бюро, которым руководит Г.И. Суханкина.

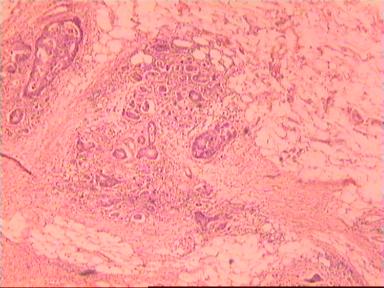
После фиксации препарата в проксимальном направлении от видимого верхнего края опухоли последовательно проводились пересечения кишечной стенки с интервалом 5мм (рис. 1).
В первый препарат обязательно включалась видимая часть раковой опухоли. В каждом последующем препарате делались три ступенчатых среза на разных уровнях поперечного пересечения кишечной стенки (а, б, в), а далее - в зависимости от морфологических изменений слизистой оболочки и нижележащих слоев кишки. Когда в двух последовательных срезах морфологических изменений ни в одном слое не обнаруживалось, дальнейшее гистологическое исследование прекращалось. В общей сложности приготовлено и просмотрено с помощью световой микроскопии 180 микропрепаратов. В большей части случаев - 13 из 17 - внутристеночного распространения злокачественной инфильтрации в проксимальном направлении от видимого края опухоли не отмечено или оно ограничивалось несколькими миллиметрами. Причем это наблюдалось как при больших, так и при небольших размерах опухоли; как при наличии метастазов опухоли в регионарные лимфоузлы, так и при отсутствии метастазов; при прорастании опухоли в примыкающую жировую клетчатку, так и без такого прорастания, а также не зависит от степени прорастания всей толщи стенки кишки. Вот несколько иллюстраций к этому.
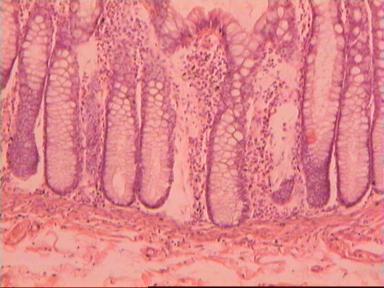
Результаты исследования. Представляем наблюдение, характеризующее отсутствие опухолевой инвазии по кишечной стенке.
Мужчина 54 года, рак анального канала и ПК, выполнена брюшнопромежностная экстирпация ПК. Гистологическое исследование 31261−31272.
Макропрепарат: блюдцеобразно возвышающееся над поверхностью кишки новообразование диаметром 6 см, прорастает все стенки кишки. От края опухоли в проксимальном направлении макроскопически определяется инфильтрация стенки на протяжении 3,5 см.
Микроскопическое исследование: высокодифференцированная слизеобразующая аденокарцинома ПК, прорастание всей толщи стенки кишки, врастание опухоли в жировую ткань. В опухоли очаги некроза, выраженная мононуклеарная реакция. От проксимального края видимой инвазии уже в 1 мм внутристеночного роста опухоли нет. (Рис. 2). Метастазов аденокарциномы в лимфатических узлах и жировой ткани не выявлено.
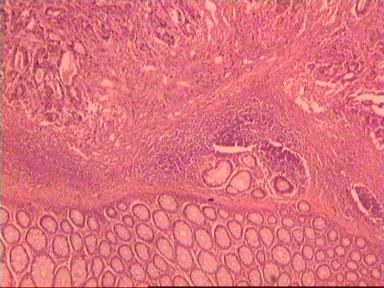
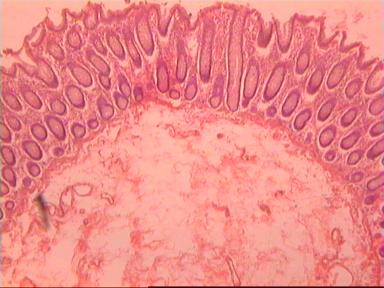
Рис. 2. Микропрепарат слизеобразующей аденокарциномы ПК
с прорастанием всей толщи стенки.
Окраска гематоксилин-эозин. Увеличение 10 х 20.
А. Первый срез - в препарате виден край аденокарциномы.
Б. Срез через 5мм - признаков опухолевого роста нет.
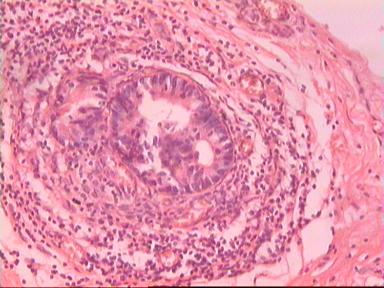
Такие данные были получены и при аденокарциноме, и при плоскоклеточном раке ПК. Приведем наблюдение, свидетельствующее о распространении опухолевого роста по кишке в проксимальном направлении. Мужчина 73 года, рак ПК, выполнена передняя резекция ПК. Гистологическое исследование № 869−870; 871−882. Макропрепарат: опухоль 5 см с кратером, циркулярно охватывающая просвет кишки, прорастание всех слоев кишки и прилежащей жировой ткани, участки абсцедирования.
Микроскопическое исследование: аденокарцинома разной степени дифференцировки. В 5 мм вне видимой опухоли − аденокарцинома в подслизистом, мышечных слоях, в клетчатке, с абсцедированием (рис 3). На срезах через 10 мм от видимого края новообразования опухолевого роста нет.
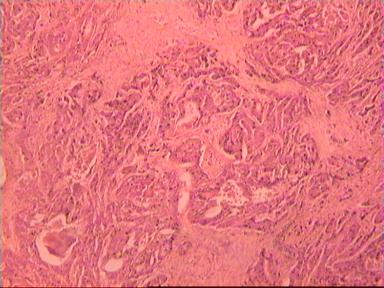 |  |
| А | Б |
Рис. 3. Микропрепарат аденокарциномы ПК разной степени дифференцировки
с прорастанием всех слоев кишки.
Окраска - гематоксилин-эозин. Увеличение 10 х 20.
А. Первый срез - в препарате виден край аденокарциномы.
Б. Срез через 5 мм - в слизистом слое видны признаки опухолевого роста.
Приведем еще одно наблюдение, свидетельствующее о несомненном распространении опухолевого роста по кишке в проксимальном направлении. Женщина 73 года, рак ПК, выполнена резекция ПК по Гартману. Макропрепарат: экзофитная опухоль 5 х 5 см, прорастание всех слоев кишки, регионарные лимфоузлы не определяются.
Микроскопическое исследование: аденокарцинома разной степени дифференцировки с очагами в слизистой оболочке, подслизистом слое, в жировой клетчатке, во внутриорганных лимфатических узлах, в сосудах определяются опухолевые эмболы. На срезах 5 и 15 мм - аденокарцинома на всех препаратах. На срезах в 20 мм от видимого края опухоли - одиночная структура аденокарциномы на границе мышечного слоя и клетчатки. На других двух ступенчатых срезах этого уровня опухолевого роста уже нет (рис. 4). На всех трех ступенчатых срезах в 25 мм от края ракового новообразования опухолевого роста нет.
 |  |  |
| А | Б | В |
Рис. 4. Микропрепарат аденокарциномы ПК разной степени дифференцировки
с прорастанием всей толщи стенки кишки.
А. Первый срез - в препарате виден край аденокарциномы.
Б. Срез через 20 мм - в слизистом слое видны признаки опухолевого роста.
В. Срез через 25 мм - признаков опухолевого роста нет.
Вопреки ожиданиям не выявилось повышенной тенденции к внутристеночному росту при низкодифференцированной аденокарциноме, слизистых и плоскоклеточных формах рака ПК. Следовательно, отступление от верхнего края опухоли на 4−5 см в проксимальном направлении с онкологических позиций вполне оправдано и нет необходимости удалять здоровую и функционально полноценную часть кишки. Однако нужно учитывать, что уровень пересечения кишки выше опухоли во многом определяется высотой перевязки основного кровеносного сосуда, которым для этой зоны является нижняя брыжеечная артерия, особенностями кровоснабжения конкретного участка кишки и вовлеченностью в онкопроцесс лимфатического аппарата. Намечая линию пересечения сигмовидной или нисходящей части ободочной кишки, нужно учитывать эти обстоятельства и по возможности бережно, экономно относиться к удалению этого отдела толстой кишки, помня, что инвазия опухоли по стенке кишки незначительна.
Каждый пациент на приёме у врача больше всего боится, что у него заподозрят или, что хуже, найдут новообразование. Однако мало кто знает о механизме развития опухоли и за счет чего конкретно данный диагноз является настолько страшным. В этой статье мы разберёмся, что именно делает онкологические заболевания такими опасными для жизни.
- Строение тканей с точки зрения формирования опухолевого процесса
- Доброкачественные и злокачественные опухоли: в чем разница?
- Что такое инвазия опухоли?
- Факторы, определяющие степень инвазивности опухоли
- Инвазия раковых клеток в сосуды
- Циркуляция раковых клеток в системе кровотока и экстравазация
- Резюме
Строение тканей с точки зрения формирования опухолевого процесса
Чтобы разобраться в механизме образования и развития опухоли, необходимо иметь представление о принципе строения тканей в организме. Большинство тканей, независимо от места их расположения, имеют сходный план строения:
- Базальная мембрана — это неклеточная структура, отграничивающая ткани друг от друга;
- Ростковый слой — группа активно делящихся клеток, расположенных на базальной мембране, которые обеспечивают обновление ткани. Именно изменение генетического материала клеток росткового слоя влечёт за собой развития опухоли;
- Слой созревающих клеток — клетки ростового слоя, которые постепенно продвигаются в верхние слои в процессе дифференцировки (приобретения формы и свойств, характерных для данной ткани);
- Поверхностный слой — группа клеток, которая и обеспечивает выполнение тканью определённой функции.
Между ростковым и поверхностным могут располагаться дополнительные слои в зависимости от конкретного вида ткани. Но принцип строения всегда один и тот же: клетки, способные делиться, находятся на базальной мембране. В процессе созревания они перемещаются в верхние слои, утрачивая способность к делению и приобретая специфические свойства.
Доброкачественные и злокачественные опухоли: в чем разница?
Исходя из того, клетки какого слоя подверглись мутации, выделяют два типа неоплазий — доброкачественные и злокачественные. Их отличия заключаются в том, что первый тип формируется из высоко дифференцированных клеток созревающего слоя. При доброкачественных опухолях клетки не будут сильно отличаться от здоровых клеток данной ткани. Такая неоплазия считается неагрессивной и растет медленно, а также не даёт метастазы. Патогенное действие доброкачественного новообразования заключается главным образом в сдавлении окружающих её тканей. Иногда такие опухоли полностью или частично закрывают просвет какого-либо полого органа.
В процессе развития рака выделяют 4 стадии:

Что такое инвазия опухоли?
Инвазия обуславливает способность опухолей давать метастазы — вторичные очаги онкологического процесса вдали от материнской опухоли, возникшие из-за миграции раковых клеток. Обязательное условие метастазирования — наличие у опухоли собственной капиллярной сети. Она формируется, когда количество неопластических клеток достигает 103 (1-2 мм).
- Разрыв межклеточных связей, соединяющих раковые клетки между собой;
- Прикрепление клеток опухоли к базальной мембране;
- Разрушение базальной мембраны лизирующими (расщепляющими) ферментами;
- Миграция клеток в соседние ткани и органы.
Раковые клетки, находящиеся в процессе инвазии, более устойчивы к облучению и химеотерапии, чем стационарные. Во многом это связано с временной утратой мигрирующими клетками способности к делению. Также движущиеся опухолевые клетки проявляют повышенную активность антиапоптотических генов (гены, препятствующие запрограммированной смерти клетки — апоптозу). И, поскольку химиотерапевтические препараты направлены на стимуляцию апопоза, их устойчивость к лечению возрастает.
Факторы, определяющие степень инвазивности опухоли
Чтобы злокачественная опухоль проросла сквозь базальную мембрану, необходимо наличие следующих факторов:
- Быстрое деление и давление. Механическое воздействие опухолевой массы на базальную мембрану способствует её разрушению и, как следствие, инвазии раковых клеток;
- Подвижность клеток. Клетки новообразования способны к миграции, причем их движение не является хаотичным. Они движутся в направлении большей концентрации кислорода, питательных веществ, а также в сторону более нейтрального показателя кислотности (рН);
- Межклеточные связи. Чем прочнее эти контакты, тем меньше шансов, что опухоль начнет инвазивный рост. У злокачественных клеток связи слабые, поэтому клетки легко отрываются от новообразования и попадают в кровоток или в лимфатическую систему;
- Действие лизосомальных ферментов. Злокачественная опухоль вырабатывает вещества, способные разрушать здоровые клетки и межклеточное вещество, что будет способствовать инвазии;
- Иммунная система человека. В организме существует собственная противоопухолевая защита, которую обеспечивает наш иммунитет. Её активность у каждого человека индивидуальна. Она зависит от генетической предрасположенности и состояния всего организма в конкретный момент. Так, при заболеваниях, сопровождающихся угнетением иммунной системы (например, при ВИЧ), пациенты могут погибать от онкологических заболеваний, возникших из-за отсутствия противоопухолевой активности.
Инвазия раковых клеток в сосуды
Вслед за прорастанием в базальную мембрану наступает интравазальная (внутрисосудистая) инвазия опухоли. Чаще раковые клетки мигрируют в артерии. Это связано с тем, что стенки артерий более упругие и эластичные, в то время как у вен они тонкие и легко спадаются в опухолях. Однако раковые клетки могут быть занесены в вены из лимфатических сосудов.
Циркуляция раковых клеток в системе кровотока и экстравазация
Экстарвазация представляет собой выход опухолевых клеток из сосудов для формирования метастатического очага. В этом процессе задействованы те же ферменты, что и в инвазии через базальную мембрану.
Резюме
Вот что следует знать об инвазии опухолей:
- Инвазия — это проникновение раковых клеток через базальную мембрану ткани, из которой развилась опухоль;
- Инвазия свойственна только злокачественным новообразованиям;
- В инвазии участвуют лизирующие ферменты, которые способны разрушать как неклеточные структуры, так и связи между здоровыми клетками (например, выстилка сосудов);
- Явление инвазии лежит в основе метастазирования;
- Инвазия бывает индивидуальной и групповой, и последняя чаще обуславливает появление метастазов,
- Самые распространенные виды инвазивных опухолей — рак шейки матки и рак молочной железы.
МРТ методика и МРТ стадирование рака прямой кишки
Основным направлением в лечении колоректального рака в настоящее время является иссечение прямой кишки вместе с эмбриологически связанным с ней фасциальным футляром и параректальной клетчаткой содержащей лимфатические узлы, total mesorectal excision (TME). Другим направлением является переход от адъювантной к неоадъювантной химиолучевой терапии. Оба подхода кардинально изменили частоту местных рецидивов и выживаемость пациентов. Полная ремиссия может достигать до 30% у пациентов получающих неоадьювантную химиотерарию. Вопрос состоит в том, является ли пациент с раком прямой кишки кандидатом на TME или же необходима предоперационная химиолучевая терапия с последующей TME. МРТ, как наиболее точный метод для стадирования рака прямой кишки, может ответить на этот вопрос.
Radiology Departement of the Maastricht University Hospital and the Rijnland Hospital in Leiderdorp, the Netherlands
Введение
Ранние методы хирургического лечения рака прямой кишки заключались в резекции опухоли с окружающей параректальной клетчаткой. Однако при использовании данных методик частота местных рецидивов достигала 40%. В 1982 году хирургом Richard John Heald была предложена техника TME. Широкое внедрение данной техники позволило снизить частоту местных рецидивов с 40% до 11% (1,2). Роль МРТ заключается в определении возможности TME операции, а в случае значительной распространенности опухолевого процеса назначения химиолучевой терапии как первого этапа лечения, с последующей TME.
Total mesorectal excision
На МР изображениях параректальная клетчатка имеет высокую интенсивность сигнала на Т1 и Т2 взвешенных изображениях. Параректальная клетчатка отграниченна мезоректальной фасцией, которая виднка как тонкая линия с низкой интенсивностью МР сигнала (красные стрелки).
Роль мезоректальной фасции при планировании TME.
Наименьшая дистанция от края опухоли или лимфатических узлов называется circumferential resection margin (CRM/циркулярный край резеции/ проксимальный, дистальный и латеральный края резекции). Она является одим из главных факторов риска местного рецидива. Вовлеченный латеральный край резекции является отдельным прогностическим фактором общей и безрецидивной выживаемости, расстояние > 2 мм позволяет говорить о том, что мезоректальная фасция интактна, 1-2 мм с возоможной инвазией, и вовлечена в процесс если это расстояние ⩽1 mm.
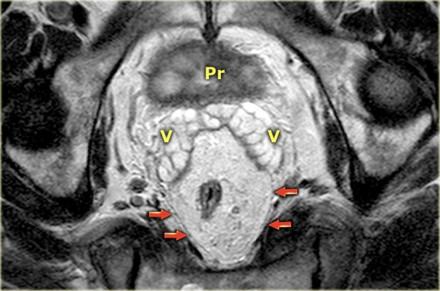
Прямая кишка окружена параректальной клетчаткой, отграниченной мезоректальной фасцией, помеченной красными стрелками. Р - простата V - семенные пузырьки
Сircumferential resection margin / циркулярный край резеции / латеральный край резекции
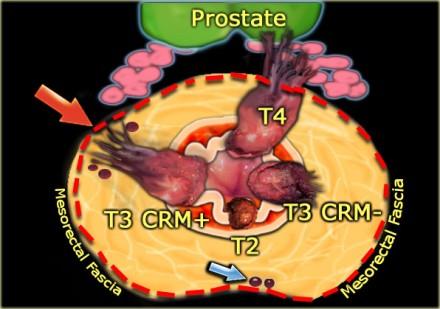
На иллюстрации слева:
- T2-опухоль ограниценная стенкой кишки
- T3-опухоль с широким circumferential resection margin или T3 CRM-
- T3-опухоль с вовлечениемм латерального края резекции или T3 CRM+ (красная стрелка)
- T4-опухоль с прорастанием в семенные пузырьки и простату
При наличии визуализируемых лимфатических узлов и "отсевов" опухоли в 2 мм от мезоректальной фасции, всегда необходимо отражать это в описании, так как они могут отражать вовлечение латерального края резекции (синяя стрелка).

МРТ исследование должно определить следующее:
- Расположение опухоли
- Уровень (нижне-, средне- или верхнеампулярный отдел прямой кишки), размер, окружость роста
- T-стадию: T1, T2, T3 или T4
- Расстояние от опухоли до мезоректальной фасции. Вовлечен или нет?
- Рост опухоли или лимфатических узлов в 1 мм от края резекции?
- N-стадию: Есть ли лимфатические узлы в пределах параректальной клетчатки или за ее пределами?
Локализация опухоли
Прямой кишкой называется сегмент толстой кишки к низу от сигмовидной ободочной кишки и до заднепроходного отверстия. Ректосигмоидный переход условно определяется на 15 см выше анального отверстия. Опухоли с локализацией более 15 см выше анального отверстия рассматриваются и рассматриваться как опухоли сигмовидной кишки. Поскольку на МР изображениях мы не можем обнаружить анального отверстия, лучше измерять это расстояние от аноректального угла. Таким образом опухоли на 15 см выше аноректального угла рассматриваютсякак опухоли сигмовидной кишки.
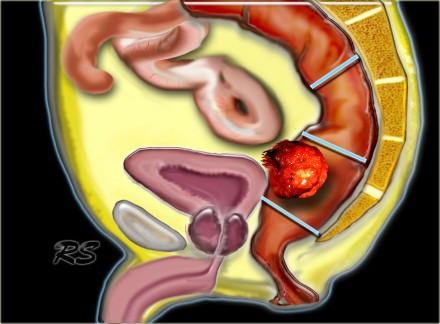
Рак прямой кишки может быть разделен на:
- Нижнеампулярный рак прямой кишки:
Дистальная граница от аноректального угла на 5 см. - Среднеампулярный рак прямой кишки:
Границы составляют 5-10 см от аноректального угла. - Верхнеампулярный рак прямой кишки:
Границы составляют 10-15 см от аноректального угла.
Нижнеампулярный рак прямой кишки
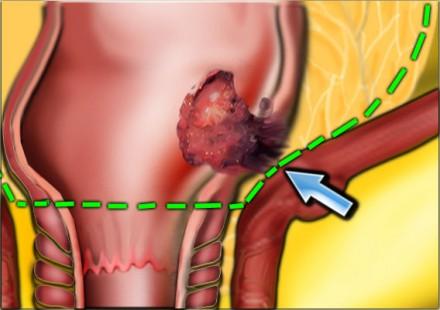
Нижнеампулярный рак прямой кишки имеет более высокую частоту местных рецидивов. Дистальное сужение параректальной клетчатки предрасполагает к тому, что нижнеампулярный рак прямой кишки более легко проникает в окружающие структуры и более трудоемок для получения свободного края резекции хирургом (см рисунок).
T-стадия и мезоректальная фасция.

Следующим шагом после определения локализации опухоли, необходимо определить Т-стадию. МРТ не может определить отграниченна ли опухоль подслизистым слоем или есть инвазия мышечного слоя, и следовательно, не может разграничить T1 и T2 стадию. Чтобы избежать рисков, тяжелых осложнений, связанных с обширными операциями, для ранних опухолей прямой кишки Т1 применяется трансанальное местное иссечение. Этот метод требует тщательной предоперационной диагностики с участием трансанального УЗИ, как более точного в дифференцировке на T1 и T2 стадиях.
T1 и T2
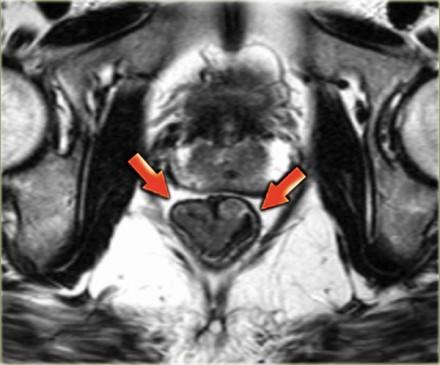
T1 и T2 опухоли ограничены стенкой кишечника и имеют хороший прогноз в лечении.
Они могут быть достаточно точно определены на МРТ, так как неизмененная стенка прямой кишки будет иметь вид линии с МР-сигналом низкой интенсивности, что означает что наружный мышечный слой окружает опухоль (3). На изображении, опухоль прямой кишки полностью окружена черной полоской наружной мышечной стенки. Это Т2 опухоль.
T3 MRF-
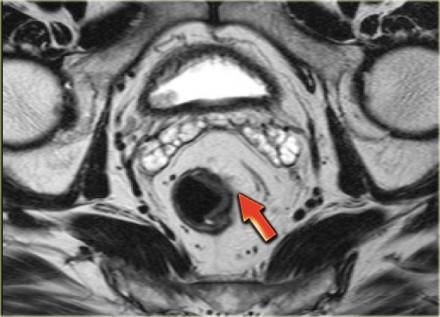
Т3 опухоли прорастают все слои кишечной стенки и проникают в параректальную жировую клетчатку. При данной стадии важно определить имеется ли вовлечение мезоректальной фасции или нет. Слева изображена опухоль с возможной инвазией в параректальную клетчатку т.е. Т3 (стрелка). Край резекции широкий и нет увеличения лимфатических узлов прилегающих к мезоректальная фасции . Эта опухоль классифицируется как Т3 MRF-. В Нидерландах, как и в большинстве европейских стран, этому пациенту будет проведен короткий предоперационный курс лучевой терапии с последующим TME.
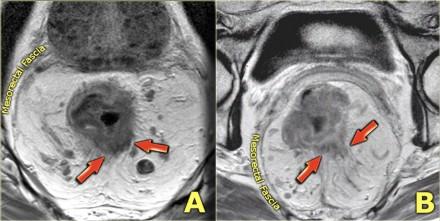
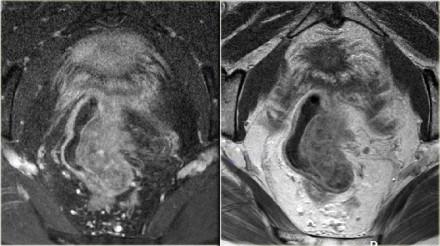
Чувствительность МРТ в диагностике инвазии в периректальную клетчатку составляет 82%. Видимая лучистая инфильтрация периректальной клетчатки, может быть ловушкой, так как может быть как результатом опухолевого прорастания, так и местной десмопластической реакции. Что бы избежать неправильной трактовки, опухоли с инфильтрацией периректальной клетчатки рекомендуется стадировать как Т3. Степень экзофитного распространения является прогностическим фактором. На МР изображениях слева предствалены две опухоли со схожей МР картиной. На изображении А была выявленая инвазия периректальной клетчатки. На изображении В опухоль была отграничена стенкой кишечника, Т2 стадия, периректальная инфильтрация клетчатки в данном случае была результатом десмопластической реакции. На выбор лечебной тактики данный признак, при дифференцировке между T2 MRF- и T3 MRF- опухолями, не оказывает значимого влияния. Обе опухоли будут подвергнуты ТМЕ или предоперационному курсу низкодозной лучевой терапии 5х5 Гр с последующим TME
T3 MRF +
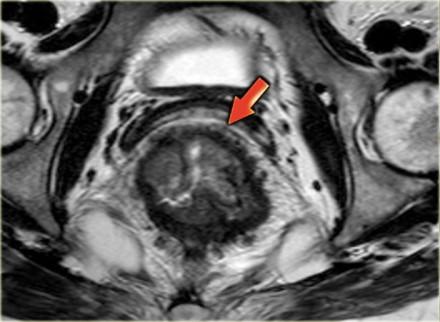
Слева опухоль с инвазией параректальной клетчатки и инвазией переднего края резекции (стрелка). Такая опухоль классифицируется как Т3 MRF +. Данный пациент будет проходить курс химиолучевой терапии, при положительном ответе на которую по результатам МРТ контроля будет проведено рестадирование с последующей ТМЕ.
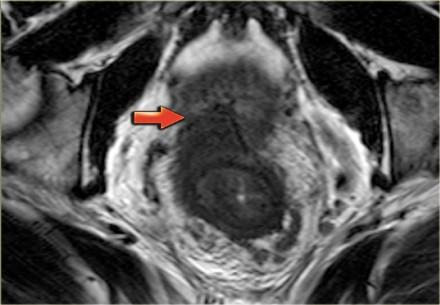
Т4 — опухоль инфильтрирует окружающие органы (влагалище, простату, семенные пузырьки или мочевой пузырь) и ткани. Пациенты с данной стадией требуют длительного курса химиолучевой терапии и обширной операции. Для определяется инвазии в окружающие органы все диагностические методы показывают схожую чувствительность: 70% для ТРУЗИ, 72% для КТ и 74% для МР-томографии. Слева T4-опухоль с инвазией предстательной железы.
N-стадия
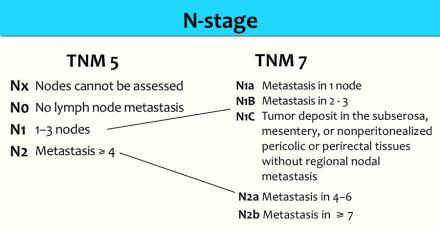
Наличие N-стадии является важным фактором риска развития локорегионарного рецидива. К сожалению МРТ, как и большинство других методов визуализации, имеет низкую чувствительность и специфичность для обнаружения метастазов в лимфатических узлах. Пораженными считаются лимфатические узлы с размерам по короткой ось > 5 мм, изменением формы, с лучистыми контурами и нечеткими границами или гетерогенной структурой. Однако не все пораженные лимфатические узлы отвечают этим критериям.
Более часто используется классификация TNM5 для определения N-стадии. N-стадии в TNM7 схожи с TNM5, но N1 и N2-стадии более дифференцированы.
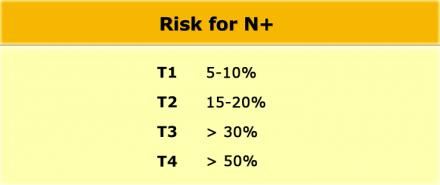
Даже в T1 и T2 стадии опухолевого процесса имеют значительный риск метастатическго поражения лимфоузлов (см. таблицу).
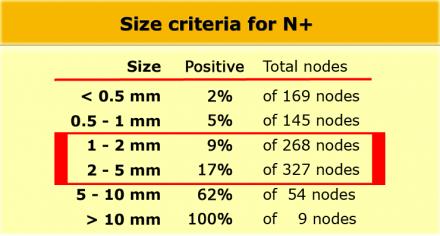
Низкая чувствительной использования для оценки только размеров, может быть объяснена тем фактом, что при колоректальном раке широко распространено наличие злокачественных изменений даже в мелких лимфатических узлах, до 9% в узлах размерами 1-2 mm nodes и до 17% у узлах размерами 2-5 mm (11). Как показано в таблице слева, большинство изменений выявляется в лимфатических узлах размерами 1-5 mm. Чтобы не занижать стадию все визуализируемые лимфатические узлы можно рассматривать как малигнезированные.
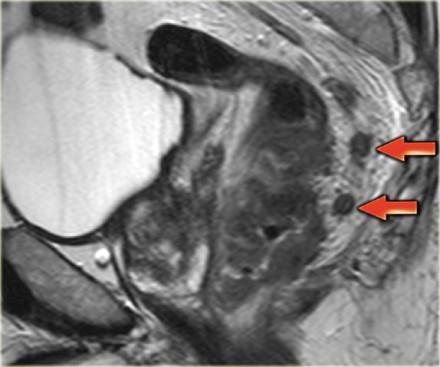
На изображении слева нижнеампулярный рак прямой кишки с множественными лимфатическими узлами в периректальной клетчатке кзади от ампулы. Это имеет огромное влияние на прогноз у пациента, основанное на MRF+ и N+ статусе, по этому пациент будет получать более агрессивное лечение с неоадъювантной химиолучевой терапией.
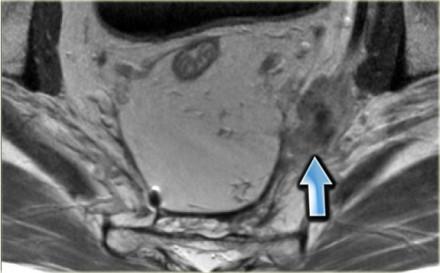
Важно обращать внимание на лимфатические узлы задней мезоректальной клетчатки (стрелка). Данные мезоректальные лимфатические узлы важны, так как могут быть причиной местных рецидивов. При их обнаружении с помощью МРТ, лучевая терапия и хирургическое планирование будут адаптированы.
Слева пациент после TME с рецидивом в узлах мезоректальной клетчатки (стрелка). Эти мезоректальные лимфатические узлы не были резецированы во время стандартной ТМЕ операции.
Определение малигнезированных мезоректальных лимфатических узлов как минимум влечет за собой более расширенную хирургическую тактику, так как необходимо удалить все опухолевые узлы или увеличение дозы лучевой терапии в зоне риска.
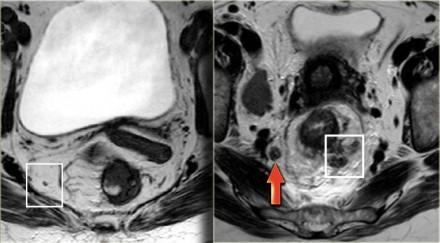
На аксиальных Т2-взвешенных изображениях слева представлены два пациента с раком прямой кишки. Эти примеры иллюстрируют сложности определяется N-статуса. На крайний слева определяется небольшой эктрамезоректальный лимфатический узел.
На изображении справа визуализируются многочисленные крупные мезоректальные лимфатические узлы, а также в правых отделах эктрамезоректальной клетчатки определяется лимфатический узел с нечеткими границами (красная стрелка). Хотя лимфатические узлы этих пациентов имеют разные характеристики по размерам, границам и гетерогенному внешнему виду, все они оказались малигнезированными.
Рак прямой кишки характеризуется метастатическим поражением мелких лимфатических узлов.
МР протокол
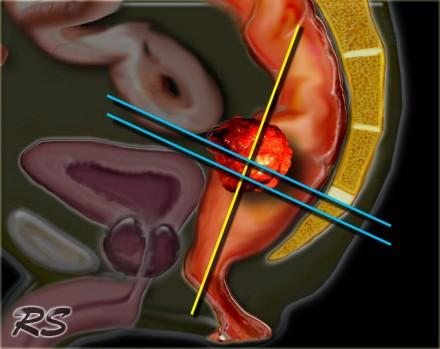
Только T2 FSE изображения, нет контрастное усиления.
Требуются только T2 FSE последовательности. Применение препаратов гадолиния не улучшает диагностическую точность и, следовательно, они не включены в стандартный протокол при данной патололгии. Изображения получают в сагиттальной, корональной и аксиальной плоскостях. Начинать необходимо с сагиттальной серии, по ней выстраиваются аксиальные изображения, перпендикулярные стенкам прямой кишки на уровне опухоли (синие линии). Коронарные изображения выстраиваются перпендикулярно аксиальной серии (желтая линия) через дистальные отделы опухоли и параллельно анальному каналу. Данный подход позволяет избежать артефакт частичного объема и позволяет точно оценить глубину инвазии опухоли, а так же оценить врастание опухоли в анальный канал. Кроме того правильно планировать МР последовательности помогает указание хирургом в направлении на исследование уровня опухоли. Верхней границей поля обследования (FOV) является L5, каудальная граница - ниже уровня анального канала. Рекомендуется использовать поверхностную катушку, в эндоректальной катушке нет необходимости. Единого мнения об использовании 1.5T или 3.0T систем нет. Диффузионно взвешенные изображения могут использоваться для переоценки стадии процесса. Высокий уровень сигнала на изображениях с B1000 указывает на неполный ответ.
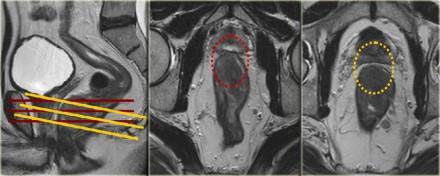
Аксиальные изображения должны быть под правильным углом, перпендикулярно оси опухоли, чтобы избежать усреднения объема.
На примере слева первое планирование аксиальных изображений было выполнено под неправильным углом, что создало ложное впечатление о вовлечении мезоректальной фасции (MRF, выделено красным кругом), при правильном изменении угла перпендикулярно оси опухоли видно, что мезоректальная фасция (MRF) не вовлечена в процесс (желтый круг).
Не используйте программы с подавлением сигнала от жира и ректальное контрастирование
Подавление сигнала жира не улучшает визуализацию границ опухоли. Пациенты не нуждаются в подготовке кишечника. Использование ректального контраста не рекомендуется, потому что растяжение стенок кишечника может привести ложноположительным результатам при отсутствии инвазии в мезоректальную фасцию.
Кроме того, это затрудняет оценку дистальных мезоректальных лимфатических узлов.
Описание исследования
Описание исследования
А. Первичное исследование
Радиологический отчет должен содержать следующие пункты:
- Положение опухоли в нижне-, средне- или верхнеампулярном отделе прямой кишки.
- Расстояние от аноректального угла до нижнего полюса опухоли.
- Длина опухоли.
- Циркулярная или полуциркулярная. Положении опухоли боковых, передней или задней стенке.
- T-стадии:
- T1 / T2: опухоль ограничена стенки кишечника
- T3: инвазия периректальной клетчатки с указанием степени прорастания в мм.
- T4: вторжение в окружающие органы и ткани, с указанием пораженных органов.
- Наименьшее расстояние (в мм) между опухолью и мезоректальной фасцией с указанием локализации.
- N-стадия: лимфатические узлы в параректальной клетчатке с указанием минимального расстояния к краю резекции, указание экстрамезоректальных лимфатических узлов . Обозначить количество подозрительных лимфатических узлов.
Б. Оценка ответа на неоадъювантную химиолучевую терапию
Контрольное исследование выполняется аналогичным образом как и первичное исследование, с добавлением префикса Y.
Например YT3 означает, что пациент с опухолевой инвазией в мезоректальную фасцию получает неоадъювантую терапию.
Лечение
Существуют различные подходы в лечении рака прямой кишки в разных странами и разных учреждениях. Общепринято, что TME является лучшим методом радикального лечения для всех опухолей со свободным краем резекции. В Нидерландах, как и в большинстве европейских стран, большинству пациентов до TME проводится краткий курс лучевой терапии 5x5 Гр. В отдельных учреждениях, при наличии хороших прогностических факторов (верхнеампулярные раки T1N0 и T2N0), предоперационный курс лучевой терапии не проводится. Короткие курсы лучевой терапии непосредственно перед TME не снижают распространенность и поэтому не подходят для местно распространенных опухолей.Все пациенты с Т4-опухолями, опухолями с инвазией края резекции, а так же опухолями с малигнезацией лимфатических узлов вблизи или за пределами края резекции, сначала получают высокодозную химиолучевую терапию. Дальнейшая тактика зависит от ответа на проводимое предоперационное лечение. В случае регрессии опухоли выполняется менее обширная резекция. В случаях уменьшения размеров опухоли и стерилизации узлов (yN0) следующим шагом выполняется TME. При полном исчезновение опухоли и лимфатических узлов может рассматриваться выжидательная тактика. Однако этот подход остается спорным и не является стандартным.
Читайте также:

