Химиопрепараты способные тормозить деление раковых клеток называются
Понятие об избирательной цитотоксичности противоопухолевых препаратов
Идея применения специальных лекарств, повреждающих опухоль более чем нормальные ткани, т.е. обладающих избирательной токсичностью, оптимально может быть реализована при условии качественных различий в биологии опухолевой и нормальной клетки.
Эти различия существуют, однако носят скорее количественный, чем качественный характер, что не позволяет получать стабильный противоопухолевый эффект, но практически всегда — видимые или скрытые повреждения нормальных тканей и систем в виде побочных действий цитостатиков.
Отличия между раковой и нормальной клеткой, обусловливающие клинически значимые лечебные эффекты цитостатической терапии, касаются биохимических характеристик, свойств мембран, хромосомного аппарата, кинетики и способности к восстановлению функций.
В опухолевой клетке биохимические процессы не имеют специфических особенностей. Однако они, при одинаковых путях метаболизма препарата в нормальной и опухолевой клетке, различаются на фоне цитотоксического воздействия.
Раковая клетка отстает в темпе детоксикации препарата, дольше подвергается контакту с ним и, таким образом, относительно избирательно повреждается. До настоящего времени не ясно, в какой степени влияют на избирательную цитотоксичность имеющиеся различия по содержанию липидов, гликопротеина, мукополисахаридов, наличию (только у опухолевых клеток) специфических или эмбриональных антигенов, различия в структуре и функциях мембран опухолевых и нормальных клеток.
Нельзя также объяснить избирательную токсичность цитостатиков более быстрой пролиферацией опухолевой ткани по отношению к исходно нормальной. Однако некоторые нормальные ткани — костный мозг, эпителий кишечника, волосяных фолликулов и половых желез — по уровню пролиферативной активности способны превосходить опухолевые, вследствие чего неизбежны побочные эффекты химиотерапии в первую очередь со стороны перечисленных систем.
Из всех известных особенностей биологии раковой клетки наиболее существенной, по-видимому, оказывается сниженная устойчивость клеток новообразований к повреждению при большей способности нормальных тканей к ликвидации его последствий.
Преимущественно функциональные отличия опухолевой клетки от нормальной в совокупности все-таки позволяют на практике осуществить идею относительно избирательной токсичности и получить лечебные эффекты, вполне оправдывающие клиническое применение цитостатиков.
Механизмы реализации противоопухолевого действия химиопрепаратов
Основу современной медикаментозной терапии опухолевых заболеваний пока составляют цитотоксические и цитостатические препараты. Для понимания механизмов действия цитостатиков необходимо в общих чертах напомнить основные положения механизма размножения клеток.
Рост и размножение (деление) опухолевых и нормальных клеток происходит принципиально однотипно, репродуктивный цикл тех и других включает одни и те же фазы. Нарушения, характерные для новообразования, заключаются не в самом механизме репродукции клеток, а в анормальностях регуляции роста.
Жизненный цикл исходной опухолевой клетки, приводящий к образованию дочерних, состоит из четырех фаз — G1, S, G2 и М (рис. 9.13).

Рис. 9.13. Клеточный цикл опухолевой клетки.
Из перечисленных фаз М, S и G2 относительно постоянны во времени, тогда как продолжительность фазы G1 различна: при высокой пролиферативной активности опухоли она значительно короче, чем при низкой. Существует также фаза G0, которой обозначают выход клетки из числа способных к дальнейшему делению в покоящееся состояние.
Прямое повреждающее действие противоопухолевые препараты оказывает лишь на делящиеся (пролиферирующие) клетки не только опухолей, но и любых органов и тканей и не влияют на клетки, находящиеся в состоянии покоя (G0).
При всем различии в механизмах действия общим в эффектах химиопрепаратов является конечная направленность на повреждение генома опухолевых клеток. Принято считать, что такое повреждение реализуется в процессе клеточного деления либо путем прямого взаимодействия с ДНК, либо через ферменты, ответственные за синтез и функцию ДНК (рис. 9.14).

Рис. 9.14. Общая схема механизмов и мест действия противоопухолевых химиопрепаратов [Гершанович И.Л. и соавт. 1999].
Наиболее уязвимой для действия цитостатиков является фаза S, ряд препаратов влияют преимущественно на фазу М, G2. Препараты, действующие на данные фазы цикла, образуют группу фазоспецифических (зависимых).
Часть препаратов действуют на G1 и/или на все фазы цикла — фазонеспецифические (независимые) — действие проявляется одновременно в разных фазах клеточного цикла. И, наконец, есть группа цитостатиков, действие которых не зависит от клеточного цикла — цикл-независимые (рис. 9.15).

Рис. 9.15. Механизм действия химиопрепаратов с учетом фаз клеточного цикла опухоли [Хайленко В.А. и соавт., 2005].
В таблице 9.4 приведены наиболее типичные примеры цитостатиков с различным действием на фазы клеточного цикла.
Таблица 9.4. Некоторые фазово-зависимые, фазово-независимые (цикл-зависимые) и цикл-независимые химиопрепараты. 
Однако подобный механизм не обеспечивает истинную избирательность противоопухолевого действия, поскольку уязвимыми для поражения онколитиками являются не только злокачественные, но и пролиферирующие клетки нормальных тканей. К сожалению, терапевтическая широта их, т.е. интервал между лечебной и токсической дозой у практических всех препаратов небольшой.
В этом состоит суть ограниченности (дозолимитированности) возможностей химиотерапии цитостатиками. Это обуславливает необходимость постоянного учета фармакологии, механизма, спектра действия и особенностей токсического эффекта противоопухолевых препаратов.
Необходимо указать, что для каждой группы цитостатиков свойственны специфические особенности в механизмах действия.
Угляница К.Н., Луд Н.Г., Угляница Н.К.
1. После радикального лечения злокачественных опухолей больным не показаны следующие физиопроцедуры .
+ контрастный душ (чередование холодного и горячего)
+ УФО, солнечные ванны
2. Рак (карцинома) - это злокачественная опухоль, развивающаяся из .
3. Признаки паллиативной операции при раке .
+ опухоль удалена, отдельные МТS остались для воздействия на них химиопрепаратами
– радикальное удаление опухоли, не имеющей метастазов
– ликвидация осложнений опухоли без ее удаления
4. Рост рака с инфильтрацией стенки органа называется .
– экзофитный с экстраорганным ростом
5. Опухоль любых размеров с отдаленными MTS относится к .
6. Внутриэпителиальный неинвазивный рак обозначается .
7. Наличие предопухолевых морфологических изменений в тканях называется .
8. К цитологическому методу относятся исследования .
9. Карцинома in situ это .
– ранний инвазивный рак
10. Средства, применяемые с целью антибластики .
– хлоргексидина водный раствор
+ интраоперационная лучевая терапия
11. Больной с полипозом желудка (предрак) относится к клинической группе .
12. К методам биопсии относятся .
+ пункция толстой иглой с забором тканей (трепанобиопсия)
+ эндоскопическое взятие кусочка тканей щипком
+ иссечение кусочка тканей
13. Признаки злокачественной опухоли .
14. Облигатным предраком является .
– неспецифический язвенный колит
+ полипоз толстой кишки
– фиброаденома молочной железы
– хроническая язва желудка
15. Неизлечимый онкологический больной называется .
16. Опухолью Крукенберга называется .
+ метастазы в яичники
– опухоль головного мозга
– метастазы в пупок
17. Воздействие сфокусированного лазерного луча на опухоль приводит к ее .
18. Символ, обозначающий гистологический критерий глубины прорастания опухоли в стенку полого органа .
19. Абластика во время операции включает .
– обработку раны спиртом
+ частую смену инструментария и белья
+ неоднократное мытье рук во время операции
+ не травмировать опухоль во время операции
+ не проводить разрезы вблизи опухоли
20. Рентгенологические признаки рака органов желудочно-кишечного тракта .
21. Учреждение, где содержатся инкурабильные онкологические больные для подъема их душевного состояния и ухода, называется .
22. Боль при раке обычно возникает при .
+ прорастании всех слоев органа
+ инфильтрации нервных стволов
+ обтурации просвета органа
+ прорастании в окружающие органы
23. К неэпителиальным опухолям относятся .
24. Клиническая группа, к которой следует отнести больного с нерезектабельной опухолью .
25. Символ, обозначающий невозможность оценить размеры и распространенность опухоли .
26. Наличие метастазов в одном или нескольких регионарных лимфоузлах обозначается .
27. При использовании электроножа опухолевые клетки погибают при температуре .
28. Больного с опухолью прямой кишки 2 стадии из-за выраженной легочно-сердечной недостаточности решено не оперировать. Это состояние больного оценивается как .
29. Инфильтрирующая опухоль с одновременным ростом в просвет органа называется .
30. Заболевания, относящиеся к факультативному предраку .
+ одиночные полипы желудочно-кишечного тракта
+ дискератозы, хронические язвы
+ хронические воспалительные заболевания
– полипоз толстой кишки
31. Принцип зональности при удалении опухоли предусматривает .
– удаление опухоли в пределах неизмененных тканей
– удаление всего пораженного опухолью органа
+ одновременное удаление опухоли и регионарных лимфатических узлов
32. Химиопрепараты, тормозящие деление раковых клеток называются .
33. Опухоли из эмбриональных остатков .
34. Цитологическим называется исследование .
– быстрое по сроку
+ клеточного состава тканей
– морфологических изменений ткани
35. Удалимая опухоль называется .
36. Вирховским метастазом называется МТS в .
37. Симптоматические операции .
+ формирование колостомы при нерезектабильной стенозирующей опухоли толстой кишки
– резекция кишки со стенозирующей опухолью при оставлении отдаленных MTS для воздействия на них химиопрепаратами
– резекция кишки со стенозирующей опухолью без MTS
+ формирование гастростомы при неудалимой стенозирующей опухоли пищевода
38. Символ, обозначающий метастазы в регионарные лимфоузлы второго порядка .
39. Характеристика симптоматической операции .
– опухоль удалена, MTS остались для воздействия на них химиопрепаратами
+ ликвидация осложнения опухоли без ее удаления
– удаление опухоли, метастазирования нет
40. Биопсия это исследование .
– клеточного состава тканей
+ структурных изменений ткани
41. Срочного радикального хирургического лечения требуют .
+ ранний инвазивный рак
42. Название операции по поводу опухоли, которая после ревизии оказалась неудалимой .
43. Из перечисленных опухолей злокачественной является .
44. MTS в отдаленные лимфоузлы обозначается .
45. Эффект криодеструкции при лечении опухолей достигается .
– испарением внутриклеточной жидкости
+ кристаллизацией воды и солей в клетке
+ разрывом клеточных мембран
46. Клиническая группа, к которой будет отнесен больной, перенесший радикальную операцию .
47. Признаки раковой интоксикации .
+ потеря массы тела
48. Если диагноз рака установлен только по клиническим данным, то это обозначается (надежность) символом .
49. Допустимые физиотерапевтические процедуры у больных, перенесших радикальное лечение по поводу злокачественной опухоли .
+ электростимуляция нервов, мочевого пузыря
50. Отдаленные метастазы определить невозможно. Это обозначается символом .
51. Препараты, действующие на обмен веществ в раковой клетке .
52. Возможные пути распространения опухолей .
53. Символ, обозначающий глубину прорастания опухоли, если она захватывает слизистый, подслизистый и мышечный слои .
54. Обозначение опухоли при невозможности оценить ее размеры .
55. Символ, обозначающий отсутствие отдаленных метастазов .
56. Показание к санаторному лечению больных, закончивших специальное лечение по поводу злокачественной опухоли .
+ после радикального лечения при удовлетворительном или хорошем состоянии
– после радикального лечения с наличием выраженных изменений со стороны крови
– лучевое поражение кожи
– язвы, свищи после радикального хирургического лечения
57. Предрасположенность к развитию рака без морфологических и клинических признаков называется .
– ранний инвазивный рак
58. Из перечисленных опухолей доброкачественной является .
59. Принципы абластики .
+ профилактика распространения раковых клеток в зоне операции
– уничтожение оставшихся после операции раковых клеток в зоне вмешательства
60. Онкологического больного с множественными метастазами решено не оперировать. Это состояние оценивается как .
61. Эпителиальными опухолями являются .
62. Добавочные, рудиментарные и дистопированные органы являются предраком .
63. Символ, обозначающий степень достоверности диагноза в зависимости от использованных методов диагностики .
64. Для прединвазивного рака характерно .
+ атипизм эпителия, сохраненность базальной мембраны клеток
– атипизм эпителия, базальная мембрана клеток нечеткая
– опухоль до 2 см без MTS
65. Укажите опухоли происходящие из мышечной ткани .
66. Местные признаки рака .
+ отсутствие четких границ
67. Вид биопсии, если для гистологического исследования удален один из увеличенных лимфоузлов паховой области .
68. Орган в который чаще всего происходит метастазирование опухолей разной локализации .
69. Надежность диагноза злокачественной опухоли, установленного на основании специальных диагностических методов, обозначается символом .
70. Операция, при которой выполнена резекциия органа в пределах здоровых тканей с удалением регионарных лимфоузлов, называется .
71. Для карциномы in situ характерно .
– поражение клеточной базальной мембраны
+ целостность мембраны клеток
– неизмененная структура эпителия
72. Морфологические признаки раннего инвазивного рака .
– целостность клеточной мембраны
– неизмененность структуры эпителия
+ поражение базальной клеточной мембраны
73. Метастазирование не наступает при .
+ карциноме in situ
– раннем инвазивном раке
– раке первой стадии
74. Предрак характеризуется .
+ морфологическими изменениями тканей без атипизма клеток
+ наличием клинических признаков предракового заболевания
– отсутствием клинических признаков заболевания
75. При предрасположенности к раку характерно .
+ изменение гормонального фона
– наличие предраковых заболеваний
76. Предрак рано или поздно перерождающийся в рак называется .
77. Деструктивные изменения в опухоли полого органа, могут сопровождаться .
+ улучшением проходимости просвета органа
+ кровотечением из пораженного органа
78. Безконтрастные рентгенологические исследования .
+ рентгенография грудной клетки
79. При контрастном рентгенологическом исследовании полых органов для злокачественной опухоли характерно .
+ деформация (неровность контуров)
+ нарушение просвета (дефект наполнения)
– конвергенция складок слизистой оболочки
– 'ниша' вне контура органа
80. При безконтрастном рентгенологическом исследовании паренхиматозных органов для рака характерно .
+ затенение с нечеткими контурами
– затенение с четкими контурами
81. Абсолютный эндоскопический признак опухоли полых органов .
+ объемное образование в просвете органа ('плюс' ткань)
82. Клинико-морфологические признаки злокачественной опухоли .
– экспансивный медленный рост
83. Доброкачественная опухоль из эпителиальной ткани .
84. Злокачественная опухоль из эпителиальной ткани .
85. Злокачественная опухоль из соединительной ткани .
86. Доброкачественная опухоль из соединительной ткани .
87. Врожденная опухоль, состоящая из отдельных органов или их частей .
88. Для доброкачественной опухоли не характерно .
– сдавление окружающих органов и тканей
+ прорастание в подлежащие ткани
+ рецидив после радикальной операции
89. Доброкачественные опухоли мягкой консистенции .
+ полипы слизистых оболочек
90. Доброкачественные опухоли твердой консиситенции .
91. Деревянистая плотность характерна для .
92. При прорастании опухоли в подлежащие ткани исчезает ее подвижность .
93. Лимфоузел, пораженный метастазами .
+ спаян с окружающими тканями
94. Злокачественные клетки от нормальных отличают .
95. Аденокарциномы, злокачественные опухоли, происходящие из .
+ эпителия с железистым компонентом
96. Саркома происходит из .
– эпителия с железистым компонентом
97. У женщин наиболее часто рак развивается в .
98. Метастазирование в кости наиболее характерно для рака .
99. Прямая инвазия опухоли осуществляется .
100. Имплантационное метастазирование характеризуется распространение опухоли по .
101. По лимфатическим путям метастазирование происходит .
+ в регионарные лимфоузлы
+ в отдаленные лимфоузлы
– в отдаленные органы
– по серозным оболочкам
102. Распространение опухоли по серозным оболочкам происходит.
103. Гематогенным путем метастазирование наступает в .
104. Рецидив опухоли - это появление опухоли .
+ на прежнем месте
– в регионарных лимфоузлах
– в отдаленных лимфоузлах
– в отдаленных органах
105. При злокачественных опухолях стадия О обозначается .
106. 1 стадия злокачественной опухоли обозначается .
107. Спровоцированная подвижность опухоли возникает при .
– изменением положения больного
108. Абластика - это .
+ недопустить оставления раковых клеток в операционной ране
– воздействие на раковые клетки оставленные в операционной ране
109. Комбинированные операции предполагают .
+ удаление органа пораженного опухолью вместе с органом, который опухоль прорастает
– удаление опухоли + лимфодиссекция
110. Самым достоверным методом подтверждающим диагноз злокачественной опухоли является исследование .
111. Биопсия, при которой для исследования удаляют поверхностную часть опухоли называется .
112. Если для гистологического исследования полностью удаляют опухоль, то такая биопсия называется .
113. Радикальное лечение опухоли предполагает .
– высокий риск рецидива
114. Воздействие на опухоль и регионарные лимфоузлы достигается применением .
115. На области отдаленного метастазирования воздействуют проведением .
116. Иммуномаркеры опухолей используют для .
+ дополнения к гистологической диагностике
+ отбора лиц с высоким риском онкозаболеваний
+ контроля проводимого лечения
+ прогнозирования рецидива опухоли
– основного метода диагностики онкозаболеваний
Дата добавления: 2015-04-19 ; просмотров: 2975 . Нарушение авторских прав
В настоящее время существует более сотни препаратов для химиотерапии рака (химиопрепаратов). Они различаются по химической структуре и механизмам действия, благодаря этому врач-химиотерапевт может подобрать наиболее оптимальное сочетание препаратов для конкретного пациента, в зависимости от типа, стадии рака и других факторов.
Как работают химиопрепараты?
Несмотря на разные механизмы действия, все химиопрепараты работают в одном направлении: они нарушают клеточный цикл, останавливают размножение раковых клеток и вызывают их гибель.
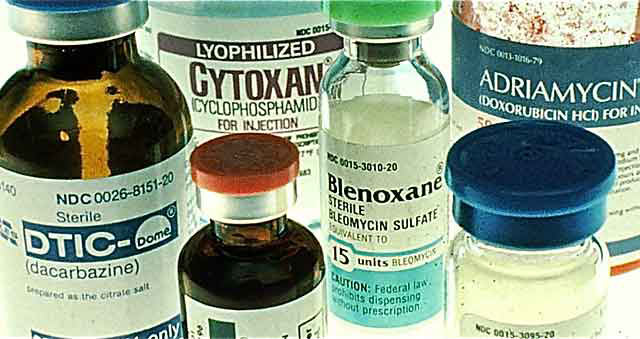
За счет того, что опухолевые клетки быстро размножаются, они представляют собой идеальную мишень для химиотерапии. Но под удар, хотя и в меньшей степени, попадают и здоровые клетки организма. Сильнее всего страдают органы, в которых наиболее интенсивно происходят процессы клеточного деления: красный костный мозг, кожа (в том числе волосы и ногти), слизистые оболочки (ротовая полость, кишечник). Химиопрепараты обладают многочисленными побочными эффектами, справиться с ними помогает специальная поддерживающая терапия.
Противопоказания к химиотерапии
Несмотря на потенциальную пользу, которую способны принести химиопрепараты, некоторым пациентам они противопоказаны из-за высокого риска тяжелых побочных эффектов. К основным противопоказаниям относят тяжелую тромбоцитопению, острые инфекции с высокой температурой, тяжелые нарушения со стороны сердечно-сосудистой системы, легких, печени, почек, первый триместр беременности, перенесенные серьезные операции, пожилой возраст, сильное истощение.
Перед началом курса химиотерапии врач должен тщательно оценить состояние пациента, выявить имеющиеся у него проблемы со здоровьем и связанные с ними потенциальные риски.
Противопоказания к применению противоопухолевых препаратов бывают не только абсолютными, но и относительными. Химиотерапию проводить можно, но только с соблюдением некоторых условий:
- Снизить дозы, подобрать препараты, которые наиболее безопасны.
- Использовать один препарат химиотерапии вместо комбинации из двух и более.
- Перед началом курса провести лечение и устранить имеющиеся проблемы со здоровьем.
- Выждать некоторое время, например, после перенесенной операции или пока не стихнет инфекция.
В каждом случае требуется индивидуальный подход.
Типы химиопрепаратов
Препараты для химиотерапии делят на группы, в зависимости от химической структуры и механизма действия. Один и тот же препарат может работать разными способами и относиться к разным группам. Зная, к какой группе относится химиопрепарат, врач может прогнозировать лечебные и побочные эффекты, правильно спланировать курс лечения.

Традиционно противоопухолевые препараты делят на две группы:
- Цитостатические (цитостатики) останавливают размножение раковых клеток и запускают в них процесс запрограммированной клеточной смерти — апоптоз. К этой группе относят, в частности, фторурацил, цисплатин, доксорубицин.
- Цитотоксические (цитотоксины) повреждают ядро, оболочку и другие компоненты клетки, приводят к её гибели.
Также в настоящее время существуют таргетные препараты, которые нарушают жизнедеятельность и размножение опухолевых клеток путем воздействия на определенные молекулы-мишени, и иммунопрепараты, которые задействуют ресурсы противоопухолевого иммунитета.
Самая старая группа средств для химиотерапии. Они так названы потому, что могут алкилировать различные молекулы, включая ДНК, РНК и белки. Препарат связывается с молекулой ДНК и приводит к ее разрыву во время удвоения в процессе деления клетки. В итоге запускается процесс запрограммированной клеточной гибели — апоптоз.
Алкилирующие агенты атакуют клетки на любой стадии клеточного цикла. Химиотерапия данными средствами эффективна при многих типах рака: легких, яичников, молочной железы, а также при саркомах, множественных миеломах, болезни Ходжкина, лимфоме, лейкемии.
Представители группы: цисплатин, карбоплатин, дакарбазин, хлорамбуцил, оксалиплатин, темозоломид.
Представители группы: 5-фторурацил, 6-меркаптопурин, капецитабин, гемцитабин, метотрексат.
Напоминают антибактериальные препараты, которые используются для лечения инфекций. Эти химиопрепараты повреждают ДНК опухолевых клеток и нарушают их размножение. Существуют разные группы антибиотиков для химиотерапии, одна из них — антрациклины. Эти препараты нарушают функции ферментов, которые необходимы для удвоения ДНК.
Представители антрациклинов: доксорубицин (адриамицин), эпирубицин, даунорубицин, идарубицин.
Представители противоопухолевых антибиотиков, не являющихся антрациклинами: блеомицин, митоксантрон, митомицин-С, актиномицин D.
Представители группы: топотекан, иринотекан, этопозид, тенипозид, митоксантрон.
Средства для химиотерапии из этой группы имеют растительное происхождение. Они блокируют деление клеток, нарушая функцию микротрубочек и некоторых белков-ферментов. Ингибиторы митоза применяют для лечения рака молочной железы, легких, миеломы, лимфомы, лейкозов.
Представители группы: доцетаксел, паклитаксел, винбластин, винкристин.
Первые ингибиторы митоза из этой группы — винбластин и винкристин — были выделены из растения барвинок розовый (Vinca rosea). Затем на основе винбластина были созданы полусинтетические соединения для химиотерапии — винорелбин и виндезин. Основной механизм действия этих препаратов состоит в том, что они связывают с белком тубулином в составе микротрубочек и не дают ему полимеризоваться. Деление клеток останавливается.
Также винкаалкалоиды нарушают другие клеточные процессы: изменяют обмен аминокислот и некоторых других веществ, влияют на синтез нуклеиновых кислот, жиров, клеточное дыхание.
Эти препараты начали широко применяться для химиотерапии с 90-х годов прошлого столетия. Первым был получен 1960-х годах паклитаксел из экстракта тихоокеанского тиса (Taxus brevifolia). В 1980-х годах из экстракта хвои европейского тиса (Taxus baccata) удалось выделить более мощный препарат — доцетаксел.
Таксаны тоже влияют на микротрубочки, но не так, как винкаалкалоиды. Они, напротив, ускоряют полимеризацию тубулина, впоследствии препятствуют его деполимеризации и распаду микротрубочек. Из-за этого также нарушается деление клеток.
Глюкокортикостероиды, или глюкокортикоиды, представляют собой препараты гормонов коры надпочечников. Они обладают многими функциями, в частности, принимают участие в регуляции обмена веществ, подавляют иммунные реакции и воспаление. Также эти препараты обладают противоопухолевыми свойствами. Иногда глюкокортикоиды используют для поддерживающей терапии. Они помогают устранить вызванную противоопухолевыми препаратами тошноту и рвоту, предотвратить аллергические реакции.
Представители группы: метилпреднизолон, преднизон, дексаметазон.
Некоторые химиопрепараты не входят ни в одну группу и обладают собственными механизмами действия. Например, ингибитор протеосом бортезомиб, фермент L-аспарагиназа.
Принципы применения препаратов для лечения рака
Для того чтобы обеспечить необходимую эффективность химиотерапии, нужно придерживаться некоторых правил:
Обычно дозировку химиопрепаратов рассчитывают, основываясь на площади поверхности тела или весе пациента. Также нужно учитывать общее состояние здоровья, сопутствующие заболевания.
- Подкожные и внутримышечные инъекции.
- Интратекально — в спинномозговую жидкость.
- Внутрибрюшинно — в брюшную полостью. При канцероматозе брюшины применяется современная методика HIPEC (гипертермическая интраперитонеальная химиотерапия), когда после удаления из брюшной полости всех крупных очагов её промывают подогретым раствором химиопрепарата, чтобы уничтожить оставшиеся мелкие очаги.
- Внутриплеврально — в плевральную полость, окружающую легкие.
- Внутриартериальная химиотерапия — непосредственно в артерию, питающую опухоль. При этом можно использовать высокие дозы химиопрепаратов: они почти не проникают в системный кровоток и не вызывают серьезных побочных эффектов.
- Введение в мочевой пузырь с помощью катетера.
Когда больному требуется лечение в течение длительного времени, в Европейской клинике применяют имплантируемые венозные порт-системы. Под кожу подшивают небольшой резервуар, одна из стенок которого представлена специальной мембраной, и соединяют его катетером с веной. В дальнейшем лекарства вводят с помощью иглы, которой прокалывают кожу и находящуюся под ней мембрану.
Эффективность препаратов, применяемых при химиотерапии
Для того чтобы судить об эффективности химиотерапии, обычно нужно провести не менее 2–3 циклов лечения. Затем выполняют исследования, которые помогают визуализировать и измерить опухоль, проводят анализы на онкомаркеры. Возможен один из четырех результатов:
- Полный ответ. Опухоль исчезла, уровень онкомаркера снизился и находится в пределах нормы.
- Частичный ответ. Опухоль уменьшилась, уровень онкомаркера при этом также может снизиться.
- Стабильное состояние: размеры и количество опухолей, уровень онкомаркера не изменились.
- Прогрессирование на фоне лечения: опухоль продолжает расти, появляются новые очаги, уровень онкомаркера повышается.
Если лечение эффективно, его продолжают по прежней схеме. В противном случае комбинации химиопрепаратов нужно менять.
Побочные эффекты применения химиопрепаратов
Химиотерапия вызывает различные побочные эффекты. Симптомы могут возникать спустя некоторое время после начала лечения и даже по завершении курса. Одни из них быстро проходят, другие сохраняются в течение длительного времени. Степень их выраженности тоже бывает разной, это зависит от многих факторов, таких как возраст, состояние здоровья пациента, тип, доза и способ введения химиопрепарата, параллельный прием других лекарств.
Врачи в Европейской клинике назначают поддерживающее лечение, которое помогает справиться с большинством побочных эффектов и комфортно пройти курс химиотерапии. Больной получает подробные рекомендации по поводу образа жизни, ему рассказывают, при возникновении каких симптомов нужно срочно обратиться к врачу.
Вы можете подробно узнать о возможных побочных эффектах химиопрепаратов на этой странице.
Что такое персонализированная химиотерапия?
За последние годы подходы к классификации злокачественных опухолей несколько изменились. Раньше ученые могли лишь рассматривать раковые клетки под микроскопом, сейчас появилась возможность изучать их молекулярно-генетические характеристики. Клетки могут выглядеть одинаково, но иметь разный набор изменений в генах. В них вырабатываются разные вещества, которые по-разному помогают им выживать, размножаться, защищаться от агрессии иммунитета.
Сейчас молекулярно-генетические исследования, которые помогают назначить персонализированную химиотерапию, доступны далеко не в каждой клинике. Но за ними — будущее онкологии.
Большие надежды современные ученые и врачи-онкологи возлагают на иммунопрепараты. Эти лекарственные средства используют возможности иммунной системы, чтобы уничтожать раковые клетки.
Развитие онкологии не останавливается. Ученые продолжают работать над созданием новых противоопухолевых препаратов. Некоторые лекарства сейчас проходят клинические испытания. К сожалению, создание и проверка новых препаратов — процесс долгий и недешевый. Тем не менее, прогресс есть, а значит, есть и надежда для онкологических больных.
Препараты для восстановления после химиотерапии
Как мы уже упоминали, химиопрепараты атакуют не только опухолевые, но и здоровые клетки. После курса лечения в той или иной степени могут пострадать разные органы. Это неизбежное зло, с которым приходится мириться, чтобы уничтожить раковые клетки.
Для более быстрого и полноценного восстановления после химиотерапии каждый пациент получает индивидуальную программу лечения. В первую очередь усилия направлены на восстановление состава крови, нормализацию работы печени, почек, сердца, борьбу с депрессией и другими психоэмоциональными проблемами.
Читайте также:

