Фталевая кислота с хлором
Карбоновые кислоты
Дикарбоновыми кислотами называются производные углеводородов, содержащие две карбоксильные группы в составе молекулы. Химические и физические свойства дикарбоновых кислот сильно зависят от количества атомов в цепи, разделяющих карбоксильные группы. Так, кислотность возрастает при их сближении, т.к. карбоксилы оказывают друг на друга отрицательный индуктивный эффект. Те соединения, в которых карбоксильные группы разделены более чем двумя атомами углерода, напоминают по свойствам уксусную кислоту.
Номенклатура
Нумерация атомов цепи, как и для обычных кислот, проводится таким образом, чтобы карбоксильные группы получили наименьшие номера.
Щавелевая кислота
Основной способ получения щавелевой (этандиовой) кислоты заключается в пиролизе формиата натрия. При этом происходит гомолитический разрыв связи С-Н и последующая рекомбинация образующихся анион-радикалов.
Щавелевая кислота обладает более высокой кислотностью, чем уксусная. Это связано с акцепторным влиянием одной карбонильной группы на другую. Вторая константа ионизации уже не сильно отличается от обычных алифатических кислот, т.к. карбоксилатная группа акцепторными свойствами не обладает. Щавелевая кислота вступает в характерные для карбоновых кислот превращения, например, образует сложные эфиры и амиды.
Симметричный хлорангидрид щавелевой кислоты оксалилхлорид является весьма активным соединением, и имеет склонность к реакциям, сопровождающимся разрывом связи С-С. Его применяют для хлоркарбонилирования органических соединений.
Под действием сильных протонных кислот щавелевая кислота разлагается с образованием окиси и двуокиси углерода.
Малоновая кислота
Малоновую (пропан-1,3-диовую) кислоту обычно синтезируют из хлоруксусной: сначала действием цианид-ионом ее переводят в циануксусную, затем проводят гидролиз, либо алкоголиз в кислой среде. В первом случае получается собственно малоновая кислота, а во втором – ее диэтиловый эфир.
Малоновая кислота и ее эфир обладают свойствами, которые присущи β-дикарбонильным соединениям, поэтому химия этих соединений более многогранна, нежели свойства простых кислот. Рассмотрим их поведение подробнее.
Свойства малоновой кислоты
Малоновая кислота и ее производные в большей степени, чем многие другие кислоты, склонна к декарбоксилированию и этим она сильно напоминает ацетоуксусную. Декарбоксилирование малоновой кислоты, как и ацетоуксусной, протекает по пути электроциклической реакции в шестичленном 6π-электронном переходном состоянии, в котором облегчена миграция электронных пар и элиминирование СО2.
Наличие β-дикарбонильного фрагмента в молекуле приводит к тому, что малоновая кислота может выступать не только как ОН-, но и как СН-кислота (образует енолят-анион). Это делает возможной электрофильную атаку α-углеродного атома в щелочной среде; например, для малоновой кислоты характерна конденсация с оксосоединениями, в первую очередь с ароматическими альдегидами – разновидность реакции Кневенагеля.
Образующаяся в результате арилиденмалоновая кислота неустойчива и очень легко декарбоксилируется, давая соответствующие коричные кислоты в качестве основных продуктов.
Свойства малонового эфира
Малоновый эфир, или диэтилмалонат способен под действием оснований давать исключительно енолят-анион, поэтому его активность по отношению к электрофилам выше. Сильные основания, такие как этилат натрия (магния), металлоорганические соединения и т.д., нацело депротонируют малоновый эфир. Полученные таким образом металлические производные по метиленовой группе находят широкое применение в синтезе, т.к. легко алкилируются и ацилируются а образующиеся при этом замещенные малоновые эфиры можно подвергать гидролизу и декарбоксилированию, получая разнообразные ценные продукты. Здесь просматривается прямая аналогия с синтезами на основе ацетоуксусного эфира (кетонное расщепление). См. главу Производные кислот, ацетоуксусный эфир.
Так, с помощью натриймалонового эфира можно синтезировать разнообразные карбоновые кислоты.
Если на первой стадии проводить ацилирование, то после расщепления могут быть получены кетоны сложного строения. Происходит двукратное декарбоксилирование, которое возможно благодаря тому, что вначале образуется β-кетокислота, которая, как известно, без труда декарбоксилируется при небольшом нагревании.
Если требуется получить замещенные янтарные кислоты, на натриймалоновый эфир действуют молекулярным иодом. При этом сначала в результате сшивания метиновых С-атомов двух молекул натриймалонового эфира возникает эфир тетракарбоновой кислоты. Последний при гидролизе и декарбоксилировании дает янтарную кислоту.
Малоновый эфир, являясь 1,3-бисэлектрофилом, находит широкое применение и в синтезе гетероциклических соединений. Например, реакция с мочевиной в щелочной среде дает 2,4,6-пиримидинтрион – барбитуровую кислоту, которая ранее по своиму происхождению называлась малонилмочевиной.
Янтарная кислота
Янтарную (бутандиовую) кислоту синтезируют по методологии, которая аналогична вышеизложенной для получения малоновой. В качестве исходного соединения используют 1,2-дибромэтан. Гидролиз нитрильных групп проводится в щелочной либо кислой среде.
Янтарная кислота проявляет характерные свойства карбоновых кислот – образует сложные эфиры со спиртами, амиды, хлорангидрид и другие функциональные производные.
Вместе с тем, четырехуглеродная цепь молекулы обусловливает определенные особенности химических свойств. Поскольку янтарная кислота является 1,4-бисэлектрофилом, ее взаимодействие с нуклеофилами может приводить к образованию циклов. Действительно, она весьма легко превращается в циклический ангидрид при обработке водоотнимающими средствами и даже при нагревании.
Янтарный ангидрид, как и другие ангидриды карбокислот, взаимодействует с нуклеофилами. Если ацилирование спиртов приводит к полным эфирам янтарной кислоты, то реакция янтарного ангидрида с аммиаком дает циклическое азотистое производное – сукцинимид, находящий широкое применение в тонком органическом синтезе.
Благодаря наличию двух электроноакцепторных карбонильных групп по соседству с атомом азота NH-связь в молекуле сукцинимида сильно поляризована, и легко диссоциирует под действием оснований. Образующийся при этом анион является активным нуклеофилом, и реагирует с разнообразными положительно заряженными частицами. Взаимодействие сукцинимида с галогенами (хлор, бром) приводит к соответствующим N-галогенпроизводным – N-бромсукцинимиду (NBS) и N-хлорсукцинимиду (NCS).
Эти соединения широко используются в органическом синтезе в качестве эффективных галогенирующих реагентов. NBS и NCS склонны к гомолитической диссоциации с высвобождением радикалов галогена, поэтому применяются именно для свободно-радикального галогенирования, в первую очередь, боковых цепей ароматических соединений, а также α-углеродного атома алкилкетонов.
Фталевая кислота
Фталевая кислота – тривиальное название 1,2-бензолдикарбоновой кислоты. Ее получают окислением нафталина в жестких условиях.
В промышленности находит применение также каталитическое окисление орто-ксилола в аналогичных условиях.
Находящиеся по соседству карбоксильные группы придают фталевой кислоте некоторые свойства, нехарактерные для других дикарбоновых кислот. Так, в зависимости от условий, фталевая кислота образует два различающихся по структуре изомерных хлорангидрида.
Внутренний ангидрид фталевой кислоты, как и янтарный, в реакции с аммиаком дает циклический амид (фталимид), соединение которое используют для получения первичных алкиламинов (синтез Габриэля). Калиевая или натриевая соль фталимида, взаимодействуя с алкилгалогенидом или другим алкилирующим реагентом, превращается в соответствующий N-алкилфталимид. Последний вводят в реакцию с более мощным нуклеофилом – гидразином, в результате чего происходит переацилирование и выделяется первичный амин. Основным фактором, смещающим равновесие последней реакции вправо, является образование устойчивого ароматического гетероцикла – фталазин-1,4-диона (фталогидразида).
Для разложения N-алкилфталимида с целью получения алкиламина можно также применить гидролиз в кислой среде, но этот путь менее эффективен.
Хлорангидрид - фталевая кислота
Хлорангидрид фталевой кислоты ( фталилхлорид) способен реагировать как нормально ( в соответствии со структурой хлорангидрида), так и, в некоторых случаях, в соответствии с изомерной ему ( таутомерной. [1]
Хлорангидрид фталевой кислоты ( фталилхлорид) способен реагировать как нормально ( в соответствии со структурой хлорангидрида), так и, в некоторых случаях, в соответствии с изомерной ему ( таутомерией. [2]
Хлорангидрид фталевой кислоты также ведет себя аномально. Вместо ожидаемых о-дикетонов обычно получаются изомерные диарилфталиды. [3]
Реакция хлорангидрида фталевой кислоты со вторичными диаминами протекает с образованием высокомолекулярных полимеров. [4]
Аналогично хлорангидриду фталевой кислоты в условиях реакции Фриде-ля - Крафтса ведет себя и хлорангидрид о-бензоилбензойной кислоты. [5]
Фталилхлорид ( хлорангидрид фталевой кислоты ) получается действием на фталевую кислоту пятихлористого фосфора. Здесь наблюдается замечательный случай таутомерии, связанной с перемещением атомов не водорода, а хлора. [6]
При взаимодействии симметричного хлорангидрида фталевой кислоты с фенолами и хлористым алюминием всегда получаются несимметрично построенные производные, потому что фталилхлорид под влиянием хлористого алюминия сначала перегруппировывается в изомерную форму. [7]
ФТАЛИЛХЛОРИД ( фталоилхлорид, хлорангидрид фталевой кислоты ) о - СвН4 ( СОС1) 2, мол. [8]
При использовании некоторых образцов хлорангидрида фталевой кислоты вследствие присутствия в веществе неизвестных примесей первые несколько капель дестиллата оказываются окрашенными в красноватый цвет. В тех случаях, когда приходилось прерывать перегонку и впускать в систему воздух, было замечено, что при возобновлении операции наблюдается аналогичное явление. [9]
Согласно указаниям авторов, исходя из хлорангидрида фталевой кислоты ( 1 моль хлорангидрида на 1 моль одноосновной кислоты и 2 моля хлорангидрида на 1 моль двухосновной кислоты), можно получать с выходом порядка 95 % и другие хлорангидриды. При взаимодействии большинства кислот и их ангидридов с хлор-ангидридом фталевой кислоты применение хлористого цинка в качестве катализатора не является обязательным. [10]
При нагревании либо высокоплавкой или же низкоплавкой формы хлорангидридов фталевой кислоты достигается равновесие. [11]
Особый случай перемещения галогена имеет место при превращении обычного хлорангидрида фталевой кислоты в так называемый несимметричный хлорангидрид. Способ, при помощи которого может быть осуществлен этот переход, по Отту, приведен в Синт. [12]
В 1929 г. Карозерс и Арвин [2] синтезировали полиэтиленфталат из эти-ленгликоля и хлорангидрида фталевой кислоты . Вагнер [3] получил полиэфиры из ряда хлорангидридов дикарбоновых кислот и диолов, например из хлорангидрида фталевой кислоты и резорцина, хлорангидрида адипиновой кислоты и 4 4 -диоксидифенил - 2 2-пропана. [13]
Присадка сантопур получается конденсацией хлоропроиа-водных парафина с фенолом и этерификацяей полученного алкил фенола хлорангидридом фталевой кислоты . [14]
Хлорангидриды кислот, например фосген, а также хлористый оксалил, хлористый бензоил, хлорангидрид фталевой кислоты , реагируют с диметиланилином совершенно аналогично. [15]
ФТАЛЕВАЯ КИСЛОТА (1,2-бензолдикарбоновая к-та, 0-фталевая к-та), мол. м. 166,14; бесцв. кристаллы; т. пл. 211 0 C (с разл.); 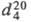
1,593; 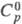
кДж/(кг·К):0,808 (-73 0 C), 1,047 (0 0 C), 1,114 (20 0 C); 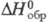
-783,02 кДж/моль, 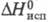
98,46 кДж/моль, DН 0 пл 52,37 кДж/моль, DН 0 сгор -3224 кДж/моль; 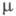
7,67·10 -30 Кл·м (25 0 C); PK 1 2,95, рК 2 5,41. Р-римость, в % по массе: в CH 3 OH 18,5 (19 0 C), C 2 H 5 OH 11,0 (19 0 C), воде 0,7 (25 0 C), 1,47 (45 0 C), 8,33 (85 0 C), 19,0 (100 0 C), диэтиловом эфире 0,68 (15 0 C), CH 3 COOH 12,0 (100 0 C), CCl 4 0,24 (28 0 C), бензоле 0,45 (28 0 C), ацетоне 2,89 (28 0 C).
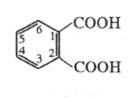
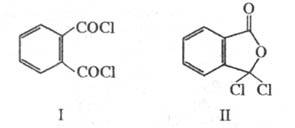
Ф талевая кислота обладает св-вами бензолполикарбоновых кислот. При нагр. или действии дегидратирующих агентов легко превра щается во фталевый ангидрид. При взаимод. с PCl 5 образует фталоилдихлорид (ф-ла I), к-рый при действии AlCl 3 перегруппировывается в изомерную несимметричную форму (П); при нагр. соед. II легко переходит в I.
В водной нейтральной среде фталевая кислота хлорируется сначала до 4-хлор-, а затем до 4,5-дихлорфталевой к-ты, при хлорировании в кислой среде дает тетрахлорпроизводное. Нитрование фталевой кислоты приводит к смеси приблизительно одинаковых кол-в 3-и 4-нитропроизводных. При 200 0 C (кат.- соли Zn, Ni, Cu) фталевая кислота декарбоксилируется до бензойной к-ты, при 350 0 C в присут. CdO - до бензола. С основаниями фталевая кислота образует соли по одной или двум карбоксильным группам, со спиртами -моно- и диэфиры; соли и эфиры фталевой кислоты наз. фталатами. Из эфиров наиб. практич. значение имеют диметилфталат и дибутилфталат. Калиевая соль фталевой кислоты при 400 0 C в присут. фталата Zn или Cd изомеризуется в соль терефталевой к-ты. При восстановлении Zn-пылью в CH 3 COOH фталевая кислота превращается в 1(ЗH)-изобензофуранон - фталид.
В природе фталевая кислота содержится в зелени и семенных коробочках мака Papaver somniferum.
В пром-сти фталевую кислоту получают в виде ее ангидрида окислением о-ксилола или нафталина (о получении см. Фталевый ангидрид).
Эфиры фталевой кислоты - бутил-, изобутил-, октил- и изооктилфтала-ты - пластификаторы полимеров, высококипящие р-рители; диметил-, диэтил- и дибутилфталаты - репелленты.
Ф талевая кислота малотоксична; ЛД 50 7,9 г/кг (мыши, перорально).
ФТАЛЕВАЯ КИСЛОТА (1,2-бензолдикарбоновая кислота, 0-фталевая кислота)
мол. м. 166,14; бесцветные кристаллы; т. пл. 211 °C ( с разл.); 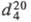
1,593; 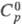
кДж/(кг∙К):0,808 ( −73 °C), 1,047 (0 °C), 1,114 (20 °C); 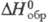
-783,02 кДж/моль, 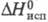
98,46 кДж/моль, DН 0 пл 52,37 кДж/моль, DН 0 сгор −3224 кДж/моль; μ 7,67∙10 −30 Кл∙м (25 °C); PK1 2,95, pK2 5,41. Растворимость, в % по массе: в CH3OH 18,5 (19 °C), C2H5OH 11,0 (19 °C), воде 0,7 (25 °C), 1,47 (45 °C), 8,33 (85 °C), 19,0 (100 °C), диэтиловом эфире 0,68 (15 °C), CH3COOH 12,0 (100 °C), CCl4 0,24 (28 °C), бензоле 0,45 (28 °C), ацетоне 2,89 (28 °C).
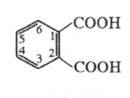
Ф. к. обладает свойствами бензолполикарбоновых кислот. При нагр. или действии дегидратирующих агентов легко превращается во фталевый ангидрид. При взаимодействии с PCl5 образует фталоилдихлорид (формула I), который при действии AlCl3 перегруппировывается в изомерную несимметричную форму (П); при нагр. соед. II легко переходит в I.
В водной нейтральной среде Ф. к. хлорируется сначала до 4-хлор-, а затем до 4,5-дихлорфталевой кислоты, при хлорировании в кислой среде дает тетрахлорпроизводное. Нитрование Ф. к. приводит к смеси приблизительно одинаковых количеств 3- и 4-нитропроизводных. При 200 °C ( кат. — соли Zn, Ni, Cu) Ф. к. декарбоксилируется до бензойной кислоты, при 350 °C в присутствии CdO — до бензола. С основаниями Ф. к. образует соли по одной или двум карбоксильным группам, со спиртами — моно- и диэфиры; соли и эфиры Ф. к. наз. фталатами. Из эфиров наиб. практич. значение имеют диметилфталат и дибутилфталат. Калиевая соль Ф. к. при 400 °C в присутствии фталата Zn или Cd изомеризуется в соль терефталевой кислоты. При восстановлении Zn-пылью в CH3COOH Ф. к. превращается в 1(ЗH)-изобензофуранон — фталид.
В природе Ф. к. содержится в зелени и семенных коробочках мака Papaver somniferum.
В промышленности Ф. к. получают в виде ее ангидрида окислением о-ксилола или нафталина (о получении см. фталевый ангидрид).
Эфиры Ф. к. — бутил-, изобутил-, октил- и изооктилфтала-ты — пластификаторы полимеров, высококипящие растворители; диметил-, диэтил- и дибутилфталаты — репелленты.
Ф. к. малотоксична; ЛД50 7,9 г/кг (мыши, перорально).
ФТАЛЕВАЯ КИСЛОТА (1,2-бензолдикарбоновая кислота, 0-фталевая кислота), молекулярная масса 166,14; бесцветные кристаллы; температура плавления 211 0 C (с различные); 
1,593; 
кДж/(кг•К):0,808 (-73 0 C), 1,047 (0 0 C), 1,114 (20 0 C); 
-783,02 кДж/моль, 
98,46 кДж/моль, DН 0 пл 52,37 кДж/моль, DН 0 сгор -3224 кДж/моль; 
7,67•10 -30 Кл•м (25 0 C); PK 1 2,95, рК 2 5,41. Растворимость, в % по массе: в CH 3 OH 18,5 (19 0 C), C 2 H 5 OH 11,0 (19 0 C), воде 0,7 (25 0 C), 1,47 (45 0 C), 8,33 (85 0 C), 19,0 (100 0 C), диэтиловом эфире 0,68 (15 0 C), CH 3 COOH 12,0 (100 0 C), CCl 4 0,24 (28 0 C), бензоле 0,45 (28 0 C), ацетоне 2,89 (28 0 C).

ФТАЛЕВАЯ КИСЛОТА к. обладает свойствами бензолполикарбоновых кислот. При нагревании или действии дегидратирующих агентов легко превра щается во фталевый ангидрид. При взаимодействие с PCl 5 образует фталоилдихлорид (формула I), который при действии AlCl 3 перегруппировывается в изомерную несимметричную форму (П); при нагревании соединение II легко переходит в I.

В водной нейтральной среде ФТАЛЕВАЯ КИСЛОТА к. хлорируется сначала до 4-хлор-, а затем до 4,5-дихлорфталевой кислоты, при хлорировании в кислой среде дает тетрахлорпроизводное. Нитрование ФТАЛЕВАЯ КИСЛОТА к. приводит к смеси приблизительно одинаковых кол-в 3-и 4-нитропроизводных. При 200 0 C (катализатор- соли Zn, Ni, Cu) ФТАЛЕВАЯ КИСЛОТА к. декарбоксилируется до бензойной кислоты, при 350 0 C в присутствии CdO - до бензола. С основаниями ФТАЛЕВАЯ КИСЛОТА к. образует соли по одной или двум карбоксильным группам, со спиртами -моно- и диэфиры; соли и эфиры ФТАЛЕВАЯ КИСЛОТА к. называют фталатами. Из эфиров наиболее практическое значение имеют диметилфталат и дибутилфталат. Калиевая соль ФТАЛЕВАЯ КИСЛОТА к. при 400 0 C в присутствии фталата Zn или Cd изомеризуется в соль терефталевой кислоты. При восстановлении Zn-пылью в CH 3 COOH ФТАЛЕВАЯ КИСЛОТА к. превращается в 1(ЗH)-изобензофуранон - фталид.
В природе ФТАЛЕВАЯ КИСЛОТА к. содержится в зелени и семенных коробочках мака Papaver somniferum.
В промышлености ФТАЛЕВАЯ КИСЛОТА к. получают в виде ее ангидрида окислением о-ксилола или нафталина (о получении см. Фталевый ангидрид).
Эфиры ФТАЛЕВАЯ КИСЛОТА к.- бутил-, изобутил-, октил- и изооктилфтала-ты - пластификаторы полимеров, высококипящие растворители; диметил-, диэтил- и дибутилфталаты - репелленты.
ФТАЛЕВАЯ КИСЛОТА к. малотоксична; ЛД 50 7,9 г/кг (мыши, перорально).
Литература см. при ст. Фталевый ангидрид. А.Г. Любарский.
Химическая энциклопедия. Том 5 >> К списку статей
Номер патента: 141149


Текст
41149 СССР АНИЕ ИЗОБРЕТЕНИЯ О ОРСКОМУ СВИД ЬСТВУ Подписная грд)гпа ЛБ Ю А. Э. Иоффе и Н, Е. МакУЧЕНИЯ ФТАЛЕВЫХ КИСЛОФОРМА Х. Е. Х ОСОБ СОчеян, Д. С, Азбел МЕСТНОГО ПО И ХЛОбря 1 Ч 60 г. аа М 661301/26 а Коган,е; но делам иаовре ения и открнтий нри Сонете Чицстров СГС;Р Заяилено 6 ок икоиано и ;Ьюгпетен аопретенийъ,Хе 18 аа 196 итп Известен способ одновременного получения терефталевой и изофталевой кислот с выделением в качестве побочного продукта хлороформа.Предлагаемый способ получения фталевых кислот и хлороформа по сравнению с известным более прост в технологическом отношении и имеет ряд других преимушеств, Особенность способа состоит в том, что изомерные бис-(трихлорацетил)-бецзолы или цх техническую смесь нагревают с водными растворами гцелочей с последуюшим выделением кислот известными приемами, Исходным сырьем для осуществления способа служит отход производства этилбензола - смесь дихлорбензолов, окисляющихся хорошо в диацетилбецзолы, которые хлорированием газообразным хлором с выходами, близкими к количественным, дают бис-(трихлорацетил)-бензолы, не требуюшие дополнительной очистки, причем в этом случае процент использования хлора возрастает в 3 раза по сравнению с применением гцпохлорита кальция по известному способу.П р и м ер 1. Смесь 5 г м-бис-(трихлорацетил)-оензола, 1,1 г гидрата окиси кальция и 40 лл воды нагревают до кипения при размешивации. Выделяющийся хлороформ отгоняют с водой и затем обычным приемом отделяют от воды. Выход хлороформа 70,2%. Реакционную смесь подкисляют концентрированной соляной кислотой до кислой реакции ца конго. Выделившуюся изофталсвую кислоту отфилыровывают, промывают водой до нейтральной реакции и высушивают при температуре 100. Температура плавления кислоты 328 - 334, Выход 92,5%.П р и м е р 2. Смесь 8 г гексахлорида м-диацетилбензола, 2,38 г гидрата окиси кальция и 30 лл воды нагревают при перемешивании до кипения. В течение 0,5 часа из реакционной смеси отгоняют хлороМ. 14114 с 9 с Предмет изобретения Способ совместного получения фталевых кислот и хлороформа, отличающийся тем, что изомерные бис-(трихлорацетил)-бензолы или их технническую смесь нагревают с водными растворами щелочей с последующим выделением кислот известными способами. Составитель описания А, В Нечайкин Редактор Н. И. Мосин Техред А. А. Камышникова Корректор О, А Савельева Формат бум. 70 Х 1081/6 Тираж 700 ЦБТИ при Комитете по делам изобретений и открытий при Совете Министров СССР Москва, Центр, М. Черкасский пер д. 2/б.Подл. к печ 18.1 ХгЛак. 9050 Типография ЦБТИ Комитета по делам изобретений и открытий при Совете Министров СССР, Москва, Петровка, 14.форм с водой, а затем отделяют хлороформ с выходом 76,8%. При подкислении концентрированной соляной кислотой реакционной массы, оставшейся после отгонки хлороформа и воды, выделяется белый осадок изофталевой кислоты, Осадок отфильтровывают, промывают водой и вь сушивают при 100. Выход кислоты 90,6%. Температура плавления 330 - 336,Пример 3. 25 г технической смеси гексахлоридов диацетилбензола, состоящей из м-изомера (70%) и изомера (30%) обрабатываот при нагревании и перемешивании водной суспензией 7,5 г гидрата окиси кальция. При отгонке получают 60,8% хлороформа. Реакционную смесь отфильтровывают, осадок кальциевой соли терефталевой кислоты и гидрата окиси кальция на фильтре промывают водой, Маточник и промывание воды соединяют и подкисляют концентрированной соляной кислотой. Выпавший осадок изофталевой кислоты отфильтровывают, промывают водой и высушивают при 100. Выход терефталевой кислоты 64,4%. Осадок, оставшийся на фильтре (соль терефталевой кислоты и гидрата окиси кальция), промывают 10%-ным раствором содь; и водой; промывные воды сцединяют и подкисляют. Выпавший осадок терефталевой кислоты отфильтровывают, промывают водой и высушивают при 00. Выход терефталевой кислоты 29,35%. Общий выход кислот 91,75%.
Заявка
Азбель Д. С, Иоффе А. Э, Мак Н. Е, Хчеян Х. Е
МПК / Метки
Код ссылки

Номер патента: 109163
. устанавливаеиной ретортой аполняют оезагннем и магр едме зооретенн Предметом изобретения является способ защиты вакуум-насосов от паров воды и кислот, выделяющихся при сепарации титановой губки, с применением ловушки, устанавливаемой между сепарационной ретортой и вяку 1 з 1-на 1 сосоь.В процессе вакуумной сепарации при магнийтермическом способе производства титана от металлического титана отделяется хлористый магний и магний; кроме того, при выкуумной сепарации, особенно в начале ее, из реакционной массы выделяются газы, которые мешают проведению процесса и портят вакуумное оборудование. К этим газам прежде всего относятся пары воды и соляной кислоты. Надежных средств защиты от этих веществ еще нет.Известный в вакуумной технике.

Номер патента: 106594
. 1 льми 1 яту н п ,151 10 н(их с(.б 51 к 1 к си 11 сргнтнч (иг Иокнслн ге (н. Этя смссь э( 311 Я 111(.,в 10ВС,11111 В(1( Т 11 Д К ньй период, н(пример, свнно( ра, при этом сама хорошо ра 1)ястс 51 В )кирс и нс требует ни( дополнительных рястворитслей И 51 Эф(1)ОВ 11 СКО) с жирными кислоН И Н С 51 Т(.М, 1 ТО, ия сырьевой базы,ПРМСН 5 НЮ ВЫСО- жнрныс кислоты, окислении пяраСпосоо пол сбн(ювой кислотытами, отличаюс целью раснпрсдля этернфикацикомолскулярныспо, учасмые прнф 11 Н и. Э(1)иры аскорбиновой кислоты с ВЫСОКОМО)СКУЙ 51)1 ЫЫ 11 ЖИРНЫМИ кислотами используются в пищевой и фармацевтической промышленности для ннгиоировяния окислительных процессов в жир(1 х, маслах, КОНЦС 11 Т)ЯТЯХ )КИРОРЯСТВОРИМЫХ ВИ- тяминов, изделиях, содср)кящих.

Номер патента: 530033
. 500 мл безводного ацетона и нагревают на водяной бане с обратным холодильником два часа. фильтрат обрабатывают бензолом, промывают смесью равных частей ацетона и бензола, Продукт высушивают надо Н ЬО, Выход 65 г (9,6%); т.пл. 133 С.Вычислено, %.С 26,91; Н 5,27; В 8,06.С 6 Н 1 0 о ВеНайдено, %: С 27,11; Н 5,04; В 7,9.Метакрилирование 1,2-4,6 -глюкозодть борной кислоты.5 ЗООЗЗ 1 т 8 Со:тавнтель Б. ЧерновРедактор Л. Герасимова Техред Н, Андрейчук Корректор С. Шекмар Заказ 5276/678 Тираж 575 Подписное ЦНИИПИ Государственного комитета Совета Министров СССР по делам изобретений и открытий 113035, Москва, Ж, Раушская наб.д,4/5Филиал ППП "Патент", г. Ужгород, ул. Проектная, 4 35 г глюкозодиборной кислоты растворяютопри -2 С в 50 мл сухого.

Номер патента: 1566699
. содержанию ндтриеной голи (11) 75 и125 мг/кг, количество деструкций слизистой желудка крыс значительно уменьшается по сравнению с жинотньгчи,получавшими препарат сравнения,такимобразом, комлекс (ортофен + ГК) является н 5,6 раза менее токсичнымвеществом, чем препарат сравнения,обладает н 4,2 рлэд большей широтойтерапевтического иротиноносиалительного действия,окдзынает менее выраженное раздражающее действие на слизистую оболочку желудка,чем последний,11 р и м е р 1. Методика испытаний иротиноноспдлительцой активности,Протиновоспдлительная активностькомплекса (ортофен+ГК) изучена намышах на днух моделях носпаления,вызвана ннепением н апоненроз стопы1 Х-ного раствора клррдгецина и 3 -ного раствора формалина н позе 0,05 мл.Животные.

Номер патента: 826219
. приготовленнал проба),подкисляют 1 мл конц.НС 1 до рН 3,5-4,(и встряхивают со 125 мл гексана .в течение 5 мин, гексановую Фракцию от -брасывают. Затем , прибавляя к пробе4 мп НС 1, доводят рН до 1,0-1,5 иэкстрагируют 2,4-Д из воды 125 млхлороформа, Хлороформный экстракт отДеляют, переноСят в колбу с оттянутымдном, хлороформ отгоняют на водянойбане досуха, к сухому остатку в колбу при перемешивании приливают 5 млраствора хромотроповой кислоты н кониентрированной серной с добавкойтреххлористой сурьмы (100 мг хромотропоной кислоты растирают н ступке с0,2 БЬС 1и растворяют н 100 млконц. НС 1). Колбу со смесью помещают Я) в термастат и выдерживают при 150 фС в течение 30 мин до появления окраски. Колбу со смесью охлаждают, осторожно.
Читайте также:

