Этиология патогенез классификация хронических лейкозов
Этиологиялейкозов многофакторна и до конца не выясне- на. Для объяснения возникновения данной патологии предложе-
ны радиационная, химическая, вирусная и генетическая теории. Каждая из них подтверждается отдельными фактами, но ни одна не может считаться универсальной в отношении всех известных видов лейкозов. В подтверждение радиационной теориисвиде- тельствуют факты повышения заболеваемости острым и хрони- ческим миелолейкозом у жителей Хиросимы и Нагасаки, у лиц принимавших участие в ликвидации последствий аварии на Чер- нобыльской атомной станции, у рентгенологов и радиологов, у детей, облученных in utero.
В эксперименте на животных показана возможность инду-
цировать лейкозы метилхлорантреном, диметилбензантраценом и др., что свидетельствует в пользу химической теориилейкогене- за. Повышена частота заболеваний острыми лейкозами у людей, имеющих длительный контакт с бензолом и летучими органиче- скими растворителями, полициклическими углеводородами, мышьяковистыми соединениями, азокрасками, алкилирующими цитостатическими препаратами (циклофосфан, миелосан, хлор- бутин). Среди химических веществ, способных вызывать разви- тие лейкоза, важная роль принадлежит бензолу, широко исполь- зуемому в промышленности. Хроническое действие бензола име-
ет место при длительном курении. Известно, что у мужчин, вы- куривающих 20 пачек сигарет в год, риск заболеть острым мие-
лоидным лейкозом в 3-4 раза выше, чем у некурящих. Кроме то- го, бензол может выступать в роли кокоанцерогена, провоцируя действие других канцерогенов, содержащихся в табачном дыме (уретан, нитрозамины и др.). Химиотерапевтические вещества, использующиеся для лечения злокачественных новообразований, также повышают риск развития лейкозов (хларамбуцил, нитро- зомочевина и др.). Эти же вещества способны вызывать хромо- сомные мутации. В развитии лейкозов человека возможно уча- стие эндогенных химических канцерогенов, в том числе произ- водных ароматических аминокислот, особенно тирозина и трип- тофана.
В основе вирусной теориилежат факты, свидетельствую-
щие о возможности вирусов вызывать лейкозы у животных –
птиц, мышей, крыс, хомячков, кошек, крупного рогатого скота. У
человека доказано вирусное происхождение лимфомы Беркитта
(вирус Эпштейна-Барр), Т-клеточного лимфолейкоза (ретровиру-
сы HTLV-I).У 25 % больных лимфогранулематозом (болезнь
Ходжкина) выделен вирус Эпштейна-Барр. Установлено, что в геноме этих вирусов существуют специфические гены, непосред- ственно отвечающие за транформацию нормальной гемопоэтиче- ской клетки в лейкозную. Эти гены получили название онкоге- нов. Гены клеток, гомологичные вирусным и активирующиеся при контакте с ним, получили название протоонкогенов. На дан- ный момент у человека установлена локализация более 60 прото- онкогенов, после взаимодействия с вирусом в них происходят то- чечные мутации и вызывают развитие лейкозов. В процессах пролиферации большую роль играет продукция онкобелков – факторов роста, кодируемых онкогенами.
Генетическая теорияимеет ряд убедительных аргументов.
Значительно увеличивают риск развития опухолей наличие гене-
тических дефектов. У больных с лейкозами часто выявляются
хромосомные и геномные мутации. Среди хромосомных мутаций
имеют наибольшее значение транслокации и делеции. У больных
хроническим миелолейкозом выявляется филадельфийская хро-
мосома, которая образуется в результате транслокации t (9;22)
части длинного плеча (q) хромосомы 22 в хромосому 9 и обрат-
ной транслокации части хромосомы 9 (онкогена abl) на хромосо-
му 22 с формированием химерного (гибридного) онкогена bcr/abl
(химерные гены – это гены, образующиеся на границе хромосом-
ных транслокаций). Продукт этого гена (тирозинкиназа) ведет к
фосфорилированию огромного количества протеинов, участвую-
щих в передаче сигнала с рецепторов клеточной мембраны к ге-
нетическому материалу ядра. Активация большого количества
различных сигнальных путей ведет к независимой от ростовых
факторов пролиферации, уменьшению адгезии клеток к стро-
мальному окружению и недостаточности апоптоза.
Известны случаи семейных лейкозов. При развитии лейкоза
у одного из близнецов у второго близнеца отмечается высокая
вероятность развития лейкозов (25%). К возникновению лейкозов
предрасполагают болезни, связанные с геномными мутациями
(болезнь Дауна, синдром Клайнфельтера, Тернера и др.). При бо-
лезни Дауна (трисомия 21) острый миелоидный лейкоз наблюда-
ется в 20 раз чаще, чем у здоровых лиц.
По-видимому, все перечисленные факторы действуют ком-
плексно, приводя к злокачественному перерождению гемопоэти-
Патогенез.В настоящее время общепризнанной является клональная теорияпатогенеза гемобластозов, согласно которой лейкозные клетки являются потомством одной мутировавшей ге- мопоэтической клетки-предшественницы. Ее доказательством яв- ляется обнаружение в кариотипе подавляющего большинства опухолевых клеток одних и тех же хромосомных аберраций.
Все теории развития лейкоза основаны на представлении о
ведущей роли онкогена, или гена, кодирующего фактор роста в
канцерогенезе. Согласно первой концепции вирусы вносят в
ции. Согласно другим представлениям все клетки содержат онко-
ген в заторможенном состоянии (протоонкоген), который активи-
руется вследствие мутаций либо эпигеномных нарушений регу-
ляции активности гена-репрессора под воздействием канцерогена
и коканцерогена, что приводит к безудержной клеточной проли-
Изменения генетической регуляции клетки лежат в основе
биохимических особенностей опухолевой ткани. В результате
репрессии одних генов прекращается синтез сопряженных с ними
ферментов, структурных белков и др., дерепрессия других ведет к
тому, что в клетке появляются новые типы белков, изоферментов.
Как правило, репрессируется выработка ферментов и белков, по-
зволяющих клетке выполнять специализированную функцию, и
активируются ферменты, которые обеспечивают клеточное деле-
Согласно современным представлениям лейкозы в развитии проходят два этапа: первый – образование доброкачественной моноклоновой опухоли и второй – формирование злокачествен- ной опухоли с признаками поликлоновой трансформации.
На первом этапе развития лейкозов появляется мутировав- шая клетка, обладающая способностью интенсивно пролифери-
ровать и давать потомство – клон. На этом этапе отсутствуют признаки полиморфизма, частично сохранена способность к дифференцировке, метастазирование в органы и ткани отсутству- ет.
На втором этапе опухоль становится поликлоновой, приоб- ретает черты злокачественной, утрачивая способность к диффе-
В формировании опухолевого клона и метастазировании опухоли большую роль играет подавление апоптоза, что обуслов- лено мутацией гена p53, контролирующего его активность. Клет- ки опухолевого клона созревают медленно, лишены способности к программированной гибели, дольше находятся в стадии проли- ферации и имеют преимущества в росте перед нормальными стволовыми элементами.
В патогенезе опухолевого роста различают 3 этапа:
§трансформация здоровой клетки в опухолевую (инициа-
Трансформация, или инициация, представляет образование клона мутировавших клеток под действием канцерогенов. Трансформация заключается в приобретении здоровой исходной клеткой способности беспредельно размножаться и ее передаче дочерним клеткам по наследству. Инициация – процесс много- стадийный. Трансформированные клетки могут оставаться в тка- ни длительное время в неактивной форме.
Вторым этапом в механизме канцерогенеза является промо-
ция (активизация). Она происходит под влиянием веществ-
промоторов или коканцерогенов (кротоновое масло и др.). До-
полнительное воздействие коканцерогенами (промоторами) при-
водит к размножению находящихся в латентном состоянии опу-
холевых клеток (моноклоновая стадия). Далее происходит рассе-
ление лейкозных клеток в костном мозге с угнетением нормаль-
ного гемопоэза. Большинство канцерогенов являются полными,
т.е. вызывают трансформации и промоцию.
Прогрессия – третий этап механизма канцерогенеза. Вслед-
ствие возникновения новых мутаций в лейкозных клетках, в том
числе после проведенного лечения (химиотерапия), происходит
формирование множества клонов лейкозных клеток (поликлоно-
вая стадия) и отбор наиболее автономных из них, что ведет к ма-
лигнизации заболевания. На этой стадии опухоли лейкозные
клетки становятся устойчивыми к терапии и метастазируют в
другие органы и ткани.
Лейкозы характеризуются анаплазией, гиперплазией, дис- плазией и метаплазиейкроветворной ткани.
Анаплазия – неспособность к дифференцировке (дедиффе- ренцировка), созреванию форменных элементов крови с наруше- нием их функций.
Гиперплазия– избыточная продукция клеток, находящихся
на различных стадиях созревания.
Метаплазия– перерождение нормальных очагов кроветво-
рения в костном мозге.
Дисплазия– вытеснение из красного костного мозга здоро-
вых ростков гемопоэза: эритроцитарного, лейкоцитарного и ме-
гакароцитарного, что приводит к развитию клинических синдро-
Лейкозная клетка является потомком мутированной клетки II-IV класса развития, которая способна к размножению, но не способна к дифференцировке и выполнению специфических функций. Клетка увеличена в размере (в 2-3 раза больше нормы) либо уменьшена до размера лимфоцита с увеличением ядерно- цитоплазматического соотношения, характерна деформация ядерных контуров, вакуолизация ядра, увеличение количества нуклеол до 8 и более, базофилия цитоплазмы, ее вакуолизация.
Классификация лейкозов
По патогенетическому принципу (степени нарушения дифференцировки лейкозных (опухолевых) клеток)лейкозы разделяют на острые и хронические.
К острым лейкозам относят лейкозы с полной остановкой дифференцировки и созревания гемопоэтических клеток на уров- не II-IV классов. Морфологическим субстратом опухоли и клет- ками, циркулирующими в крови, при острых лейкозах являются бластные клетки соответствующего ряда гемопоэза (миелобла- сты, лимфобласты, монобласты и др.).
Гематологическая картина острого лейкоза характеризуется
наличием в крови большого количества бластов и лейкемическим
небольшом количестве зрелых клеток и отсутствии созревающих
Иногда субстратом опухоли могут быть промиелоциты и промоноциты. При остром недифференцированном лейкозе суб- стратом опухоли являются клетки II и III классов, которые мор- фологическими методами не дифференцируются. При превыше- нии количества клеток лейкозного клона более 30% состава кост- ного мозга, как правило, они появляются в периферической кро- ви.
При хронических лейкозах отмечается частичная задержка способности к дифференцировке и созреванию кроветворных клеток. При хронических лейкозах патоморфологическим суб- стратом опухоли являются бластные клетки (IV класс), созре- вающие клетки (V класс), достигшие определенного уровня диф- ференцировки, и зрелые клетки (VI класс).
Острые и хронические лейкозы развиваются на разной кло- нальной основе. Острые лейкозы не переходят в хронические. При хроническом лейкозе возможна утрата способности диффе- ренцироваться некоторыми клонами.
Острые лейкозы
Вариантами острого лейкоза являются миелобластный, лимфобластный, монобластный, промиелоцитарный, плазмобла- стный,мегакариобластный, эритромиелоз, недифференцирован- ный и др.
При острых миелобластных лейкозах число лейкоцитов крови может достигать (100-150) х 109 /л и выше; часто оно держится на уровне (20-30) х 109/л и ниже. В мазке крови наряду с незначительным количеством зрелых сегментированных нейтрофилов нередко все поле зрения усеяно миелобластами (рис. 49).

Рис. 49. Большое содержание бластных клеток в периферической крови
У детей чаще всего (80 % случаев) встречается острый лим- фобластный лейкоз. Другие формы острых лейкозов наблюдают- ся значительно реже. Хроническим миелолейкозом дети болеют редко (5% лейкозов).
При остром лимфобластном лейкозе в крови преобладают лимфобласты (рис.50).
В 1975 г. гематологами Франции, США и Великобритании была предложена классификация (FAB-классификация) острых лейкозов на миелобластные и лимфобластные.
Морфологическая FAB-классификация острых миелобласт-
ных и лимфобластных лейкозов представлена в таблицах 13 и 14.

Рис. 50. Картина крови при остром лимфобластном лейкозе. В периферической крови присутствует большое количество бластных клеток
Таблица 13. Морфологическая FAB-классификация острых миелобластных лейкозов
| Обозначение | Морфологический подтип острого миелобластного лейкоза | Распространенность, % |
| М0 | острый малодифференцированный лейкоз | |
| М1 | острый миелобластный лейкоз без со- зревания | |
| М2 | острый миелобластный лейкоз с со- зреванием | |
| М3 | острый промиелоцитарный лейкоз | |
| М4 | острый миеломонобластный лейкоз | |
| М5а | острый монобластный лейкоз | 10-15 |
| М5в | острый монобластный лейкоз с диф- ференцировкой | |
| М6 | острый эритромиелоз | 3-5 |
| М7 | острый мегакариобластный лейкоз | редкий вариант |
Таблица 14. Морфологическая FAB-классификация острых лимфобластных лейкозов
| Обозначение | Морфологический подтип острого лимфобластного лейкоза |
| L1 | микролимфобластный острый лимфобластный лейкоз |
| L2 | острый лимфобластный лейкоз с типичными бластами |
| L3 | макролимфобластный острый лимфобластный лейкоз |
В настоящее время требованиям клиницистов больше удов- летворяет иммунологическая классификация острых лимфобла- стных лейкозов (EGIL, 1995), согласно которой выделяют острый лимфобластный лейкоз В-клеточной линии и Т-клеточной линии.
Хронические лейкозы
Среди хронических лейкозов выделяют миелолейкоз, лим- фолейкоз, моноцитарный и миеломную болезнь (плазмоцитома) и др.
При хроническом миелолейкозе наряду с резким повышени- ем общего количества лейкоцитов (до 600х109/л крови) наблюда- ется появление в периферической крови огромного количества гранулоцитов на ранних стадиях развития: миелобластов, про- миелоцитов, миелоцитов, метамиелоцитов (рис.51).

Рис. 51. Картина крови при хроническом миелолейкозе
1 – нейтрофильный промиелоцит; 2 – миелоциты; 3 – метамиелоцит;
4 – палочкоядерный лейкоцит; 5 – сегментоядерный лейкоцит
Процентное содержание зрелых и созревающих нейтрофи- лов в лейкоцитарной формуле становится преобладающим. При хронических миелолейкозах в крови имеет место также повы- шенное количество эозинофильных и базофильных миелоцитов (эозинофильно-базофильная ассоциация).
В редких случаях миелолейкоза лейкемическая картина кро-
ви может наблюдаться при нормальном и даже пониженном об-
щем количестве лейкоцитов в крови. В других случаях картина
крови может быть нормальной, а диагноз лейкоза ставится лишь
при исследовании пунктата костного мозга (алейкемический
тельным увеличением в периферической крови большого количе-
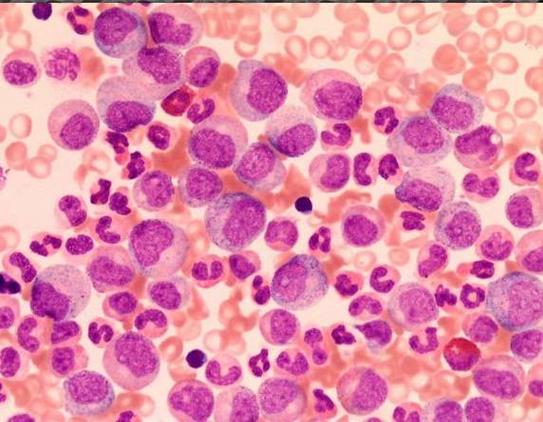
Рис. 52. Бластный криз при хроническом миелолейкозе
При хроническом лимфолейкозе преобладают зрелые лим- фоциты, присутствуют единичные лимфобласты, тени Боткина- Гумпрехта, представляющие собой разрушенные при приготов- лении мазка лимфоциты (рис. 53).
Рис. 53. Картина крови при хроническом лимфолейкозе
Классификация хронических лейкозов (Новицкий В.В., Гольдберг Е.Д., Уразова О.И., 2009):
1. Хронические миелопролиферативные лейкозы:
хронический моноцитарный (миеломоноцитарный)
хронический нейтрофильный лейкоз
хронический эозинофильный лейкоз / гиперэозино-
эритремия (истинная полицитемия)
идиопатический миелофиброз (сублейкемический мие-
2. Хронические лимфопролиферативные лейкозы:
хронические В-клеточные лейкозы:
- В-клеточный пролимфоцитарный лейкоз
множественная миелома (миеломная болезнь)
макроглобулинемия Вальденстрема болезнь тяжелых цепей
хронические Т/NK-клеточные лейкозы:
- Т-клеточный пролимфоцитарный лейкоз
- Т-клеточный лейкоз из больших гранулярных лим-
- агрессивный NK-клеточный лейкоз
Рис. 54. Частота встречаемости различных видов лейкозов в зависимости от возраста
Последнее изменение этой страницы: 2016-08-15; Нарушение авторского права страницы
Одной из наиболее опасных для жизни человека патологий системы крови являются лейкозы, относящиеся к группе гемобластозов - злокачественных новообразований кроветворной (миелоидной и лимфоидной) ткани. В отличие от лейкоцитозов, лейкемоидных реакций и лейкопений лейкоз является не реактивным состоянием, а болезнью системы крови.
Лейкоз - это опухоль, исходящая из кроветворных клеток костного мозга, в основе развития которой лежит неконтролируемый рост клеток с преобладанием процессов их пролиферации над дифференцировкой и образованием очагов патологического кроветворения в органах и тканях, в норме не участвующих в гемопоэзе. При этом утратившие способность к созреванию лейкозные клетки могут проходить значительно большее, чем нормальные клетки крови, число циклов деления, что и создает огромную клеточную продукцию, характеризующую лейкоз.
Этиология лейкозов до настоящего времени точно не установлена. Об опухолевой природе лейкозов свидетельствует наличие общих закономерностей, объединяющих лейкозы и опухоли: нарушение способности клеток к дифференцировке; морфологическая и метаболическая анаплазия клеток; способность к метастазированию; общие этиологические факторы, способствующие развитию лейкозов и опухолей, и др.
К возможным этиологическим факторам, вызывающим развитие лейкозов, относят ионизирующую радиацию, ряд химических веществ, вирусы. Определенное значение в развитии лейкозов придается генетическим факторам, наследственной и приобретенной иммунной недостаточности, действию бластомогенных метаболитов триптофана и тирозина.
Соответственно существует несколько теорий происхождения лейкозов.
Радиационная теория. Роль ионизирующих излучений в возникновении лейкозов доказана в эксперименте. Как однократное (в дозе 2 Гр и выше), так и хроническое (в течение 2-3 месяцев) облучение лучами Рентгена в малых дозах может индуцировать лейкоз у лабораторных животных (крысы, мыши). Прослежено повышение заболеваемости острым и хроническим миелолейкозом у жителей Хиросимы и Нагасаки, у рентгенологов и радиологов. Приводятся данные об увеличении частоты лейкозов у больных, леченных
большими дозами лучей Рентгена, иттрия, радия по поводу злокачественных новообразований и анкилозирующего спондилоартрита, а также у детей, получавших облучение вилочковой железы в раннем возрасте, и др. Описано учащение случаев острых лейкозов среди больных эритремией после лечения их радиоактивным фосфором.
Теория химического лейкозогенеза. Экспериментально доказана возможность индуцирования лейкозов у животных введением канцерогенных веществ (диметилбензантрацен, метилхолантрен и др.). Также в эксперименте показана возможность стимуляции лейкозогенеза метаболитами триптофана и тирозина (М.Л. Раушенбах). Однако роль этих веществ в лейкозогенезе человека не доказана. В то же время накоплены данные, указывающие на увеличение риска заболевания лейкозами (как правило, острыми) у людей, имеющих длительный профессиональный контакт с бензолом и летучими органическими растворителями (шоферы, работники кожевенной и обувной промышленности и т.д.). В последние годы отмечено заметное учащение случаев острого лейкоза у больных злокачественными новообразованиями, леченных такими цитостатическими препаратами, как циклосфосфан, хлорбутин, метотрексат, миелосан, адриамицин и др. К лекарственным препаратам, способным индуцировать лейкозы, относятся также бутадион, левомицетин и некоторые другие.
Вирусная теория связывает возникновение лейкозов с активацией (под действием радиации и химических факторов) латентных лейкозогенных вирусов. Несомненно доказанным является вирусное происхождение лейкозов у многих видов животных - птиц, мышей, крыс, хомячков, кошек, крупного рогатого скота. К настоящему времени выделено и детально охарактеризовано несколько типов вирусов, вызывающих различные виды лейкозов у животных. Как правило, это РНК-содержащие вирусы, а также ДНК-содержащие вирусы, которые относятся к герпесвирусам (подробнее см. раздел 13.3).
Генетическая теория располагает достаточно убедительными аргументами, указывающими на возможность наследственной предрасположенности к лейкозам. Известны случаи семейных лейкозов, доказана роль этнических особенностей в развитии лимфолейкоза. К возникновению лейкозов предрасполагают болезни, характеризующиеся спонтанными разрывами хромосом и нерасхождением соматических или половых хромосом (болезнь Дауна, анемия Фанкони, синдромы Кляйнфелтера, Тернера и др.). Получены линии мышей, у которых частота спонтанных лейкозов близка к 100%.
Основные стадии патогенеза лейкозов
Характеристика
Лейкозогенный фактор (радиация, вирусы и др.) действует на стволовые кроветворные клетки II-III классов, вызывая их опухолевую трансформацию в результате мутационного превращения протоонкогенов в онкогены и инактивации антионкогенов
Активация и гиперпролиферация лейкозных клеток при действии промотора с формированием клона лейкозных клеток, идентичных по фенотипу и генотипу (моноклоновая стадия)
Образование очагов патологического кроветворения вне костного мозга за счет способности лейкозных клеток к инвазии, интра- и экстравазации, миграции по сосудистой системе, имплантации и пролиферации в различных тканях и органах
При лейкозах опухолевая прогрессия отличается рядом следующих особенностей (А.И. Воробьёв, 2002):
трансформация из моноклональной формы в поликлональную;
угнетение процесса нормального кроветворения всех ростков или избирательно-гранулоцитарного, эритроцитарного либо тромбоцитарного;
появление экстамедуллярных метастазов в коже, почках, печени, мозговых оболочках и т. д., отражающих появление новых субклонов;
наличие бластного криза при хронических формах, т. е. смены дифференцированных клеток бластами;
нарастание клеточного атипизма (изменение ядра и цитоплазмы бластных клеток — вместо круглых ядер появляются ядра неправильной формы, увеличивается площадь ядра и цитоплазмы);
утрата ферментативной специфичности;
переход от лейкопении к лейкоцитозу;
формирование устойчивости к антибластомному лечению, возникающей при его применении скачкообразно или постепенно.
В основу классификации лейкозов положены следующие принципы:
1.По гистогенетической характеристике лейкозных клеток выделяются (МКБ-10):
злокачественные иммунопролиферативные болезни (неоплазмы из клеток лимфоидной линии), к которым относят: плазмоклеточный, острый лимфобластный, хронический лимфоцитарный, пролимфоцитарный, волосатоклеточный (редкий) лейкозы и др.;
неоплазмы из клеток миелоидной линии (миелопролиферативные болезни — синдромы, общим признаком которых является пролиферация миелоидного ростка): острый и хронический миелоидные лейкозы, острый промиелоцитарный, хронические миеломоноцитарный и моноцитарный лейкозы, хроническая эритремия и др.
2.По степени дифференцировки (зрелости) лейкозных клеток различают острые и хронические лейкозы.
Острые лейкозы представляют собой гетерогенную группу опухолевых заболеваний системы крови, субстратом которых являются молодые незрелые кроветворные клетки, вытесняющие нормальные элементы. Все острые лейкозы возникают из одной мутировавшей кроветворной клетки. В результате повреждения в генетическом материале клоногенной кроветворной клетки нарушается контроль за клеточным циклом, изменяются процессы транскрипции и продуцирования ряда ключевых белков. Вследствие бесконтрольной пролиферации и отсутствия дифференцировки накапливаются патологические клетки. Лейкозные клетки несут на своей поверхности маркёры, характеризующие определённые этапы дифференцировки нормальных гемопоэтических клеток; на нормальных клетках гемопоэза не обнаруживаются аберрантная экспрессия антигенов; существует группа острых лейкозов, клетки которых несут маркёры разных линий кроветворения (миело- и лимфопоэза), а в период ремиссии обнаруживаются клетки с характерным лейкемическим иммунофено- или генотипом.
В настоящее время в клинической практике часто руководствуются классификацией острых лейкозов, разработанной в 1976 г. группой гематологов Франции, США, Великобритании — FAB (ФАБ) и в последующем модифицированной. Она основана на цитологической характеристике доминирующей популяции бластов с учётом цитохимических реакций и ультраструктуры лейкозных клеток.
В развитии острых лейкозов различают следующие стадии: начальную, развёрнутую, полную ремиссию, частичную ремиссию, рецидив, терминальную стадию, стадию выздоровления (состояние полной ремиссии на протяжении 5 лет и более).
Большое количество бластных клеток и их преимущество от 30 до 90%.
“Лейкемический провал” (отсутствие промежуточных форм лейкоцитов на фоне увеличения количества бластов.
Одновременное отсутствие базофилов и эозинофилов (абазофилия и анэозинофилия).
При хронических лейкозах частично задерживается созревание клеток, субстрат опухоли составляют созревающие и зрелые клетки, которые в основном и обнаруживаются в периферической крови, анемия в большинстве случаев развивается по мере прогрессирования заболевания.
Более медленное течение хронических лейкозов прогностически сравнительно неблагоприятно. Во многих случаях острые лейкозы успешно лечатся, в то время как хронические оказываются резистентными к терапии.
Острые и хронические лейкозы развиваются на разной клональной и неидентичной мутационной основе. Острый лейкоз с течением времени не переходит в хронический, поскольку утраченную ранее способность к дифференцировке неоплазма вновь не приобретает. Однако хронический лейкоз может трансформироваться в острый.
Небольшое количество бластов и их отсутствие меньше 30% либо 1-2%.
Нет “лейкемического провала”.
Медленно прогрессирующая анемия с увеличением скорости развития в период обострения.
3.По количеству лейкоцитов в периферической крови (В. Демешек; цитируется по А.Ш. Зайчику и А.П. Чурилову, 2002) лейкозы на той или иной стадии течения квалифицируют как:
лейкемические (резкое увеличение количества лейкоцитов — 100,0·10 9 /л и выше);
сублейкемические (увеличение числа лейкоцитов до 100,0·10 9 /л);
алейкемические (число лейкоцитов не изменяется);
лейкопенические (число лейкоцитов уменьшаетсяо 9 /л).
Лейкозы (лейкемии, гемобластозы) относятся к одной из самых тяжелых категорий заболеваний, причем значимость этого вида патологии постоянно нарастает.
Несмотря на значительный прогресс, достигнутый за последние десятилетия в области разработки различных методов лечения лейкозов, смертность при данных заболеваниях по-прежнему остается высокой.
Характерно увеличение частоты возникновения лейкозов, что в определенной степени можно объяснить ухудшением экологической обстановки в экономически развитых странах мира. В частности, в связи с ростом промышленного производства концентрация канцерогенных (лейкемогенных) химических веществ в окружающей среде стала значительно выше, чем раньше.
Также претерпевает изменения и радиационный фон Земли. Следует отметить, что лейкемии — злокачественные новообразования, которые возникают у значительного количества детей и лиц молодого трудоспособного возраста и представляют собой, таким образом, особенно острую социальную проблему.
Определение понятия и классификация
В настоящее время принято следующее определение этого заболевания.
Лейкоз — это системное заболевание крови, характеризующееся бес контрольной пролиферацией и омоложением кроветворных элементов с нарушением их созревания и метаплазией кроветворной ткани.
В данном определении необходимо выделить несколько важных положений:
• будучи системными заболеваниями крови, лейкозы поражают, как правило, всю кроветворную систему, включая эритропоэтический, лейкопоэтический и тромбопоэтический ростки костного мозга;
• в основе лейкозов лежит бесконтрольный рост и нарушение диф-ференцировки (созревания) кроветворных клеток, что, как известно, наблюдается при злокачественных опухолях;
• при лейкемиях развивается метаплазия кроветворной ткани, при которой один из кроветворных ростков начинает развиваться в нетипичной для него ткани, например: миелоидные клетки появляются в лимфоидных органах, лимфоидные клетки — в костном мозге. Существует несколько классификаций лейкозов, каждая из которых основана на соответствующих критериях, определяющих особенности заболевания.
I. По течению процесса:
В настоящее время при качественной терапии острые лейкозы нередко протекают более благоприятно, чем хронические. Более того, при агрессивной химиотерапии острого лимфолейкоза у детей в 70 % случаев наступает полное выздоровление, а в 90 % — стойкая ремиссия.
II. По источнику образования опухолевого клона лейкемии:
III. По количеству лейкоцитов в периферической крови пациента:
• лейкемическая (количество лейкоцитов больше 50 тыс./мкл крови);
• сублейкемическая (от 10 до 50 тыс./мкл крови);
• алейкемическая (количество лейкоцитов находится в границах нормы);
• лейкопеническая (менее 4 тыс./1 мкл крови).
Отличия острых и хронических лейкозов
Можно выделить несколько признаков, выявляемых по анализу периферической крови, по которым отличаются между собой острые к хронические формы лейкозов:
1. Для острых лейкозов характерен разрыв между недифференцированными и зрелыми клетками белой крови, именуемый, hiatus leucemicus (лейкемическое зияние). Так, при остром миелолейкозе одна (или более) промежуточная форма отсутствует (например, промиелоциты или миелоциты). При хроническом миелолейкозе в периферической крови находят клеточные элементы, соответствующие всем стадиям созревания гранулоцитов: миелобласты — промиелоциты — миелоциты — метамиелоциты — зрелые клетки (нейтрофилы, базофилы, эозинофилы). Аналогичное отличие будет характерно для хронического и острого лимфолейкоза. При остром лимфолейкозе отсутствуют пролимфоциты (hiatus leucemicus). При хроническом лимфолейкозе в периферической крови присутствуют все клетки лимфоидного ряда: лимфобласты — пролимфоциты — лимфоциты.
2. При хроническом лейкозе наблюдается более глубокая анемия по сравнению с острым.
3. Для острого лейкоза чаще всего характерен менее выраженный лейкоцитоз, нежели для хронического.
4. При острых лейкозах уже в начале заболевания в крови обнаруживаются в значительном количестве властные (незрелые, низкодифференцированные) клетки. При хронических лейкозах подобная картина крови развивается лишь в терминальной стадии (так называемый властный криз) и то не всегда. Как правило, при хроническом лейкозе выявляется менее 5 % властных клеток в периферической крови, а при остром, напротив, больше 5 %.
Этиология и патогенез
Как и в случае с другими злокачественными опухолями, говорить о непосредственных причинах развития лейкозов довольно трудно. Вместе с тем существует ряд факторов риска, для которых установлена определенная связь с возникновением заболевания. Их можно объединить в несколько групп:
1. Физические факторы. Прежде всего, к ним относится ионизирующее излучение. У жителей японских городов Хиросимы и Нагасаки, выживших после атомной бомбардировки 1945 г., частота возникновения лейкемии была существенно выше, чем в других городах Японии. Также роль облучения в развитии лейкозов была доказана в эксперименте на животных.
2. Химические вещества. Было установлено, что в ряде случаев возникновение лейкозов связано с воздействием на организм тех же веществ, которые могут играть роль в развитии других злокачественных новообразований: метилхолантрен, бензпирен, нитраты, пестициды, ароматические углеводороды, а также некоторые лекарственные препараты (левомицетин, цитостатики и др.).
3. Биологические факторы. Пациенты, страдающие некоторыми формами лейкозов, являются носителями определенных вирусов. Так, например, при лимфоме Беркитта практически во всех случаях у больных обнаруживается вирус Эпштейна—Барр, являющийся возбудителем инфекционного мононуклеоза. Последний представляет собой инфекционное заболевание, как правило не имеющее при обычном течении серьезных последствий для организма. Также известно, что такое заболевание, как Т-клеточная лейкемия — лимфома взрослых, — вызывается HTLV- в ирусом (от англ, human T-lymphocyte virus), относящимся к семейству ретровирусов.
4. Генетические факторы. Ряд форм лейкозов имеет наследственную предрасположенность, что подтверждается случаями аналогичных заболеваний у родственников.
Говоря о патогенезе опухолей кроветворной системы, следует прежде всего отметить, что роль перечисленных выше факторов риска удается установить лишь у незначительного числа пациентов. В остальных случаях заболевание возникает спонтанно, т. е. без четко установленной связи с причинным фактором. При этом непосредственный механизм, приводящий к появлению лейкозной клетки, известен — это мутация.
Последняя, как правило, возникает в геноме полипотентной клетки кроветворной системы, приобретающей в результате этого опухолевые свойства, а именно способность к бесконтрольному делению и нарушение процесса дифференцировки (созревания). Все опухолевые клетки являются моно-клональными, т. е. продуктами деления одной злокачественной клетки.
Для некоторых форм лейкемии основным механизмом появления опухолевых клеток служит хромосомная перестройка — транслокация, т. е. перенос части одной хромосомы на другую. Так происходит, в частности, при хроническом миелолейкозе. При этом заболевании в гранулоци-тах обнаруживается так называемая филадельфийская хромосома (Ph-хромосома) — результат переноса части хромосомы с 22-й пары на 9-ю.
На определенной стадии развития лейкоза в клоне лейкозных клеток возможно возникновение новых мутаций, в результате чего появляются опухолевые клетки с более злокачественными свойствами (менее зрелые клетки), которые постепенно вытесняют старые клетки (с менее злокачественными свойствами). Таким образом, внутри старого клона появляется новый, более агрессивный клон. На этой стадии опухоль становится поликлональной. Клинически опухолевая прогрессия проявляется в виде так называемого властного криза, когда на поздней стадии хронического лейкоза в крови начинают преобладать бластные клетки. Хронический лейкоз приобретает черты острого.
Особенности кроветворения при лейкозах
1. Нарушение процесса созревания кроветворных клеток (анаплазия). Резкое увеличение доли недифференцированных клеток в костном мозге. Появление незрелых (в том числе бластных) клеток в периферической крови.
2. При многих формах лейкемии развиваются анемия и тромбоци-топения на поздних стадиях заболевания.
3. Появление так называемых экстрамедуллярных очагов кроветворения, когда клетки крови начинают появляться не в костном мозге, а в других органах и тканях (например, в селезенке или в стенке кровеносных сосудов.
Основные причины смерти при лейкозах
1. Тяжелая анемия. В большинстве случаев при хронических лейкозах развивается глубокая анемия, которая может стать причиной смерти.
2. Геморрагический синдром. При многих формах лейкозов отмечается тромбоцитопения, в результате чего даже при незначительном повреждении какого-либо кровеносного сосуда возникают тяжелые кровотечения или кровоизлияния (например, желудочно-кишечное кровотечение или кровоизлияние в головной мозг). Геморрагическим осложнениям лейкозов также способствует появление упомянутых выше экстрамедуллярных очагов кроветворения в стенке кровеносных сосудов, в результате чего они становятся особенно хрупкими и легко подвергаются сквозному разрыву.
3. Вторичные инфекции. При лейкемиях количество лейкоцитов в периферической крови может достигать очень высокого уровня. Однако большая часть этих клеток не созревает до своих конечных форм. Такие незрелые клетки не в состоянии выполнять свою защитную функцию, что проявляется в виде резко повышенной восприимчивости организма к любым инфекциям.
4. Тромбоэмболические осложнения. При некоторых формах лейкозов, сопровождающихся тромбоцитемией, полицитемией и др., значительно увеличивается гематокрит и количество тромбоцитов в единице объема крови, что на фоне даже незначительных изменений в стенке артериальных сосудов приводит к появлению тромбов, их отрыву и переносу с током крови в различные органы.
5. Кахексия. На поздних стадиях развития лейкемии нередко развивается кахексия, т. е. крайняя степень истощения. Вместе с тем как таковая она довольно редко становится непосредственной причиной смерти, поскольку чаще пациенты умирают раньше от причин, указанных в предыдущих пунктах.
Читайте также:

