Эндоскопическая реканализация при опухолях и толстой кишки
Роль эндоскопии в лечении рака толстой кишки сводится к следующим трем функциям:
• эндоскопическому удалению раковой опухоли на ранней стадии;
• наблюдению за больным после резекции опухоли;
• паллиативной помощи при раке на далеко зашедших стадиях.
Все эндоскопические операции при раке толстой кишки на ранней стадии можно свести к двум типам: плановому удалению опухоли при уже установленном диагнозе и удалению полипа, в котором при гистологическом исследовании неожиданно выявлены раковые клетки. Недостаток эндоскопического удаления злокачественных опухолей состоит в том, что после него риск метастазов в регионарных лимфатических узлах выше.
Иначе говоря, при удалении рака на ранней стадии должна быть уверенность в том, что метастазов в регионарные лимфатические узлы нет.
Риск метастазов возрастает при больших размерах опухоли, а также при инфильтрации ею подслизистой основы. Эндоскопическое удаление опухоли допустимо при глубине инфильтрации не более 1000 мкм. При уплощенных или плоских аденомах риск глубокой инфильтрации подслизистой основы, вплоть до мышечной оболочки толстой кишки, выше.
Эндоскопическое удаление раковой опухоли на ранней стадии должен выполнять лишь врач, обладающий достаточным опытом. Больных с такой опухолью следует оперировать в специализированных центрах.
Низкодифференцированный рак толстой кишки, инфильтрация лимфатических сосудов опухолевыми клетками, отсутствие уверенности в полном удалении опухоли (т.е. в соответствии полноты удаления опухоли категории R0), а также в том, что первичная опухоль соответствует степени Т1, требуют наличия еще одного фактора для выполнения дополнительной хирургической резекции с соблюдением онкологических принципов: знания путей оттока лимфы и особенностей кровоснабжения.
При раке сигмовидной кишки это означает резекцию всего сегмента кишечника, который кровоснабжается нижней брыжеечной артерией.
Критерии ведения больных после эндоскопического или хирургического удаления раковой опухоли соответствуют риску развития рецидива. Наиболее важной является стадия опухолевого процесса. Для эндоскопического удаления опухоли критерии иные. Вообще, ежегодного выполнения колоноскопии не требуется. А возможность отступления от рекомендуемых сроков выполнения контрольной колоноскопии в каждом ее случае рассматривают индивидуально.
Контрольные исследования не исключают развития рецидивов опухоли. У больных старческого возраста эндоскопия может сыграть существенную роль в паллиативном лечении. Наряду с устранением кишечной непроходимости, при эндоскопическом исследовании можно также остановить кровотечение из опухоли.
Показания к локальному паллиативному вмешательству могут быть разные; иногда оснований для выполнения такого вмешательства бывает несколько, и они могут отличаться по своей значимости. Обычно в каждом случае вмешательство бывает направлено на то, чтобы обеспечить больному приемлемое качество жизни.
Схема послеоперационного ведения больного:
1. Эндоскопическое удаление опухоли (полнота удаления R0, низкий риск [G1, G2, L0]):
• Контрольная эндоскопия через 6 мес.
• Контрольная эндоскопия через 2 года.
2. Резекция кишки при опухоли, соответствующей I стадии по классификации Международного противоракового союза (Т1Я2, N0):
• Диспансерное наблюдение не требуется, особенно при опухоли, соответствующей стадии Т1 и степени дифференцировки G1 и G2.
• Отклонение от этой тактики при степени дифференцировки опухоли G3 или прорастании ее в лимфатические или кровеносные сосуды, а также при стадии опухоли Т2.
3. Резекция кишки при опухоли, соответствующей II-II стадии по классификации Международного противоракового союза:
• Колоноскопия через 6 мес. (если не планируется операция).
• Сигмоидоскопия (только в тех случаях рака прямой кишки, когда после операции неоадъювантная или адъювантная химиолучевая терапия не проводится):
- через 6 мес;
- через 12 мес;
- через 18 мес;
- через 2 года.
• Колоноскопия через 3 года (при отсутствии опухоли следующую колоноскопию выполняют через 5 лет).
Рекомендательные положения не являются жестким предписанием. Тем не менее, если врач не следует им, он должен обосновать почему. Особенно часто приходится отклоняться от разработанных рекомендаций при наблюдении за пациентами пожилого и старческого возраста. В этих случаях решение, принимаемое врачом, должно основываться не столько на общепринятых принципах, сколько на индивидуальных особенностях больного.
Для паллиативной аблации опухоли существует два метода: лазерная аблация и аргоноплазменная коагуляция. Внедрение в клиническую практику аргоноплазменной коагуляции привело к тому, что метод лазерной деструкции несколько утратил свое значение. В принципе с помощью лазера можно эффективно разрушить опухоль, при этом он не вызывает существенного обугливания здоровой ткани.
Лазерным световодом управляют под контролем зрения, с помощью пилотного луча определяют границы опухолевой ткани, которая будет подвергнута аблации. Сам лазерный луч, вызывающий деструкцию опухолевой ткани, не виден. При выполнении лазерной аблации в принципе возможна перфорация стенки кишки, особенно когда снижение качества стекловолокна настолько ослабляет конвергенцию пилотного луча, что управление лазерным лучом становится невозможным.
С помощью аргоноплазменной коагуляции риск перфорации стенки кишки меньше. Управляют процессом коагуляции под контролем зрения. При использовании аппаратов коагуляции последнего поколения мощность, достаточная для аблации, составляет 30-40 Вт. Для коагуляции значительного объема опухолевой ткани можно использовать и большую мощность.
Для повторной коагуляции каких-либо установленных временных интервалов нет. В зависимости от тенденции к росту контрольное исследование, а заодно и повторную коагуляцию можно выполнить через 4 нед. В среднем интервал между коагуляциями равен 6-8 нед.
Для остановки кровотечения достаточно использования меньшей мощности. В таких случаях необходима не столько аблация опухоли, сколько поверхностная коагуляция сосуда.
Применение аргоноплазменной коагуляции при протяженном и резко выраженном стенозе неэффективно или дает плохой результат. Кроме того, с учетом угрозы развития полной кишечной непроходимости, в этих случаях необходимы еще и дополнительные меры. В качестве эффективной паллиативной меры таким больным можно выполнить стентирование стенозированного участка. Однако несмотря на преимущество этого метода, состоящее в восстановлении кишечной проходимости, хотя и на относительно непродолжительный период, стентирование имеет целый ряд недостатков: стент может мигрировать, вызвать кровотечение или перестать функционировать.
Причиной дисфункции стента является его обтурация каловыми массами или быстро растущей опухолью. Кроме того, возможен перегиб кишки в области ректосигмоидного перехода при глубоком введении стента, а также боли в животе. В связи с этими особенностями стентирование остается последним средством при выборе паллиативного лечения.
Нами была выявлена корреляция между анатомическим типом, размерами удаленных полипов и частотой их рецидивирования. Так, при размерах новообразований от 0,6 до 1,0 см, частота рецидивов после электроэксцизии полипов расположенных на узком или широком основании была почти в два раза выше, чем после иссечения полипов на ножке. При величине полипов от 1,1 до 2,0 см эта разница становится еще более значительной – рецидивы после удаления полипов на широком или узком основании отмечались уже почти в три раза чаще, чем после иссечения полипов на ножке. Наиболее редко рецидивы после полипэктомии наблюдались при железистых формах полипов (7,4% случаев), чаще при железисто-ворсинчатых (13,2% случаев) и значительно чаще после электроэксцизии ворсинчатых полипов (23,6%) случаев.
При выполнении эндоскопических электрохирургических полипэктомий в толстой кишке осложнения наблюдались в 4,2% случаев (в поликлинике – в 3,2% случаев, в стационаре – в 5,3% случаев). Нами были оценены возможности фиброколоноскопии и прицельной биопсии (в сравнении с данными тотальной биопсии) в определении истинного строения полипов толстой кишки. Сравнение эндоскопического диагноза с результатами морфологического исследования полипов, извлеченных из просвета толстой кишки после их электроэксцизии, произведено в 405 случаях, а прицельной биопсии с данными тотальной биопсии полипов – в 275 случаях. Если в установлении доброкачественного характера полипов разрешающая способность обоих методов оказалась достаточно высокой – соответственно 93,6% и 96,1% правильных ответов (при фиброколоноскопии и по результатам прицельной биопсии), то в диагностике малигнизированных полипов фиброколоноскопия была результативной всего в 21,0% наблюдений, а прицельная биопсия – в 23,5% всех случаев. При этом эндоскопическая полипэктомия позволила во всех случаях не только выявить малигнизацию, но и установить уровень инвазии опухоли.
На основании полученных данных нами была оптимизирована методика диспансерного наблюдения за больными, перенесшими эндоскопическую полипэктомию. При одиночных железистых полипах без признаков атипии контрольные фиброколоноскопии должны выполняться через 4 и 8 месяцев после операции и не реже одного раза в год в последующем. Пожилой возраст, локализация полипов в области физиологических изгибов и в правой половине толстой кишки, расположение полипов на широком или узком основании (особенно при размерах более 1,2 см в диаметре), железисто-ворсинчатый и ворсинчатый характер их гистологического строения, наличие атипии эпителия и множественность полипов являются неблагоприятными прогностическими факторами, увеличивавшими вероятность развития рецидивов, по меньшей мере, в два раза. Поэтому, наличие этих факторов является показанием к более частому обследованию (не реже одного раза в полгода) больных через год после операции. В случаях выявления очагов малигнизации в удаленных полипах, фиброколоноскопию для контроля над эффективностью лечения необходимо выполнять чаще: каждые 2–3 месяца на протяжении первых двух лет после эндоскопической операции и каждые полгода в последующем.
Активное диспансерное наблюдение за больными позволяет выявлять рецидивы полипов в самом начале их развития. Так, в 82,0% случаев рецидивные новообразования были обнаружены нами, когда их размеры не превышали 0,5 см. Морфологическое исследование биопсионного материала показало, что рецидивные опухоли обычно имеют то же строение, что и полипы до их иссечения. При диспансерном наблюдении в 17,8% случаев были обнаружены новые полипы в других отделах толстой кишки или на значительном расстоянии от места выполненной ранее полипэктомии, в 11 случаях появление новых полипов сочеталось с рецидивным ростом в зоне эндоскопической операции.
Мы располагаем опытом лечения 42 больных в возрасте от 32 до 67 лет, у которых при эндоскопических исследованиях в общей сложности были выявлены и удалены 52 аденомы диаметром более 4,0 см; 18 (42,9%) из них локализовались в прямой и 24 (57,2%) – в ободочной кишке.
Трансректальное ультразвуковое исследование при ворсинчатых опухолях прямой кишки было выполнено нами у всех 42 больных. Проведение эндоректального ультразвукового исследования с использованием конвексного ректального датчика, излучающая поверхность которого расположена на торце, позволяет осматривать ворсинчатые опухоли, располагающиеся в верхнеампулярном отделе прямой кишки. При ультразвуковом исследовании мы оценивали структуру и форму новообразования, локализацию, наличие и степень инфильтрации кишечной стенки, состояние параректальной клетчатки и области запирательного отверстия.
В результате результатов патоморфологического исследования и ультрасонографических данных нами были выделены следующие ультразвуковые признаки малигнизации ворсинчатой опухоли: 1) нарушение пятислойной структуры кишечной стенки; 2) выраженная эхонеоднородность опухоли; 3) наличие увеличенных лимфатических узлов в параректальной клетчатке; 4) наличие слизи в просвете кишки. Эти признаки позволили нам провести дифференциальную диагностику доброкачественной и малигнизированной ворсинчатой опухоли в 91,4% случаев.
При выявлении признаков малигнизации ворсинчатых опухолей, точность трансректального ультразвукового исследования составила 84,0% при чувствительности – 90,8% и специфичности – 75,2% случаев. Ложноположительные результаты в основном были получены при деформации слоев кишечной стенки за счет давления узлового новообразования.
При больших и гигантских аденомах толстой кишки нами использовались следующие методики их эндоскопического удаления: одномоментная петлевая электроэксцизия, фрагментация и эндоскопическая петлевая электрорезекция слизистой оболочки кишки вместе с опухолью. Методика фрагментации оказалась эффективной только при узловых формах крупных аденом. При удалении распластанных и стелющихся новообразований использование только фрагментации могло приводить к рецидивам, вызванным наличием резидуальных участков опухолевой ткани. Поэтому в таких случаях нами выполнялось удаление диатермической петлей слизистой оболочки кишки вместе с опухолью до подслизистого или мышечного слоя.
Путем одноэтапных эндоскопических вмешательств удалено 28 крупных аденом толстой кишки, в 14 случаях удаление новообразований было выполнено в два этапа. В 11 случаях многоэтапные эндоскопические вмешательства были запланированными в связи с очень большими размерами аденом, в 3 случаях выполнялись вынужденно, из-за кровотечения, потребовавшего эндоскопического гемостаза и прекращения дальнейшего удаления аденомы.
Осложнения эндоскопического удаления крупных аденом толстой кишки в нашем исследовании были следующими: в 1 случае – перфорация кишечной стенки, в 7 случаях – интраоперационное кровотечение, в 2 случаях – кровотечение в ближайшем послеоперационном периоде.
Несмотря на значительные размеры удаленных аденом, только в 8 (19,0%) из них при морфологическом исследовании была выявлена малигнизация. Это является, с одной стороны, свидетельством того, что аденомы толстой кишки могут достигать гигантских размеров, оставаясь при этом доброкачественными, с другой – говорит о необходимости более строгого отбора новообразований, подлежащих эндоскопическому удалению.
Наши исследования показали, что регенераторно-репаративные процессы в зоне эндоскопического удаления крупных аденом завершаются не позднее 3–4 месяцев после эндоскопического вмешательства. В целом сроки эпителизации вариабельны и зависят от первоначальных размеров раневого дефекта и глубины распространения коагуляционного некроза. Если удавалось избежать повреждения мышечного слоя, даже после удаления крупных стелющихся аденом, образующиеся рубцы незначительно деформировали стенку кишки и не нарушали ее функцию.
Оценка отдаленных результатов лечения больных с крупными аденомами толстой кишки в сроки от 1,5 до 8 лет, показала, что однократные или многократные эндоскопические вмешательства были эффективными у 93,1% больных. Положительных результатов лечения не удалось добиться лишь в 7,2% случаев. Причинами неудач были упорное рецидивирование аденом (2,4% случаев), выраженные рубцовые стриктуры (2,4% случаев) и развитие рака на месте ранее удаленных малигнизированных аденом (4,8% случаев).
С целью обоснования возможности применения этого метода при полипозе нами была изучена эффективность использования эндоскопической полипэктомии через колоноскоп в комплексном лечении аденоматоза толстой кишки. Клиническим материалом для этого исследования явились данные 32 пациентов, страдающих диффузным полипозом толстой кишки с преобладанием процессов пролиферации в полипах (7 – с аденоматозной и 25 – с аденопапилломатозной стадией). Эндоскопическая полипэктомия выполнялась как часть комплексного лечения в предоперационном и послеоперационном периодах. В этой группе больных было выполнено 104 эндоскопических вмешательства и всего удалено 1210 полипов.
Сроки наблюдения в послеоперационном периоде в этой группе больных составили от 4 до 10 лет. Признаки рецидивного роста полипов были выявлены в 24 случаях (75,0%), что потребовало выполнения периодических полипэктомий. У 3 больных (9,4%) при динамическом наблюдении было выявлено развитие раковой опухоли толстой кишки.
Выполнение эндоскопической полипэктомии сопровождалось следующими осложнениями: перфорация толстой кишки у 1 пациента (3,1%), которая потребовала экстренного оперативного вмешательства; кровотечения в раннем послеоперационном периоде, которые были остановлены эндоскопическими методами – у 3 пациентов (9,4%).
Преимуществом выполнения полипэктомии перед операцией является возможность определения морфологической структуры полипов, протяженности поражения, выявления злокачественных опухолей. Это определяет объем хирургического вмешательства, практически не затягивая сроки его проведения. В нашем исследовании злокачественная трансформация полипов перед операцией была выявлена в 15,6% случаев. В послеоперационном периоде рак в сохраненных отделах толстой кишки возник в 12,5% и только у тех пациентов, которым по тем или иным причинам контрольные обследования проводились с интервалом более одного года.
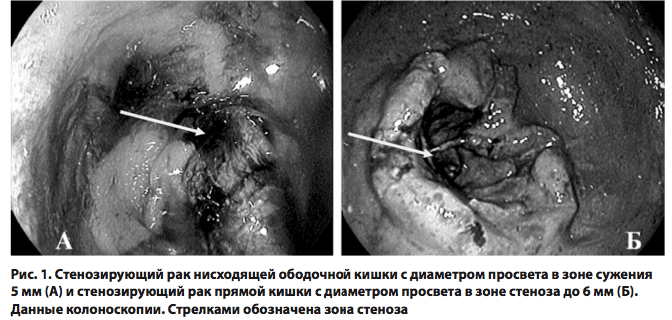
Нами была изучена эффективность методов эндоскопической реканализации толстой кишки при опухолевой толстокишечной непроходимости. Размеры опухоли толстой кишки варьировали от 5,5 до 12 см, со средним значением 7,4 см. У 9 (19,6%) больных опухоль располагалась в поперечно-ободочной кишке или ее селезеночном изгибе, у 12 (26,1%) – в нисходящей ободочной кишке, у 22 (47,9 %) – в сигмовидной кишке и у 3 (6,5%) – в прямой кишке.
Всем больным с опухолевой непроходимостью в течение 6 часов после поступления было проведено эндоскопическое исследование, при выполнении которого определялась причина непроходимости, оценивалась степень сужения и при возможности выполнялась биопсия опухолевидного образования. Эндоскопическая реканализация во всех случаях была выполнена в течение 8 часов после поступления.
Эндоскопическая картина полной непроходимости была выявлена в 15 случаях (32,6 %), при этом устье опухолевого канала не визуализировалось, кал и газы не поступали. У 34 (67,7%) больных при эндоскопии определялось устье канала в опухоли. Наличие видимого канала способствовало лучшей ориентировке, что упрощало проведение эндоскопической реканализации. Полная реканализация толстой кишки была достигнута нами у 16 (34,8 %) пациентов, частичная реканализация – у 17 (37,0 %) пациентов (рис. 31). В 13 (28,3 %) случаях реканализация оказалась неэффективной.
Кровотечение из опухоли в ходе выполнения эндоскопической реканализации возникло у 6 (13,0 %) пациентов и во всех случаях было остановлено эндоскопической электрокоагуляцией. В 3 случаях реканализация осложнилась перфорацией толстой кишки (6,5%). Во всех случаях перфорация возникла в дистальном сегменте кишки, свободном от содержимого еще до исследования и поэтому не сопровождалась значительной контаминацией брюшной полости кишечным содержимым.
Полная и частичная эндоскопическая реканализация стенозирующей опухоли, осложненной острой толстокишечной непроходимостью, была проведена у 31 (67,4%) из 46 больных. Выполнение эндоскопической реканализации у этих пациентов позволило отказаться от экстренной операции и провести полноценную предоперационную подготовку.
Временная отсрочка операции после полной или частичной реканализации давала возможность провести полноценную предоперационную подготовку. При неэффективной реканализации или возникновении осложнений в ходе выполнения эндоскопической реканализации, оперативное лечение выполняли сразу после эндоскопического исследования.
После полной реканализации стенозирующей опухоли толстой кишки, осложненной непроходимостью, в плановом порядке было оперировано 14 пациентов. У 12 из них (85,7%) операция была закончена наложением первичного толстокишечного анастомоза. После частичной реканализации стенозирующей опухоли толстой кишки, осложненной непроходимостью, через 12–24 часа оперировано 17 пациентов. Из них в 11 случаях (64,7%) был наложен первичный анастомоз.
В целом, применение эндоскопической реканализации опухоли у больных колоректальным раком, осложненным непроходимостью, позволило более чем у половины больных с опухолевой непроходимостью левой половины толстой кишки выполнить резекцию, наложить первичный анастомоз и снизить послеоперационную летальность до 11,6%. При этом эндоскопическая реканализация стенозирующей опухоли и последующая декомпрессия толстой кишки в большинстве случаев являются высокоэффективными лечебными мероприятиями, дающими возможность отсрочить основное оперативное вмешательство и провести полноценную дооперационную подготовку больного.
Нами был проведен анализ результатов эндоскопического гемостаза у 125 больных с толстокишечными кровотечениями различной этиологии. Эндоскопическая диагностика позволила нам выявить причины толстокишечных кровотечений в 93,1% случаев. При этом в экстренном порядке был локализован источник кровотечения, определено является ли оно состоявшимся или нет, а также установлена его интенсивность.
Продолжающееся кровотечение было выявлено в 6 случаях (4,8%), из которых ни одно кровотечение не было массивным. Кровотечение было расценено как умеренное в 73 случаях (58,4%). Состоявшимся кровотечение было признано в 27 (21,6%) случаях, из них источник кровотечения был покрыт сгустком крови у 16 (12,8%) больных.
В большинстве случаев были выявлены следующие особенности толстокишечных кровотечений: ретроградный заброс крови в вышележащие отделы за счет антиперистальтических маятникообразных сокращений, длительная эвакуация из толстой кишки с сохранением следов крови более суток, преобладание кровотечений малой и средней степени тяжести. Склонность к рецидивам у пациентов, имевших до поступления в стационар несколько эпизодов кровотечения, была выявлена в 44,0% случаев.
Эндоскопические способы гемостаза мы применяли в 55 случаях продолжающегося и состоявшегося кровотечения. Наиболее эффективный метод гемостаза – электрокоагуляция электродом с каналом для подачи жидкости для предотвращения его приваривания. Орошение капрофером и инъекционные методики гемостаза при продолжающемся кровотечении применялись нами в качестве предварительного этапа. Клинически значимые рецидивы кровотечения были отмечены в 8 (5,5%) случаях в сроки от 6 до 14 суток, их причиной явился дальнейший распад опухоли.
У всех больных со злокачественными неэпителиальными опухолями (3,2 %) кровотечение возникло в терминальной стадии заболевания. Источником кровотечения послужили варикозное расширение сосудов на опухоли и изъязвления на ее поверхности. В связи с утолщением стенки кишки при злокачественных неэпителиальных опухолях с экстраорганным и эндофитным ростом, выполнение гемостатической электрокоагуляции, на наш взгляд, является наилучшим способом остановки кровотечения. Рецидивов кровотечения в этих случаях мы не наблюдали.
Второй по частоте причиной толстокишечных кровотечений в наших наблюдениях явился дивертикулез толстой кишки, который был выявлен в 21 (16,8%) случаев. К кровотечению, как правило, приводила аррозия сосуда, расположенного рядом с шейкой дивертикула. Такие кровотечения отличались склонностью к рецидивированию. Признаками, указывающими на недавнее кровотечение, являлись наличие сосуда, прикрытого рыхлым сгустком, а также выступающий над поверхностью тромбированный сосуд, расположенный в непосредственной близости от шейки дивертикула.
Сегодня в мировой медицине успешно и стремительно развивается такая отрасль, как эндоскопическая хирургия раковых опухолей внутренних органов, в частности толстого кишечника. Эндоскопические операции более сложны технически в выполнении, требуют высокого профессионализма от хирурга и передовой хирургической аппаратуры. Поэтому в странах постсоветского пространства такие операции проводят в единичных лечебных учреждениях и стоят они очень дорого, практически как и в ведущих медицинских центрах Западной Европы.
В клиниках Израиля и в частности в одной из самых современных, в Топ Ихилов, такие операции уже давно поставлены на поток – им отдано предпочтение перед открытыми вмешательствами ввиду их малого травматизма, практически нулевых рисков развития осложнений, а также отсутствия необходимости в реабилитационных мероприятиях. И к слову сказать, стоят такие операции в нашей клинике значительно дешевле, чем в Германии или в США: на эндоскопическую хирургию рака толстого кишечника и прямой кишки в Израиле цены на 25-35% ниже по сравнению с указанными странами.
Колоректальные хирурги Топ Ихилов обладают и опытом в проведении эндоскопических операций, и современными техническими средствами – в нашем лечебном учреждении собраны самые последние технические и методологические медицинские наработки.
Эндоскопическая хирургия рака толстого кишечника и прямой кишки в Израиле: методики
Толстый кишечник – это терминальный отдел желудочно-кишечного тракта, заканчивающийся прямой кишкой и анальным отверстием. В толстом кишечнике завершается процесс переваривания пищевого комка и начинается формирование каловых масс. Открытые операции на этом отделе ЖКТ сопряжены с риском инфицирования брюшной полости и развития перитонита. Именно по этой причине врачи стараются избегать открытых оперативных вмешательств на толстом кишечнике и отдают предпочтение эндоскопической хирургии – удалению опухолей без разрезов, кровотечений и осложнений, которыми сопровождается открытая операция.
Эндоскоп – это медицинский прибор, оснащенный источником освещения и мини-камерой, который, в отличие от лапароскопа, вводят в полость оперируемого органа через естественные отверстия организма. Изображение с камеры, увеличенное во много раз, выводится на монитор компьютера. Таким образом, хирург отчетливо видит всю картину так сказать изнутри и вооруженным глазом.
Эндоскопическую операцию при колоректальном раке выполняют трансанальным доступом – эндоскоп вводят через анальное отверстие. Вместе с эндоскопом в полость кишки подают микрохирургические инструменты.
Различают такие виды эндоскопических операций при раке толстой и прямой кишки:

- эндоскопическую полипэктомию – удаление кишечных полипов при обнаружении единичных раковых клеток в них и не проросших в глубокие слои кишечной стенки. Одномоментно с иссечением полипа коагулируют сосуды – прижигают электрическим током во избежание кровотечения;
- эндоскопическую диссекцию – местное иссечение раковой опухоли, которая еще не успела дать метастазы и прорасти стенку кишки, вместе с участком слизистого и подслизистого слоев, но без лимфатических узлов;
- эндоскопическую электрорезекцию – выжигание опухоли электрическим током, источник которого подводится к опухоли с помощью эндоскопа;
- стентирование – это расширение просвета толстой кишки с помощью специальной саморасширяющейся трубки, которую вставляют в саму опухоль, раздвигая ее ткани и открывая проход для каловых масс.
Эндоскопическая хирургия рака толстого кишечника и прямой кишки в Израиле, по отзывам пациентов, переносится очень легко и не требует длительной госпитализации после операции – пациентов выписывали из клиники, как правило, уже через день.
Но не во всех случаях можно прибегать к эндоскопическим операциям. Такого рода вмешательства применимы при небольших опухолях, которые не проросли кишечную стенку, не поразили лимфатические узлы и не дали метастазы. В остальных случаях врачи принимают решение о проведении лапароскопических вмешательств.
Диагностика перед эндоскопической операцией
В Топ Ихилов диагностическая программа составляется индивидуально, с учетом всех анатомо-физиологических особенностей пациента и клинической картины опухолевого процесса. Все данные выясняются в ходе обследования, которое длится, как правило, 3 дня. И это подтверждают отзывы об эндоскопической хирургии рака толстого кишечника и прямой кишки в Израиле, которые оставляют наши пациенты со словами благодарности за быстро и точно поставленный диагноз.
В день прилета в страну пациент в сопровождении куратора-переводчика, который является сотрудником международного отдела и обеспечивает встречу в аэропорту, трансфер до гостиницы и клиники, попадает на прием к врачу онкологу. В этот же день врач составляет для пациента программу обследования, в которую входят такие диагностические процедуры:
- лабораторная диагностика (анализ крови на онкомаркеры, анализ кала на скрытую кровь);
- колоноскопия, ректороманоскопия;
- рентгенографические методы обследования органов брюшной полости;
- трансанальное УЗИ;
- КТ, ПЭТ-КТ;
- биопсия и гистологический анализ полученных материалов.
Все обследование длится 1 день. А на следующий день врачи уже имеют четкую картину болезни и подбирают подходящий для данного пациента метод оперативного вмешательства.
Эндоскопическая хирургия рака толстого кишечника и прямой кишки в Израиле – стоимость
В израильской клинике Топ Ихилов медицинское обслуживание, в частности эндоскопическая хирургия, находится на высочайшем уровне и ни в чем не уступает таковому в европейских и американских лечебных учреждениях. А вот в вопросе стоимости эндоскопическая хирургия рака толстого кишечника и прямой кишки в Израиле наш медицинский центр значительно выигрывает у западных центров. Поскольку разница в ценах существенная и может достигать 40%. Так, цены на эндоскопическую хирургию рака толстого кишечника и прямой кишки в Израиле ниже европейских и американских на 25-35%.
Лазерная реканализация опухоли толстой кишки
Колоректальный рак занимает третье место в структуре онкологической патологии в большинстве развитых стран мира, а количество пациентов с запущенными формами заболевания достигает 70% [2]. Наибольшая смертность при этом регистрируется в странах Западной Европы (34,3 человека на 100 000 населения), а наименьшая – в США (15,2 человек на 100 000 населения) [1, 6, 9, 21, 24]. В Республике Беларусь также отмечается рост заболеваемости колоректальным раком. За последние 11 лет (с 1990 по 2011 гг.) число пациентов с впервые установленным диагнозом рака данной локализации увеличилось с 12,9 до 19,5 человек на 100 тысяч населения [4].
До 70% пациентов доставляется в стационар в экстренном порядке (при этом в абсолютном большинстве случаев развившиеся осложнения стали первым проявлением болезни). Самое частое осложнение колоректального рака – обтурационная кишечная непроходимость. Она развивается у 26,4–69% больных [7, 17]. Наиболее характерно это осложнение для опухолей левых отделов толстой кишки (67–72%), что связано с особенностями местного роста (эндофитный, циркулярный), спецификой интрамурального лимфооттока, а также большей плотностью опухоли этой локализации и меньшим диаметром кишки [16, 18, 19, 20, 23]. От колоректального рака ежегодно в мире погибает более ста тысяч человек [22]. По официальным данным, в Республике Беларусь в 2009 г. всего от рака толстой кишки умерло 2173 человека, или 22,9 на 100 тысяч населения (городских жителей – 1628, или 23,1 на 100 тысяч населения, сельских жителей – 545 или 22,2 на 100 тысяч населения); в 2011 г. от этой локализации рака умерло 2278 человек или 24,0 на 100 тысяч населения (городских жителей – 1750 или 24,5 на 100 тысяч населения, сельских жителей – 528 или 22,7 на 100 тысяч населения) [13, 14]. При этом в большинстве экономически развитых стран мира на сто вновь выявленных больных раком ободочной и прямой кишки приходится более 70 умерших, из которых на первом году с момента установления диагноза погибает около 40% пациентов. Эта закономерность обусловлена тем, что при первичном обращении пациентов к врачу запущенные формы рака (III–IV стадия) диагностируются у 71,4% пациентов с раком ободочной кишки и у 62,4% – в случаях заболевания раком прямой кишки [15].
Развитые страны мира несут огромные экономические потери в связи с поражением населения колоректальным раком. Например, в США стоимость комплексного лечения больных с этой локализацией рака занимает второе место по затратам на лечение онкобольных, составляя 6,5 миллиарда долларов в год [6].
До настоящего времени хирургическая тактика при обтурационной толстокишечной непроходимости на фоне колоректального рака продолжает оставаться предметом оживленной дискуссии. Нет общепринятых подходов к выбору методов хирургического пособия и завершения операции, что требует дальнейшего научного поиска и изучения возможности реализации новых направлений решения проблемы.
Одним из способов реканализации зоны стеноза является лазерная вапоризация центральной части раковой опухоли. Для эффективного испарения и коагуляции ткани опухолей желудочно-кишечного тракта используют различные модели высокоэнергетических лазеров, совместимые с эндоскопическим комплексом. При этом наибольшую популярность приобрели аргоновый лазер (длина волны 514 нм), полупроводниковый лазерный скальпель (970 нм) и неодимовый лазер на алюмоиттриевом гранате (Nd:YAG-лазер,1064 нм) [3, 8, 10, 11, 23]. Достаточно быстрое достижение порога вапоризации при контактном методе применения лазерного излучения способствует быстрому испарению патологической ткани, которое, в свою очередь, обеспечивает эффективное охлаждение и предупреждение глубокого ожога тканей кишки [3].
В настоящее время методической информации по применению лазерного излучения в хирургической эндоскопии явно недостаточно. Хирургами используются различные по своей технике и режимам инсталляции лазерного излучения приемы фотодеструкции патоло- гических тканей. Это отрицательно сказывается на частоте, эффективности и безопасности применения лазерного излучения в практике внутрипросветной гастроинтестинальной эндоскопии, вызывает обоснованную неуверенность у большинства практических эндоскопистов, не имеющих надлежащих условий для отработки оптимальных методик в эксперименте и на практике [3, 10, 12].
Повысить эффективность комплексного лечения стенозирующего колоректального рака путем разработки и внедрения технологии лазерной реканализации опухоли и ускоренной подготовки пищеварительного тракта к радикальному хирургическому лечению с первичным восстановлением непрерывности пищеварительного тракта.
Проведено проспективное клиническое исследование с оценкой результатов лечения 24 пациентов со стенозирующим колоректальным раком, обусловившим развитие непроходимости кишечника. Возраст пациентов варьировал от 54 до 81 года (в среднем 62,4 ± 7,32 года). Женщин было 13 (54,2%), мужчин – 11 (45,8%). У всех пациентов имели место признаки толстокишечной непроходимости: неотхождение стула и газов в течение последних 2–4 суток, вздутие живота, пневматоз толстой кишки (выявляемый перкуторно и рентгенологически) с дилятацией ее просвета в 2–2,5 раза, пневматоз тонкой кишки. Пациенты разделены на 2 группы (таблица).
| Локализация стенозирующей опухоли | Основная группа (n=10) | Контрольная группа (n=14) |
|---|---|---|
| Рак прямой кишки | 3 | 4 |
| Рак ректосигмоидного отдела толстой кишки | 3 | 5 |
| Рак сигмовидной кишки | 2 | 3 |
| Рак нисходящего отдела | 2 | 3 |
В первой (основной) группе при поступлении пациентов в стационар (до 24 часов) всем им выполняли лечебно-диагностическую ректо- или колоноскопию, во время которой (после установления диагноза стенозирующей опухоли толстой кишки и биопсии) производили лазерную вапоризацию внутренней части опухоли с восстановлением просвета пищеварительной трубки в зоне опухоли не менее чем на 0,8–1 см. После лазерной реканализации пациентам выполняли сифонную клизму, которая в 100% случаев приводила к эффективному антеградному опорожнению толстой кишки. Пациентам назначали слабительные и вазелиновое масло. В комплекс лечения включали ежедневную инфузионную терапию (кристаллоидные и коллоидные растворы, калий-поляризующую смесь, по показаниям – препараты парентерального питания), внутривенно вводили диаветол 15–20 мг/кг (по сухому веществу), эмоксипин 1,5–2,5 мг/кг, пентоксифиллин 0,2%-ный раствор 200–400 мл/сутки и реамберин 400–800 мл/сутки (или цитофлавин 10 мл раствора в 100 мл 0,9%-ного раствора хлорида натрия). Через 4–6 суток, не выписывая пациента из стационара, в состоянии клинико-метаболической компенсации выполняли радикальную операцию с первичным восстановлением непрерывности пищеварительного тракта (только у 1 пациента реканализация опухоли стала окончательной симптоматической операцией ввиду тяжести фоновой патологии с декомпенсацией функции сердечно-сосудистой системы). В качестве радикальных вмешательств выполнены резекция сигмовидной кишки (2), передняя низкая резекция прямой кишки (6), левосторонняя гемиколэктомия (1) с первичным восстановлением непрерывности пищеварительного тракта с помощью циркулярного механического шва.
Во второй (контрольной) группе при безуспешности консервативных мероприятий после предоперационной подготовки (от 6 до 25 ча- сов) выполнены неотложные вмешательства: левосторонняя гемиколэктомия с концевой трансверзостомией (2), операция типа Гартмана – обструктивная резекция сигмовидной кишки с концевой сигмостомией (6), петлевая сигмостомия (4), трансверзостомия (2).
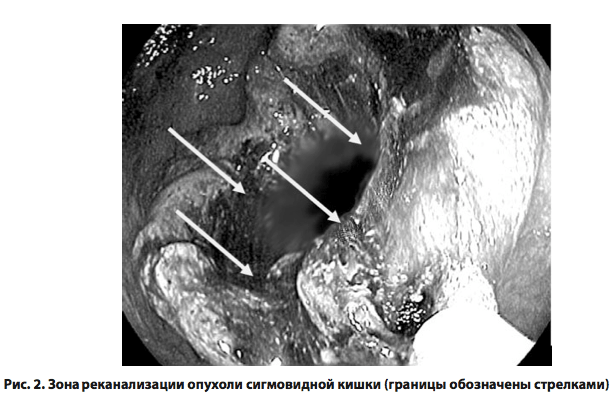
Отрабатывая режим вапоризации, было установлено, что наиболее эффективное расстояние от торца кварцевого световода до облучаемой ткани составляет 3–5 мм. При этом обработку выступающей части опухоли производили в сканирующем режиме по периметру стенозирующей опухолевой ткани. Контакт торца световода с тканью приводил к обгоранию световода с последующим снижением эффективности вапоризации.
Процедура лазерной реканализации продолжалась от 25 до 65 ми- нут (в среднем 40,0 ± 11,4 минуты). Лазерную вапоризацию внутренней части опухоли проводили до восстановления просвета пищеварительной трубки в зоне опухоли не менее чем до 0,8–1 см. В 5 случаях (50%) потребовалась повторная лазерная вапоризация опухолевой ткани для достижения целевых размеров реканализации. Даже при неполном восстановлении просвета толстой кишки в зоне опухоли уже в первые сутки после манипуляции у пациентов обильно отходили газы, у 40% был самостоятельный стул. Через сутки у всех пациентов отсутствовали клинико-рентгенологические признаки непроходимости толстой кишки. Максимальный эффект реканализации отмечен спустя 3–4 дня после лазерной процедуры (рис. 2), что было обусловлено постепенным отторжением некротических тканей в просвет кишки. Кровотечений, связанных с отторжением девитализированных опухолевых тканей, отмечено не было.
Проведенная лазерная реканализация позволила провести адекватную подготовку толстой кишки и выполнить плановую радикальную резекцию сигмовидной кишки без осложнений. После лазерной деструкции и восстановления просвета толстой кишки в зоне опухоли ставили сифонную клизму, проведение которой приводило к обильному отхождению стула и газов. Пациентам назначали слабительные и вазелиновое масло. В комплекс лечения включали ежедневную инфузионную терапию (кристаллоидные и коллоидные растворы, калий- поляризующую смесь, по показаниям – препараты парентерального питания), внутривенно вводили диаветол 15–20 мг/кг (по сухому веществу), эмоксипин 1,5–2,5 мг/кг, пентоксифиллин 0,2%-ный раствор 200–400 мл/сутки и реамберин 400–800 мл/сутки (или цитофлавин 10 мл раствора в 100 мл 0,9%-ного раствора хлорида натрия). Последние позволили в 90% случаев в течение 2–3 суток добиться клинико- метаболической компенсации и восстановления моторно-эвакуаторной функции пищеварительного тракта.
Через 4–6 суток, не выписывая пациента из стационара, в состоянии клинико-метаболической компенсации выполняли радикальную операцию с первичным восстановлением непрерывности пищеварительного тракта (только у 1 пациента 83 лет реканализация опухоли стала окончательной симптоматической операцией ввиду тяжести фоновой патологии с декомпенсацией функции сердечно-сосудистой системы на фоне ИБС, постинфарктного крупноочагового кардиосклероза с недостаточностью кровообращения 2А, аневризмой восходящего отдела аорты, артериальной гипертензией III, риск 4). В качестве радикальных вмешательств в этой группе пациентов выполнены резекция сигмовидной кишки (2), передняя низкая резекция прямой кишки (6), левосторонняя гемиколэктомия (1) с первичным восстановлением непрерывности пищеварительного тракта с помощью циркулярного механического шва. Осложнений в послеоперационном периоде зарегистрировано не было. Все пациенты были выписаны из стационара в удовлетворительном состоянии для реабилитации в амбулаторных условиях. Средний койко-день (с учетом первого этапа лечения) составил 17,3 ± 6,72.
В группе сравнения при безуспешности консервативных мероприятий после предоперационной подготовки (от 6 до 25 часов) выполнены неотложные вмешательства: левосторонняя гемиколэктомия с концевой трансверзостомией (2), операция типа Гартмана – обструктивная резекция сигмовидной кишки с концевой сигмостомией (6), петлевая сигмостомия (4), трансверзостомия (2). Выраженные признаки непроходимости кишечника потребовали интраоперационного использования различных методик зондовой декомпрессии кишечника в 71,4% случаев. Послеоперационный период у всех пациентов протекал тяжело. Во всех наблюдениях он требовал применения дополнительных способов восстановления моторно-эвакуаторной функции пищеварительного тракта (интестинального диализа, фармакологической стимуляции кишечника), проведения вспомогательных методик афферентной терапии и системного антибактериального лечения. Несмотря на интенсивное лечение, у ряда пациентов этой группы зарегистрированы послеоперационные осложнения: пневмония (14,3%), инфекция области послеоперационного вмешательства (35,7%), тромбофлебит глубоких вен (7,1%). Средний койко-день у пациентов этойгруппы составил 28,7 ± 9,28 дней.
1. Лазерная реканализация опухоли толстой кишки позволяет в условиях непроходимости кишечника выполнить раннюю антеградную декомпрессию пищеварительного тракта с быстрым восстановлением его моторно-эвакуаторной функции и раннейклинико-метаболической компенсацией (без лапаротомии и формирования кишечного свища). Предлагаемый подход позволяет в ограниченные сроки осуществить подготовку пациента к радикальному вмешательству, не выписывая его из стационара, способствует повышению надежности хирургического лечения и эффективности одномоментного восстановления непрерывности пищеварительного тракта.
4. В условиях запущенности онкологического процесса или наличия абсолютных противопоказаний к хирургическому лечению лазерная реканализация (изолированная или в сочетании со стентированием просвета толстой кишки) может стать окончательным вариантом лечебного пособия в условиях прогрессирования признаков кишечной непроходимости.
Читайте также:

