Диспансеризация при раке пищевода
Глава 14 ДИСПАНСЕРИЗАЦИЯ БОЛЬНЫХ
Все онкологические больные подлежат диспансеризации в специализированных онкологических учреждениях. Научно-исследовательские и лечебно-профилактические учреждения, занимающиеся изучением, лечением и профилактикой злокачественных опухолей, называются онкологическими, от греческого слова onkos – опухоль. Научные работники и врачи этих учреждений называются онкологами. Онкологический диспансер является основным звеном в системе противораковой борьбы, обеспечения квалифицированной, специализированной стационарной и поликлинической медицинской помощи населению, осуществляет организационно-методическое руководство и координирование деятельности всех онкологических учреждений, находящихся в его подчинении. Специалисты этого лечебного учреждения систематически изучают состояние заболеваемости злокачественными новообразованиями и смертность от них, разрабатывают комплексные планы противораковых мероприятий, проводят семинары с целью повышения квалификация врачей и средних медицинских работников лечебно-профилактических учреждений по вопросам онкологии.
Первичным звеном в организации онкологической помощи населению являются онкологические кабинеты (отделения ) при поликлиниках. Они являются массовыми проводниками онкологических идей в лечебную сеть страны, первыми консультантами поликлинических врачей по вопросам лечения и диагностики онкологических больных, организаторами профилактических осмотров населения на выявление онкологических заболеваний. От них зависят полнота регистрации онкологических больных, эффективность их диспансерного наблюдения.
Все пациенты распределяются по следующим клиническим группам:
Iа – с заболеваниями, подозрительными на злокачественную опухоль;
Iб – с предопухолевыми заболеваниями;
II – со злокачественными опухолями, подлежащими радикальному лечению;
III – излеченные от рака (практически здоровые);
IV – в запущенной стадии заболевания, подлежащие лишь симптоматическому лечению.
Многие пациенты, особенно после радикальных операций, считают, что дело сделано и они могут беззаботно жить. К сожалению, это возможно только при других заболеваниях. Не забывайте, что даже после комплексного лечения могут оставаться маленькие остатки опухоли под слизистой оболочкой органа, которые клинически проявят себя лишь спустя некоторое время (рецидив). Возможно также появление дочерних опухолей (метастазы). Своевременно выявленные, они могут быть с успехом удалены. Вот почему столь важно регулярное обследование пациента даже после окончания курса основного лечения. К тому же возможно побочное действие некоторых поддерживающих медикаментов или обострение сопутствующих заболеваний. Не стоит удивляться, если будет предложено рентгенологическое обследование легких или костей, ибо врач может заподозрить наличие метастазов в этих органах. Не исключены ультразвуковое исследование печени и серия анализов крови, также имеющие важное диагностическое значение. При заболеваниях органов пищеварительного тракта возможны эндоскопические исследования и компьютерная томография.
Согласно изложенной выше классификации больные, закончившие радикальное лечение и считающиеся выздоровевшими, относятся к III клинической группе. Хотя они считаются практически здоровыми, для возврата их к прежним условиям жизни (в быту, в семье, в коллективе) необходим ряд медицинских и социальных мероприятий. Лечебно-профилактические мероприятия по ликвидации последствий заболевания называются реабилитацией, от лат. reabilitatio – восстановление прежнего состояния. Процесс реабилитации начинается в онкологических (или общеклинических) учреждениях, производивших радикальное лечение, и продолжается в процессе диспансеризации больного. Реабилитация больного – это разработка и осуществление индивидуального плана восстановления его нарушенного психического, морального, физического и физиологического состояния. Это длительный процесс, требующий не только активной медицинской помощи, но и воздействия оздоровляющих факторов семейного и бытового окружения.
Выписка больного из стационара сопровождается эмоциональной напряженностью. Тревожит вопрос дальнейшей жизненной перспективы, неясность служебных и семейных отношений. Угнетает возможность рецидива. В этих условиях важно переключить интересы больного с факта заболевания на широкие возможности оздоровления и принятие профилактических мер. Не стоит заострять внимание на прошедших этапах лечения, ведь нужно еще многое сделать, чтобы предупредить развитие рецидива, тем более что и в этой, и в других книгах можно почерпнуть много информации, способствующей этому процессу.
Угроза рецидива злокачественной опухоли в первые годы после радикального лечения вполне реальна. Это тревожит пациентов, состоящих на учете в III клинической группе. У некоторых развиваются мнительность, тревожно-депрессивное состояние. Повышенную мнительность следует снять не высмеиванием жалоб и опасений, а внимательным отношением к ним. Надо помнить, что психическая депрессия больного является не только фактором, способствующим злокачественному росту, но и ранним симптомом некоторых локализаций злокачественной опухоли. Игнорируя жалобу мнительного больного, можно не выявить рецидив своевременно.
Думаю, вы обратили внимание, что одной из клинических групп является Iб, то есть предопухолевые заболевания. И хотя мы старались дать максимально больше информационного материала (в пределах издательских возможностей) для тех, кому уже установлен диагноз, нельзя обойти молчанием этот вопрос. Во-первых, пациент после радикального лечения сам становится практически здоровым человеком, а во-вторых, подавляющее большинство читателей прохладно относится к своему здоровью и не спешит в поликлинику, чтобы пройти очередное обследование в соответствии с планом оздоровления, имеющегося у домашнего (участкового) врача. Мне, как практикующему 40 лет врачу и бывшему руководителю лечебного учреждения, эти проблемы хорошо известны.
Подавляющее большинство больных, у которых выявлены злокачественные опухоли, прежде страдали каким-либо хроническим заболеванием. Больные раком желудка отмечают в анамнезе хронический анацидный гастрит, язву или полип желудка, пищевода – рефлюкс, толстой кишки – полипы (или полипоз) и т. д. И это естественно, ибо рак чаще всего возникает в патологически измененных тканях, длительно находившихся под действием различных повреждающих факторов (физических, химических, биологических).
Клинически и экспериментально установлено, что некоторые патологические процессы чаще других предшествуют появлению злокачественных новообразований. Поэтому эти хронические процессы называют предопухолевыми или предраковыми заболеваниями. Но возникновение злокачественной опухоли у человека, страдающего этими заболеваниями, не является обязательным. Хронический анацидный гастрит – очень распространенное заболевание, а злокачественная опухоль желудка возникает в очень небольшом проценте случаев. Неисправный зубной протез, травмирующий край языка, – явление частое, однако злокачественная опухоль возникает лишь у некоторых из подвергающихся этой травматизации. Привычку сковыривать бородавку или прыщик на лице, срывать корочку с длительно не заживающей ранки имеют многие, но далеко не у всех в этом месте развивается злокачественная опухоль.
Большинство предопухолевых заболеваний представляют собой лишь благоприятный фон для возникновения злокачественной опухоли, но это возникновение необязательно, поэтому они называются факультативными (необязательными) предопухолевыми заболеваниями. Но, поскольку риск развития рака при этом реален, задачей лечебных учреждений является выявление заболевших и своевременное квалифицированное лечение их соответствующими специалистами и службами. Терапевты занимаются больными с хроническими гастритами, язвой желудка, хроническими язвенными колитами. У хирургов на диспансерном учете состоят пациенты с полипами прямой кишки, незаживающими трещинами и свищами анального канала. Различные изменения в полости рта наблюдаются у стоматологов.
Онкологи осуществляют контроль учета и лечения больных с предраковыми заболеваниями в лечебных учреждениях. Многолетние наблюдения показали, что некоторые из этих болезней обладают большей агрессивностью и чаще становятся причиной рака. Есть и такие предопухолевые процессы, которые обязательно ведут к злокачественному росту опухоли. Они называются облигатными (обязательными) предраками. Этих заболеваний немного, встречаются они преимущественно в дерматологической практике. Облигатные предраки подлежат наблюдению в онкологических учреждениях. Лечение этих больных осуществляется по направлениям онкологов и под их контролем. К заболеваниям с повышенной возможностью возникновения злокачественного роста и требующих специальных методов определения начала опухолевого роста относятся полипоз и каллезная язва желудка, очаговый гиперпластический ригидный гастрит, семейный полипоз толстого кишечника.
Больные с предопухолевыми заболеваниями подлежат радикальному лечению в специализированных учреждениях. Это лечение часто является сложным и продолжительным. Например, при тотальном полипозе толстой и прямой кишок производятся поэтапные электрокоагуляции полипов или экстирпация (удаление) толстой кишки. Даже если заболевание протекает без выраженной кровопотери и расстройства функции кишечника, больные нередко не соглашаются на такие обширные и повторные вмешательства. У некоторых больных оперативное лечение сопряжено с определенным риском. В этих случаях больным, состоящим на учете в онкологическом кабинете по клинической группе Iб, необходимо проходить систематический контроль каждые 3–6 месяцев, а также консервативную терапию и диетическое лечение с целью профилактики травматизации полипов и снятия воспалительного компонента. В случае обнаружения при очередном контрольном исследовании злокачественного роста показания к оперативному лечению становятся жизненными. Все больные, подвергшиеся радикальному лечению по поводу предопухолевых заболеваний, остаются на учете в онкологическом учреждении один год. При отсутствии признаков рецидива они снимаются с учета.
Данный текст является ознакомительным фрагментом.
В первые 1-2 года физикальный осмотр и сбор жалоб рекомендуется проводить каждые 3-6 месяца, на сроке 3-5 лет – 1 раз в 6-12 месяцев. После 5 лет с момента операции визиты проводятся ежегодно или при появлении жалоб.
- Анамнез и физикальное обследование.
- Развернутый клинический и биохимический анализ крови (по клиническим показаниям).
- ЭГДС.
- УЗИ или КТ органов брюшной полости (по клиническим показаниям).
- Рентгенография органов грудной клетки (по клиническим показаниям).
- Онкомаркеры (если были повышены исходно) (по клиническим показаниям).
- Контроль нутритивного статуса, рекомендации по лечению нутритивной недостаточности.
Для предупреждения развития РЖ применяют два основных направления профилактических мер.
Первичная профилактика включает мероприятия, имеющие отношение к неопределённому кругу лиц, то есть затрагивающие интересы не только включённых в группу повышенного риска.
- правильное питание;
- отказ от вредных привычек;
- проведение осмотров у врача с целью раннего диагностирования и лечения онкологического процесса.
Для первичных профилактических мероприятий требуется активное участие самого человека.
К вторичной профилактике относятся мероприятия врачей в отношении пациентов, включённых в группу риска.
Эрадикация (устранение) хеликобактерной-инфекции
Лечение Нр-инфекции проводится по стандартным схемам, эффективность которых доказана в ходе исследований. Схему и продолжительность лечения определяет врач (предпочтительно 14 дней, иначе шансы на успех меньше). Спустя 4–8 недель после окончания лечения следует провести оценку его результата. Для этого может быть использован 13С-дыхательный тест либо ЭГДС с гистологической оценкой наличия Нр-инфекции.
Успешная эрадикация Нр значимо снижает риск развития РЖ, однако не устраняет его полностью в тех случаях, когда уже развилась атрофия, кишечная метаплазия либо дисплазия слизистой оболочки желудка. Таким пациентам может потребоваться дальнейшее наблюдение.
Изменение образа жизни
– отказ от курения, нормализация массы тела, смена характера питания (с учетом пищевых факторов риска).
Раннее выявление рака с помощью скрининга
Как правило, для скрининга широких масс населения используют неинвазивные тесты: в случае хеликобактерной-инфекции – 13С-дыхательный тест или анализ крови на антитела к хеликобактеру.
Наблюдение предраковых изменений
Атрофический гастрит, кишечная метаплазия и дисплазия слизистой оболочки желудка рассматриваются как предраковые изменения.
Наблюдение означает регулярное проведение ЭГДС с биопсией, которая должна выполняться по определенным правилам. Частота наблюдения может составлять от 1 раза в 6 месяцев до 1 раза в 3–5 лет и зависит от степени изменений в желудке. Так, например, более часто должны обследоваться пациенты, у которых выявлялась дисплазия, а также распространенная кишечная метаплазия в фундальном отделе (теле) желудка.
Пациентам с атрофией или метаплазией, локализованной только в антральном отделе желудка, частое наблюдение не требуется.
Рак пищевода встречается нечасто, ежегодно поражает чуть более 7,5 тысяч россиян или 8–9 человек из 100 тысяч населения, преимущественно пожилого возраста. Самые высокие показатели, двадцатикратно превышающие российские, отмечены в Китае, Корее, Японии, Монголии, Иране и Бразилии.
В структуре мужской онкологической заболеваемости рак пищевода взял 2, 5%, тогда как среди женских раков — только 0,5%. Это совсем не женское заболевание, мужчины болеют почти в четыре раза чаще и начинают болеть раньше. В мужской когорте средний возраст выявления онкологического поражения пищевода 64 года, то в женской — после 70 лет.
- Факторы риска
- Клиническая картина
- Диагностика
- Лечение рака пищевода
- Паллиативное лечение распространённого рака пищевода
Факторы риска
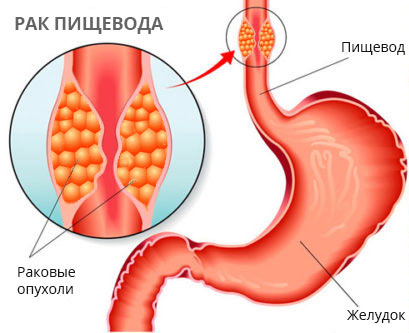
Есть ещё одна проблема — проблема личности. Для жителей Средней Азии, пьющих обжигающий чай, рак пищевода — традиционная болезнь. Злокачественная опухоль пищевода поражает пьющих крепкие алкогольные напитки, курящих, потребляющих некачественную пищу. Не минует рак пищевода и граждан с избыточным весом.
Второе заболевание, с довольно высокой частотой приводящее к развитию аденокарциномы пищевода — пищевод Барретта. При пищеводе Барретта нормальный природный плоский эпителий слизистой оболочки в месте перехода в желудок локально, буквально гнёздами, замещается нетрадиционным цилиндрическим эпителием, такое состояние частичной замены называется метаплазией. И то воздействие различных жизненных факторов, которое легко переносит плоский эпителий, совершенно не подходит цилиндрическому, он страдает и сбивается с курса, давая рост раковым клеткам. Все больные пищеводом Барретта должны наблюдаться и лечиться, во избежание развития рака.
Эти факторы риска развития рака пищевода устранимы. Но есть и неустранимый — ахалазия пищевода, двадцатикратно увеличивающая вероятность рака. Заболевание обусловлено ненормальным регулированием нервной системой сокращений пищевода при передвижении по нему пищи и правильного открытия сфинктера у входа в желудок. Пищевод сужается циркулярными рубцами, а над сужением возникает чрезмерное расширение. Особенность в том, что твёрдая пища проходит легко, а вот жидкая — плохо. При этом состоянии пища проходит очень плохо, подолгу застаиваясь в расширении и формируя хроническое воспаление слизистой оболочки. При воспалении начинается избыточное деление клеток эпителия слизистой, и сбой одной клетки с правильной программы может дать начало раку.
Клиническая картина
В пищеводе есть физиологические сужения, где преимущественно и начинается злокачественный рост. Сужения эти обусловлены прохождением вблизи других анатомических образований — аорты и развилки трахеи на бронхи, в местах перехода глотки в пищевод и пищевода в желудок тоже имеется небольшое сужение. Считается, что здесь слизистая более подвержена мелким травмам грубой пищей, значит, чаще возникает воспаление. Тем не менее, в шейном отдела частота рака составляет 10%, в нижней трети пищевода — 30%, а 60% раков образуется в среднем сегменте.
Злокачественные клетки не только растут в толщу органа, как бывает при большинстве раковых образований, они ещё и мигрируют по мелким лимфатическим сосудикам. Сосудики формируют внутри пищеводной стенки полноценную лимфатическую сеть, распространяя опухоль внутри, поэтому протяжённость опухоли может быть и 5, и 10, и 15 сантиметров.
В запущенной стадии локализация определяет симптоматику, а первыми признаками считается ощущение прилипания пищи к одному и тому же месту или царапание слизистой кусочком еды. По мере прогрессирования появляется затруднённое прохождение сначала твёрдых кусочков, потом каши, далее жидкости. Всё этот называется дисфагия. Сначала пациент запивает кусочки еды водой, проталкивая их, после это уже не помогает, нарушается питание, человек худеет. Соприкосновение опухоли с пищей приводит к воспалению, появляется неприятный гнилостный запах, при регулярной травме рыхлая слизистая опухоли начинает кровоточить, может развиться опасное для жизни кровотечение.
Присоединяются боли, поскольку пищевод сокращается перистальтическими волнами, боль имеет спастический характер. Прорастание опухоли через всю толщу пищеводной стенки делает боль постоянной, локализуется она между лопатками. Инфильтрация опухолью клетчатки средостения вовлекает в процесс возвратный нерв, отвечающий за движение голосовых связок, появляется осиплость и попёрхивание при питье. Нерв могут сдавить увеличенные метастазами лимфатические узлы и пропадёт звучность голоса.
Как и при ахалазии, над сужением пищевода опухолью образуется расширение, где копится еда. Ночной заброс скопившихся пищевых масс в дыхательное горло тоже может привести к пневмонии. А днём беспокоит сильная слабость, температура. Если в процесс вовлечены дыхательные пути, то может сформироваться соустье между пищеводом и трахеей или крупными бронхами — свищ, по которому крошки еды будут попадать в дыхательную трубку, вызывая кашель и пневмонию. Если такой свищ откроется из пищевода в клетчатку средостение, то её воспаление приведёт к смерти.
Диагностика
Современная диагностика, сделавшая с конца прошлого века рывок в развитии, активному выявлению опухоли пищевода помогает мало, только у 6,4% из всех заболевших опухоль находят до появления ярких клинических признаков. Как и в докомпьютерную медицинскую эру рак пищевода на I–II стадии выявляют только у 28,2%, на III стадии — у 36,4%, и треть попадает к доктору уже с отдалёнными метастазами. По причине запущенности 60% больных с момента выявления рака не проживут и года, а 5 лет проживают только 32,3%.
Статистические показатели у россиян хуже только при раке печени и поджелудочной железы, действительно высокозлокачественных опухолях с весьма высоким метастатическим потенциалом. По степени злокачественности рак пищевода отнюдь не под стать им, просто у 73% рак выявляется в распространённом варианте, когда возможности терапии ограничены сугубо паллиативной помощью.
Лечение рака пищевода
Главный и основной метод терапии — хирургия, но выявление опухоли в запущенном состоянии при невозможности замены всей пищеводной трубки аналогичной анатомической структурой — техническое ограничение хирургических возможностей, не всегда даёт желаемый результат. Поэтому к операции подключают лекарственную и лучевую терапии. Выбор ведущего метода лечения диктуется размерами и локализацией опухоли, состоянием больного и сопутствующими заболеваниями.

Паллиативное лечение распространённого рака пищевода
В этой ситуации на передний план выходит полная невозможность питания через практически закрытый опухолью пищевод. Часто прибегают к расширению — реканализации или установке специального стента в пищеводе. Стенты обязательны при соединении пищевода и трахеи или бронхов соустьем — опухолевым свищом, что предотвращает заброс пищи в дыхательное дерево и уберегает от пневмонии. В некоторых случаях во время эндоскопии опухоль частично разрушают лазером, используя фотодинамическую терапию. Вариантов лечения рака пищевода достаточно, надо вовремя и умело их использовать.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
В статье представлены современные методы диагностики и прогноз рака пищевода. Отмечается, что в связи с большим процентом (до 40%) бессимптомного течения рака пищевода для его диагностики рекомендуются такие методики, как эндоскопия с хромоскопией, эндоскопическое ультразвуковое исследование, компьютерная томография для определения метастазов и прицельная биопсия слизистой оболочки с гистологическим исследованием.
Прогноз рака пищевода в первую очередь зависит от диагностируемой стадии болезни и соответствующего метода лечения. В целом он неблагоприятный, так как поздно диагностируется, а процент пятилетней выживаемости не достигает 10.
The paper outlines the currently available techniques for diagnosing and predicting esophageal cancer. It is noted that due to the great proportion (as much as 40%) of its asymptomatic course; techniques, such as endoscopy with chromoscopy, endoscopic ultrasound, computerized tomography for detection of metastases, and multiple target mucosal biopsy with histology are recommended for the diagnosis of the disease.
The prognosis of esophageal cancer primarily depends on the stage of the disease and appropriate treatment. By and large, it is poor as the disease is late detectable and the survival rate is not as much as 10.
С.И. Рапопорт, М.Ю. Тельных
Объединенный научно-учебный центр гастроэнтерологии (терапия) (дир. - член-корр. РАМН В.Т. Ивашкин) РАМН, ММА им. И.М. Сеченова
S. I. Rapoport, M. Yu. Telnykh
United Research and Training Center for Gastroenterology (Therapy) (its Director is
V. T. Ivashkin, Corresponding Member of the Russian Academy of Medical Sciences), Russian Academy of Medical Sciences, I. M. Sechenov Moscow Medical Academy
П роблема лечения рака пищевода, впрочем как и других злокачественных опухолей, заключается преимущественно в его ранней диагностике. Примерно в 40% случаев ранний рак пищевода протекает бессимптомно [6], у остальных больных могут возникать атипичные симптомы, такие как пищеводная или загрудинная боль во время глотания, преходящая дисфагия, ощущение инородного тела и боль в эпигастрии. Степень дисфагии устанавливается по оценочной шкале (табл. 1) . Большинство систем оценки включают 4 степени тяжести [6,20].
Клиническая оценка общего состояния больных раком пищевода проводится по методу А. Карновского с использованием оценочной шкалы от 100 до 0 (табл. 2) . Оценка общего состояния необходима для решения вопроса о выборе лечебной тактики. Без принятия во внимание возможности наличия специфических противопоказаний рекомендуемый нижний предел индекса А. Карновского для оперативного лечения рака пищевода составляет 70, а для химиотерапии или лучевой терапии - 50. Как правило, больные, находящиеся в тяжелом состоянии, хуже отвечают на любой вид терапии или не отвечают вовсе.
Таблица 1. Оценка тяжести дисфагии
Степень тяжести
Характеристика
Возможность принимать обычную пищу
Невозможность принимать отдельные виды твердой пищи
Употребление только мягкой, полужидкой пищи
Употребление только жидкой пищи (свободное)
Невозможность проглотить обычное количество жидкой пищи
Таблица 2. Клиническая оценка общего состояния больных раком пищевода
Таблица 3. Эндоскопическая классификация рака пищевода
| Тип опухоли | Характеристика | Примечание |
| 0 | Подтип 1 - полипозный | С подтипами |
| Подтип 2 - плоский | С вариантами: а)приподнятый, б)плоский, в) углубленный | |
| Подтип 3 - язвенный | ||
| 1 | Выбухающий, полипозный | |
| 2 | Язвенный, локализованный | |
| 3 | Язвенный, инфильтративный | |
| 4 | Разные типы |
Таблица 4. Сравнение 5-летнего ОУВ при раке пищевода в различных странах (данные по статистическим регистрам общего населения, оба пола)
Период исследования
Австралия (юг) [6]
1977-1990 гг.
Япония (Осака) [8]
1981-198 2 гг.
1983-1988 гг.
1978-1985 гг.
Таблица 5. Временная тенденция ОУВ при раке пищевода (данные статистических регистров по общему населению, оба пола)
период исследования
период исследования
1974-1976 гг.
1977-1979 гг.
1977-1982 гг.
1980-1982 гг.
1983-1988 гг.
1983-1990 гг.
Примечание. * - Программа SEER, 9 областей США [1];
** - Южно-австралийский регистр [6].
Таблица 6. Временная тенденция ОУВ при раке пищевода в Европе (по данным JARC, исследование Eurocare [7])
Таблица 7. Временная тенденция частоты возникновения, смертности и ОУВ рака пищевода и желудка в США (данные статистических регистров общего населения, оба пола)
Примечание. п - пищевод, ж - желудок. По данным Программы частота и смертность даны на 100 000 населения, подобрано по возрасту.
Таблица 8. Выживаемость при раке пищевода в зависимости от вида лечения (2-летний УВ)
Популяционное исследование, район Ноттингема
Хирургия и паллиативное лечение
Лучевая терапия
Паллиативное лечение
Регистр Массачусетского общего госпиталя (1950-1979 гг.)
Прогресс эндоскопической диагностики [17, 18] является ключевым моментом в улучшении распознавания рака пищевода на ранней стадии. При эндоскопии основное внимание должно быть сосредоточено на участках более красной или бледной окраски, а также на незначительных изменениях рельефа. При хромоскопии с 2,5% йодным раствором Люголя нормальный эпителий слизистой оболочки пищевода окрашивается в бурый цвет, чего не происходит в опухолевых участках, что указывает на места для проведения биопсии. Выявление ранней железистой метаплазии пищевода требует внимательного изучения пальцевидных разрастаний слизистой оболочки желудка в нижнюю часть пищевода.
Достоверность результатов гистологического исследования зависит как от числа и размеров биоптатов, так и от правильного выбора участка для биопсии. На участках пищевода, покрытых цилиндрическим эпителием, необходимо систематическое проведение биопсий на разных уровнях, так как при таком поиске часто обнаруживаются мелкие опухоли [18].
Определение объема опухоли в пищеводе с помощью эндоскопии или контрастирования бариевой взвесью неточно, поэтому достоверность можно повысить при использовании компьютерной томографии или эхоэндоскопии в 3-мерном режиме. Японское общество по изучению заболеваний пищевода [17] предлагает эндоскопическую классификацию рака пищевода, которая была усовершенствована в 1992 г. (табл. 3) .
Отдельные авторы [5, 7] пытаются установить глубину рака пищевода также с помощью эндоскопии. Однако наиболее точным и информативным методом определения стадии опухоли является эхоэндоскопия. Если при эндоскопии опухоль, которая проникает через мышечную оболочку (Т2), может быть ошибочно принята за поверхностную, при контрольной эхоэндоскопии такие ошибки встречаются у 20-30% больных. Поэтому при дифференцировании поверхностного (Т1) и позднего рака пищевода эффективность эхоэндоскопии составляет по меньшей мере 85% [16, 21].
Для установления стадии рака пищевода не совсем устарел и рентгенологический метод диагностики [21]. В частности, глоток бария помогает оценить продолжительность стеноза и степень расширения пищевода. Компьютерная томография - медиастенальная и абдоминальная - позволяет установить наличие метастазов в печень, лимфатичесие узлы брюшной полости, поражение аорты и бронхиального дерева. Ядерно-магнитный резонанс имеет низкую точность при установлении стадии рака пищевода.
Прогноз рака пищевода
Частота рака пищевода как годовой численный показатель рассчитывается на 100 000 населения, данная выборка стандартизируется по возрасту в зависимости от географической зоны. Удельный вес рака пищевода в России составляет 7,6 на 100 000 населения [I, 2]. Смертность также рассчитывается на 100 000 населения. Уровень 5-летней выживаемости (УВ) определяется относительно конкретного заболевания, отражая общее число смертей от рака пищевода. Этот относительный УВ (ОУВ) теоретически является благоприятным индексом, который помогает сравнивать популяции населения разных стран.
Среднее время выживаемости (СВВ) отражает клиническую динамику больных, которым проводится лечение. СВВ обычно выражается в месяцах или днях. В табл. 4 приведены сравнительные показатели 5-летний ОУВ при раке пищевода в разных странах. Как видно, в течение достаточно длительного времени ОУВ за 5 лет не превышал 10% и не повышался в зависимости от способа лечения. Тем не менее, последние наблюдения показывают тенденцию к улучшению этой ситуации. В частности, данные Программы наблюдений, эпидемиологии и оценки отдаленных результатов лечения Национального противоракового института США (SEER), которые суммируют информацию из 9 регионов за период с 1974 по 1988 г. (табл. 5) , показывают почти удвоение 5-летнего ОУВ за 15 лет. Однако наблюдаются и различия этого показателя в Австралии (табл. 5) и в Европе (табл. 6) . Еще более выражены эти различия 1- и 2-летнего ОУВ в США и Европе ( табл. 6 и 7 ). При сравнении выживаемости при раке пищевода и желудка ( см. табл. 7 ) по данным SEER за период с 1973 по 198 9 г. показатели улучшаются по обоим видам опухоли, однако годовые заболеваемость и смертность снижаются только для рака желудка.
Ряд авторов [4, 14, 20] проводили сравнительную оценку УВ у больных после оперативного лечения, радиотерапии, паллиативных эндоскопических процедур и без лечения в ограниченных географических областях. В частности, одно из исследований было проведено в США [11] по данным 30-летних наблюдений Массачусетского общеклинического госпиталя, другое - в Англии при Ноттингемской переписи населения [13]. Эти данные представлены в табл. 8 . СВВ для хирургического, лучевого и эндоскопического лечения составило соответственно 293, 190 и 100 дней. УВ по данным госпитального регистра США несколько выше (13%), чем в Британском регистре (8%). В обоих исследованиях у больных после резекции пищевода наблюдались более высокие показатели: 38% (США) и 19% (Англия). В исследовании, которое было проведено на аналогичной выборке населения во Франции на 716 больных за период с 1984 по 1988 г., СВВ составило 9,1 мес, более высокие цифры были отмечены после радикальной (22,5 мес), чем после паллиативной хирургии (11,3 мес). 5-летний УВ был определен в 6% случаев [4].
Выживаемость после эзофагоэктомии по поводу рака пищевода является оценочным показателем. Как показывают последние работы, проведенные в Японии [12, 14, 19] и Европе [11], излечение с помощью хирургического вмешательства касается лишь группы поверхностных опухолей в стадии T1. В частности, 5-летний УВ при раке, который не выходит за пределы слизистой оболочки, составляет около 100%, более низкие цифры наблюдаются, если опухоль распространяется на подслизистую оболочку (40-70%), где прогноз ухудшается из-за метастазов в лимфатические узлы.
Таким образом, учитывая большой процент (до 40) бессимптомного течения рака пищевода, наиболее эффективным методом его выявления является диспансерное наблюдение за больными старше 40 лет, имеющими такие предрасполагающие к развитию рака заболевания, как пептический эзофагит, язвы и полипы пищевода, ахалазия кардии и болезнь Баррета. В этих случаях необходимо применять современные методы диагностики, такие как эндоскопия с хромоскопией, эндоскопическое УЗИ, прицельная многократная биопсия слизистой оболочки пищевода с последующим гистологическим исследованием.
Тактика и выбор метода лечения (оперативного, паллиативного или комбинированного) определяются в первую очередь стадией заболевания, локализацией опухоли и общим состоянием больного. Прогноз также зависит от стадии болезни. При поздних стадиях прогноз неблагоприятный, так как 5-летняя выживаемость при раке пищевода не достигает 10%.
Читайте также:

